修回日期: 2008-10-05
接受日期: 2008-10-27
在线出版日期: 2008-12-28
目的: 探讨S100A2基因在结直肠癌发生及演进过程中的作用.
方法: 对66例结直肠癌组织标本进行DNA、mRNA及蛋白提取. 采用PCR-SSCP和微卫星结合PCR-变性聚丙烯酰胺凝胶电泳技术检测S100A2基因DNA突变及缺失; 分别以RT-PCR技术、Western blot检测S100A2 mRNA及蛋白表达水平.
结果: 66例结直肠癌组织标本中, 未发现S100A2基因存在杂合性缺失(LOH)及第二外显子和第三外显子突变; S100A2 mRNA及蛋白表达水平在结直肠癌中明显低于正常结直肠组织(0.499±0.307 vs 1.187±0.264; 0.542±0.193 vs 1.301±0.233, 均P<0.05).
结论: S100A2蛋白表达下调可能与结直肠癌的发生发展有关. S100A2基因在结直肠癌中表达下调可能不是杂合性缺失或突变所致.
引文著录: 王珣, 胡义奎. S100A2基因在结直肠癌组织中的表达、突变及杂合性缺失. 世界华人消化杂志 2008; 16(36): 4118-4122
Revised: October 5, 2008
Accepted: October 27, 2008
Published online: December 28, 2008
AIM: To evaluate the possible role of S100A2 gene in the progression of colorectal carcinoma.
METHODS: DNA, mRNA and protein were extracted from 66 colorectal carcinoma specimens. Single strand conformation polymoerphism (SSCP) and microstatellites denaturing PAGE gel electrophoresis analysis were used to detect the mutation and loss of heterozygosity (LOH) of S100A2 gene. The S100A2 mRNA and protein were detected by using reverse transcription chain reaction (RT-PCR) and Western blot.
RESULTS: No mutation in exon 2, 3 or deletion of S100A2 was found. RT-PCR and Western blot indicated expression of S100A2 were significantly lower in colorectal carcinoma than in adjacent normal colorectal lesions (0.499 ± 0.307 vs 1.187 ± 0.264; 0.542 ± 0.193 vs 1.301 ± 0.233, both P < 0.05).
CONCLUSION: The expression of S100A2 gene was down-regulated in colorectal carcinoma, suggesting a possible involvement of S100A2 gene in carcinogenesis and progression of colorectal carcinoma. The reduced level of S100A2 in colorectal carcinoma may not be attributed to the deletion and mutation of S100A2 gene.
- Citation: Wang X, Hu YK. Expression, mutation and deletion of S100A2 gene in human colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(36): 4118-4122
- URL: https://www.wjgnet.com/1009-3079/full/v16/i36/4118.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i36.4118
S100A2基因是1991年由Lee et al[1]利用抑制性消减杂交技术从正常上皮细胞系和肿瘤上皮细胞系中筛选并克隆出1个候选抑癌基因. S100A2基因定位于人染色体1q21区[2], 基因全长为8670 bp, 有3个外显子和2个内含子, 编码具有97个氨基酸的S100A2蛋白. 在S100蛋白家族成员中, 与肿瘤相关的有S100A2、S100A4和S100A6[3]. S100A2蛋白在S100蛋白家族中是唯一与肿瘤生成呈负相关的蛋白. 本课题旨在从基因组DNA水平分析结直肠癌组织中S100A2基因的突变, LOH情况, 从S100A2基因的mRNA、蛋白水平展开分析, 评价S100A2基因在结直肠癌发生过程中的可能作用机制, 从DNA水平、mRNA水平、蛋白表达水平探讨S100A2基因在结直肠癌发生及演进过程中的作用.
66例结直肠癌组织及远端正常结直肠黏膜组织(距癌组织>5 cm远端的结直肠黏膜)取材于2007-05/2008-05武汉市武昌医院结直肠癌手术切除术标本, 所有结直肠癌患者术前均未经化疗和放疗, 所有标本均经病理确诊. 取结直肠癌组织及正常结直肠黏膜组织各2-4小块, 每块组织大小约为100 mg. 取材后迅速置于液氮内冷冻. 将病例按分化程度、浸润深度、淋巴结转移进行分组[4-5]. 高分化癌28例, 中分化癌21例, 低分化癌17例; 男38例, 女28例; 年龄30-65(平均48)岁.
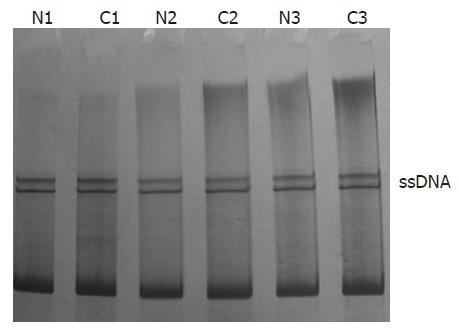
1.2.1 RT-PCR检测S100A2 mRNA: TRIzol法提取组织总RNA, 所有标本A260/A280比值均介于1.70-1.95之间, 符合RNA纯度标准. 根据引物设计原则, 从GenBank中查询GAPDH和S100A2的完整cDNA序列, 软件Primer 5.0辅助设计PCR引物(GAPDH上游引物: 5'-GGATTTGGTCGTATTGGGCG-3', 下游引物: 5'-TACTTCTCATTGGTTCACAC-3')通过同源性比较(http://www.ncbi.nih.gov/blast)为特异性引物, 送大连宝生物基因公司合成, PAGE纯化. 在100 μL总反应体系中加10×RT缓冲液9.8 μL, 25 mmol/L MgCl2 7.5 μL, 10 mmol/L dNTP混合液1.8 μL, 25 μmol/L引物各2 μL, 5倍稀释后的反转录产物15 μL, Taq DNA聚合酶2.5 U, 去RNA酶水61.4 μL. 反应条件: 96 ℃预变性5 min, 然后95 ℃ 1 min, 52 ℃ 45 s, 72 ℃ 30 s, 共30个循环, 最后72延伸5 min. 分子质量标记及对照: GAPDH为对照, DNA Marker DL2000为分子量标准. 扩增后取PCR产物10 μL进行1 g/L琼脂糖凝胶电泳(含溴化乙锭0.5 g/L)检测, 凝胶成像系统照相. 凝胶用薄层扫描仪进行灰度扫描, 分析各产物的灰度值(V值), 将目的基因的V值(Vx)分别与对应标本的VGAPDH相比(Rx = Vx/VGAPDH). 相对表达强度Rx代表样本目的基因相对表达量.
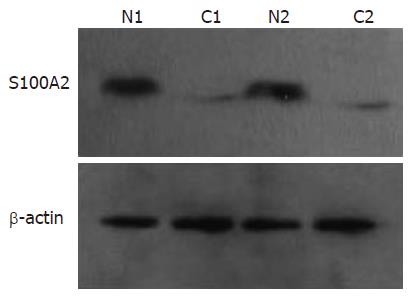
1.2.2 Western blot检测S100A2蛋白: 参照《分子克隆实验指南》第2版[6]的蛋白提取方法, 应用组织裂解液分别裂解结直肠癌与正常黏膜组织得到组织总蛋白. 以牛清蛋白(BSA)为标准品, 根据BCA蛋白定量试剂盒(Preice公司)的说明绘制蛋白定量标准曲线, 于酶标仪(ELX800, BIO-TEK公司)490 nm下测定吸光度值(A值), 计算提取总蛋白的浓度. 取总蛋白30 μg, 120 g/L SDS-PAGE电泳分离后电转移到PVDF膜, 50 mL/L牛奶封闭2 h后, 按1:250加入一抗(鼠抗人S100A2 mAb, Sigma公司)37 ℃孵育2 h, 抗体洗脱液TBST洗3次, 每次20 min. 按1:4500加入辣根过氧化物酶(HRP)标记的羊抗兔二抗(购自北京中衫)37 ℃孵育1 h, TBST洗3次. 每次20 min. 加ECL发光剂, 显影、定影. X光片洗涤干燥后, 并登记记录. 胶片条带用薄层扫描仪进行灰度扫描, 分析各产物灰度值(V值), 将目的基因的V值(Vx)分别与对应标本的Vβ-actin相比(Rx = Vx/Vβ-actin). 相对表达强度Rx代表样本蛋白相对表达量.
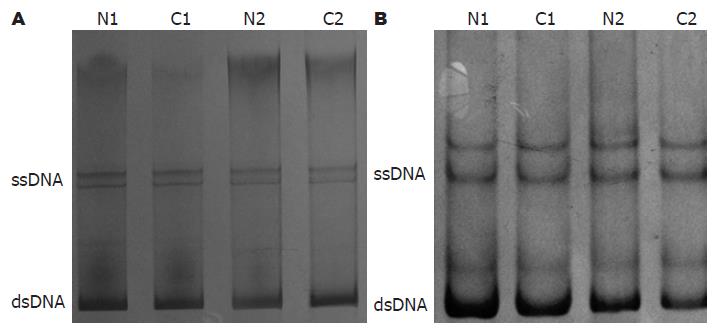
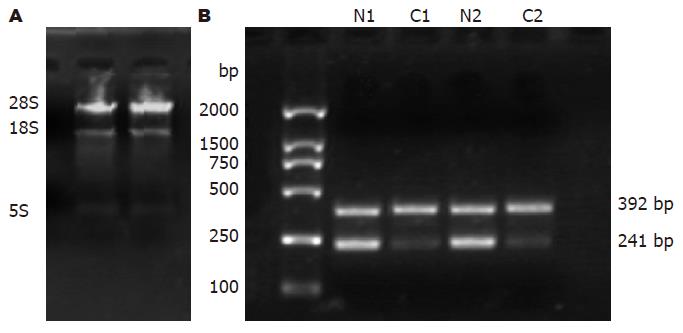
1.2.3 PCR-SSCP和微卫星结合PCR-变性聚丙烯酰胺凝胶电泳检测S100A2基因突变及缺失: 酚-氯仿法提取组织DNA, 根据引物设计原则, 从GenBank中查询S100A2基因第二和三外显子的序列, 软件Primer 5.0辅助设计PCR引物(外显子2: 5'-TCCTTCCTGGGTCTGTCT-3', 下游引物5'-CCTCATCCACTTTCTCCC-3'; 外显子3: 上游引物5'-GGATGAGGAGGGGCTGAAGA-3', 下游引物5'-CTCAAAGGCATCAACAGTCC-3'), PCR反应条件: 50 μL PCR反应总体积中加入基因组DNA 2 μL, 10×Buffer 5 μL, MgCl2 3 μL, dNTPs(10 mmol/L)1 μL, Taq DNA聚合酶2.5 U, 一对引物各1 μL. 外显子2: 96 ℃预变性5 min, 其循环条件为95 ℃ 1 min, 53 ℃ 45 s, 72 ℃ 30 s, 28个循环后72 ℃延伸5 min. 外显子3: 96 ℃预变性5 min, 其循环条件为95 ℃ 1 min, 58 ℃ 45 s, 72 ℃ 30 s, 30个循环后72 ℃延伸5 min. 取5 μL PCR扩增产物加5 μL变性液(95 mg/L甲酰胺、20 mmol/L EDTA、0.05 mg/L溴酚蓝、0.05 mg/L二甲苯青)混合后100 ℃加热10 min变性后行聚丙烯酰胺凝胶电泳, 硝酸银染色观察泳动条带是否移位以判断突变情况. 选取离S100A2基因最近的微卫星序列D1S3498进行PCR扩增, D1S3498引物序列直接从GenBank中查询(上游引物5'-CCCCCTCCTACCCTCTCTC-3', 下游引物5'-CTCTGCTGAGCCTCGAGG-3'), PCR反应条件: 50 μL PCR反应总体积中加入基因组DNA 2 μL, 10×Buffer 5 μL, MgCl2 3 μL, dNTPs(10 mmol/L)1 μL, Taq DNA聚合酶2.5 U, 一对引物各1 μL. 96 ℃预变性5 min, 其循环条件为95 ℃ 1 min, 60 ℃ 45 s, 72 ℃ 30 s, 30个循环后72 ℃延伸5 min. 取5 μL PCR扩增产物加5 μL变性液(95 mg/L甲酰胺、20 mmol/L EDTA、0.05 mg/L溴酚蓝、0.05 mg/L二甲苯青)混合后100 ℃加热10 min变性后进行聚丙烯酰胺凝胶电泳, 硝酸银染色, 观察条带有无LOH.
统计学处理 采用SPSS10.0统计学软件进行结果分析, 计量资料的组间比较采用t检验, P<0.05判断为差异有显著性意义.
2 结果
66例结直肠癌组织中无1例检出外显子2, 3有突变情况(图1).
66例正常结直肠黏膜组织中均能检测出S100A2 mRNA的表达, 正常结直肠黏膜组织中S100A2基因mRNA相对表达强度Rv为1.187±0.264, 结直肠癌标本中相对表达强度为0.499±0.307, 与正常结直肠黏膜对比显著减弱(P<0.05, 图3).
S100A2 mRNA表达与患者性别、年龄及肿瘤浸润深度无关, S100A2 mRNA表达水平在高、中、低分化的结直肠癌中呈逐渐降低趋势(P<0.05), 在有淋巴结转移的结直肠癌中S100A2 mRNA相对表达强度较无淋巴结转移组弱(P<0.05, 表1).
| 分组 | n | S100A2 mRNA | S100A2蛋白(Rv) |
| 性别 | |||
| 男 | 38 | 0.507±0.203 | 0.489±0.201 |
| 女 | 28 | 0.539±0.199 | 0.607±0.273 |
| 年龄 | |||
| ≤50岁 | 34 | 0.517±0.209 | 0.593±0.325 |
| >50岁 | 32 | 0.551±0.213 | 0.526±0.259 |
| 分化程度 | |||
| 高分化 | 28 | 0.843±0.206 | 0.809±0.384 |
| 中分化 | 21 | 0.501±0.229 | 0.558±0.255 |
| 低分化 | 17 | 0.197±0.132 | 0.301±0.174 |
| 浸润深度 | |||
| 黏膜 | 26 | 0.553±0.214 | 0.552±0.231 |
| 肌层 | 22 | 0.525±0.216 | 0.537±0.202 |
| 浆膜 | 18 | 0.530±0.224 | 0.501±0.221 |
| 淋巴转移 | |||
| 有 | 20 | 0.209±0.157 | 0.257±0.238 |
| 无 | 46 | 0.769±0.191 | 0.661±0.221 |
66例正常结直肠黏膜组织中均能检测出S100A2蛋白的表达(图4), 正常结直肠黏膜组织中S100A2蛋白相对表达强度Rv为1.301±0.233, 结直肠癌组织中相对表达强度为0.542±0.193, 与正常结直肠黏膜相比显著减弱(P<0.05).
S100A2蛋白表达与患者性别、年龄及肿瘤浸润深度无关, S100A2蛋白表达水平在高、中、低分化的结直肠癌中呈逐渐降低趋势(P<0.05), 在有淋巴结转移的结直肠癌中S100A2 蛋白相对表达强度较无淋巴结转移组弱(P<0.05, 表1).
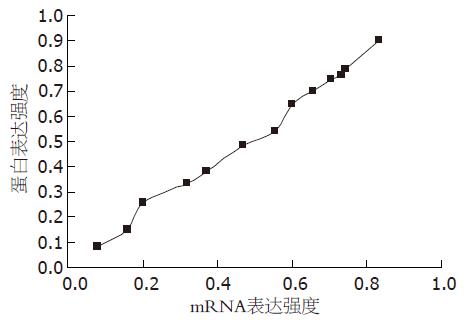
S100A2 mRNA表达与S100A2蛋白表达水平呈显著正相关, 两者表达基本呈一致性, 蛋白表达水平在结直肠癌中基本反应mRNA水平, 经有序资料的趋势检验相关性具有显著性意义(P<0.05, 图5).
结直肠癌和其他肿瘤一样, 其发生是一个多因素、多基因引起的细胞生长失控和分化受阻过程[7-8]. 因此, 结直肠癌的发生是多种癌基因、抑癌基因及DNA修复基因等的异常积累的结果. 正常结直肠黏膜上皮癌变的发生和发展受许多细胞内和细胞外因素的影响. 然而, 在结直肠黏膜上皮癌变通路中, 癌基因和抑癌基因是占主导地位, 这两类数量过百的基因在调控细胞生长和分化过程中起中心作用, 在结直肠癌发生发展的各个阶段均发挥重要作用. 因此对抑癌基因及其在细胞生物学信号传导中的作用研究, 已成为肿瘤分子遗传学和分子生物学研究的前沿和热点.
S100A2基因是Lee et al[1]利用抑制性消减杂交技术, 从正常上皮细胞系(NMECS)和肿瘤上皮细胞系(TMECS)中筛选并克隆出的一个候选抑癌基因. 定位于人染色体1q21区[2], 基因全长为8670 bp, 由3个外显子和2个内含子组成, 外显子1为非编码区, 外显子2和3共同编码一个由97个氨基酸组成的S100A2蛋白. S100A2蛋白有两个EF-手型结构, EF-手型结构由具有高度亲和性和选择性结合钙离子的螺旋-环-螺旋配基组成, 两侧为疏水区, 中央为铰链区; 羧基端EF-手型结构通常由12个氨基酸组成, 有较高的钙离子亲和性, 氨基端EF-手型结构由14个氨基酸组成, 呈环状结构与钙离子的亲和性低[9]. 钙离子在细胞正常生理活动中具有重要作用, 参与细胞DNA的合成和细胞增殖的调控, 钙结合蛋白S100A2存在时, 因其能够结合钙离子而使钙离子浓度降低, 致使细胞增生得到控制, 从而抑制肿瘤的生成.
Western blot结果显示, 正常结直肠黏膜均可检测到S100A2蛋白的表达, 其表达强度1.301±0.233, 而结直肠癌组织中的S100A2蛋白表达强度为0.542±0.193, 结直肠癌组织S100A2蛋白的表达强度低于正常结直肠黏膜(P<0.05). 结果表明S100A2蛋白的表达下调或缺失可能参与了结直肠癌的发生发展过程. 分析结直肠癌中S100A2蛋白表达水平与临床病理特征的关系, 显示S100A2蛋白在结直肠癌中的阳性表达率与结直肠癌的分化程度及淋巴结转移有关, 而与患者年龄、性别及肿瘤浸润深度无关系. S100A2蛋白表达强度在高、中、低分化结直肠癌中呈逐渐下降趋势(P<0.05). 上述结果表明S100A2蛋白与结直肠癌的分化程度密切相关, 并呈正相关关系, 分化程度愈低, S100A2蛋白表达水平愈低. 说明S100A2蛋白在细胞分化过程中起着重要的作用. 有淋巴结转移结直肠癌组中S100A2相对表达强度与无淋巴结转移结直肠癌组S100A2蛋白表达相对表达强度差异具有显著性意义(P<0.05). 结直肠癌淋巴结转移与结直肠癌患者的预后非常密切, 因此S100A2蛋白表达可能也与结直肠癌的预后有关.
应用RT-PCR方法检测正常结直肠黏膜组织和结直肠癌组织中S100A2基因mRNA的表达, 正常结直肠黏膜组织中均表达, 其表达强度为1.187±0.264; 结直肠癌组织中S100A2基因mRNA的表达强度仅为0.499±0.307, 与正常结直肠黏膜组织相比, 明显降低. 分析S100A2基因mRNA表达与临床病理特征的关系, 发现S100A2基因mRNA在结直肠癌中的表达与结直肠癌的分化程度及淋巴转移有关, 而与患者年龄、性别及肿瘤浸润深度无关. S100A2基因mRNA表达强度在高、中、低分化结直肠癌中呈逐渐降低趋势(P<0.05). 无淋巴结转移的结直肠癌组织中S100A2基因mRNA表达强度为0.769±0.191, 而有淋巴结转移结直肠癌组S100A2基因mRNA表达强度仅为0.209±0.157, 明显低于无淋巴结转移结直肠癌组. 结直肠癌组织中S100A2 mRNA表达水平与S100A2蛋白表达水平经有序资料的趋势检验, 发现S100A2 mRNA水平与蛋白水平具有一致性, 且呈显著正相关性关系, 说明S100A2蛋白表达水平在结直肠癌中基本反应S100A2 mRNA水平.
本研究在结直肠癌中未发现S100A2基因的杂合性缺失和突变, 提示S100A2基因在结直肠癌中表达下调, 可能不是S100A2基因杂合性缺失或突变所致. Feng et al[10]在肺癌中也未检测出S100A2基因缺失和突变存在, 说明S100A2基因的缺失与突变在肿瘤中并不是功能失活的主要机制. 本实验发现S100A2基因的mRNA与蛋白质表达水平基本一致, 推测该基因表达下调可能不是发生在转录后, 引起S100A2基因表达下调, 可能还存在其他机制. Feng et al[10]发现在肺癌组织中S100A2基因启动子区CpG岛高甲基化, 认为S100A2基因的高甲基化可能是S100A2表达下调的主要机制. S100A2基因的高甲基化, 是否是引起结直肠癌中该基因表达下调的主要原因, 还有待进一步研究.
结直肠癌是最常见的恶性肿瘤之一, 严重威胁着人们的健康和生命. 随着分子生物学研究的发展和应用, 人们对结直肠癌发病机制的探讨已深入到基因水平, 但至今未找到结直肠癌特异的分子病理学标志物.
蔡开琳, 副教授, 华中科技大学同济医学院附属协和医院普通外科; 黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
S100A2基因是1991年由Lee et al利用抑制性消减杂交技术从正常上皮细胞系和肿瘤上皮细胞系中筛选并克隆出一个候选抑癌基因. 研究表明, S100A2基因在卵巢癌及皮肤上皮恶性肿瘤中表达上调. 然而对于在结直肠癌发生发展过程中S100A2基因缺失、突变等的相关报道较少.
Lee et al应用S100A2 cDNA作为探针, 检测人正常乳腺上皮细胞系及乳腺癌细胞系中S100A2基因的mRNA水平, 发现在人正常乳腺上皮细胞中S100A2基因的mRNA表达丰富, 而在乳腺癌细胞系(SK-MB-2和MDA-MB-361)中表达微弱.
本文研究发现S100A2基因与结直肠癌关系密切, 为S100A2作为结直肠癌分化程度的标志物提供了有利依据.
本文对66例结直肠癌中S100A2基因的表达情况进行了初步研究, 思路清晰, 内容合理, 具有一定参考价值.
编辑: 李军亮 电编: 何基才
| 1. | Lee SW, Tomasetto C, Sager R. Positive selection of candidate tumor-suppressor genes by subtractive hybridization. Proc Natl Acad Sci USA. 1991;88:2825-2829. [PubMed] |
| 2. | Engelkamp D, Schäfer BW, Mattei MG, Erne P, Heizmann CW. Six S100 genes are clustered on human chromosome 1q21: identification of two genes coding for the two previously unreported calcium-binding proteins S100D and S100E. Proc Natl Acad Sci USA. 1993;90:6547-6551. [PubMed] |
| 3. | Maelandsmo GM, Flørenes VA, Mellingsaeter T, Hovig E, Kerbel RS, Fodstad O. Differential expression patterns of S100A2, S100A4 and S100A6 during progression of human malignant melanoma. Int J Cancer. 1997;74:464-469. [PubMed] |
| 4. | 廖 松林. 肿瘤组织病理诊断. 第2版. 山东: 山东科学技术出版社 1995; 184. |
| 5. | Jass JR, Sobin LH, Watanabe H. The World Health Organization's histologic classification of gastrointestinal tumors. A commentary on the second edition. Cancer. 1990;66:2162-2167. [PubMed] |
| 8. | Nakayama S, Kretsinger RH. Evolution of the EF-hand family of proteins. Annu Rev Biophys Biomol Struct. 1994;23:473-507. [PubMed] |
| 9. | Feng G, Xu X, Youssef EM, Lotan R. Diminished expression of S100A2, a putative tumor suppressor, at early stage of human lung carcinogenesis. Cancer Res. 2001;61:7999-8004. [PubMed] |