修回日期: 2008-11-11
接受日期: 2008-12-08
在线出版日期: 2008-12-28
目的: 探讨IκB蛋白激酶α及γ基因沉默对巨噬细胞分泌的NF-κB依赖性的下游炎性因子表达的影响.
方法: 应用RNA干扰技术将IκB蛋白激酶α及γ基因沉默后, 观察RAW264.7小鼠巨噬细胞经LPS刺激后, NF-κB的活化以及多种NF-κB依赖性的下游炎性因子的表达.
结果: RNA干扰处理后RAW264.7巨噬细胞中IKKα及IKKγ基因表达出现明显下调, 而对照组中IKKα及IKKγ基因表达无明显变化. 经LPS刺激活化, IKKα和IKKγ表达随作用时间逐渐增强. IKKα及IKKγ基因沉默后, 可导致TNF-α、iNOS、IL-10、IκBα等多种炎症相关基因表达的明显下调.
结论: IKKα及IKKγ两种蛋白激酶参与NF-κB信号通路的调节, NF-κB信号通路的活化是全身性炎症反应的中心环节.
引文著录: 陈海龙, 李海龙, 李宏, 刘佳, 贺雪梅. RNA干扰介导的IκB蛋白激酶α及γ基因沉默对巨噬细胞分泌细胞因子的影响. 世界华人消化杂志 2008; 16(36): 4056-4061
Revised: November 11, 2008
Accepted: December 8, 2008
Published online: December 28, 2008
AIM: To investigate the potential effect of IKK activation on expression of inflammatory cytokines in macrophage over-activation in systemic inflammatory response syndrome.
METHODS: RNAi was used to assess the role of IκB kinase α and γ in LPS-induced NF-κB activation and expression of downstream cytokines in RAW264.7 macrophages.
RESULTS: IKKα and IKKγ were markedly down-regulated in macrophages following RNA interference treatment while no obvious changes in IKKα and IKKγ expression were noted in control group. After LPS activation, expressions of IKKα and IKKγ increased with time. Silenced IKKα and IKKγ resulted in down-regulation in such relevant genes as TNF-α, iNOS, IL-10, and IκBα.
CONCLUSION: The current studies demonstrate multiple functions of IκB kinases in activating NF-κB signal pathway and in regulating expressions of inflammatory cytokines induced by LPS in RAW264.7 macrophages. Drugs targeting the IKKα and IKKγ interaction may be of clinical significance for inflammation regulation.
- Citation: Chen HL, Li HL, Li H, Liu J, He XM. Effect of expression silencing of NF-κB in RAW264.7 macrophages on secretory cytokines in systemic inflammatory response syndrome. Shijie Huaren Xiaohua Zazhi 2008; 16(36): 4056-4061
- URL: https://www.wjgnet.com/1009-3079/full/v16/i36/4056.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i36.4056
核因子-κB(nuclear factor-kappaB, NF-κB)被认为在细胞应对多种胞外刺激过度活化时的信号传递过程中发挥着十分重要的作用[1]. 静息状态下, NF-κB与抑制蛋白IκB结合, 以无活性的形式存在于胞质内. 当细胞受内毒素、肿瘤坏死因子等外界信号刺激后, IκB在蛋白激酶IKK的作用下发生磷酸化降解, NF-κB迅速移位到细胞核, 与特异性κB序列结合, 诱导TNF-α、IL-1、IL-6、IL-8、化学因子、黏附分子、集落刺激因子、COX-2、诱生性一氧化氮合酶等相关基因转录[2-3], 引发全身炎症反应, 甚至发展成急性肺损伤(acute lung injury, ALI)、急性呼吸窘迫综合征(acute respiratory distresssyndrome, ARDS)、多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS). 因此, 通过抑制NF-κB的过度活化进而降低由内毒素或细胞因子引起的炎症病理损害将是十分理想的治疗手段. RNA干扰(RNA interference, RNAi)是最近发展起来的抑制特定基因产物表达的有效方法[4-5]. 是一种由双链RNA(double-stranded RNA, dsRNA)分子在mRNA水平上关闭相应序列基因的表达或使其沉默的过程. siRNA(small interfering, RNAs)就是这种短片段双链RNA分子, 其来源于长双链RNA(dsRNA)的酶切降解, 能够以序列同源互补的mRNA为靶目标, 降解特定的mRNA[6],是目前研究基因调控的重要手段. 我们应用RNA干扰技术特异性地将NF-κB信号通路中的IKKα及IKKγ基因沉默, 探究RAW264.7巨噬细胞经LPS刺激后NF-κB的活性及炎症细胞因子表达的变化, 进而为临床上全身炎症反应性疾病的靶向治疗提供实验基础.
小鼠单核巨噬细胞系RAW264.7购于中国科学院上海细胞所; Silencer siRNA Cocktail Kit(RNase Ⅲ, Ambion, USA)试剂盒购自美国Ambion公司; RT-PCR试剂盒购自大连宝生物工程公司.
1.2.1 细胞培养: 小鼠单核巨噬细胞系RAW264.7细胞用含100 mL/L胎牛血清、0.2% NaHCO3和0.3% HEPES的DMEM培养液(Gibco Life Science, USA), 加青霉素100 U/mL、链霉素100 mg/L, 在37 ℃、50 mL/L CO2和100%湿度的孵箱中培养至对数生长期. 用2.5 g/L胰蛋白酶和0.04% EDTA的无Ca2+、Mg2+的PBS混合液消化处理细胞, 重悬细胞于培养液中, 进行细胞计数, 调整细胞密度, 以2×108/L的密度分装到含有培养液(pH 7.2)的细胞培养皿中, 混匀, 将细胞悬液均匀铺在培养皿中. 本实验中, 以1×109/L的密度将细胞接种于60 mm培养板(NUNC, Denmark)中, 37 ℃、50 mL/L CO2培养24 h. 用于RNA干扰和转染的细胞, 先与转染试剂/短链RNA复合物共同作用48 h, 然后给予LPS(10 mg/L)刺激, 于不同时间点收集细胞低温保存. 去离子水稀释LPS(serotype 055: B5, Sigma, USA)至储存浓度为0.5 g/L, 分装后存放于-20 ℃. 本实验共分为12组, 每组5个培养皿: Group N0: RAW264.7巨噬细胞正常培养组; Group N1, N2: 给予LPS(10 mg/L)刺激, 作用30 min, 2 h; Group A0: 细胞与转染试剂/IKKα siRNA混和物作用48 h; Group A1, A2: 细胞经转染及IKKα干扰处理后, 给予LPS(10 mg/L)刺激分别作用30 min, 2 h; Group B0: 细胞与转染试剂/IKKγ siRNA混和物作用48 h; Group B1, B2: 细胞经转染及IKKγ干扰处理后, 给予LPS(10 mg/L)刺激分别作用30 min, 2 h; Group C0: 细胞与转染试剂/IKKα & IKKγ siRNA 混和物作用48 h; Group C1, C2: 细胞经转染及IKKα & IKKγ同时干扰处理后, 给予LPS(10 mg/L)刺激分别作用30 min, 2 h; 于不同作用时间点收集的样本分装后-80 ℃保存.
1.2.2 RAW264.7巨噬细胞核蛋白的提取: 参照文献[7]方法进行. 倒去细胞培养液, 用PBS洗两次, 用刮板将细胞刮下, 收集于适当体积离心管, 4 ℃离心5 min, 使细胞沉淀. 弃上清, 加入200 µL冷缓冲液A(10 mmol/L HEPES-KOH pH 7.9, 1.5 mmol/L MgCl2, 10 mmol/L KCl, 0.5 mmol/L dithiothreitol, 0.5 mmol/L PMSF, 5 mg/L leupeptin, 5 mg/L aprotinin, 10 mg/L soybean trypsin inhibitor and 1 mg/L of pepstatin), 冰浴10 min, 振荡10 s, 混匀. 离心10 s, 上清即为胞浆提取物, 分装后-70 ℃保存. 沉淀中加入20 µL冷缓冲液B(20 mol/L HEPES-KOH pH 7.9, 25% glycerol, 420 mmol/L NaCl, 1.5 mmol/L MgCl2, 0.2 mmol/L EDTA, 0.5 mmol/L dithiothreitol, 0.5 mmol/L PMSF, 5 mg/L leupeptin, 5 mg/L aprotinin, 10 mg/L soybean trypsin inhibitor and 1 mg/L of pepstatin), 冰浴20 min. 4 ℃离心2 min, 弃沉淀. 上清即为核提取物, 分装后-80 ℃保存.
1.2.3 siRNA的设计与制备过程: siRNA的制备过程严格按照Ambion公司Silencer siRNA Cocktail Kit(RNase Ⅲ, Ambion, USA)试剂盒操作说明进行. 简言之, 设计5'端具有T7启动子对应序列的DNA模板, 经单独的转录反应合成dsRNA. 携带T7启动子序列的IKKα及IKKγ的上游引物分别为: 5'-TAATACGACTCACTATAGGGGCAGACCGTGAACATCCTCT-3', 5'-TAATACGACTCACTATAGGGGGTGGAGAGACTGAGCTTGG-3'; 下游引物为: 5'-TAATACGACTCACTATAGGGTCCAGGACAGTGAACGAGTG-3', 5-TAATACGACTCACTATAGGGCTAAAGCTTGCCGATCCTTG-3'.
1.2.4 siPORT Lipid方法转染细胞: 转染过程严格按照Ambion公司siPORT Lipid(Ambion, USA)试剂盒操作. 简言之, 转染前24 h将细胞接种于培养板内正常培养(DMEM, 100 mL/L FBS), 直至达到70%汇片, 4 µL of siPORT Lipid+DMEM reduced serum medium, 总体积15 µL体系; 5 µL of siRNA(25 nmol/L)+DMEM reduced serum medium, 总体积185 µL体系. 将稀释好的siRNA 加入稀释好的siPORT Lipid中, 轻轻混匀, 室温作用20 min. 先加入新鲜DMEM培养液800 µL至培养孔中, 将转染试剂/siRNA混合物加入孔内, 正常培养条件下, 孵育4 h. 每孔加入5 mL新鲜正常培养液(DMEM, 100 mL/L FBS), 转染48 h后检测干扰效果.
1.2.5 RNA的提取及RT-PCR: 常规TRIzol法(Life Technology, USA)提取各标本的总RNA, CRAY-50(Varian Inc, Australia)紫外分光光度仪对其浓度加以测定, 10 g/L琼脂糖凝胶电泳鉴定RNA完好性. 反转录体系20 μL, 包含样品RNA 3 μL, 依照TaKaRa RNA LA PCR Kit试剂盒提供说明书进行操作, 反应条件为: 55 ℃ 30 min, 99 ℃ 5 min, 5 ℃ 5 min; PCR反应体系15 μL, 包含反转录液2.4 μL. PCR反应条件为94 ℃预变性5 min; 94 ℃ 45 s, 58 ℃ 45 s, 72 ℃ 45 s, 循环35次; 72 ℃延伸7 min, 4 ℃恒定. 取出扩增产物直接加入3 μL 6倍溴酚蓝载样缓冲液混匀, 性10 g/L琼脂糖凝胶电泳, 在紫外透射仪下数码成像. TNF-α、IL-10、iNOS、IKKα、IKKγ及内对照β-actin引物序列见表1.
| 检测项目 | 上游引物 | 下游引物 | 扩增片段(bp) |
| TNF-α | 5'-GCGACGTGGAACTGGCAGAAG-3' | 5'-GGTACAACCCATCGGCTGGCA-3' | 372 |
| IL-10 | 5'-GCTATGCTGCCTGCTCTTAC-3' | 5'-CTGGGGCATCACTTCTACC-3' | 274 |
| iNOS | 5'-CTGCAGGTCTTTGACGCTCGG-3' | 5'-GTGGAACACAGGGGTGATGCT-3' | 741 |
| IKKα | 5'-GCAGACCGTGAACATCCTCT-3' | 5'-TCCAGGACAGTGAACGAGTG-3' | 202 |
| IKKγ | 5'-GGTGGAGAGACTGAGCTTGG-3' | 5'-CTAAAGCTTGCCGATCCTTG-3' | 203 |
| β-actin | 5'-GCATGGAGTCCTGTGGCAT-3' | 5'-CTAGAAGCATTTGCGGTGG-3' | 324 |
1.2.6 Western印迹分析: 参照文献[8]方法进行. 用紫外分光光度仪(Cary 50, Varian Inc, Australia)测定各蛋白样品的浓度. 煮沸变性后, 以每孔120 μg的蛋白含量点样, 经100 g/L SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离. 通过电转仪将凝胶上蛋白样品移至PVDF膜(Amersham, UK)上, 分别与1:1000稀释度的兔抗小鼠TNF-α、IL-10、iNOS多克隆抗体(Santa Cruz, CA, USA)和1:3000稀释度的辣根酶标记山羊抗兔抗体(Dako, Denmark)孵育. 应用增强的化学放射发光法(ECL, Roche, Diagnostics Corporation, Indianapolis, In USA)标记结合信号, 通过荧光自显影感光在Kodak XAY胶片上. 同一蛋白样品按照相同蛋白上样量及上样顺序经SDS-PAGE电泳分离后用考马斯亮蓝染色作为内对照. 本实验中PVDF膜至少重复使用2次, 方法如下: 首先预热洗脱液(100 mmol/L 2-Mercaptoethanol, 20 g/L SDS, 1 mol/L Tris-HCl pH6.8)至55 ℃, 然后将膜放入其中, 55 ℃水浴箱内, 间歇震荡30 min, 随后封闭(5% milk powder in TBS-T)过夜, 再重复上述的杂交操作步骤.
统计学处理 所有数据以mean±SD表示, 采用SPSS11.5统计分析软件进行处理, 组间比较采用方差分析和t检验, P<0.05为具有统计学意义.
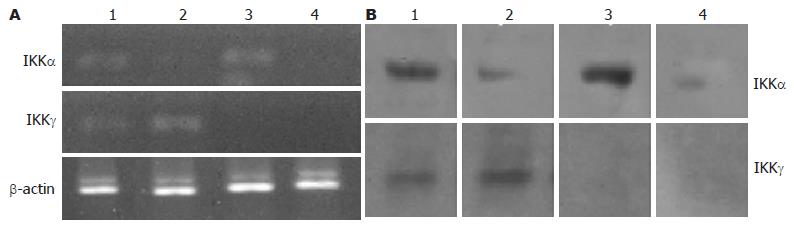
以脂质体为转染载体, 将针对靶基因的小片段RNA导入细胞并培养48 h后, RT-PCR结果显示RAW264.7巨噬细胞中IKKα及IKKγ基因表达出现明显下调, 而未给予RNA干扰处理的对照组中IKKα及IKKγ基因表达无明显变化(图1). 经LPS刺激活化后, RAW264.7巨噬细胞中IKKα和IKKγ表达随作用时间逐渐增强. 当对目的基因IKKα及IKKγ进行RNA干扰后, 能显著降低二者的表达水平, 且以si-IKK(α&γ) 组最为明显.
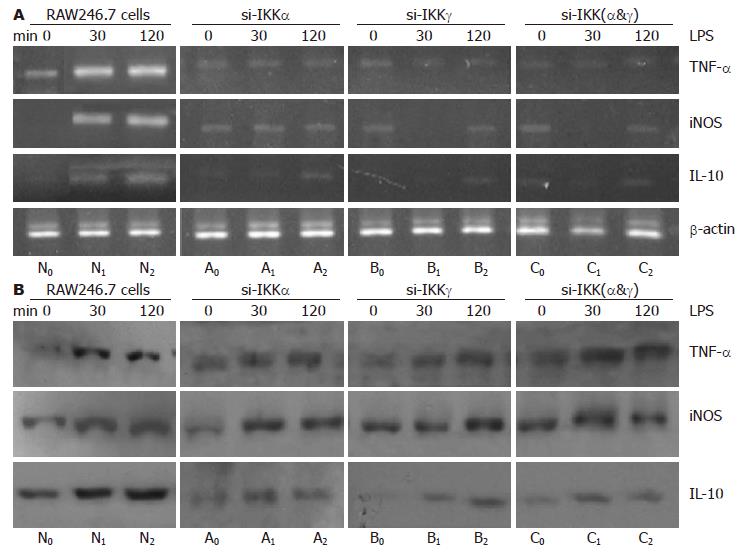
应用RT-PCR及Western蛋白印记分析的方法对RNA干扰后的RAW264.7巨噬细胞内NF-κB依赖性的下游因子TNF-α、iNOS及IL-10表达的检测结果显示: 正常状态下, RAW264.7巨噬细胞仅生成少量的TNF-α, 以维持细胞正常生理功能的需要. 给予LPS刺激后, TNF-α的转录及蛋白表达均显著增强. 然而针对目的基因IKKα及IKKγ进行基因沉默后, 于30 min和2 h时间点检测到TNF-α: 在蛋白水平仅受到部分地抑制; 而转录水平却出现明显降低(图2). iNOS在正常RAW264.7巨噬细胞中无表达, 当给予LPS(10 mg/L)刺激后, 可诱导其高表达并与刺激持续的时间呈正相关. IKKα及IKKγ基因沉默后, 能明显减弱巨噬细胞对LPS刺激引起的iNOS高表达状态, 且在si-IKKγ处理组及si-IKK(α&γ)处理组中30 min时间点, 此种现象更为突出. LPS能够诱导巨噬细胞合成大量IL-10, 但IKKα及IKKγ基因沉默后, IL-10基因的转录及蛋白表达亦受到显著抑制, 以si-IKK(α&γ)处理组最明显. 并且, 经转染目的基因siRNA处理的细胞再给予LPS刺激时, 即使延长作用时间亦不能诱导IL-10蛋白表达增强(图2).
自从1998年Fire et al首次发现并命名RNAi以来, 该技术已经被广泛应用于多种细胞系中结构蛋白、核转录因子、功能调节及关键蛋白功能多样性等研究领域[9-10]. 本实验中, 经针对IKKα及IKKγ的siRNA分别转染到RAW264.7巨噬细胞内, 经RT-PCR和免疫印迹检测, 转染细胞的IKKα及IKKγ的表达显著降低, 证明本研究中所使用的RNA干扰的方法针对目的基因的沉默作用是有效可靠的. 正常细胞给予LPS刺激能诱导IKKα及IKKγ的表达, 并且随作用时间的延长而增强; 但如果预先将IKKα及IKKγ基因沉默再给予LPS刺激时, 则仅出现转录水平的低表达. 正常生理状态下, NF-κB蛋白二聚体主要以失活的形式存在于细胞质中, 其核定位信号区域被抑制蛋白IκBs遮蔽. 当各种细胞外刺激因素与膜表面受体结合后, 炎症信号传入细胞内, 进而启动一系列炎症相关的连锁反应, NF-κB蛋白二聚体被激活并发生核易位进入细胞核, 与多种炎症效应基因启动子区域的特定κB序列结合, 加速多种细胞因子和炎症介质的转录[11].
研究已经证明, 经LPS刺激活化后, 巨噬细胞内能通过NF-κB信号通路启动大量炎症细胞因子及炎症介质, 如: TNF-α、iNOS、IL-10等的合成和释放[3]. 因此设想, 如果将NF-κB信号通路上的两个关键酶IKKα和IKKγ进行基因沉默, 就极有可能使多种炎症效应基因的转录和释放发生一系列的变化. 为验证上述假设, 首先应用LPS刺激RAW264.7巨噬细胞使其过度活化, 随之检测到炎症因子TNF-α、iNOS、IL-10的大量表达, 且与作用时间呈正相关性. Aupperle et al[12]的研究亦证实TNF-α、IL-10等刺激因子可以活化蛋白激酶IKK家族, 后者能促使抑制蛋白IκBα发生磷酸化降解, 进而促进NF-κB二聚体核易位. 研究普遍认为, TNF-α不仅为一类炎症效应因子, 具有促炎作用; 同时还是巨噬细胞活化的炎症诱导因子, 在炎症的"级联瀑布"过程发挥着至关重要的作用[13]. iNOS是NO合成的关键酶, 主要存在于过度活化的炎症细胞中, 经其催化生成的NO作用持久、不易被机体代谢降解, 参与机体不同器官的损害过程[14]. IL-10是一种内源性的抗炎因子, 能抑制机体内炎症细胞的过度活化状态, 在炎症的负反馈调节中扮演着重要角色[15]. 另据报道, 将IKKα和IKK-β的基因敲除后, 会引起IκBα、IL-10等多种NF-κB依赖的炎性因子表达改变[16].
实验结果表明, 蛋白激酶IKKα及IKKγ在IκBα、IL-10、iNOS基因转录和表达方面具有重要的调节作用. 预先对巨噬细胞中IKKα及IKKγ的基因进行RNA干扰处理后, 再给予LPS刺激细胞时, TNF-α在mRNA水平的抑制效果明显; 而在蛋白水平受到了部分的抑制. 结果提示可能的原因: 一方面IKKα和IKKγ能够介导TNF-α的转录合成; 另一方面, 除转录因子NF-κB外, 可能有其他调节因子对其转录后水平发挥了一定程度的调节作用. 在研究IKKα及IKKγ基因沉默的影响时发现, iNOS在si-IKKγ及si-IKK(α&γ)处理组的表达被显著抑制, 说明蛋白激酶IKKγ可能对iNOS基因转录具有更为直接的调节作用. 另外, 预先将IKKα及IKKγ的基因沉默后再给予LPS刺激, 巨噬细胞中IL-10处于较低表达水平, 即使延长刺激时间亦无明显改变. 鉴于本实验结果, 可以推断蛋白激酶IKKα及IKKγ对炎症反应过程中巨噬细胞合成释放一些抗炎因子和炎症的负反馈调节方面具有重要的作用, 二者功能上的持续表达对于IL-10的合成量及发挥抗炎作用时维持稳定的功能状态都是不可或缺的. 新近研究报道, IL-10还能通过抑制IκB激酶的活性、削弱NF-κB与DNA特定位点的结合能力等环节进一步实现对NF-κB通路的调控[17].
本研究进一步明确了蛋白激酶IKKα及IKKγ对NF-κB信号通路活化和相关炎症细胞因子表达调节的分子机制.
自从1998年Fire et al首次发现并命名RNAi以来, 该技术已经被广泛应用于多种细胞系中结构蛋白、核转录因子、功能调节及关键蛋白功能多样性等研究领域.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
研究普遍认为, TNF-α不仅为一类炎症效应因子, 具有促炎作用; 同时还是巨噬细胞活化的炎症诱导因子, 在炎症的"级联瀑布"过程发挥着至关重要的作用.
本研究进一步明确了蛋白激酶IKKα及IKKγ对NF-κB信号通路活化和相关炎症细胞因子表达调节的分子机制.
本文主要探究RAW264.7巨噬细胞经LPS刺激后NF-κB的活性及炎症细胞因子表达的变化, 进而为临床上全身炎症反应性疾病的靶向治疗提供实验基础.
编辑: 李军亮 电编: 何基才
| 1. | Sen R, Baltimore D. Multiple nuclear factors interact with the immunoglobulin enhancer sequences. Cell. 1986;46:705-716. [PubMed] [DOI] |
| 2. | Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest. 2001;107:7-11. [PubMed] [DOI] |
| 3. | Blackwell TS, Christman JW. The role of nuclear factor-kappa B in cytokine gene regulation. Am J Respir Cell Mol Biol. 1997;17:3-9. [PubMed] |
| 4. | Lee KY, D'Acquisto F, Hayden MS, Shim JH, Ghosh S. PDK1 nucleates T cell receptor-induced signaling complex for NF-kappaB activation. Science. 2005;308:114-118. [PubMed] [DOI] |
| 5. | Yang D, Buchholz F, Huang Z, Goga A, Chen CY, Brodsky FM, Bishop JM. Short RNA duplexes produced by hydrolysis with Escherichia coli RNase III mediate effective RNA interference in mammalian cells. Proc Natl Acad Sci USA. 2002;99:9942-9947. [PubMed] [DOI] |
| 6. | Zamore PD, Tuschl T, Sharp PA, Bartel DP. RNAi: double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals. Cell. 2000;101:25-33. [PubMed] [DOI] |
| 7. | Li HL, Chen HL, Li H, Zhang KL, Chen XY, Wang XW, Kong QY, Liu J. Regulatory effects of emodin on NF-kappaB activation and inflammatory cytokine expression in RAW 264.7 macrophages. Int J Mol Med. 2005;16:41-47. [PubMed] |
| 8. | Li H, Sun Y, Kong QY, Zhang KL, Wang XW, Chen XY, Wang Q, Liu J. Combination of nucleic acid and protein isolation with tissue array construction: using defined histologic regions in single frozen tissue blocks for multiple research purposes. Int J Mol Med. 2003;12:299-304. [PubMed] |
| 9. | Heinonen JE, Smith CI, Nore BF. Silencing of Bruton's tyrosine kinase (Btk) using short interfering RNA duplexes (siRNA). FEBS Lett. 2002;527:274-278. [PubMed] [DOI] |
| 10. | Jacque JM, Triques K, Stevenson M. Modulation of HIV-1 replication by RNA interference. Nature. 2002;418:435-438. [PubMed] [DOI] |
| 11. | Driessler F, Venstrom K, Sabat R, Asadullah K, Schottelius AJ. Molecular mechanisms of interleukin-10-mediated inhibition of NF-kappaB activity: a role for p50. Clin Exp Immunol. 2004;135:64-73. [PubMed] [DOI] |
| 12. | Aupperle KR, Bennett BL, Boyle DL, Tak PP, Manning AM, Firestein GS. NF-kappa B regulation by I kappa B kinase in primary fibroblast-like synoviocytes. J Immunol. 1999;163:427-433. [PubMed] |
| 13. | Chang JH, Ryang YS, Morio T, Lee SK, Chang EJ. Trichomonas vaginalis inhibits proinflammatory cytokine production in macrophages by suppressing NF-kappaB activation. Mol Cells. 2004;18:177-185. [PubMed] |
| 14. | Baeuerle PA, Henkel T. Function and activation of NF-kappa B in the immune system. Annu Rev Immunol. 1994;12:141-179. [PubMed] |
| 15. | Wang P, Wu P, Siegel MI, Egan RW, Billah MM. Interleukin (IL)-10 inhibits nuclear factor kappa B (NF kappa B) activation in human monocytes. IL-10 and IL-4 suppress cytokine synthesis by different mechanisms. J Biol Chem. 1995;270:9558-9563. [PubMed] [DOI] |
| 16. | Kellum JA, Song M, Venkataraman R. Hemoadsorption removes tumor necrosis factor, interleukin-6, and interleukin-10, reduces nuclear factor-kappaB DNA binding, and improves short-term survival in lethal endotoxemia. Crit Care Med. 2004;32:801-805. [PubMed] [DOI] |
| 17. | Zimmerman MA, Reznikov LL, Raeburn CD, Selzman CH. Interleukin-10 attenuates the response to vascular injury. J Surg Res. 2004;121:206-213. [PubMed] [DOI] |