修回日期: 2008-11-22
接受日期: 2008-11-24
在线出版日期: 2008-12-18
目的: 建立和优化肝脏细胞质膜蛋白质研究的方法系统, 并对正常组小鼠和内毒素休克小鼠组肝脏细胞质膜蛋白质进行二维液相色谱分离, 分析两者之间的差异表达谱.
方法: BALB/c小鼠20只随机分为正常组和内毒素休克小鼠组(10只, LPS刺激3 h, LPS剂量为35 mg/kg), n = 10. 采用差速离心结合蔗糖密度梯度离心法分离和富集两组肝脏细胞质膜蛋白, 分别将两组样品按蛋白质PI进行一维的色谱聚焦分离, 然后每个PI组分再按蛋白质的疏水性经二维HPLC分离, 利用ProteoVue软件将UV光吸收图谱转换成PI对疏水性的胶样图谱, 再利用DeltaVue软件分析两组肝脏质膜蛋白质组的表达差异.
结果: 图像分析显示两组比值在≥2.0及≤0.5的差异蛋白点共有24个, 与正常组比较, 在内毒素休克小鼠的肝脏质膜蛋白中有16个蛋白点表达上调, 8个蛋白点表达下调.
结论: 正常组和内毒素休克小鼠组的肝脏质膜蛋白质组有明显差异.
引文著录: 李红梅, 陈丽, 夏高晓, 赵明哲, 胡水旺, 姜勇. 内毒素休克小鼠肝脏细胞质膜差异蛋白质组的二维液相色谱分析. 世界华人消化杂志 2008; 16(35): 3988-3992
Revised: November 22, 2008
Accepted: November 24, 2008
Published online: December 18, 2008
AIM: To establish and optimize the methods for plasma membrane proteome research, and comparatively analyze plasma membrane proteomes of normal control group and the group treated with LPS for 3 h.
METHODS: Twenty BALB/c mice were assigned to 2 groups: the control group and LPS-treated group. Plasma membrane of liver cells from mice was extracted using differential centrifugation and sucrose density-gradient centrifugation. Plasma membrane proteins of two groups were fractionated according to pI using chromatofocusing with analytical columns in the first dimension, followed by separation of the proteins in each pI fraction using nonporous reversed-phase high performance liquid chromatography (HPLC). A two-dimensional map of the protein content for each group based upon pI versus hydrophobicity as detected by UV absorption was generated and a differential display map indicating the presence of up- or down-regulated proteins was exhibited using ProteoVue and DeltaVue software.
RESULTS: Image analysis of two-dimensional map revealed 24 differentially expressed proteins between the normal control group and that treated with LPS for 3 h. Compared with normal control, 16 protein fractions were up-regulated and 8 protein fractions were down-regulated in the group treated with LPS for 3 h.
CONCLUSION: There is a significant difference of plasma membrane proteome between the normal control and the mice treated with LPS.
- Citation: Li HM, Chen L, Xia GX, Zhao MZ, Hu SW, Jiang Y. Two-dimensional liquid chromatography analysis of differential proteome of liver plasma membrane in mice with endotoxic shock. Shijie Huaren Xiaohua Zazhi 2008; 16(35): 3988-3992
- URL: https://www.wjgnet.com/1009-3079/full/v16/i35/3988.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i35.3988
目前, 尽管抗生素被广泛应用, 并且有重症监护的支持, 感染和中毒性休克(septic shock)仍然是住院患者, 特别是创伤、烧伤和手术后患者面临的一个严重的问题, 其死亡率高达35%-60%[1-2]. 其中革兰氏阴性(G-)菌感染导致的中毒性休克是这类患者死亡的主要原因. 近年来对革兰氏阴性菌引起中毒性休克的机制已有了比较深入的了解. 虽然革兰氏阴性菌内毒素(Endotoxin), 即脂多糖(lipopolysaccharide, LPS)的确切作用现在仍有争论, 但他在启动体内免疫系统反应, 导致中毒性休克的重要性已经得到普遍认识. LPS与细胞质膜上的内毒素受体相互作用可以激活致炎细胞因子系统而介导细胞毒反应, 引起肺损伤、急性呼吸窘迫综合征, 最终导致脓毒性休克甚至多器官功能障碍综合征[3-4].
细胞质膜作为细胞与外界进行物质、能量和信息交流的场所, 在细胞的生命活动中起着至关重要的作用. 膜蛋白行使着独特的、联系生物膜内外环境的功能, 如细胞信号转导、细胞间相互作用、细胞器与细胞内的区室化作用、离子和溶质的传输、能量产生等; 同时, 也是许多药物的作用靶标. 据估计, 膜蛋白只占人类基因编码蛋白质的20%-30%[5], 但是在已经发现的药靶中大约有70%是质膜蛋白质[6]. 蛋白质组学研究具有大规模、高通量及高灵敏度的特点, 因此本文利用蛋白质组学的技术方法研究内毒素休克小鼠肝脏细胞质膜蛋白质组的变化, 为了解内毒素休克时肝脏参与内毒素休克的分子机制提供理论基础.
SPF级BALB/c♂小鼠, 7周龄, 15-19 g, 由南方医科大学实验动物中心提供. 二维液相色谱系统ProteomeLabTM PF2D及其配套试剂盒(ProteomeLabTM PF2D Kit)均为贝克曼(Beckman)公司产品, 试剂盒包括HPCF 1D色谱柱(2.1 mm×250 mm)、HPRP 2D无孔硅胶C18反相色谱柱(4.6 mm×33 mm)、起始缓冲液(start Buffer, SB)、洗脱缓冲液(eluent buffer, EB)和PD10 G-25脱盐柱(SephadexTM G-25, Amersham Pharmacia Biotech). LPS(血清型O111: B4)、正辛基β-D-吡喃葡萄糖苷(n-octyl-β-D-glucopyranoside, OG)、蛋白酶抑制剂混合物(protease inhibitor cocktail)、尿素、硫脲、SB3-10、亚氨基二乙酸(iminodiacteic)、氨水均购自Sigma公司. 乙腈、三氟乙酸(TFA)、甲醇、异丙醇均为色谱级, 购于Fisher公司. 系统用水为利用ELGA Utra-pure water系统制备的18.2 MΩ的水. 2-D quant kit蛋白浓度检测试剂盒购于GE公司.
1.2.1 BALB/c小鼠内毒素休克模型的制备: SPF级♂BALB/c小鼠20只, 7周龄, 15-19 g, 随机平均分为2组, 每组10只: 一组为正常对照组, 另一组为LPS处理组. 小鼠经乌拉坦(0.6 mL/100 g)ip麻醉后, 固定并分离右侧颈总动脉. 将PE50聚乙烯管插入右侧颈总动脉, 插管与压力传感器和4道生理记录仪连接. 所有动物经插管手术后均需稳定30-60 min后, 再记录正常平均动脉压(mean arterial pressure, MAP). ip LPS(35 mg/kg), 监测血压8 h, 然后放回笼内观察动物死亡时间. 对照组小鼠ip等量无致热源的PBS. 另取20只SPF级♂BALB/c小鼠, 7周龄, 15-19 g, 随机平均分为2组, 每组10只: 一组为正常对照组, 另一组为LPS处理3 h组, LPS的剂量同上, 对照组ip等量无致热源的PBS, 3 h后两组小鼠摘眼球放血处死, 取其肝脏, 提取肝脏细胞质膜.
1.2.2 小鼠肝脏质膜的提取: 小鼠肝脏用冰的磷酸盐缓冲液(KCl: 0.2 g, KH2PO4: 0.2 g, NaCl: 8.0 g, Na2HPO4·12H2O: 3.9054 g, pH 7.4, 1000 mL)漂洗3次以充分去除血液, 滤纸拭干, 称质量. 小鼠肝脏质膜的分离参照文献[7], 并作了一些改动, 所有操作均在4 ℃下进行, 每一步均需要加入蛋白酶抑制剂. 用眼科小剪尽快剪碎组织块, 将剪碎的组织倒入玻璃匀浆管中, 按质量:体积加入5倍体积的匀浆液(0.25 mol/L蔗糖, 10 mmol/L HEPE, pH 7.5)进行匀浆, 按捣杆垂直插入套管中上下转动研磨数十次, 充分研碎, 使组织匀浆化. 匀浆液1000 g离心10 min, 收集沉淀, 沉淀用5 mL的Buffer A(0.3 mol/L蔗糖, 50 mmol/L Tris, 3 mmol/L MgCl2, pH 7.5)重悬, 加入9倍体积的Buffer B(1.98 mol/L蔗糖, 50 mmol/L Tris, 3 mmol/L MgCl2, pH 7.5)以形成1.8 mol/L的蔗糖密度, 上层用0.25 mol/L SHE(0.25 mol/L蔗糖, 10 mmol/L HEPES, pH 7.5, 1 mmol/L EDTA)填满离心管, 此蔗糖的密度为83%(w/w), 70900 g离心90 min, 收集0.25 mol/L/1.8 mol/L界面的膜层, 此为质膜的粗提物(crude plasma membrane, CPM). 将质膜粗提物用适量的0.25 mol/L SHE重悬, 加入适量体积的2.4 mol/L SHE(2.4 mol/L蔗糖, 10 mmol/L HEPES, pH7.5, 1 mmol/L EDTA)使蔗糖终浓度达到1.45 mol/L(42% w/w), 上层用0.25 mol/L SHE填满离心管, 68 400 g离心60 min, 收集0.25 mol/L/1.45 mol/L(8.3%/42%)界面的膜层. 该膜层用适量的0.25 mol/L SHE重悬, 加入适量体积的2.4 mol/L SHE使蔗糖终浓度达到1.35 mol/L, 230000 g离心60 min, 收集0.25/1.35(8.3%/39%)界面的膜层, 此膜层即为纯的细胞质膜(purified plasma membrane, PPM). 用10 mmol/L HEPES(pH 7.5)洗涤细胞质膜以去除蔗糖, 1000 g离心10 min, 沉淀溶于膜裂解液(5 mol/L尿素, 2 mol/L硫脲, 10%甘油, 50 mmol/L Tris pH 8.0, 2.0% OG, 2.5% SB3-10, 1×蛋白酶抑制剂)中, 充分震荡溶解后, 20000 g离心1 h, 收集上清, 上清即为膜蛋白, 分装后冻存于-80 ℃.
1.2.3 样品的脱盐浓缩: 利用25 mL起始缓冲液SB平衡脱盐柱PD-10, 弃去洗脱液, 加入2.5 mL膜蛋白裂解液, 再用SB洗脱并收集前3.5 mL洗脱液, 通过2D quant kit测定蛋白浓度. 根据所测浓度, 用SB缓冲液配制浓度为2 g/L的上样样品.
1.2.4 一维色谱聚焦分离: (1)分离条件: 利用HPCF 1D色谱柱, 流动相A1-A4分别为SB(pH 8.5), EB(pH 4.0), 1 mol/L NaCl和HPLC级水, 所有溶液在实验前均通过0.2 μm滤膜过滤并超声5 min, 设定流速为0.2 mL/min, 检测波长为280 nm(室温下进行), 流动相pH由系统pH计在线检测, 并在每次运行前利用pH标准液(pH 4.00, pH 7.00, pH 10.01)校正. (2)分离程序: 由仪器自带的32 Karat软件控制自动运行, 首先以30倍柱体积(column volume, CV)的SB 平衡柱子, 然后由进样器进样2 mL样品, 蛋白上样量为4 mg, 用SB洗脱20 min, 再用EB洗脱, 约在45 min时, pH值开始下降, 每间隔0.3个pH单位收集1份样品. 当流出液的pH为4.0时, 用10 CV的1 mol/L NaCl和水依次洗脱柱子. 共收集到pH值在8.5-4.0之间的16份样品.
1.2.5 二维反相色谱分离: 分离条件: 利用HPRP 2D色谱柱, 流动相A为0.1% TFA水溶液, 流动相B为0.08% TFA乙腈溶液, 实验前超声5 min, 设定流速为0.75 mL/min, 检测波长为214 nm, 50 ℃恒温下进行洗脱分离. 分离程序: 由32 Karat软件控制自动运行, 首先以5 CV的流动相B和10 CV的流动相A平衡柱子后, 将一维分离的pH值在8.5-4.0之间的组份分别以0%-100%梯度的流动相B在30 min内进行分离.
1.2.6 蛋白质表达的差异比较: 用ProteoVue软件将二维分离的UV吸收光谱图(线图)转换成胶图(每1个pI组份为1个泳道), 建立小鼠肝脏质膜蛋白的吸收峰/等电点(UV/pI)图谱. 用DeltaVue软件分析两组样品间相同的pI组份的差异蛋白, 根据保留时间对相应的色谱峰面积进行比较, 获得相应的比值. 将比值变化超过2倍(即比值>2.0和比值<0.5)的组份作为正常组和LPS刺激3 h组中表达有差异的蛋白, 比值<0.5的组份称之为上调, 比值>2.0的组份称之为下调.
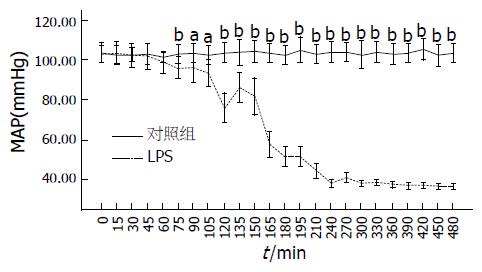
BALB/c小鼠ip LPS(35 mg/kg)后, 开始记录小鼠动脉血压(图1). LPS ip 45 min后, 血压开始下降, 但是下降速度缓慢, 到120 min时, 血压迅速下降到80 mmHg以下, 135 min时有所回升, 150 min时开始迅速下降, 180 min时血压降至50 mmHg左右, 并在此后的时间内持续下降, 形成较典型的"双峰型"曲线. 至240 min时接近重度休克(血压低于40 mmHg). 10只小鼠在注射12-16 h内死亡.
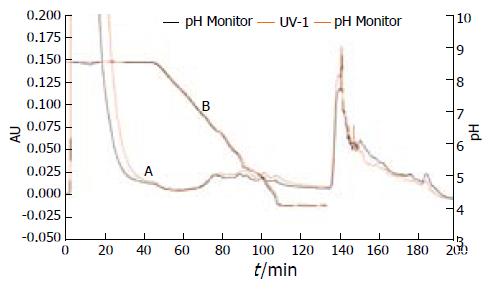
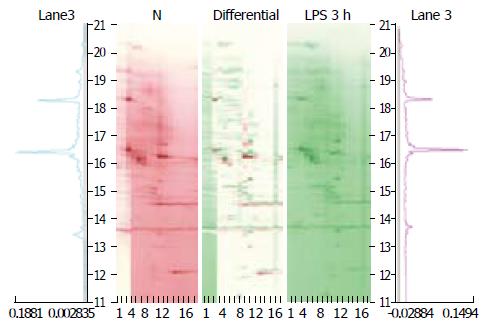
膜蛋白通过一维色谱聚焦分离, 收集了pH在8.5-4.0之间的组份, 共获得16个组份, 图2是两组小鼠肝脏细胞质膜蛋白的一维色谱聚焦图谱. 将两组样品一维获得的组份分别通过二维反相色谱在流动相(0.08%乙腈)0%-100%的洗脱梯度下进行二维分离, 将得到的二维信息通过仪器自带的ProteoVue软件转换成直观的高分辨彩色二维蛋白质组图谱(PI/UV). 将两组ProteoVue文件配对, 然后将数据输入DeltaVue软件中, 将各组pH梯度信息输入, 然后软件会展示两组间相同pI组分对比线图和胶图, 即为DeltaVue差异图谱, 如图3所示. 通过图谱分析, 找到了24个差异点, 其中上调的有16个, 下调的有8个.
蛋白质组学作为一种新兴的技术, 已经为揭示疾病发病机制、寻找新的检测指标蛋白和治疗靶点以及新药研发提供了有力的工具. 目前蛋白质组的研究工作主要分两个方面, 一是通过双向凝胶电泳等技术得到正常生理条件下的机体、组织或细胞的全部蛋白质的图谱, 建立参考图谱和数据库, 另一方面是进行不同条件下的蛋白质组差异比较分析. 目前蛋白质组学的发展既受技术的推动也受技术水平的限制, 传统的双向凝胶电泳技术仍然是目前复杂蛋白组份分离的主流技术, 但其分离能力有一定的限度, 重复性差, 上样量小, 难以检测到低丰度和难溶于水的蛋白[8-10]. 而往往这些蛋白对生理和病理过程具有关键性的调节作用. 目前以高效液相色谱方法(HPLC)为主的技术平台是传统凝胶电泳技术的有效补充. 我们使用的Beckman的ProtemeLabTMPF2D系统是由第一维的色谱聚焦和第二维的无孔硅胶反相HPLC组成, 在液态状态下对蛋白进行分离. 从第二维洗脱的蛋白质可用电喷雾离子阱质谱(ESI-MS)直接检测, 或用基质辅助激光解吸质谱(MALDI-MS)鉴定蛋白质. 该方法具有以下几个优点: (1)上样量大, 最大上样量可达到5 mg, 为传统凝胶电泳的5倍, 有利于低丰度蛋白质的检测; (2)自动化程度高, 所有分离收集过程由系统自动操作; (3)分辨率高, 可根据样品特点改变一维及二维洗脱条件提高分辨率; (4)重现性好; (5)与质谱兼容性好, 可以实现在线连用; (6)自带软件分析直观方便, 通过ProteoVue软件将二维UV图转换成直观的PI/UV图谱, 然后通过DeltaVue软件可比较两个样品的二维图谱差异[11-13]. 因此, 应用二维液相色谱分离方法研究蛋白质组的差异有可能成为有效的方法之一.
LPS信号转导通路的启动是内毒素致病过程中的重要环节, 而LPS与细胞膜上的受体相结合是其启动细胞内信号反应的第一步. 近年来对LPS受体识别机制的研究取得了较大进展, 发现识别LPS的受体并非单一受体[14-17]. 在LPS的跨膜信号转导过程中, LPS与分化抗原-14(CD-14)结合后作用于细胞膜脂质双分子层并激发多种生物活性分子, 他们相互作用, 聚集在一起形成LPS受体簇, 共同完成LPS的跨膜信号转导. 与正常细胞相比较, 受刺激细胞表面许多分子的活性部位暴露, 一些与病理相关的分子启动表达或表达增高, 提示受刺激的细胞与正常细胞表面存在着差异的分子, 这些分子可能与内毒素休克的发生发展密切相关, 因此, 研究LPS刺激后的细胞膜脂质层中的蛋白质可能对LPS致病机制的认识具有推动作用. 在本实验中, 我们利用LPS成功复制了内毒素休克小鼠模型, 并应用差速离心结合蔗糖密度梯度离心富集了小鼠肝脏细胞质膜, 运用二维液相色谱对两组细胞质膜蛋白进行分离, 初步建立了正常组和内毒素休克小鼠肝脏细胞质膜蛋白的差异图谱, 为下一步运用质谱技术鉴定差异蛋白打下基础.
脂多糖, 或称为内毒素, 被认为是引起脓毒症的主要作用分子. 内毒素信号转导通路是内毒素致病过程中的重要环节, 近年发现LPS受体识别是多种生物活性分子相互作用, 聚集在一起形成LPS受体族, 共同完成LPS的跨膜信号转导. 目前蛋白质组学技术不断发展, 为寻找参与内毒素休克过程中的生物活性分子提供了有效的手段.
姚登福, 教授, 南通大学附属医院分子医学中心
近年来对LPS受体识别机制的研究取得了较大进展, 发现识别LPS的受体并非单一受体.
本文利用蛋白质组学的技术方法研究内毒素休克小鼠肝脏细胞质膜蛋白质组的变化, 为了解内毒素休克时肝脏参与内毒素休克的分子机制提供理论基础.
本研究对照设计合理, 论据充足, 结果可信, 讨论条理分明, 学术价值较好.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Sakaguchi S, Furusawa S. Oxidative stress and septic shock: metabolic aspects of oxygen-derived free radicals generated in the liver during endotoxemia. FEMS Immunol Med Microbiol. 2006;47:167-177. [PubMed] [DOI] |
| 2. | Balk RA. Optimum treatment of severe sepsis and septic shock: evidence in support of the recommendations. Dis Mon. 2004;50:168-213. [PubMed] [DOI] |
| 3. | 丁 宁, 姜 勇. 细菌脂多糖识别系统. 中国生物化学与分子生物学报. 2007;23:711-717. |
| 5. | Zhang L, Xie J, Wang X, Liu X, Tang X, Cao R, Hu W, Nie S, Fan C, Liang S. Proteomic analysis of mouse liver plasma membrane: use of differential extraction to enrich hydrophobic membrane proteins. Proteomics. 2005;5:4510-4524. [PubMed] [DOI] |
| 6. | Schindler J, Nothwang HG. Aqueous polymer two-phase systems: effective tools for plasma membrane proteomics. Proteomics. 2006;6:5409-5417. [PubMed] [DOI] |
| 7. | Song Y, Hao Y, Sun A, Li T, Li W, Guo L, Yan Y, Geng C, Chen N, Zhong F. Sample preparation project for the subcellular proteome of mouse liver. Proteomics. 2006;6:5269-5277. [PubMed] [DOI] |
| 8. | Gorg A, Weiss W, Dunn MJ. Current two-dimensional electrophoresis technology for proteomics. Proteomics. 2004;4:3665-3685. [PubMed] [DOI] |
| 9. | Li X, Gong Y, Wang Y, Wu S, Cai Y, He P, Lu Z, Ying W, Zhang Y, Jiao L. Comparison of alternative analytical techniques for the characterisation of the human serum proteome in HUPO Plasma Proteome Project. Proteomics. 2005;5:3423-3441. [PubMed] [DOI] |
| 10. | Hamler RL, Zhu K, Buchanan NS, Kreunin P, Kachman MT, Miller FR, Lubman DM. A two-dimensional liquid-phase separation method coupled with mass spectrometry for proteomic studies of breast cancer and biomarker identification. Proteomics. 2004;4:562-577. [PubMed] [DOI] |
| 11. | Pirondini A, Visioli G, Malcevschi A, Marmiroli N. A 2-D liquid-phase chromatography for proteomic analysis in plant tissues. J Chromatogr B Analyt Technol Biomed Life Sci. 2006;833:91-100. [PubMed] [DOI] |
| 12. | Linke T, Ross AC, Harrison EH. Proteomic analysis of rat plasma by two-dimensional liquid chromatography and matrix-assisted laser desorption ionization time-of-flight mass spectrometry. J Chromatogr A. 2006;1123:160-169. [PubMed] [DOI] |
| 13. | Soldi M, Sarto C, Valsecchi C, Magni F, Proserpio V, Ticozzi D, Mocarelli P. Proteome profile of human urine with two-dimensional liquid phase fractionation. Proteomics. 2005;5:2641-2647. [PubMed] [DOI] |
| 14. | Triantafilou M, Brandenburg K, Kusumoto S, Fukase K, Mackie A, Seydel U, Triantafilou K. Combinational clustering of receptors following stimulation by bacterial products determines lipopolysaccharide responses. Biochem J. 2004;381:527-536. [PubMed] [DOI] |
| 15. | Triantafilou M, Triantafilou K. Heat-shock protein 70 and heat-shock protein 90 associate with Toll-like receptor 4 in response to bacterial lipopolysaccharide. Biochem Soc Trans. 2004;32:636-639. [PubMed] [DOI] |
| 16. | Triantafilou M, Triantafilou K. The dynamics of LPS recognition: complex orchestration of multiple receptors. J Endotoxin Res. 2005;11:5-11. [PubMed] [DOI] |