修回日期: 2008-10-14
接受日期: 2008-10-21
在线出版日期: 2008-12-08
目的: 探讨N-乙酰半胱氨酸(N-acetylcysteine, NAC)对重症急性胰腺炎(severe acute pan-creatitis, SAP)大鼠肝损伤的保护作用及作用机制.
方法: Wistar大鼠42只随机分为3组, SAP组(SAP, n = 18), 采用逆行十二指肠胰胆管注射50 g/L牛黄胆酸钠溶液制备SAP模型; SAP+NAC组(SAP+NAC, n = 18), 建模前2 h给予NAC 300 mg/kg体质量预处理; 假手术组(SO, n = 6). 建模成功后3、6和12 h, 分别取下腔静脉血液、胰腺和肝脏组织. 光镜下观察胰腺和肝脏组织病理改变, 全自动生化分析仪检测各时段血液ALT和AST水平, 逆转录-聚合酶链反应(RT-PCR)检测肝脏组织中TNF-α mRNA表达, SP免疫组化法检测肝脏组织中NF-κB活化.
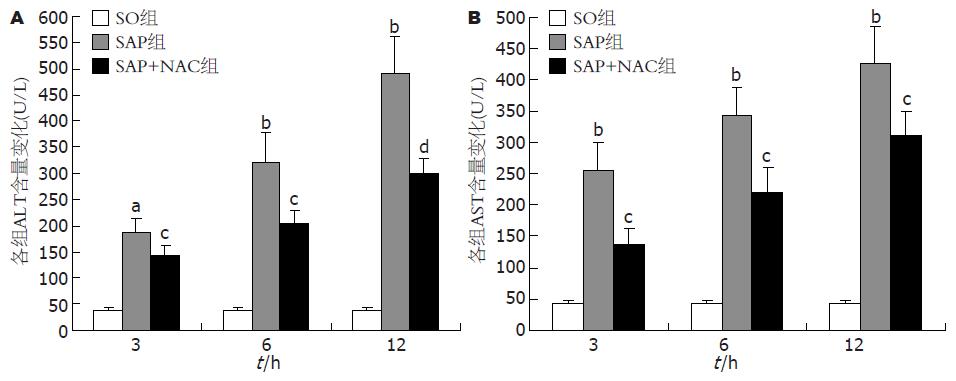
结果: SO组血液ALT、AST以及肝胰组织病理无显著性变化. SAP组各时间点肝胰病理改变较SO组严重, 术后3、6和12 h时间点ALT及AST均较SO组显著升高(186.67±27.28, 321.17±56.14, 492.50±69.77 vs 36.83±7.02; 255.50±44.15, 343.17±43.70, 425.33±58.37 vs 41.67±5.35, P<0.05或0.01); TNF-α mRNA表达均显著高于SO组(0.37±0.03, 0.77±0.04, 0.54±0.04 vs 0.24±0.03, P<0.05或0.01); NF-κB活性术后3、6 h均显著高于SO组(51.95±4.76, 24.67±4.93 vs 9.33±2.05, P<0.05或0.01), 12 h与SO组相比差异无显著性意义. SAP+NAC组各时间点肝胰组织病理改变均较SAP组减轻, 术后3-12 h血液ALT及AST水平(143.67±16.62, 203.33±25.41, 301.17±26.82; 136.33±26.27, 221.50±38.31, 310.50±38.17)均显著低于SAP组(P<0.05或0.01); 各时间点肝脏TNF-α mRNA表达(0.25±0.03, 0.50±0.05, 0.43±0.03)显著低于SAP组(P<0.05或0.01); 术后3-6 h NF-κB活性(37.60±6.37, 12.88±2.66)均较SAP组显著降低(P<0.05).
结论: NF-κB活化与TNF-α mRNA表达上调参与了SAP大鼠肝损伤过程, NAC 300 mg/kg预处理能够有效减轻SAP大鼠肝损伤, 其作用机制可能与抑制NF-κB活化进而下调炎性细胞因子TNF-α mRNA表达水平相关.
引文著录: 邹忠东, 张再重, 宋香全, 王烈, 涂小煌, 陈少全, 王瑜. N-乙酰半胱氨酸对重症急性胰腺炎大鼠肝损伤的保护作用. 世界华人消化杂志 2008; 16(34): 3894-3899
Revised: October 14, 2008
Accepted: October 21, 2008
Published online: December 8, 2008
AIM: To investigate the role of nuclear factor-kappa B (NF-κB) activation in liver injury in rats with severe acute pancreatitis (SAP), and to explore the protective effect of N-acetylcysteine (NAC) against SAP-associated liver injury in rats.
METHODS: Forty-two Wistar male rats were divided into sham operation group (SO, n = 6), SAP group (n = 18), and SAP + NAC group (NAC, 300 mg/kg body wt, n = 18). SO group underwent laparotomy only. SAP model was established by retrograde injection of 50 g/L sodium taurocholate into the bili-pancreatic duct in Wistar rats. SAP + NAC group were given NAC 300 mg/kg body weight intaperitoneally 2 h before SAP model was established. Rats were sacrificed at 3, 6 and 12 h after operation. The liver and pancreas tissues were obtained to observe their pathological changes with light microscopy. The levels of serum ALT and AST were determined at three time points (8 rats for each time point). The expression of TNF-α mRNA was detected by reverse transcription polymerase chain reaction (RT-PCR). The activity of NF-κB in liver was examined by immunohistochemical methods.
RESULTS: The levels of serum ALT and AST increased significantly in SAP group as compared with those in SO group at 3, 6 and 12 h (ALT: 186.67 ± 27.28, 321.17 ± 56.14, 492.50 ± 69.77 vs 36.83 ± 7.02; AST: 255.50 ± 44.15, 343.17 ± 43.70, 425.33 ± 58.37 vs 41.67 ± 5.35; P < 0.05 or 0.01). The level of TNF-α mRNA in SAP group was significantly higher than that in SO group at 3, 6 and 12 h (0.37 ± 0.03, 0.77 ± 0.04, 0.54 ± 0.04 vs 0.24 ± 0.03; P < 0.05 or 0.01). The activity of NF-κB was also higher in SAP group than that in SO group at 3 or 6 h (51.95 ± 4.76, 24.67 ± 4.93 vs 9.33 ± 2.05; P < 0.01 or 0.05). Liver and pancreas pathological damages were more severe in SAP group than those in SO group under light microscope. In SAP + NAC group, the levels of serum ALT and AST (143.67 ± 16.62, 203.33 ± 25.41, 301.17 ± 26.82; 136.33 ± 26.27, 221.50 ± 38.31, 310.50 ± 38.17) decreased significantly in comparison with those in SAP group (P < 0.05 or 0.01), and the expression of TNF-α mRNA was significantly lower than that in SAP group at the three time points (0.25 ± 0.03, 0.50 ± 0.05, 0.43 ± 0.03, P < 0.05 or 0.01). The activity of NF-κB in SAP + NAC group was lower than that in SAP group at 3 or 6 h (37.60 ± 6.37, 12.88 ± 2.66, P < 0.05).
CONCLUSION: NF-κB activation and TNF-α mRNA up-regulation involve in the pathogenesis of liver injury in SAP rats. NAC at a dose of 300 mg/kg can alleviate the pathological damage to liver, and its mechanism might relate to inhibition of NF-κB activation and reduction of cytokines such as TNF-α.
- Citation: Zou ZD, Zhang ZZ, Song XQ, Wang L, Tu XH, Chen SQ, Wang Y. Protective effects of N-acetylcysteine against liver injury in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2008; 16(34): 3894-3899
- URL: https://www.wjgnet.com/1009-3079/full/v16/i34/3894.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i34.3894
重症急性胰腺炎(severe acute pancreatitis, SAP)引起的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS), 是SAP病情危重、发展迅速、并发症和死亡率较高的主要原因, 肝脏是这一病变过程中最常见的受累胰外器官之一[1]. NF-κB可调控包括炎性细胞因子在内的多种基因表达, 在SAP及其相关SIRS和MODS的发生与发展中扮演着重要角色[2-3]. 有研究表明, 一定剂量的N-乙酰半胱氨酸(N-acetylcysteine, NAC)预处理对实验性SAP具有一定防护作用, 并可减轻SAP相关肝损伤严重程度, 但其作用机制仍未阐明[4]. 本研究旨在探讨SAP大鼠肝组织NF-κB活化与肝损伤的关系, 以及NAC防护SAP大鼠肝损伤的作用机制.
成年健康♂清洁级Wistar大鼠42只, 体质量220-250 g, 由中国科学院上海实验动物中心提供(符合国标GB14922-94 SPF级质量标准), 在SPF条件下适应性饲养1 wk. 乙酰半胱氨酸注射液(NAC)(国药准字H20051788)购自杭州民生药业集团有限公司, 牛黄胆酸钠购自Sigma公司(用生理盐水配制成浓度为50 g/L的溶液), TRIzol试剂(美国Invitrogen公司), Taq DNA聚合酶、PCR 缓冲液和dNTPs(美国Promega公司), NF-κB p65 mAb购自Santa Cruz公司, SP免疫组化和DAB显色试剂盒(福建福州迈新生物技术开发有限公司), AU 2700型全自动生化分析仪(日本Olympus公司), PCR扩增仪为德国Eppendorf公司产品, PCR引物由上海生工生物工程技术服务有限公司合成.
1.2.1 分组: 42只成年健康♂Wistar大鼠按随机数字表法分为3组, SAP组(SAP, n = 18) 采用胆胰管逆行注入50 g/L牛黄胆酸钠溶液建立SAP模型; SAP+NAC组(SAP+NAC, n = 18)建模前2 h先给予腹腔注射NAC 300 mg/kg体质量预处理; 假手术组(SO, n = 6)开腹后仅翻动十二指肠和胰腺. 前两组根据不同时间点再分为建模后3、6和12 h共3个亚组.
1.2.2 SAP模型制备: 参考文献[5]制备SAP模型, 实验前大鼠禁食12 h, 自由饮水. 以戊巴比妥钠(40 mg/kg体质量)ip麻醉大鼠后, 严格无菌条件下, 上腹正中切口进腹, 找到胆胰管汇入十二指肠乳头处, 4号头皮静脉针于十二指肠乳头附近穿刺十二指肠壁, 进入胆胰管, 并逆行刺入胆胰管约0.5 cm深度, 同时动脉夹夹闭肝门处胆总管, 匀速注入50 g/L牛黄胆酸纳溶液l mL/kg, 滞留2 min后去除动脉夹和针头, 保持管内压力10 min, 关腹. 术后10 min尾静脉注射生理盐水5 mL/kg体质量, 以补充术中丢失的液体.
1.2.3 标本采集及指标检测: 各组大鼠在规定的时间点注射致死剂量的戊巴比妥钠(200 mg/kg体质量)安乐处死, 严格无菌条件下采取肝胰组织和血液标本. 检测指标及方法如下: (1)肝胰组织形态学观察: 取肝胰相同部位标本2 cm左右, 40 g/L甲醛溶液固定, 修剪、脱脂、石蜡包埋和切片, 苏木精-伊红(HE)染色, 光镜下观察肝胰病理改变. (2)肝功能指标测定: 取下腔静脉血液2 mL, 3000 r/min离心10 min, 取上层血清-20 ℃保存, 借助AU 2700型自动生化分析仪测定肝功能指标ALT和AST. (3)肝组织TNF-α mRNA表达: 用半定量RT-PCR检测TNF-α mRNA表达. 取液氮冻存肝组织, 用TRIzol试剂一步法抽提肝样品总RNA, 通过读取其在分光光度计260 nm和280 nm处的吸收值, 测定RNA浓度和纯度. 随机引物法将RNA逆转录为cDNA, 再以TNF-α引物进行PCR扩增, β-肌动蛋白(β-actin)作为内参照. TNF-α引物上游序列为: 5'-GCCAATGGCATGGATCTCAAAG-3', 下游序列为: 5'-CAGAGCAATGACTCCAAAGT-3', 扩增片段357 bp; β-actin上游序列为: 5'-CACGATGGAGGGGCCGGACTCATC-3', 下游序列为: 5'-TAAAGACCTCTATGCCAACACAGF-3', 引物扩增片段241 bp. PCR条件为: 94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸1 min, 共35次循环后, 72 ℃延伸8 min. 取5 μL PCR扩增反应产物在20 g/L琼脂糖凝胶中电泳, 采集图像后测定目的基因TNF-α和β-actin基因的电泳条带灰度值, 以两者比值表示待测基因mRNA相对含量. (4)肝脏NF-κB活性检测: 参考文献[1]方法, 用常规免疫组化方法检测肝脏NF-κB活性. 肝组织迅速用中性甲醛溶液固定, 常规脱水、石蜡包埋, 制备4 μm厚连续切片. 采用免疫组织化学链霉素抗生物素蛋白-过氧化酶连接法(SP法), 进行免疫组化染色. 操作按照SP免疫组化试剂盒说明进行. 一抗工作浓度为1:100. 用磷酸缓冲液(PBS)代替一抗作为空白对照. 结果判定: 阳性细胞为细胞或(和)细胞质呈棕黄色染色. 在10个高倍视野(10×40)下观察阳性肝细胞数N1和总细胞数N, 阳性率 = N1/N×100%.
统计学处理 应用SPSS13.0软件包, 计量数据用mean±SD描述, 采用单因素方差分析(One-way ANOVA), P<0.05为差异有显著性意义.
大体观察: SO组胰腺未见明显改变; SAP组各时间点均可见腹腔内血性腹水, 胰腺充血水肿、出血坏死, 胰腺颜色逐渐变深, 呈渐进性病理改变; SAP+NAC组各时间点上述变化均较SAP组明显减轻. 光镜下: SO组胰腺形态结构未见异常, 偶可见腺叶间隙增宽; SAP组各时间点可见不同程度的腺叶间灶性水肿、无结构坏死区和组织间隙红细胞分布, 并可见大量炎性细胞浸润, 坏死腺泡细胞呈点状、片状分布, 其中以12 h病理改变最为明显; SAP+NAC组各时间点胰腺水肿、出血、坏死, 炎性细胞浸润程度均较SAP组同时间点明显减轻.
大体观察: SO组肝脏呈鲜红色, 表面光滑, 无渗出, 无充血, 未见明显改变; SAP组各时间点均可见不同程度充血、肿胀, 颜色变深, 12 h可见散在性浅黄色坏死灶; SAP+NAC组各时间点上述变化均较SAP组明显减轻. 光镜下: SO组肝脏形态结构未见明显异常, 偶可见肝窦扩张; SAP组各时间点可见不同程度的肝窦扩张, 肝细胞肿胀变性, 肝实质内点状或斑块状出血坏死, 可见明显炎性细胞浸润, 主要集中在汇管区和坏死区域, 并以12 h病理改变最为严重; SAP+NAC组各时间点肝脏病理改变均较SAP组明显减轻.
SO组ALT和AST水平分别为36.83±7.02 U/L和41.67±5.35 U/L, 均在正常范围; SAP组3-12 h ALT和AST水平呈逐渐上升趋势, ALT各时间点均较SO组明显升高(186.67±27.28 vs 36.83±7.02, 321.17±56.14 vs 36.83±7.02, 492.50±69.77 vs 36.83±7.02, P<0.05或P<0.01), AST各时间点均较SO组显著升高(255.50±44.15 vs 41.67±5.35, 343.17±43.70 vs 41.67±5.35, 425.33±58.37 vs 41.67±5.35, P<0.01); SAP+NAC组各时间点血液ALT水平均显著低于SAP组(143.67±16.62 vs 186.67±27.28, 203.33±25.41 vs 321.17±56.14, 301.17±26.82 vs 492.50±69.77, P<0.05或P<0.01), 各时间点血液AST水平均显著低于SAP组(136.33±26.27 vs 255.50±44.15, 221.50±38.31 vs 343.17±43.70, 310.50±38.17 vs 425.33±58.37, P<0.05, 图1).
SAP组肝组织TNF-α mRNA术后3-6 h呈上升趋势, 术后6 h达高峰, 6 h后开始缓慢下降, 但3-12 h均显著高于SO组(0.37±0.03 vs 0.24±0.03, 0.77±0.04 vs 0.24±0.03, 0.54±0.04 vs 0.24±0.03, P<0.05或P<0.01); SAP+NAC组各时间点肝脏TNF-α mRNA表达较SAP组显著降低, 差异有显著性意义(0.25±0.03 vs 0.37±0.03, 0.50±0.05 vs 0.77±0.04, 0.43±0.03 vs 0.54±0.04, P<0.05或 P<0.01)(表1).
NF-κB在SO组仅有少量表达; SAP组NF-κB活性在3 h为高峰, 3-12 h呈下降趋势, 但3-6 h均显著高于SO组(51.95±4.76 vs 9.33±2.05, 24.67±4.93 vs 9.33±2.05, P<0.05或P<0.01), 12 h与SO组相比差异无显著性意义; SAP+NAC组NF-κB活性3-6 h均较SAP组显著降低(37.60±6.37 vs 51.95±4.76, 12.88±2.66 vs 24.67±4.93, P<0.05), 12 h与SAP组和SO组相比差异无显著性意义(表1).
SAP是外科常见的急腹症, 发病迅速, 病情凶险, 并发症较高, 临床死亡率常高达10%-20%, 甚至超过30%[1]. 目前认为, 胰腺腺泡细胞早期产生和释放的过多炎性细胞因子, 出现失控的炎症级联反应, 诱发或加重SIRS, 并产生MODS, 是导致SAP发生及其复杂化的主要原因[6-7]. 肝脏作为胰腺血液回流心脏的必经器官, 肝枯否(Kupffer)细胞占整个机体单核巨噬细胞的50%, 固定巨噬细胞群的80%-90%, 是产生炎性细胞因子的主要效应细胞[8], 在临床上肝脏也是SAP最常累及得到胰外器官之一[9]. 肝损伤与SAP病情发展及预后密切相关, 研究SAP肝损伤的作用机制, 对于防护胰外器官损伤, 降低MODS的发生有着重要意义.
TNF-α被认为是在急性胰腺炎中最早升高并起着重要作用的细胞因子, 是与SAP的严重性相关并可作为SAP预后的指标之一[10-11]. 较高浓度的TNF-α不但具有直接损伤机体细胞的作用, 还能够诱发和调控多种炎性细胞因子如IL-1, IL-6, IL-8等的释放, 直接和间接参与引起了机体内两次高水平细胞因子血症, 引起炎症瀑布样级联反应, 进而导致SIRS并继发MODS[12]. 近来研究也表明, NF-κB可以调控下游信号分子TNF-α等众多炎性细胞因子的基因表达, 在SAP发病及其相关SIRS和MODS发生发展过程中扮演关键角色[2,13-14]. Gukovsky et al[15]研究显示, 用NAC阻滞NF-κB活性, 能显著减少胰腺炎症细胞浸润, 降低TNF-α、IL-6等细胞因子基因表达, 有效改善胰腺局部炎症反应, 这也说明NF-κB在SAP发生与发展中发挥关键作用. Zhang et al[16]研究发现, SAP大鼠肝脏中同样存在NF-κB大量激活. 这些研究提示我们, NF-κB表达可能参与了SAP大鼠肝损伤的发生, 通过抑制NF-κB活化进而下调TNF-α mRNA表达是有效防护肝损伤的一个重要途径.
我们研究发现, SAP组大鼠术后3-12 h, 血清ALT和AST显著高于SO组, 胰腺和肝脏病理改变较SO组严重; 肝脏TNF-α mRNA表达3-6 h呈上升趋势, 3-12 h均显著高于同时间点SO组; SAP建模后3 h出现肝脏NF-κB活化高峰, 3-12 h呈持续降低趋势; 这些结果表明NF-κB活化与TNF-α表达上调参与介导了SAP大鼠肝损伤的发生与发展. 我们应用抗氧化剂NAC预处理, 可以显著抑制SAP大鼠肝脏NF-κB活化和TNF-α mRNA表达, 降低血中ALT和AST水平, 有效减轻肝脏病理改变程度, 提示NAC可能通过抑制NF-κB活化并下调细胞因子TNF-α mRNA表达, 来发挥保护肝脏的作用, 减轻SAP大鼠肝损伤严重程度.
因此, 我们认为NF-κB活化和TNF-α mRNA表达参与了SAP肝损伤, NF-κB活化并上调TNF-α等细胞因子基因表达在SAP肝损伤发生与发展中起着关键作用; 适当抑制NF-κB活化能够下调TNF-α等细胞因子基因表达, 并减轻SAP相关肝损伤的严重程度. NAC具有保护肝脏、减轻SAP肝损伤的作用, 值得进一步深入研究.
重症急性胰腺炎(SAP)常并发全身炎症反应综合征和多器官功能障碍综合征. 肝脏是主要受累的胰外器官之一, 肝损伤与SAP病情发展和预后密切相关. 有效防护SAP肝损伤对降低胰外器官损伤, 减轻SAP复杂化具有重要意义.
孙诚谊, 教授, 贵阳医学院附属医院院长办; 王春友, 教授, 华中科技大学同济医学院附属协和医院胰腺外科中心
近年研究发现, NF-κB和炎性细胞因子TNF-α在SAP肝损伤发生与发展中发挥关键作用, 逐渐成为国内外学者研究的最新热点之一.
本文通过检测TNF-α mRNA表达和NF-κB活化情况, 从基因调控的角度探讨SAP肝损伤的发病机制, 并进一步揭示了NAC防治SAP肝损伤的可能作用机制.
该研究课题阐述了TNF-α和NF-κB在SAP肝损伤的发病中的作用, 并探讨了可能的防治策略, 为防治SAP肝损伤提供了实验和理论依据, 对SAP肝损伤新型治疗药物的开发具有一定指导意义.
N-乙酰半胱氨酸: 为左旋精氨酸的天然衍生物, 分子式为C5H9NO3S, 分子质量163.20, 是一种抗氧化剂和体内活性氧自由基清除剂, 可抑制炎症介质和促炎细胞因子的生成, 同时具有保护肝脏的作用.
本文具有一定新颖性、科学性和先进性.
编辑: 李军亮 电编: 何基才
| 1. | Zhao YF, Zhai WL, Zhang SJ, Chen XP. Protection effect of triptolide to liver injury in rats with severe acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2005;4:604-608. [PubMed] |
| 2. | Rakonczay Z Jr, Hegyi P, Takács T, McCarroll J, Saluja AK. The role of NF-kappaB activation in the pathogenesis of acute pancreatitis. Gut. 2008;57:259-267. [PubMed] [DOI] |
| 3. | Xia SH, Fang DC, Hu CX, Bi HY, Yang YZ, Di Y. Effect of BN52021 on NFkappa-Bp65 expression in pancreatic tissues of rats with severe acute pancreatitis. World J Gastroenterol. 2007;13:882-888. [PubMed] |
| 4. | Demols A, Van Laethem JL, Quertinmont E, Legros F, Louis H, Le Moine O, Devière J. N-acetylcysteine decreases severity of acute pancreatitis in mice. Pancreas. 2000;20:161-169. [PubMed] [DOI] |
| 5. | Wang G, Sun B, Gao Y, Meng QH, Jiang HC. The effect of emodin-assisted early enteral nutrition on severe acute pancreatitis and secondary hepatic injury. Mediators Inflamm. 2007;2007:29638. [PubMed] |
| 6. | Almeida JL, Sampietre SN, Mendonça Coelho AM, Trindade Molan NA, Machado MC, Monteiro da Cunha JE, Jukemura J. Statin pretreatment in experimental acute pancreatitis. JOP. 2008;9:431-439. [PubMed] |
| 7. | Zhang Q, Ni Q, Cai D, Zhang Y, Zhang N, Hou L. Mechanisms of multiple organ damages in acute necrotizing pancreatitis. Chin Med J (Engl). 2001;114:738-742. [PubMed] |
| 9. | Zhang XP, Zhang L, Wang Y, Cheng QH, Wang JM, Cai W, Shen HP, Cai J. Study of the protective effects of dexamethasone on multiple organ injury in rats with severe acute pancreatitis. JOP. 2007;8:400-412. [PubMed] |
| 10. | Malleo G, Mazzon E, Siriwardena AK, Cuzzocrea S. TNF-alpha as a therapeutic target in acute pancreatitis--lessons from experimental models. ScientificWorldJournal. 2007;7:431-448. [PubMed] [DOI] |
| 12. | Zyromski N, Murr MM. Evolving concepts in the pathophysiology of acute pancreatitis. Surgery. 2003;133:235-237. [PubMed] [DOI] |
| 13. | Rakonczay Z Jr, Jármay K, Kaszaki J, Mándi Y, Duda E, Hegyi P, Boros I, Lonovics J, Takács T. NF-kappaB activation is detrimental in arginine-induced acute pancreatitis. Free Radic Biol Med. 2003;34:696-709. [PubMed] [DOI] |
| 14. | Chen X, Ji B, Han B, Ernst SA, Simeone D, Logsdon CD. NF-kappaB activation in pancreas induces pancreatic and systemic inflammatory response. Gastroenterology. 2002;122:448-457. [PubMed] [DOI] |
| 15. | Gukovsky I, Gukovskaya AS, Blinman TA, Zaninovic V, Pandol SJ. Early NF-kappaB activation is associated with hormone-induced pancreatitis. Am J Physiol. 1998;275:G1402-G1414. [PubMed] |
| 16. | Zhang XP, Zhang L, Chen LJ, Cheng QH, Wang JM, Cai W, Shen HP, Cai J. Influence of dexamethasone on inflammatory mediators and NF-kappaB expression in multiple organs of rats with severe acute pancreatitis. World J Gastroenterol. 2007;13:548-556. [PubMed] [DOI] |