修回日期: 2008-10-30
接受日期: 2008-11-03
在线出版日期: 2008-11-28
目的: 研究乙型肝炎肝硬变患者HBV共价闭合环状DNA(cccDNA)在肝组织和外周血中的分布及临床应用.
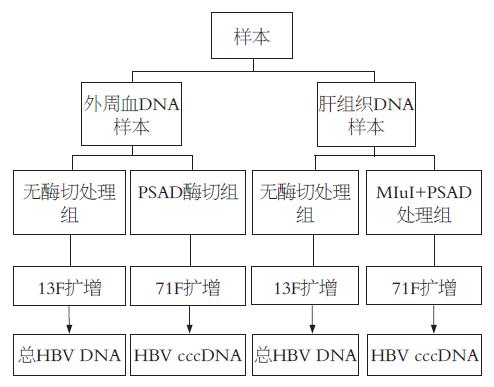
方法: 选取60例乙型肝炎肝硬变患者肝组织和外周血样本, 外周血样本以不降解质粒的ATP依赖的DNA酶(PSAD)进行酶切, 肝组织样本以限制性内切酶MluⅠ联合PSAD酶切, 而后进行荧光定量PCR检测.
结果: 60例乙型肝炎肝硬变患者外周血HBV cccDNA均阴性, 肝组织HBV cccDNA阳性24例(40.00%), 在HBeAg(+)组、HBeAg(-)HBeAb(-)组、HBeAb(+)组分布分别为66.67%、52.94%和26.47%, 定量结果在3组呈递减趋势, 且HBeAg(+)组与HBeAb(+)组差异存在统计学意义(P<0.05). 肝组织HBV cccDNA占总HBV DNA 0%-7.77%, 肝组织HBV cccDNA与肝组织总HBV DNA存在相关性(r = 0.53, P<0.01), 与外周血总HBV DNA无相关性(r = 0.18, P = 0.18), 与ALT、TBIL均无相关性(r = 0.15, P = 0.25; r = 0.01, P = 0.94).
结论: 乙型肝炎肝硬变患者外周血检测不到HBV cccDNA, 肝组织HBV cccDNA占总HBV DNA比例较低, HBeAg(+)患者病毒复制最为活跃.
引文著录: 李莹, 韩涛, 高英堂, 刘磊, 王毅军, 景丽, 张涛, 杜智. 乙型肝炎肝硬变患者外周血和肝组织中HBV cccDNA的定量检测. 世界华人消化杂志 2008; 16(33): 3752-3758
Revised: October 30, 2008
Accepted: November 3, 2008
Published online: November 28, 2008
AIM: To investigate the distribution of hepatitis B virus (HBV) covalently closed circular DNA (cccDNA) in peripheral blood and liver tissues of liver cirrhosis patient with hepatitis B virus infection.
METHODS: DNA was extracted from serum and liver biopsy samples of 60 cirrhotic patients with hepatitis B virus infection. The serum samples were treated with Plasmid-Safe ATP dependent Dnase (PSAD), while the liver biopsy samples were digested with restriction enzymes MluI and PSAD to reduce non-HBV cccDNA; then the total HBV DNA and cccDNA were measured by the real-time PCR assay.
RESULTS: HBV cccDNA was negative in all the serum samples, but positive in 40% (24/60) hepatic biopsy samples. In HBeAg-positive, HBeAg-negative plus HBeAb-negative, and HBeAb-positive hepatic tissues, HBV cccDNA positive rate was 66.7%, 52.9% and 26.5%, respectively. Meanwhile, the positive rate had significant difference between HBeAg-positive group and HBeAb-positive group (P < 0.05). Intrahepatic cccDNA accounted for 0%-7.77% of total HBV DNA, and there was a significant correlation between intrahepatic cccDNA and total HBV DNA (r = 0.53, P < 0.01). Intrahepatic cccDNA had no correlation with the total HBV DNA in the serum samples, as well as with ALT and TBIL levels (r = 0.15, P = 0.25; r= 0.01, P = 0.94).
CONCLUSION: HBV cccDNA can not be detected in peripheral blood of cirrhotic patients with hepatitis B virus infection. Intrahepatic cccDNA accounts for a small proportion of the total HBV DNA. Replication of HBV is the most active in HBeAg-positive patients.
- Citation: Li Y, Han T, Gao YT, Liu L, Wang YJ, Jing L, Zhang T, Du Z. Quantification of hepatitis B virus covalently closed circular DNA in peripheral blood and hepatic tissues of cirrhotic patients with hepatitis B. Shijie Huaren Xiaohua Zazhi 2008; 16(33): 3752-3758
- URL: https://www.wjgnet.com/1009-3079/full/v16/i33/3752.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i33.3752
乙型肝炎病毒(hepatitis B virus, HBV)感染影响全球约35000万人, 每年约100万人死于终末期肝硬化或肝细胞癌[1-3]. 共价闭合环状DNA(cccDNA)是HBV的重要复制中间体, 肝细胞核内存在稳定的HBV cccDNA池[4], 对HBV的复制及感染状态的建立具有十分重要的意义[5]. 大量实验表明, 抗病毒药物对其影响甚微, HBV cccDNA很难被彻底清除[6], 是停药后复发的主要原因[7-8], 所以HBV cccDNA是彻底清除HBV的关键, 监测HBV cccDNA可以辅助评价抗病毒疗效和预后. 而目前尚无较理想的HBV cccDNA定量检测方法, 消除非特异性扩增仍为一难题, 且HBV cccDNA在乙型肝炎肝硬变患者中研究较少, 我们力求建立一种较为特异的HBV cccDNA定量检测方法, 并在此基础上对我院60例HBV感染肝硬变患者外周血及肝组织中HBV cccDNA的存在状况进行检测分析.
1.1.1 病例资料及标本来源: 60份肝组织标本及对应外周血标本, 均取自天津市第三中心医院2003-12/2006-08住院患者, 男51例, 女9例; 年龄最大75岁, 最小22岁, 平均53.4±11.5岁. 其中60例均为乙型肝炎肝硬变患者, 按照病毒标志物分为3组, HBeAg(+)组9例, HBeAg(-)HBeAb(-)组17例, HBeAb(+)组34例. 没有HBsAg与抗-HCV均(+)的患者. 诊断符合2000年病毒性肝炎防治方案中的诊断标准[9]. 肝组织经肝穿刺活检取得后立即移入-80 ℃冰箱保存, 外周血样本于肝穿刺当日采集, 并保存于-80 ℃冰箱. 病毒标志物和肝功能血清指标检测采用ELISA检测, 试剂盒为华美生物工程公司产品. 限制性内切酶MluⅠ(北京天根生化科技有限公司), 不降解质粒的ATP依赖的DNA酶(PSAD, 美国Epioentre公司), ABI7000荧光定量PCR扩增仪(美国ABI公司) Realtime PCR(Toyobo公司).
1.1.2 引物及探针: 依据GenBank选取HBV常见B、C基因型菌株50株的全基因组序列, 结合HBV rcDNA、cccDNA结构特点选择相对保守序列设计引物/探针(表1). 引物/探针均由上海基康生物有限公司合成.
| 引物及探针 | 序列(5'-3') | 位置(nt) | |
| 总HBV DNA检测 | 13F | AGAGGACTCTTGGACTCTCAGCAA | 1659-1682 |
| 引物/探针(简称13F) | 93R | CCTCCCAGTCTTTAAACAAACAGTC | 1715-1739 |
| 38T | FAM-TCAACGACCGACCTT-MGB | 1685-1699 | |
| HBV cccDNA检测 | 71F | ATCTGCCGGACCGTGTGC | 1567-1584 |
| 引物/探针(简称71F) | 381R | TTGGAGGCTTGAACAGTAGGA | 1857-1877 |
| 96T | FAM-GCACGTCGCATGGAGA-MGB | 1601-1616 | |
| 重组质粒制备 | 276F | ACGGGGCGCACCTCTCTTTACG | 1521-1542 |
| 引物(简称276F) | 644R | CAAGGCACAGCTTGGAGGCTTGAAC | 1864-1888 |
1.1.3 质粒标准品: 选取乙型肝炎病毒C基因型样本应用276F进行PCR扩增, 得到369 bp扩增产物, 将此片断连接至PGMT载体(北京天根生化科技有限公司), 连接产物导入DH5α感受态细胞(北京天根生化科技有限公司), 碱裂解法提取重组质粒并纯化, 琼脂糖凝胶电泳鉴定, 紫外分光光度计测量A值, 根据分子质量计算得出重组质粒原始浓度.
1.2.1 核酸抽提: (1)肝组织总DNA提取: 采用常规蛋白酶K消化、酚一氯仿抽提, 产物溶解于100 µL TE缓冲液中. (2)外周血HBV DNA提取: 取患者血清10 µL, 加HBV病毒裂解液10 µL混匀, 37 ℃ 1 h, 加入中和液20 µL混匀, 取2 µL上清液做PCR模板.
1.2.2 限制性内切酶MluⅠ酶切: 5 µL(0.5 µg)肝组织DNA样本, 加2 µL 10×MluⅠ缓冲液, 1µL MluⅠ(15 U/µL), 去离子水12 µL, 总体积20 µL; 设置空白对照(用水代替DNA样品)和重组质粒阳性对照. 混匀后置于37 ℃水浴酶切4 h, 100 ℃煮沸灭活内切酶.
1.2.3 不降解质粒的ATP依赖的DNA酶切: 2 µL 10×PSAD缓冲液, 0.8 µL 25 mmol/L ATP, 1 µL PSAD(10 U/µL), 去离子水11.2 µL, MluⅠ消化产物或外周血DNA样本5 µL, 总体积20 µL. 与MluⅠ一致同时设置空白对照及重组质粒阳性对照. 样本混匀后置于37 ℃水浴酶切12-16 h. 于70 ℃水浴30 min灭活PSAD.
1.2.4 荧光定量PCR检测: 应用ABI7000荧光定量PCR扩增仪进行检测, 反应体系: 上游引物1 µL, 下游引物1 µL, 探针1 µL, Realtime PCR Master Mix 20 µL, 模板2 µL, 总反应体积25 µL. 循环参数: 1. 预变性37 ℃ 5 min; 2. 变性94 ℃ 2 min, 退火94 ℃ 15 s, 延伸60 ℃ 40 s, 共45个循环. 每次荧光定量检测均设空白对照(样本具体处理检测步骤如图1).
统计学处理 采用SPSS13.0软件进行统计学分析, 多组间比较采用ANOVA分析, 两组配对数据比较采用配对t检验, 数据相关性分析采用线性相关性分析.
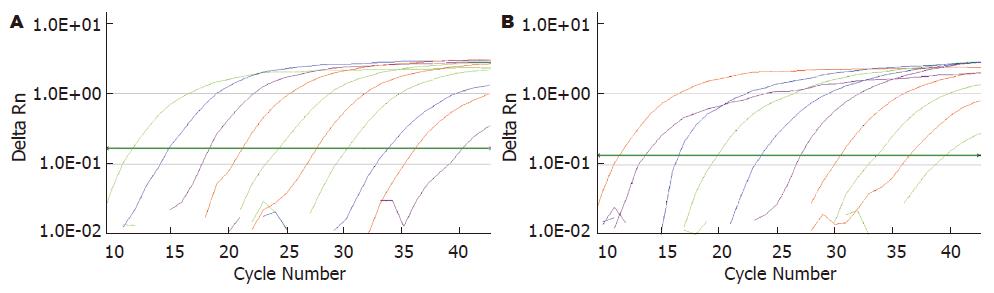
2.1.1 敏感性: 取105-1014拷贝/L的重组质粒梯度稀释产物, 用13、71F重复进行荧光定量PCR扩增, 同时PCR产物进行琼脂糖凝胶电泳. 重复3次PCR扩增可以获得稳定一致结果, 且与琼脂糖凝胶电泳结果对应性良好, 13、71F检测限为105拷贝/L, 检测线性范围2.4×105-2.4×1014拷贝/L. 梯度稀释扩增曲线如图2.
2.1.2 特异性: 酶切反应及每次荧光PCR反应设置的空白对照定量检测结果均阴性, 排除酶切样本操作和荧光PCR反应中存在污染的可能性. 酶切反应设置的重组质粒平行阳性对照与未经酶切处理的重组质粒定量检测结果无统计学差异(P = 1.0), 排除酶切反应体系对荧光PCR反应抑制可能性. 基于上述基础我们得到60例乙型肝炎肝硬变患者外周血、肝组织DNA样本定量结果如表2, HBV cccDNA定量结果较总HBV DNA降低4-5个log值, 根据13、71F两对引物梯度扩增曲线, 验证两对引物扩增效率一致, 说明HBV cccDNA定量数值低并非由于可能存在的扩增抑制或选择性引物扩增效率低等因素造成的, 而更可能是此操作流程显著提高了HBV cccDNA荧光定量PCR检测的特异性.
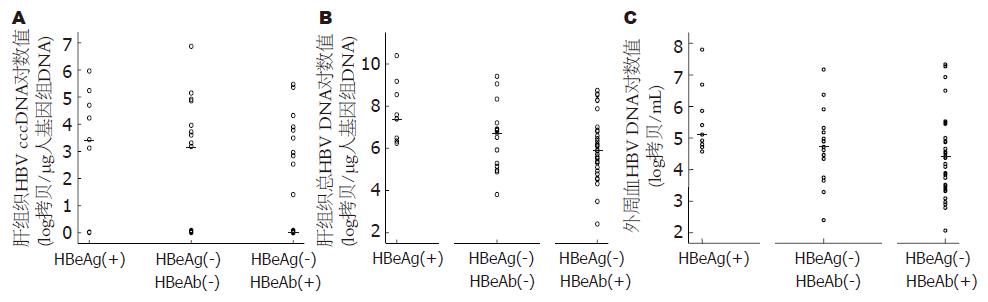
外周血HBV cccDNA检出率为0%; 肝组织总检出率40.00%, 其中HBeAg(+)组、HBeAg(-)HBeAb(-)组、HBeAb(+)组检出率分别为66.67%、52.94%、26.47%, 各组HBV cccDNA定量值见表3, HBeAb(+)组低于HBeAg(+)组, 且存在统计学意义(P = 0.02), HBeAg(-)HBeAb(-)组与HBeAg(+)组定量结果虽无统计学差异(P = 0.46), 但前者亦低于后者. 同时我们对上述三组患者肝组织和外周血总HBV DNA亦分别进行比较, 结果与肝组织HBV cccDNA比较结果一致, [肝组织总HBV DNA: HBeAg(+)组 vs HBeAb(+)组: 7.73±1.41 vs 6.03±1.45, P<0.01; HBeAg(+)组 vs HBeAg(-)HBeAb(-)组: 6.66±1.65 vs 7.73±1.41, P = 0.09; 外周血总HBV DNA: HBeAg(+)组 vsHBeAb(+)组: 5.54±1.08 vs 4.51±1.35, P = 0.03; HBeAg(+)组 vs HBeAg(-)HBeAb(-)组: 4.73±1.14 vs 5.54±1.08, P = 0.12, 图3].
| HBeAg(+) | HBeAg(-)HBeAb(-) | HBeAb(+) | |||||||
| 最大值 | 最小值 | mean±SD | 最大值 | 最小值 | mean±SD | 最大值 | 最小值 | mean±SD | |
| 肝组织(log拷贝/μg人基因组DNA) | |||||||||
| HBV DNA | 10.40 | 6.24 | 7.73±1.41 | 9.42 | 3.81 | 6.66±1.65 | 8.75 | 2.41 | 6.03±1.45 |
| HBV cccDNA | 5.96 | 0 | 2.96±2.38 | 6.87 | 0 | 2.33±1.41 | 5.47 | 0 | 1.06±0.79 |
| 外周血(log拷贝/mL) | |||||||||
| HBV DNA | 7.80 | 4.57 | 5.54±1.08 | 7.17 | 2.40 | 4.73±1.14 | 7.33 | 2.07 | 4.51±1.35 |
| HBV cccDNA | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
同一患者肝组织中HBV cccDNA占总HBV DNA比例0%-7.77%. 其中HBeAg(+)组比例范围0%-7.77%, 均数0.88%; HBeAg(-)HBeAb(-)组比例范围0%-3.72%, 均数0.45%; HBeAb(+)组比例范围0%-4.66%, 均数0.38%, 三组比较无统计学差异(P = 0.59).
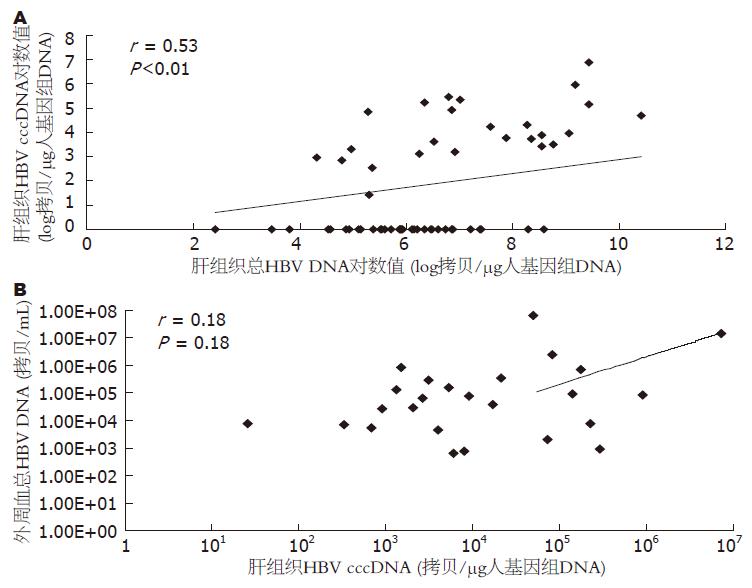
肝组织HBV cccDNA与其对应肝组织总HBV DNA呈正相关(r = 0.53, P<0.01), 与外周血总HBV DNA无明显相关性(r = 0.18, P = 0.18, 图4).
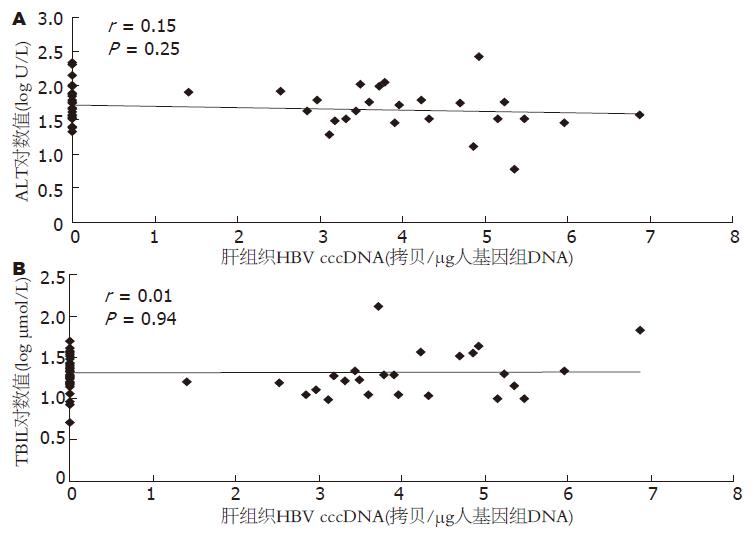
肝组织HBV cccDNA与其对应ALT、TBIL均无明显相关性, 如图5. 肝组织和外周血总HBV DNA与ALT、TBIL亦无明显相关性(肝组织总HBV DNA与ALT: r = 0.02, P = 0.89; 肝组织总HBV DNA与TBIL: r = 0.06, P = 0.67; 外周血总HBV DNA与ALT: r = 0.18, P = 0.17; 外周血总HBV DNA与TBIL: r = 0.21, P = 0.11).
HBV cccDNA选择性引物能够优先扩增HBV cccDNA, 但对于rcDNA, 由于上下游引物均能延伸生成部分片段, 积累至一定浓度后, 这些只包含单侧引物的片段可自身退火并延伸, 形成含两端引物的PCR模板, 从而产生非特异性扩增[10], 因此, 选择性引物并无绝对的特异性. 我们在以往工作基础上将HBV cccDNA定量检测系统进行优化: (1)设计一对HBV cccDNA选择性扩增引物, 并验证选择性引物与总HBV DNA引物扩增效率一致. (2)扩增前外周血DNA先以PSAD酶切, 肝组织DNA应用限制性内切酶MluⅠ联合PSAD酶切, 选用MluⅠ作用在于, 肝组织DNA分子量大空间结构复杂直接以PSAD酶切效率较低, MluⅠ可将肝组织大分子DNA切割为小片段, 充分发挥PSAD酶切效力, 更好的去除肝组织内病毒整合DNA. 通过酶切处理样本尽可能纯化cccDNA. (3)实验中设置一系列对照, 防止酶切样本操作及荧光定量PCR反应中出现污染, 保证酶切反应体系对荧光定量PCR反应无抑制作用, 充分证明定量结果是由检测方法特异性而得到. 结果显示HBV cccDNA定量值较总HBV DNA降低4-5个log值, 体现建立的HBV cccDNA定量检测方法高特异性.
抗病毒治疗已成为乙型肝炎肝硬变患者一种重要治疗手段, 乙型肝炎肝硬变患者已处于疾病较晚期, 对病毒复制的良好抑制利于阻止病情的进展, 不合理停药会导致病毒复燃、病情恶化, 目前乙型肝炎肝硬变患者抗病毒治疗主张长期性, 对乙型肝炎肝硬变患者体内病毒复制状态及其与其他临床指标关系详尽掌握对临床有很好指导意义, 但目前对病毒复制研究多局限于慢性乙型肝炎, 对乙型肝炎肝硬变患者研究较少, 而乙型肝炎肝硬变患者体内病毒复制情况和慢性乙型肝炎并非完全一致, 所以我们进行了此项研究. 在60例乙型肝炎肝硬变患者HBV cccDNA在外周血及肝组织中分布情况研究中, 发现60例患者外周血样本均未检出HBV cccDNA. 外周血中是否存在HBV cccDNA始终存有争议, 有学者否认外周血中存在HBV cccDNA[11], 也有学者在外周血中检测到HBV cccDNA[12-13]. HBV cccDNA一般只存在于肝细胞核中[14], 感染肝细胞HBV cccDNA通常维持在30-50拷贝/细胞[15], 仅在肝细胞破坏时释放出来, 能够到达外周血的HBV cccDNA含量微乎其微, 且其在外周血中的稳定性也需考证[16], 所以在外周血中很难检测到HBV cccDNA. 但不能除外外周血中存在HBV cccDNA, 可能因含量甚微, 低于检测下限不能检出. 肝组织HBV cccDNA占肝组织总HBV DNA比例仅为0%-7.77%, 低于有些学者研究结果[17], 提示乙型肝炎肝硬变患者病毒复制状态与慢性乙型肝炎不同, 有待我们增加疾病种类及样本量进一步研究.
通过HBV cccDNA、总HBV DNA与肝功能血清指标相关性分析发现, 肝组织HBV cccDNA以及外周血、肝组织总HBV DNA与ALT、TBIL均无相关性, 即变化不具有同步性, 并非病毒活跃复制同时ALT、TBIL值升高, 肝功能损害加重. 原因可能为, HBV本身并不会破坏肝细胞, 肝细胞破坏发生在病毒激发了人体免疫系统, 对病毒感染的肝细胞进行攻击, 从而导致肝细胞的破坏[17]. 从病毒活跃复制到激发人体免疫系统对感染肝细胞进行攻击破坏, 可能存在一定的时间延迟, 最终导致HBV cccDNA与ALT、TBIL变化的不同步性. 有研究显示HBV cccDNA的升高先于ALT、TBIL的升高[18], HBV cccDNA可能成为早期肝细胞破坏预警指标, 我们的实验将对同一患者做动态检测进一步得出结论.
由于肝穿刺活检属于有创性检查, 患者不易接受, 取材困难, 肝组织HBV cccDNA检测的临床应用受到了极大限制, 许多学者在研究肝组织HBV cccDNA与外周血总HBV DNA、HBV cccDNA的关系[12,19-20], 探讨外周血总HBV DNA、HBV cccDNA是否可以间接反映肝组织中病毒的复制状态. 我们的实验结果显示, 外周血总HBV DNA与肝组织HBV cccDNA无相关性, 单纯外周血总HBV DNA检测很难反映肝组织HBV cccDNA情况, Chan et al持相同意见[21], 肝组织HBV cccDNA检测尚不能被取代. 研究中我们还发现肝组织HBV cccDNA与肝组织总HBV DNA虽存在相关性(P<0.01), 但相关系数仅为0.534, 二者变化并不完全一致, 提示肝脏内病毒复制状态可能还与其他因素相关. 有研究应用HBV cccDNA和pgRNA共同反映病毒复制活性[19]. 将外周血DNA、肝组织cccDNA甚至pgRNA等指标结合起来, 可能对患者抗病毒治疗有更好的指导性.
乙型肝炎肝硬变患者60例根据病毒标志物分为三组: HBeAg(+)组, HBeAg(-)HBeAb(-)组, HBeAb(+)组. 我们建立的HBV cccDNA定量检测方法, 通过引物设计较好地去除非病毒DNA混杂因素对结果的影响, 通过限制性内切酶联合PSAD共同消化样本尽可能减少总HBV DNA中非cccDNA混杂因素对结果的影响, 保证实验结果可靠. 在此基础上我们得到肝组织HBV cccDNA占肝内总HBV DNAd 比例在上述三组间虽无统计学差异, 但HBeAg(+)组高于其他两组, HBeAb(+)组最低. 同时总HBV DNA、HBV cccDNA定量结果HBeAg(+)组明显高于其他两组(P<0.05), HBeAb(+)组仍为最低, 可以看出HBeAg(+)组病毒复制最为活跃, HBeAb(+)组即发生HBeAg血清学转换患者病毒复制受到很大抑制, HBeAg转阴组虽低于HBeAg(+)组, 但病毒复制活性仍高于发生HBeAg血清学转换组. 可能由于一部分HBeAg转阴患者是病毒基因序列变异而导致HBeAg检测不出, 并非病毒复制活 性降低. 我们看到乙型肝炎肝硬变患者病毒复制在上述三组中并不相同, 可进一步研究其机制以指导临床.
总之, 我们在建立起可靠的HBV cccDNA特异性定量检测方法的基础上, 深入研究了HBV cccDNA在乙型肝炎肝硬变患者外周血和肝组织中分布及临床意义, 对于判断乙型肝炎肝硬变患者是否应用抗病毒治疗、评价抗病毒治疗疗效以及预测停药后复发提供了强大的辅助手段.
抗病毒治疗已成为乙型肝炎肝硬变患者一种重要治疗手段, 对病毒复制良好抑制利于阻止病情进展, 不合理停药会导致病毒复燃、病情恶化, 对乙型肝炎肝硬变患者体内病毒复制状态详尽掌握对临床有很好指导意义, 目前研究多局限于慢性乙型肝炎,对乙型肝炎肝硬变患者研究较少, 而乙型肝炎肝硬变患者体内病毒复制和慢性乙型肝炎并非完全一致, 因此有必要进行此项研究.
成军, 教授, 北京地坛医院传染病研究所
HBV cccDNA在肝组织及肝外组织如外周血、白细胞等定量检测始终是研究热点, 同时研究HBV cccDNA与疾病其他临床指标关系, 以指导临床. 不同检测方法会得到不同结果, 检测结果不可靠会误导临床治疗, 目前缺乏一种快速简便特异的HBV cccDNA定量检测方法, 仍需深入研究.
根据文献报道, HBV cccDNA定量检测目前常用方法有选择性PCR(普通PCR、套式PCR、荧光PCR)、侵入者探针法(Invader assaay)、嵌合引物荧光PCR法.
HBV cccDNA Real-time方法定量检测中, 应用PSAD消化肝组织样本前, 加用了限制性内切酶(HBV DNA无酶切位点), 将人基因组大分子DNA切割为小片段, 利于PSAD充分酶切样本, 进一步提高HBV cccDNA检测特异性; HBV cccDNA在乙型肝炎肝硬变患者中研究较少, 本研究对60例乙型肝炎肝硬变患者进行研究, 所得结论对临床有较好指导价值.
本研究在建立起可靠的HBV cccDNA特异性定量检测方法基础上, 深入研究了HBV cccDNA在乙型肝炎肝硬变患者外周血和肝组织中分布及临床意义, 对于判断乙型肝炎肝硬变患者是否应用抗病毒治疗、评价抗病毒治疗疗效以及预测停药后复发提供了强大的辅助手段.
HBV cccDNA: HBV共价闭合环状DNA. HBV脱去外膜进入胞质, 又脱去核壳, 形成HBV松弛环状DNA, HBV rcDNA解脱负链5'端连接的末端蛋白、正链5'端的RNA残段, 以DNA聚合酶延长正链, 将各链缺口封闭, 最后转换为cccDNA分子, cccDNA是HBV的原始复制模板.
本研究符合医学伦理学规范, 采用Real-time方法检测HBV cccDNA国内外已有报道, 因此本文虽具有一定科研与临床价值, 但创新性略有不足. 尤其是作者选择肝硬化患者作为研究对象, 但意义并未充分体现.
编辑: 史景红 电编: 吴鹏朕
| 1. | Mahoney FJ. Update on diagnosis, management, and prevention of hepatitis B virus infection. Clin Microbiol Rev. 1999;12:351-366. [PubMed] |
| 2. | Seeger C, Mason WS. Hepatitis B virus biology. Microbiol Mol Biol Rev. 2000;64:51-68. [PubMed] [DOI] |
| 3. | Kao JH, Chen DS. Global control of hepatitis B virus infection. Lancet Infect Dis. 2002;2:395-403. [PubMed] [DOI] |
| 4. | Wu TT, Coates L, Aldrich CE, Summers J, Mason WS. In hepatocytes infected with duck hepatitis B virus, the template for viral RNA synthesis is amplified by an intracellular pathway. Virology. 1990;175:255-261. [PubMed] [DOI] |
| 5. | Addison WR, Walters KA, Wong WW, Wilson JS, Madej D, Jewell LD, Tyrrell DL. Half-life of the duck hepatitis B virus covalently closed circular DNA pool in vivo following inhibition of viral replication. J Virol. 2002;76:6356-6363. [PubMed] [DOI] |
| 6. | Luscombe C, Pedersen J, Uren E, Locarnini S. Long-term ganciclovir chemotherapy for congenital duck hepatitis B virus infection in vivo: effect on intrahepatic-viral DNA, RNA, and protein expression. Hepatology. 1996;24:766-773. [PubMed] |
| 7. | Singh M, Dicaire A, Wakil AE, Luscombe C, Sacks SL. Quantitation of hepatitis B virus (HBV) covalently closed circular DNA (cccDNA) in the liver of HBV-infected patients by LightCycler real-time PCR. J Virol Methods. 2004;118:159-167. [PubMed] [DOI] |
| 8. | Yokosuka O, Omata M, Imazeki F, Okuda K, Summers J. Changes of hepatitis B virus DNA in liver and serum caused by recombinant leukocyte interferon treatment: analysis of intrahepatic replicative hepatitis B virus DNA. Hepatology. 1985;5:728-734. [PubMed] [DOI] |
| 10. | Köck J, Theilmann L, Galle P, Schlicht HJ. Hepatitis B virus nucleic acids associated with human peripheral blood mononuclear cells do not originate from replicating virus. Hepatology. 1996;23:405-413. [PubMed] |
| 11. | 郝 勇, 苗 千里, 缪 晓辉, 赵 克开, 李 东良, 林 江, 沈 雪林. 慢性乙型肝炎患者外周血单个核细胞及肝组织中HBV cccDNA定量检测. 中华传染病杂志. 2007;1:38-42. |
| 12. | Wong DK, Yuen MF, Yuan H, Sum SS, Hui CK, Hall J, Lai CL. Quantitation of covalently closed circular hepatitis B virus DNA in chronic hepatitis B patients. Hepatology. 2004;40:727-737. [PubMed] [DOI] |
| 13. | Yuen MF, Wong DK, Sum SS, Yuan HJ, Yuen JC, Chan AO, Wong BC, Lai CL. Effect of lamivudine therapy on the serum covalently closed-circular (ccc) DNA of chronic hepatitis B infection. Am J Gastroenterol. 2005;100:1099-1103. [PubMed] [DOI] |
| 14. | Tuttleman JS, Pourcel C, Summers J. Formation of the pool of covalently closed circular viral DNA in hepadnavirus-infected cells. Cell. 1986;47:451-460. [PubMed] [DOI] |
| 15. | Werle-Lapostolle B, Bowden S, Locarnini S, Wursthorn K, Petersen J, Lau G, Trepo C, Marcellin P, Goodman Z, Delaney WE 4th, Xiong S, Brosgart CL, Chen SS, Gibbs CS, Zoulim F. Persistence of cccDNA during the natural history of chronic hepatitis B and decline during adefovir dipivoxil therapy. Gastroenterology. 2004;126:1750-1758. [PubMed] [DOI] |
| 17. | Mohamed R, Desmond P, Suh DJ, Amarapurkar D, Gane E, Guangbi Y, Hou JL, Jafri W, Lai CL, Lee CH. Practical difficulties in the management of hepatitis B in the Asia-Pacific region. J Gastroenterol Hepatol. 2004;19:958-969. [PubMed] [DOI] |
| 18. | Chen Y, Sze J, He ML. HBV cccDNA in patients' sera as an indicator for HBV reactivation and an early signal of liver damage. World J Gastroenterol. 2004;10:82-85. [PubMed] |
| 19. | Laras A, Koskinas J, Dimou E, Kostamena A, Hadziyannis SJ. Intrahepatic levels and replicative activity of covalently closed circular hepatitis B virus DNA in chronically infected patients. Hepatology. 2006;44:694-702. [PubMed] [DOI] |
| 20. | Sung JJ, Wong ML, Bowden S, Liew CT, Hui AY, Wong VW, Leung NW, Locarnini S, Chan HL. Intrahepatic hepatitis B virus covalently closed circular DNA can be a predictor of sustained response to therapy. Gastroenterology. 2005;128:1890-1897. [PubMed] [DOI] |
| 21. | Chan HL, Wong VW, Tse AM, Tse CH, Chim AM, Chan HY, Wong GL, Sung JJ. Serum hepatitis B surface antigen quantitation can reflect hepatitis B virus in the liver and predict treatment response. Clin Gastroenterol Hepatol. 2007;5:1462-1468. [PubMed] [DOI] |