修回日期: 2008-10-30
接受日期: 2008-11-03
在线出版日期: 2008-11-28
目的: 探讨谷氨酰胺保护肠黏膜屏障功能的作用机制.
方法: Caco-2细胞(20-30代)应用含有不同浓度谷氨酰胺(0、0.1、1、4 mmol/L)的DMEM培养液在Transwell上培养21 d, 检测跨上皮电阻的变化. 免疫荧光染色检测紧密连接蛋白occludin的定位、表达. 应用不同裂解液制备NP-40可溶性及不溶性蛋白框架, 分别进行蛋白印迹杂交检测活性和非活性occludin蛋白的相对含量.
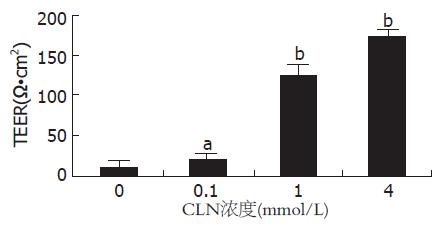
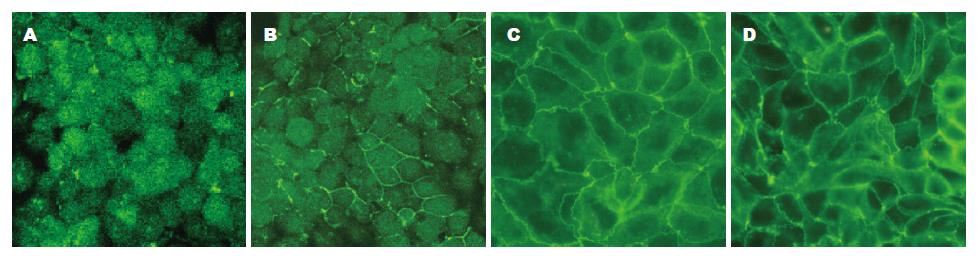
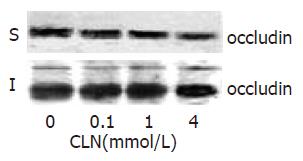
结果: 与0 mmol/L GLN组比较, 补充GLN后, 跨上皮电阻明显升高(21.4±0.1, 124.5±0.3, 173.6±0.2 vs 11.3±0.3, 均P<0.05). 免疫荧光染色可见0 mmmol/L GLN组occludin呈团状分布于细胞胞质内, 随着GLN浓度的增加, occludin阳性荧光染色呈沿细胞膜分布的蜂巢状线性荧光. GLN缺乏不影响65 kDa occludin蛋白的表达, 但能降低85 kDa occludin蛋白的表达(1.04±0.03, 1.17±0.04, 1.29±0.03, 1.43±0.06, P<0.05).
结论: 谷氨酰胺缺乏能够减少活性紧密连接蛋白occludin的表达, 增加肠上皮细胞屏障通透性, 补充GLN能够阻断这些改变.
引文著录: 崔巍, 闻颖, 董亚珞, 刘沛. 谷氨酰胺对体外培养肠上皮细胞屏障通透性的影响. 世界华人消化杂志 2008; 16(33): 3729-3733
Revised: October 30, 2008
Accepted: November 3, 2008
Published online: November 28, 2008
AIM: To explore the mechanism of glutamine (GLN) underlying maintenance of intestinal barrier permeability.
METHODS: Caco-2 cells were placed on Transwell filters and grown in a culture medium composed of DMEM with indicated concentration of GLN (0, 0.1, 1, 4 mmol/L) for 21 d before treatment. Next, transepithelial electrical resistance (TEER) was measured. The localization and expression of tight junction (TJ) protein occludin were measured under immunofluorescence light microscopy. Cells were lysed into detergent-soluble and -insoluble protein fractions and the expression of active or non active occludin protein were measured using Western blot.
RESULTS: Transepithelial electrical resistance was significantly raised following GLN supplementation compared with 0 mmol/L GLN group (21.4 ± 0.1, 124.5 ± 0.3, 173.6 ± 0.2 vs 11.3 ± 0.3, P < 0.05). Immunofluorescence test showed that occludin protein was localized in cytoplasm, with increasing GLN, positive occludin appeared as continuous belt-like structures encircling the cells at the apical cellular junctions in 0 mmol/L GLN group. GLN deprivation did not affect 65-kDa occludin expression, but 85- kDa occludin expression was down-regulated (1.04 ± 0.03, 1.17 ± 0.04, 1.29 ± 0.03, 1.43 ± 0.06, P < 0.05).
CONCLUSION: Deprivation of glutamine decreases active occludin protein expression and increases the intestinal barrier permeability, which is partially reversible with GLN supplementation.
- Citation: Cui W, Wen Y, Dong YL, Liu P. Effect of glutamine on intestinal epithelial barrier permeability in vitro. Shijie Huaren Xiaohua Zazhi 2008; 16(33): 3729-3733
- URL: https://www.wjgnet.com/1009-3079/full/v16/i33/3729.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i33.3729
肠黏膜屏障是机体最重要的免疫防御屏障, 将机体与肠道内的外源性物质隔离开来. 肠黏膜具有屏障功能最重要的解剖基础是肠上皮细胞间具有完整的紧密连接, 封闭了细胞旁间隙, 使得肠上皮细胞仅对离子、氨基酸等营养物质选择性通过. 但在病理情况下(如败血症、烧伤、急性重症胰腺炎等), 紧密连接破坏, 细菌、毒素等有害物质通过肠黏膜屏障进入血液系统, 引起全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)甚至多器官功能衰竭[1-5]. 谷氨酰胺在保护肠黏膜屏障功能方面发挥重要作用, 能够促进肠上皮细胞更新, 减少细菌穿透[6-11], 但是具体的作用机制还不十分清楚, 紧密连接的形成是否参与谷氨酰胺的肠黏膜保护功能还未见报道. 因此, 本文应用Caco-2细胞建立体外肠上皮细胞屏障模型, 观察谷氨酰胺对肠上皮细胞屏障通透性和紧密连接蛋白occludin形成的影响, 以探讨谷氨酰胺肠黏膜保护作用的机制.
DMEM高糖培养基, FBS购自美国Gibco-BRL公司, 非必需氨基酸购自美国Hyclone公司, L-GLN购自美国Sigma公司, 兔抗occludin多克隆抗体购自美国Zymed公司, FITC标记的羊抗兔IgG购自北京中杉金桥公司.
1.2.1 细胞培养及分组: Caco-2细胞来源于人大肠癌细胞, 可分化成有极性的肠上皮细胞. 将分化良好的Caco-2细胞接种于Transwell板上(孔径3 μm, 有效膜面积0.6 cm2), 接种密度为5×104/cm2. 实验分为4组, 每组细胞均应用含有200 mL/L胎牛血清、10 g/L非必需氨基酸和青霉素-链霉素双抗液的DMEM培养液, 但是加入不同浓度的谷氨酰胺(0、0.1、1、4 mmol/L)在37 ℃、50 mL/L CO2条件下进行培养, 隔天换液(Transwell上层加入100 μL培养液, 下层加入600 μL培养液), 倒置显微镜下观察细胞生长情况, 同时测定跨上皮电阻(transepithelial electrical resistance, TEER). 另将一部分细胞接种于六孔细胞培养板中, 培养液同上, 生长7 d左右细胞达到70%融合后进行免疫荧光和蛋白印迹杂交. 每种实验均选取至少三组非同代细胞进行.
1.2.2 跨上皮电阻的测定: 在细胞生长过程中, 每日应用EVOM测定各组细胞的TEER值, 具体测定方法参照文献[12]. 为保证数值的准确性, 整个过程在恒定温度下(37 ℃)进行, 每个Transwell均取不同方向的三个点, 重复测定3次, 取平均值乘以Transwell的膜面积, 即为该样品的TEER值, 以Ω•cm2表示; 因为Transwell膜本身也具有一定的TEER, 因此标准TEER(Ω•cm2) = 样本实测TEER-空白对照TEER.
1.2.3 免疫荧光: 取同代细胞接种于盖玻片上, 加入含不同浓度谷氨酰胺的DMEM培养液, 待细胞生长融合达70%左右, 取出盖玻片, PBS漂洗3次(每次10 min), 37 g/L甲醛固定15 min, PBS漂洗, 加入0.5% Triton X-100处理10 min, PBS漂洗, 100 mL/L小牛血清白蛋白封闭1 h, 加入浓度为1:50的多克隆兔抗occludin抗体, 4 ℃过夜, PBS漂洗后加入用FITC标记的羊抗兔IgG抗体37 ℃ 1 h, 再用PBS漂洗, 蒸馏水洗后用甘油封片, 荧光显微镜下观察.
1.2.4 NP-40可溶性及不溶性蛋白框架的制备: 参照文献[13]各组细胞用冰PBS洗3遍, 然后用NP-40蛋白裂解液(25 mmol/L HEPES, pH 7.4, 150 mmol/L NaCl, 4 mmol/L EDTA, 1% Nonidet P-40, 25 mmol/L NaF, 1 mmol/L Na3VO4, 10 mmol/L sodium pyrophosphate, 1 mmol/L PMSF)冰上裂解细胞20 min, 4 ℃离心12000 g 30 min, 上清即为NP-40可溶性蛋白, 转移至新的Microtube内. 剩余沉淀应用SDS蛋白裂解液(25 mmol/L HEPES, pH 7.4, 4 mmol/L EDTA, 10 g/L SDS, 25 mmol/L NaF, 1 mmol/L Na3VO4, 10 mmol/L sodium pyrophosphate, 1 mmol/L PMSF)冰上裂解细胞20 min, 超声波粉碎5 s×5次, 4 ℃离心12000 g 30 min, 所得上清即为NP-40不溶性蛋白, 采用BCA法对蛋白样品进行定量, 用蒸馏水将蛋白样品调成相同浓度, 加入相同体积上样缓冲液, 沸水煮5 min进行蛋白变性.
1.2.5 Western blot: 每个样本取等量蛋白(约50 μg)进行80 g/L SDS-PAGE凝胶电泳, 电压100 V, 90 min; 电泳后将蛋白转至硝酸纤维素膜上, 电压50 V, 2 h; 脱脂奶粉封闭2 h, 加入多克隆兔抗occludin 抗体(1:1000)4 ℃过夜; 然后加入辣根过氧化物酶标记的羊抗兔-IgG抗体(1:2000)室温2 h, ECT显色. 以β-actin作为内参, 结果通过天能图像分析系统进行分析, occludin蛋白含量 = 样本occludin蛋白灰度值/同一样本β-actin灰度值.
统计学处理 以mean±SD表示, 应用SPSS10.0对各组间数据进行分析. 采用单因素方差分析(AVONA)的LSD方法对各组间数据进行比较.
0 mmol/L GLN组Caco-2细胞随着培养时间的延长, 细胞间隙没有消失, TEER值无明显升高(11.3±0.3 Ω•cm2); 0.1 mmol/L GLN组Caco-2细胞培养21 d后, 细胞间隙仍然存在, TEER值有所升高(21.4±0.1 Ω•cm2, P<0.05), 1 mmol/L GLN组Caco-2细胞培养21 d后, 细胞间隙消失, TEER值达124.5±0.3 Ω•cm2, 与0 mmol/L GLN组比较有统计学差异(P<0.0005); 4 mmol/L GLN组Caco-2细胞培养21 d后, 细胞形成紧密单层, TEER值进一步升高, 达到173.6±0.2 Ω•cm2, 与0 mmol/L GLN组比较差异有统计学意义(P<0.0005, 图1).
0 mmol/L GLN组可见细胞胞质内成团状的阳性荧光染色, 细胞间连接处缺乏阳性荧光染色; 0.1 mmol/L GLN组于细胞间连接处可见不连续的线状荧光染色; 1 mmol/L GLN组细胞间连接处出现沿细胞膜分布的蜂巢状线性荧光, 轮廓较完整, 胞质内阳性荧光染色减弱; 4 mmol/L GLN组细胞间连接处阳性荧光信号明显增强, 轮廓完整, 胞质内可见少量极弱的荧光信号(图2).
kDa处见一特异性的蛋白条带, 对各条带进行灰度分析发现各组occludin蛋白的表达无明显差异(0.91±0.05, 0.85±0.09, 0.87±0.06, 0.88±0.05,各组蛋白样品分为NP-40可溶性(S)与NP-40不溶性(I)两个框架分别进行蛋白杂交, 结果发现NP-40可溶性标本仅在65 P>0.05). NP-40不溶性标本可见两条蛋白条带, 分别在65 kDa和85 kDa, 对各条带进行灰度分析发现, 随着谷氨酰胺浓度的增加, occludin蛋白的相对含量明显增加(1.04±0.03, 1.17±0.04, 1.29±0.03, 1.43±0.06, P<0.05), 提示谷氨酰胺能够影响occludin蛋白的表达(图3).
肠道积极参与应激反应, 如反应失调可直接或间接损伤肠黏膜屏障, 引起肠腔内细菌和内毒素逸出肠壁, 导致肠源性全身感染及SIRS甚至多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS), 造成大量重症患者死亡[14-19]. 目前已有研究表明在烧伤、重症胰腺炎、暴发性肝衰竭等疾病引起的肠黏膜屏障损伤中, 均存在肠上皮屏障的破坏[20-25], 表现为紧密连接蛋白表达减少, 紧密连接完整性的破坏, 因此推断在上述疾病中, 肠上皮紧密连接屏障的损害是诱发全身炎症反应综合征的启动环节, 阻断此环节对疾病的转归具有重要意义.
GLN是目前应用非常广泛的肠黏膜保护剂, 是维持肠道黏膜代谢、结构和功能的必须营养成分, 对维护肠黏膜细胞的生长、分化和增殖具有重要的意义[26-30]. 体内实验表明GLN缺乏可使肠道黏膜萎缩, 绒毛变稀变矮, 屏障功能下降; 补充GLN后能明显增加大鼠肠黏膜质量、恢复绒毛高度、黏膜表面积和陷窝深度, 加快肠上皮细胞更新速度, 阻止肠黏膜萎缩及炎症所致的通透性增加, 从而恢复并维持肠黏膜屏障功能[31-32]. Potsic et al[33]利用胃造口术喂养大鼠发现, GLN的缺乏可以引起肠上皮细胞间连接的破坏, 并且与凋亡无关, 提示GLN可能对于肠上皮细胞紧密连接的形成和功能维持有一定影响. 为了验证这一推论, 我们应用研究紧密连接屏障的经典细胞Caco-2细胞建立体外肠上皮细胞屏障, 检测了不同浓度GLN对肠上皮屏障通透性和紧密连接蛋白occludin表达的影响.
我们首先利用TEER检测了GLN对肠上皮屏障通透性的影响. TEER由离子经细胞旁间隙的流动形成, 是检测细胞旁通透性的常用指标[12]. 我们的实验结果表明在GLN缺乏的情况下, Caco-2细胞不能形成紧密单层, TEER值始终处于较低水平; 而在补充1 mmol/L GLN后, Caco-2细胞的细胞间隙消失, TEER值明显升高, 4 mmol/L GLN的这种作用更加明显, 说明GLN的含量能够影响肠上皮细胞屏障的通透性.
TEER值主要反映肠上皮细胞的细胞旁通透性, 而肠上皮细胞的细胞旁转运主要受紧密连接的限制. 有研究报道紧密连接蛋白occludin是TJ的主要功能调节蛋白[34], 其表达量的多少直接决定TEER的高低, 并且occludin缺失可引起肠上皮屏障通透性的增高[35], 因此我们进一步检测了GLN对紧密连接蛋白occludin表达的影响.
Occludin存在两种形式, 磷酸化和非磷酸化, 磷酸化是其活性形式. 非磷酸化occludin主要存在于胞质内, 可溶解于去垢剂NP-40中, 而磷酸化occludin定位于细胞间的紧密连接处, 不溶于NP-40[13], 因此我们制备了NP-40可溶性和不溶性蛋白成分, 分别进行蛋白印迹杂交. 结果表明GLN缺乏能够明显减少NP-40不溶性occludin蛋白的表达, 补充GLN后, NP-40不溶性occludin蛋白的含量明显增加, 提示GLN缺乏能够引起活性状态occludin蛋白表达的减少. 这一结论可由免疫荧光进一步证实: 在GLN缺乏的情况下, occludin蛋白呈团块状分布于Caco-2细胞胞质内, 不能定位在紧密连接处发挥功能; 补充GLN后, occludin蛋白逐渐向细胞膜上转移, 定位于膜尖端的紧密连接处, 形成完整的紧密连接.
总之, GLN缺乏能够通过减少活性紧密连接蛋白occludin的表达, 影响紧密连接的完整性, 进而增加肠上皮屏障通透性, 补充GLN是维护紧密连接完整性, 降低肠上皮屏障通透性的有效手段.
谷氨酰胺是最重要的肠黏膜保护剂, 能够促进肠上皮细胞更新, 减少细菌穿透, 但是具体的作用机制还不十分清楚. 紧密连接是肠黏膜机械屏障的重要组成部分, 紧密连接的形成是否参与谷氨酰胺的肠黏膜保护功能还未见报道. 因此, 本文观察了谷氨酰胺对体外肠上皮细胞屏障通透性和紧密连接形成的影响.
王炳元, 教授, 中国医科大学附属第一医院消化内科
谷氨酰胺的肠黏膜保护作用已经证实, 但其发生机制是目前研究的热点, 尤其是分子水平的研究是今后的趋势.
张媛莉 et al证实在慢性酗酒大鼠中, 补充谷氨酰胺能够提高occludin、ZO-1等紧密连接分子蛋白和mRNA的表达.
目前国内关于谷氨酰胺影响肠上皮细胞间紧密连接形成的文章尚未见报道. 谷氨酰胺肠黏膜屏障保护功能的研究主要集中在光镜下肠组织结构的改变以及肠上皮细胞的凋亡.
本研究证实谷氨酰胺缺乏能够影响紧密连接的形成, 为临床补充谷氨酰胺治疗肠黏膜屏障损害提供依据.
紧密连接: 存在于各类上皮细胞及血管内皮细胞间的顶端, 形成一个顶端闭锁结构且发挥"屏障"和"防御"功能, 以控制细胞间的通透性和保持细胞的极性. 紧密连接由多种紧密连接蛋白组成, 包括Claudin, occludin以及ZO-1, ZO-2, Zo-3等, 在不同的组织结构, 各种紧密连接蛋白的表达亦存在差别.
本研究新颖性较强, 数据可靠, 结论可信, 具有一定的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Rotstein OD. Pathogenesis of multiple organ dysfunction syndrome: gut origin, protection, and decontamination. Surg Infect (Larchmt). 2000;1:217-223; discussion 223-225. [PubMed] [DOI] |
| 2. | McGuckin MA, Eri R, Simms LA, Florin TH, Radford-Smith G. Intestinal barrier dysfunction in inflammatory bowel diseases. Inflamm Bowel Dis. 2008; Jul 11. [Epub ahead of print]. [PubMed] |
| 3. | Xu GF, Lu Z, Gao J, Li ZS, Gong YF. Effect of ecoimmunonutrition supports on maintenance of integrity of intestinal mucosal barrier in severe acute pancreatitis in dogs. Chin Med J (Engl). 2006;119:656-661. [PubMed] |
| 4. | Ding LA, Li JS, Li YS, Zhu NT, Liu FN, Tan L. Intestinal barrier damage caused by trauma and lipopolysaccharide. World J Gastroenterol. 2004;10:2373-2378. [PubMed] |
| 6. | Li JY, Lu Y, Hu S, Sun D, Yao YM. Preventive effect of glutamine on intestinal barrier dysfunction induced by severe trauma. World J Gastroenterol. 2002;8:168-171. [PubMed] |
| 9. | Vicario M, Amat C, Rivero M, Moretó M, Pelegrí C. Dietary glutamine affects mucosal functions in rats with mild DSS-induced colitis. J Nutr. 2007;137:1931-1937. [PubMed] |
| 10. | Salman B, Oguz M, Akmansu M, Bebitoglu I, Akca G, Sultan N, Emre U, Kerem M, Yilmaz U. Effect of timing of glutamine-enriched enteral nutrition on intestinal damage caused by irradiation. Adv Ther. 2007;24:648-661. [PubMed] [DOI] |
| 11. | Wojtuń S, Gil J, Błaszak A. [Dietary treatment in acute pancreatitis]. Pol Merkur Lekarski. 2007;22:469-473. [PubMed] |
| 12. | Schmitz H, Fromm M, Bentzel CJ, Scholz P, Detjen K, Mankertz J, Bode H, Epple HJ, Riecken EO, Schulzke JD. Tumor necrosis factor-alpha (TNFalpha) regulates the epithelial barrier in the human intestinal cell line HT-29/B6. J Cell Sci. 1999;112:137-146. [PubMed] |
| 13. | Sakakibara A, Furuse M, Saitou M, Ando-Akatsuka Y, Tsukita S. Possible involvement of phosphorylation of occludin in tight junction formation. J Cell Biol. 1997;137:1393-1401. [PubMed] [DOI] |
| 14. | Vega D, Badami CD, Caputo FJ, Watkins AC, Lu Q, Xu da Z, Berezina TL, Zaets SB, Feketeova E, Deitch EA. The influence of the type of resuscitation fluid on gut injury and distant organ injury in a rat model of trauma/hemorrhagic shock. J Trauma. 2008;65:409-414; discussion 414-415. [PubMed] |
| 15. | Zhang F, Tong L, Qiao H, Dong X, Qiao G, Jiang H, Sun X. Taurine attenuates multiple organ injury induced by intestinal ischemia reperfusion in rats. J Surg Res. 2008;149:101-109. [PubMed] [DOI] |
| 16. | Farmer DG, Venick RS. Morbidity and mortality associated with chronic intestinal failure. Transplantation. 2008;85:1385-1386. [PubMed] [DOI] |
| 17. | Liu H, Li W, Wang X, Li J, Yu W. Early gut mucosal dysfunction in patients with acute pancreatitis. Pancreas. 2008;36:192-196. [PubMed] |
| 18. | Flint R, Windsor J. The role of the intestine in the pathophysiology and management of severe acute pancreatitis. HPB (Oxford). 2003;5:69-85. [PubMed] |
| 19. | Beale RJ, Sherry T, Lei K, Campbell-Stephen L, McCook J, Smith J, Venetz W, Alteheld B, Stehle P, Schneider H. Early enteral supplementation with key pharmaconutrients improves Sequential Organ Failure Assessment score in critically ill patients with sepsis: outcome of a randomized, controlled, double-blind trial. Crit Care Med. 2008;36:131-144. [PubMed] [DOI] |
| 21. | Ergün O, Ergün G, Oktem G, Selvi N, Doğan H, Tunçyürek M, Saydam G, Erdener A. Enteral resveratrol supplementation attenuates intestinal epithelial inducible nitric oxide synthase activity and mucosal damage in experimental necrotizing enterocolitis. J Pediatr Surg. 2007;42:1687-1694. [PubMed] [DOI] |
| 22. | Moriez R, Salvador-Cartier C, Theodorou V, Fioramonti J, Eutamene H, Bueno L. Myosin light chain kinase is involved in lipopolysaccharide-induced disruption of colonic epithelial barrier and bacterial translocation in rats. Am J Pathol. 2005;167:1071-1079. [PubMed] |
| 23. | Fink MP. Intestinal epithelial hyperpermeability: update on the pathogenesis of gut mucosal barrier dysfunction in critical illness. Curr Opin Crit Care. 2003;9:143-151. [PubMed] [DOI] |
| 24. | Ammori BJ, Cairns A, Dixon MF, Larvin M, McMahon MJ. Altered intestinal morphology and immunity in patients with acute necrotizing pancreatitis. J Hepatobiliary Pancreat Surg. 2002;9:490-496. [PubMed] [DOI] |
| 25. | Rupani B, Caputo FJ, Watkins AC, Vega D, Magnotti LJ, Lu Q, Xu da Z, Deitch EA. Relationship between disruption of the unstirred mucus layer and intestinal restitution in loss of gut barrier function after trauma hemorrhagic shock. Surgery. 2007;141:481-489. [PubMed] [DOI] |
| 26. | Shimizu M, Son DO. Food-derived peptides and intestinal functions. Curr Pharm Des. 2007;13:885-895. [PubMed] [DOI] |
| 27. | Wu XQ, Shu LH, Sun M, Wang H, Gao H. [Effect of glutamine on apoptosis of the small intestine in young rats with endotoxemia and its mechanism]. Zhongguo Dangdai Erke Zazhi. 2006;8:496-498. [PubMed] |
| 28. | Margaritis VG, Filos KS, Michalaki MA, Scopa CD, Spiliopoulou I, Nikolopoulou VN, Vagianos CE. Effect of oral glutamine administration on bacterial tanslocation, endotoxemia, liver and ileal morphology, and apoptosis in rats with obstructive jaundice. World J Surg. 2005;29:1329-1334. [PubMed] [DOI] |
| 29. | De-Souza DA, Greene LJ. Intestinal permeability and systemic infections in critically ill patients: effect of glutamine. Crit Care Med. 2005;33:1125-1135. [PubMed] [DOI] |
| 30. | Assimakopoulos SF, Nikolopoulou VN, Scopa CD, Vagianos CE. Beneficial effects of glutamine on intestinal barrier function in obstructive jaundice. World J Surg. 2005;29:935-936. [PubMed] [DOI] |
| 31. | Boelens PG, Houdijk AP, Haarman HJ, Nijveldt RJ, van Leeuwen PA. Glutamine-enriched enteral nutrition decreases infectious complications in trauma patients. Am J Clin Nutr. 2002;76:253-254; author reply 254-255. [PubMed] |
| 32. | Karinch AM, Pan M, Lin CM, Strange R, Souba WW. Glutamine metabolism in sepsis and infection. J Nutr. 2001;131:2535S-2538S; discussion 2550S-2551S. [PubMed] |
| 33. | Potsic B, Holliday N, Lewis P, Samuelson D, DeMarco V, Neu J. Glutamine supplementation and deprivation: effect on artificially reared rat small intestinal morphology. Pediatr Res. 2002;52:430-436. [PubMed] |
| 34. | Huber JD, Witt KA, Hom S, Egleton RD, Mark KS, Davis TP. Inflammatory pain alters blood-brain barrier permeability and tight junctional protein expression. Am J Physiol Heart Circ Physiol. 2001;280:H1241-H1248. [PubMed] |
| 35. | Vorbrodt AW, Dobrogowska DH. Molecular anatomy of intercellular junctions in brain endothelial and epithelial barriers: electron microscopist's view. Brain Res Brain Res Rev. 2003;42:221-242. [PubMed] [DOI] |