修回日期: 2008-10-17
接受日期: 2008-10-21
在线出版日期: 2008-11-18
目的: 观察黄芪、莪术配伍对MKN-45细胞COX-2、PPARγ、NF-κB的影响.
方法: 以黄芪、莪术配伍作用于MKN-45细胞, 并设塞莱希布组、罗格列酮组、黄芪组、莪术组和空白组相对照. 用MTT法观察各组药物对胃癌细胞的抑制率, 用RT-PCR以及Western blot方法检测给药后人胃癌细胞COX-2、PPARγ、NF-κB基因及COX-2蛋白表达的变化.
结果: 各组对COX-2和NF-κB的mRNA表达均有抑制作用, 除莪术外对PPARγ mRNA均有促表达作用, 其中以塞莱希布组和配伍组对COX-2 mRNA表达的抑制作用最为明显, 且配伍组作用明显强于黄芪组和莪术组, 以罗格列酮组和配伍组对NF-κB mRNA的表达抑制作用和对PPARγ表达的促表达作用都是最明显.
结论: 黄芪、莪术配伍能起到增效作用, 对细胞的抑制效应明显, 对COX-2的抑制作用大于黄芪、莪术的单独效应, 与塞莱希布相近, 其对COX-2的抑制作用可能是通过PPARγ/NF-κB信号途径发挥作用的.
引文著录: 沈天华, 沈洪, 骆殊, 朱学军, 刘丽, 李春婷, 刘亚军. 黄芪、莪术配伍对胃癌细胞COX-2表达的调节作用. 世界华人消化杂志 2008; 16(32): 3599-3604
Revised: October 17, 2008
Accepted: October 21, 2008
Published online: November 18, 2008
AIM: To investigate the effect of Astragalus membranaceus and Rhizoma curcumae′s compatibility on MKN-45 cells and the regulatory action of the compatibility on expression of cyclooxygenase 2 (COX-2), peroxisome proliferators activated receptorγ (PPARγ) and nuclear factor κB (NF-κB).
METHODS: The compatibility of Astragalus membranaceus and Rhizoma curcumae was used on MKN-45 cells and there were five groups including Celecoxib group, Rosiglitazone group, Astragalus membranaceus group, Rhizoma curcumae group and control group. The inhibition ratio in each group was determined using MTT method, and the expressions of COX-2 mRNA, PPARγ mRNA, NF-κB mRNA and COX-2 protein were measured using RT-PCR and Western blot methods.
RESULTS: Both the Chinese drugs and Western medicines had suppression on NF-κB mRNA and COX-2 mRNA. All medicines except Rhizoma curcumae promoted the expression of PPARγ mRNA. The most obvious suppressive effect on COX-2 mRNA expression was detected in celecoxib group and compatibility group. And suppressive effect was significantly stronger in compatibility group than either in Astragalus membranaceus group or Rhizoma curcumae group. Both Rosiglitazone group and compatibility group had the best suppressive effect on NF-κB mRNA and the best promoting effect on PPARγ mRNA.
CONCLUSION: Astragalus membranaceus and Rhizoma curcumae′s compatibility has better effect with marked suppressive effect. The compatibility group showed stronger suppressive effect on COX-2 expression than Astragalus membranaceus and Rhizoma curcumae used alone, closing to Celecoxib. Its suppressive effect on COX-2 may be produced through the signal pathway of PPARγ/NF-κB.
- Citation: Shen TH, Shen H, Luo S, Zhu XJ, Liu L, Li CT, Liu YJ. Regulatory effect of compatibility of Astragalus membranaceus and Rhizoma curcumae on COX-2 expression in gastric cancer MKN-45 cells. Shijie Huaren Xiaohua Zazhi 2008; 16(32): 3599-3604
- URL: https://www.wjgnet.com/1009-3079/full/v16/i32/3599.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i32.3599
环氧合酶(cyclooxygenase, COX)是花生四烯酸生物合成前列腺素的限速酶. COX-2为其中一种亚型, 他的过度表达与胃癌发生、发展有关[1]. 刺激COX-2表达的因子广泛存在于细胞内外, 主要包括: 促肿瘤剂(如脂TPA, PMA), 癌基因(如ras, v-src), 内皮素(ET), 一氧化氮(NO)等, 这些刺激因子经过一系列信号转导途径作用于COX-2的5'旁侧区的转录调控序列, 促进COX-2转录, 诱导COX-2的表达. COX-2与胃癌具有密切联系, 其在正常胃黏膜、浅表性胃炎、萎缩性胃炎伴肠化、不典型增生及胃癌组织中的表达呈逐渐递增趋势[2-5], 且与胃癌等消化系统肿瘤的发生、发展和转移之间具有明显相关性[6-10].
过氧化物酶增殖因子激活受体(peroxisome proliferators activated receptor γ, PPARγ), 是核激素受体超家族中的一员, 在脂肪形成及炎症过程中起重要作用. 最近发现, PPARγ在多种肿瘤细胞上表达, 经其配体作用后可通过其下游目的基因, 如抑癌基因(PTEN)、原癌基因(c-myc)、p27、COX-2和间质金属蛋白酶9(MMP9)等, 实现其抑制细胞生长以及诱导细胞凋亡和抑制肿瘤血管形成等生物学功能[11-14]. 近年来研究表明PPAR-γ以失活状态在多种肿瘤中高表达, 同时大量文献证实PPAR-γ配体可以通过激活PPAR-γ而发挥潜在的抗肿瘤作用[15-17].
NF-κB是一种基因多显性转录因子, 与多种基因的转录有关, 参与多种肿瘤发生发展的过程. 结构性活化的NF-κB与肿瘤形成的几个方面有关, 包括上调促细胞存活基因表达促进肿瘤细胞增殖分化、抑制促凋亡因子抑制肿瘤细胞凋亡、促进恶性转化、浸润转移和肿瘤血管形成等[18]. NF-κB在胃癌细胞和组织中过表达, 通过使其靶基因COX-2、 ICAM-1、uPA[19], IL-8[20-21]等的mRNA及蛋白水平上调, 从而与胃癌形成, 浸润转移密切相关并在某种程度上决定着患者的预后[22]. 因此, 结构性活化的NF-κB与上皮源性的肿瘤(如乳腺癌、胃癌、膀胱癌等)有关, 提示其高表达或过度激活在肿瘤的发生、发展中起重要作用[23-25].
在益气活血法治疗胃癌的前期研究中, 我们已经分别证实黄芪、莪术能调控COX-2的表达, 进而抑制VEGF、PGE2的表达来发挥其抗肿瘤作用. 但黄芪、莪术配伍而成的益气活血疗法效用如何, 通过何种途径实现对COX-2的调控还不清楚, 本研究旨在进一步探讨益气活血法抗肿瘤的作用, 通过蛋白、基因检测技术测定黄芪、莪术配伍对胃癌细胞COX-2、PPARγ、NF-κB表达的影响, 从分子生物学角度揭示黄芪、莪术配伍作用的机制.
黄芪和莪术饮片由江苏省中医院制剂部提供; 塞莱希布胶囊(塞来昔布)(西尔大药厂波多黎各分厂生产, 辉瑞制药有限公司分口包装, 批号: BK070127), 罗格列酮片剂(文迪雅)(天津葛兰素-史克有限公司生产, 批号: 07030016)购自江苏省中医院中心药房. 人胃癌细胞株MKN-45购自上海仁济医院. RPMI 1640干粉培养基、胎牛血清为Gibico公司产品, MTT、二甲基亚砜(DMSO)为Sigma公司产品. 山羊抗人COX-2的多克隆抗体和辣根过氧化物酶标记的抗山羊IgG抗体均购自Abcam公司. 预染蛋白Marker(Fermentas), 100 bp DNALadder(TaKaKa), Total RNA TRIzol抽提试剂盒(Invitrogen), ECL化学发光试剂为英国Amersham公司产品. 第一链cDNA合成试剂盒、PCR扩增试剂盒购自上海生工生物有限公司. 其他试剂如SDS上样缓冲液、显影液、定影液, 琼脂糖等由江苏省中医院分子细胞实验室提供.
1.2.1 MTT法观察药物对细胞的抑制率: 以每孔1×104个细胞的单细胞悬液接种于96孔培养板(每孔100 μL), 分别加入黄芪(10 mg/L)、莪术(5 mg/L)、黄芪与莪术配伍(10 mg/L)、塞莱希布(100 μmol/L)、罗格列酮(20 μmol/L), 37℃ CO2孵箱中分别培养24、48、72 h. 然后每孔加入MTT溶液(5 g/L)20 μL, 37℃孵育4 h后弃上清, 加入100 μL DMSO振荡10 min, 在酶联免疫检测分析仪测定A490nm的值. 以只加培养液的空白对照孔调零. 根据公式: 细胞增殖抑制率 = (对照组吸光度平均值-实验组吸光度平均值)/对照组吸光度平均值×100%, 计算各组药物对胃癌细胞的抑制率.
1.2.2 RT-PCR测COX-2、PPARγ、NF-κB基因: 取对数生长期的细胞加入到6孔板中(2×106个/孔), 细胞贴壁后加药, 作用24、48、72 h后收集各组细胞. 用Total RNA TRIzol试剂盒提取RNA, 并用紫外分光光度计测定A260nm及A280nm值, 分析其纯度, 同时定量. 于冰上混合2 μg RNA样品及10 μL随机六聚体引物, 70℃退火5 min, 立即置于冰浴中, 加入5 μL逆转录酶缓冲液, 40 mU/L rRNase抑制剂1 μL, 10 mmol/L dNTP 1.25 μL, 200 U/mL的M-MLV逆转录酶1 μL, 并补加水至25 μL充分混合. 然后37℃ 1 h; 80℃ 5 min终止反应, -20℃保存.
PCR反应体系: 10×reaction Buffer 2.5 μL, 25 mmol/L MgCl2 18.0 μL, 10 mmol/L dNTP 0.5 μL, 10 mmol/L上下游引物各1 μL(表1), cDNA 2 μL, 及Taq酶1 μL, 补加水至50 μL. PCR条件: 94℃热启动, 95℃变性50 s, 58℃复性50 s, 72℃延伸50 s, 35循环, 其中NF-κB复性的温度和时间为52℃ 50 s. 最后于72℃延伸8 min. 反应完毕后, 取扩增产物10 μL, 于1.5 g/L的琼脂糖凝胶上进行电泳分析. 为比较各组细胞间表达水平的强弱, 应用图像分析仪对扩增条带做了扫描半定量.
| 目的基因 | 正义序列 | 反义序列 | 片段长度(bp) |
| COX-2 | 5' TTC AAA TGA GAT TGT GGG AAA ATT GCT 3' | 5' GAG TAT GAG TCT GCT GGT TTG GAA TAG TT 3' | 490 |
| PPARγ | 5' TCT GGC CCA CCA ACT TTG GG 3' | 5' CTT CAC AAG CAT GAA CTC CA 3' | 361 |
| NF-κB | 5' TCA ATG GCT ACA CAG GAC 3' | 5' TTG AGC AGG ATG CTG AGG ATT CTG 3' | 352 |
1.2.3 Western blot检测COX蛋白表达: 换用含药物的RPMI 1640培养液, 分别在培养24、48、72 h后, 终止培养, 弃培养液, 用预冷的PBS洗两遍, 加100 μL含PMSF的裂解液, 于冰上裂解. 超声(150-200 W)3 s, 10次. 离心, 分装倒0.5 mL的离心管中. 用BCA法将细胞的蛋白样品定量, 并于100℃, 5 min煮沸变性处理. 制作100 mL/L的分离胶和40 mL/L的浓缩胶, 按每孔60 μg蛋白上样. 电泳时电压调至最大, 电流强度浓缩胶30 mA, 分离胶40 mA(恒流). 用100 V电压转膜60-90 min. 转膜完毕后用封闭液封闭1.5 h. 再用TBST液洗3次, 每次10 min. 加入COX-2的一抗, 4℃冰箱过夜. 一抗浓度: 均为1:500, 用含50 g/L脱脂牛奶的TBST稀释. 一抗孵育成功后用TBST液洗3次, 每次10 min. 加入二抗室温下孵育1 h. 二抗浓度为1:2000, 用含50 g/L脱脂牛奶的TBST稀释. 最后再用TBST液洗3次, 每次10 min. 每张膜加1:1的发光液1 mL, 在暗室中曝光5-7 min, 等条带清晰后将胶片取出, 扫描后用Tanon Gis 3500软件半定量分析.
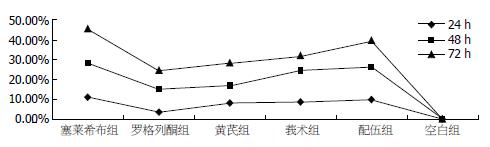
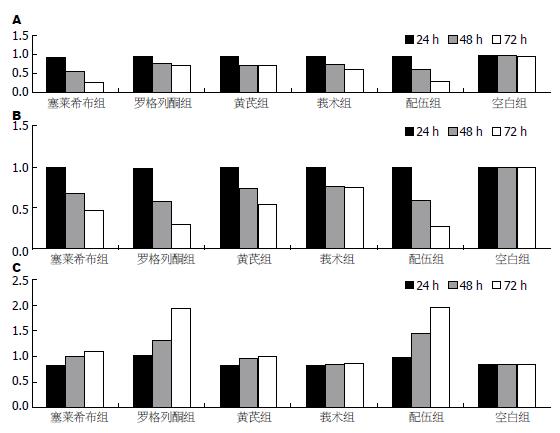
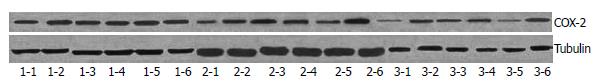
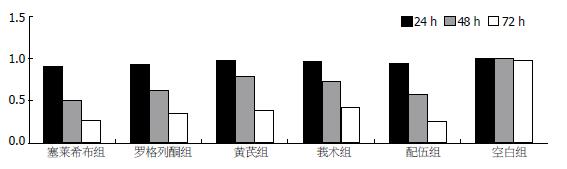
用MTT法测定各组细胞增殖活力, 可以看出, 在药物开始作用的24 h里, 塞莱希布组、黄芪组、莪术组和配伍组对细胞产生了抑制作用, 与空白组和罗格列酮组差异明显, 且塞莱希布组、黄芪组、莪术组和配伍组作用相近. 药物作用48 h时, 各组均对细胞产生了抑制作用, 与空白组对比差异明显, 且莪术组、配伍组与塞莱希布组的抑制作用相当. 药物作用48 h后, 配伍组抑制作用明显高于黄芪组和莪术组, 仅次于塞莱希布组(图1). 将RT-PCR产物经电泳分析, 加入各引物后均可在相应位置见到其扩增带, 且特异性好. 说明胃癌细胞中有COX-2 mRNA、PPARγ mRNA、NF-κB mRNA的表达(图2). 对各条带进行灰度分析发现, 中西药对COX-2 mRNA和NF-κB mRNA均有抑制作用, 除莪术外, 其他中西药对PPARγ mRNA均有促进表达的作用. 各组对COX-2的抑制作用以塞莱希布组和配伍组最明显, 且成时间依赖性. 对PPARγ的影响罗格列酮组和中药配伍组效果明显, 塞莱希布组和黄芪组亦有促进作用(图3). 胃癌细胞的Western blot曝光结果可见, 正常对照细胞组在72 kDa处均可见特异性的COX-2蛋白表达条带(图4), 说明MKN-45细胞中有COX-2蛋白的表达. 内参Tubulin的表达在55 kDa处. 对各条带进行灰度分析发现: 各组中西药对COX-2均有明显的抑制作用, 且成时间依赖性, 其中以中药配伍和塞莱希布的抑制作用最强(图5).
目前已经证实在COX-2基因的5'端flanking区域存在两处NF-κB结合位点. 在各种刺激因素作用下, NF-κB被激活后从胞质移位至胞核内, 与COX-2的NF-κB结合位点结合, 启动COX-2基因的转录, 促进COX-2的表达上调, 从而引起细胞凋亡与增殖的失衡及其他种种变化, 最终诱发癌变. 而PPARγ可以直接与NF-κB的亚基p65/p50结合, 发生蛋白质-蛋白质相互作用, 形成转录抑制复合物, 降低了NF-κB与DNA结合活性, 抑制NF-κB DNA合成[26-27]. 从而抑制其下游相关基因的表达. PPARγ还可以通过与竞争结合协同活化因子p300和CBP来抑制NF-κB的转录. 据报道, 在大鼠结肠炎的模型中, 应用PPARγ激动剂罗格列酮, 可以观察到大鼠组织中COX-2、PGE2、TNF-α等炎症介质表达显著减少, 证实了上述说法[28-30].
从MTT结果看, 塞莱希布抑制作用最强, 说明COX-2在胃癌细胞中有明显表达, 是抑制胃癌细胞生长的重要靶点, 罗格列酮对细胞也有一定的抑制作用, 但作用较弱. 配伍组作用与塞莱希布接近, 说明配伍组可能是以COX-2为作用靶点的. 这与COX-2 mRNA结果吻合. 通过对NF-κB mRNA的结果分析可见, 罗格列酮的抑制作用最明显, 与其对PPARγ的促表达作用成明显的负相关性, 证明PPARγ高表达可以降低NF-κB的水平, 与目前的观点相符. 同时罗格列酮对COX-2的抑制作用存在时间依赖性, 其抑制趋势与其对NF-κB的抑制相关, 且塞莱希布对PPARγ无明显促表达作用, 说明NF-κB、COX-2可能依次是PPARγ调节的下游基因, COX-2可能受PPARγ/NF-κB信号通路的调控. 中药的作用结果表明, 黄芪、莪术配伍后对肿瘤细胞的抑制作用要强于单用黄芪或莪术. 黄芪、莪术单用时对NF-κB、COX-2的抑制作用及对PPARγ的促表达作用均分别弱于塞莱希布和罗格列酮, 但配伍后的作用均不亚于塞莱希布和罗格列酮, 即明显提高PPARγ mRNA水平, 同时降低NF-κB mRNA、COX-2 mRNA水平. 总之, 黄芪、莪术配伍后可能是通过PPARγ/NF-κB信号途径调控胃癌COX-2的表达, 进而发挥抗肿瘤作用.
本课题组的前期研究已证实黄芪、莪术对胃癌COX-2的表达有抑制作用, 并以此为靶点发挥抗肿瘤作用. 但临床中很少单独用于治疗肿瘤患者, 多将二者配伍使用, 构成益气活血的治疗方法. 所以, 本研究以黄芪、莪术配伍为研究对象, 以证实配伍后较单位药物具有更强的抗肿瘤作用, 并进一步揭示中药调节COX-2表达的信号通路机制.
杜群, 副研究员,广州中医药大学脾胃研究所药理室
目前已经证实在COX-2基因的5'端flanking区域存在两处NF-κB结合位点. 在各种刺激因素作用下, NF-κB被激活后从胞质移位至胞核内, 与COX-2的NF-κB结合位点结合, 启动COX-2基因的转录, 促进COX-2的表达上调, 从而引起细胞凋亡与增殖的失衡及其他种种变化, 最终诱发癌变.
谌辉 et al研究发现在大鼠结肠炎的模型中, 应用PPARγ激动剂罗格列酮, 可以观察到大鼠组织中COX-2、PGE2、TNF-α等炎症介质表达显著减少.
本研究发现黄芪、莪术配伍后可能是通过PPARγ/NF-κB信号途径调控胃癌COX-2的表达, 进而发挥抗肿瘤作用, 为进一步研究其抗肿瘤机制提供了实践经验.
本文探讨中药配伍抑癌作用的机制, 选题新颖, 研究方法先进, 有较好的科学意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Tang X, Sun YJ, Half E, Kuo MT, Sinicrope F. Cyclooxygenase-2 overexpression inhibits death receptor 5 expression and confers resistance to tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis in human colon cancer cells. Cancer Res. 2002;62:4903-4908. [PubMed] |
| 2. | Ohno S, Ohno Y, Suzuki N, Soma G, Inoue M. Cyclooxygenase-2 expression correlates with apoptosis and angiogenesis in endometrial cancer tissue. Anticancer Res. 2007;27:3765-3770. [PubMed] |
| 3. | Trifan OC, Hla T. Cyclooxygenase-2 modulates cellular growth and promotes tumorigenesis. J Cell Mol Med. 2003;7:207-222. [PubMed] [DOI] |
| 4. | Ferguson HR, Wild CP, Anderson LA, Murphy SJ, Johnston BT, Murray LJ, Watson RG, McGuigan J, Reynolds JV, Hardie LJ. Cyclooxygenase-2 and inducible nitric oxide synthase gene polymorphisms and risk of reflux esophagitis, Barrett's esophagus, and esophageal adenocarcinoma. Cancer Epidemiol Biomarkers Prev. 2008;17:727-731. [PubMed] [DOI] |
| 5. | Fujimura T, Ohta T, Oyama K, Miyashita T, Miwa K. Role of cyclooxygenase-2 in the carcinogenesis of gastrointestinal tract cancers: a review and report of personal experience. World J Gastroenterol. 2006;12:1336-1345. [PubMed] |
| 6. | Mao XY, Wang XG, Lv XJ, Xu L, Han CB. COX-2 expression in gastric cancer and its relationship with angiogenesis using tissue microarray. World J Gastroenterol. 2007;13:3466-3471. [PubMed] |
| 7. | Li M, Liu W, Zhu YF, Chen YL, Zhang BZ, Wang R. Correlation of COX-2 and K-ras expression to clinical outcome in gastric cancer. Acta Oncol. 2006;45:1115-1159. [PubMed] [DOI] |
| 8. | Samaka RM, Abdou AG, Abd El-Wahed MM, Kandil MA, El-Kady NM. Cyclooxygenase-2 expression in chronic gastritis and gastric carcinoma, correlation with prognostic parameters. J Egypt Natl Canc Inst. 2006;18:363-374. [PubMed] |
| 9. | 陈 白莉, 曾 志荣, 胡 品津, 唐 保东, 何 瑶, 陈 为. 幽门螺杆菌感染与慢性胃炎胃黏膜组织中COX-2、iNOS表达的相关性研究. 世界华人消化杂志. 2004;12:902-906. [DOI] |
| 11. | Theocharis S, Margeli A, Vielh P, Kouraklis G. Peroxisome proliferator-activated receptor-gamma ligands as cell-cycle modulators. Cancer Treat Rev. 2004;30:545-554. [PubMed] [DOI] |
| 12. | Nehlin JO, Mogensen JP, Petterson I, Jeppesen L, Fleckner J, Wulff EM, Sauerberg P. Selective PPAR agonists for the treatment of type 2 diabetes. Ann N Y Acad Sci. 2006;1067:448-453. [PubMed] [DOI] |
| 13. | Han S, Roman J. Suppression of prostaglandin E2 receptor subtype EP2 by PPARgamma ligands inhibits human lung carcinoma cell growth. Biochem Biophys Res Commun. 2004;314:1093-1099. [PubMed] [DOI] |
| 14. | Zandbergen F, Mandard S, Escher P, Tan NS, Patsouris D, Jatkoe T, Rojas-Caro S, Madore S, Wahli W, Tafuri S. The G0/G1 switch gene 2 is a novel PPAR target gene. Biochem J. 2005;392:313-324. [PubMed] [DOI] |
| 15. | Jia Y, Guo GL, Surapureddi S, Sarkar J, Qi C, Guo D, Xia J, Kashireddi P, Yu S, Cho YW. Transcription coactivator peroxisome proliferator-activated receptor-binding protein/mediator 1 deficiency abrogates acetaminophen hepatotoxicity. Proc Natl Acad Sci USA. 2005;102:12531-12536. [PubMed] [DOI] |
| 16. | Kim E, Chen F, Wang CC, Harrison LE. CDK5 is a novel regulatory protein in PPARgamma ligand-induced antiproliferation. Int J Oncol. 2006;28:191-194. [PubMed] |
| 17. | Shen ZN, Nishida K, Doi H, Oohashi T, Hirohata S, Ozaki T, Yoshida A, Ninomiya Y, Inoue H. Suppression of chondrosarcoma cells by 15-deoxy-Delta 12,14-prostaglandin J2 is associated with altered expression of Bax/Bcl-xL and p21. Biochem Biophys Res Commun. 2005;328:375-382. [PubMed] [DOI] |
| 18. | Sasaki N, Morisaki T, Hashizume K, Yao T, Tsuneyoshi M, Noshiro H, Nakamura K, Yamanaka T, Uchiyama A, Tanaka M. Nuclear factor-kappaB p65 (RelA) transcription factor is constitutively activated in human gastric carcinoma tissue. Clin Cancer Res. 2001;7:4136-4142. [PubMed] |
| 19. | Isomoto H, Miyazaki M, Mizuta Y, Takeshima F, Murase K, Inoue K, Yamasaki K, Murata I, Koji T, Kohno S. Expression of nuclear factor-kappaB in Helicobacter pylori-infected gastric mucosa detected with southwestern histochemistry. Scand J Gastroenterol. 2000;35:247-254. [PubMed] [DOI] |
| 20. | Dutta J, Fan Y, Gupta N, Fan G, Gelinas C. Current insights into the regulation of programmed cell death by NF-kappaB. Oncogene. 2006;25:6800-6816. [PubMed] [DOI] |
| 21. | Mattson MP, Meffert MK. Roles for NF-kappaB in nerve cell survival, plasticity, and disease. Cell Death Differ. 2006;13:852-860. [PubMed] [DOI] |
| 22. | Karin M, Cao Y, Greten FR, Li ZW. NF-kappaB in cancer: from innocent bystander to major culprit. Nat Rev Cancer. 2002;2:301-310. [PubMed] [DOI] |
| 23. | Pajak B, Orzechowski A. [FLIP--an enemy which might lose the battle against the specific inhibitors of translation]. Postepy Hig Med Dosw (Online). 2005;59:140-149. [PubMed] |
| 26. | Li M, Pascual G, Glass CK. Peroxisome proliferator-activated receptor gamma-dependent repression of the inducible nitric oxide synthase gene. Mol Cell Biol. 2000;20:4699-4707. [PubMed] [DOI] |
| 27. | Maeda S, Yoshida H, Mitsuno Y, Hirata Y, Ogura K, Shiratori Y, Omata M. Analysis of apoptotic and antiapoptotic signalling pathways induced by Helicobacter pylori. Gut. 2002;50:771-778. [PubMed] [DOI] |
| 28. | 谌 辉, 张 景辉, 刘 文琪, 贺 永文. 罗格列酮对日本血吸虫病肝纤维化小鼠肝组织核因子-κB和过氧化物酶体增殖物激活受体γ表达的影响. 世界华人消化杂志. 2007;15:741-745. [DOI] |
| 29. | Tang X, Sun YJ, Half E, Kuo MT, Sinicrope F. Cyclooxygenase-2 overexpression inhibits death receptor 5 expression and confers resistance to tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis in human colon cancer cells. Cancer Res. 2002;62:4903-4908. [PubMed] |
| 30. | Shen H, Oesterling E, Stromberg A, Toborek M, MacDonald R, Hennig B. Zinc deficiency induces vascular pro-inflammatory parameters associated with NF-kappaB and PPAR signaling. J Am Coll Nutr. 2008;27:577-587. [PubMed] |