修回日期: 2008-10-10
接受日期: 2008-10-14
在线出版日期: 2008-11-08
目的: 构建携凋亡素(Apoptin)基因重组腺病毒, 为进一步研究Apoptin基因抗肿瘤作用分子机制建立基础.
方法: 利用BamHⅠ和SpeⅠ双酶切质粒pVAX1-Apoptin, 获得Apoptin片段并连接入pacAd5 CMV K-N pA, 构建含Apoptin基因的穿梭质粒pacAd5-Apoptin. 利用PacⅠ单酶切对pacAd5-Apoptin和腺病毒基因组质粒(pAd5)进行线性化处理后应用脂质体介导法共转染AAV-293细胞, 分别利用蚀斑纯化和RT-PCR、Western blot等方法对重组病毒进行筛选和鉴定, 并测定所获得重组病毒的滴度.
结果: 所构建重组腺病毒中的Apoptin基因得到了正确转录, 表达产物的相对分子质量约为13 kDa, 与CVA阳性对照一致; 所获得重组腺病毒可有效表达Apoptin蛋白, 该蛋白与CAV阳性血清具有反应原性, 重组病毒滴度为1011 PFU/L.
结论: 成功构建含Apoptin基因的重组腺病毒, 所获得重组病毒的滴度可以满足体内外实验要求.
引文著录: 陈漉, 金宁一, 李霄, 刘立明, 贾鹏, 刘妍, 高鹏, 陆蕴松, 迟宝. 含Apoptin基因重组腺病毒的构建及鉴定. 世界华人消化杂志 2008; 16(31): 3505-3509
Revised: October 10, 2008
Accepted: October 14, 2008
Published online: November 8, 2008
AIM: To construct a recombinant adenovirus carrying Apoptin gene so as to provide a basis for further studying the molecular mechanism of Apoptin gene in inducing tumor cell apoptosis.
METHODS: The plasmid pVAX1-Apoptin was digested by endonuclease BamHⅠ and SpeⅠ, and the obtained Apoptin segment was inserted into vector pacAd5 CMV K-N pA to construct a shuttle plasmid pacAd5-Apoptin. After PacⅠ digestion and linearized process, the plasmid pacAd5-Apoptin and pAD (genome plasmid) were co-transfected into AAV-293 cells by liposome mediation. The DNA containing Apoptin gene of the recombinant adenovirus was identified by plaque purification, reverse transcription-polymerase chain reaction (RT-PCR) and Western blot. The titer of the obtained adenovirus was also examined.
RESULTS: The recombinant adenovirus expressed Apoptin gene and the molecular weight of the protein was about 13 kDa, which was consistent with the CVA-positive control. The protein of Apoptin could be effectively expressed in the recombinant adenovirus, and this protein had response to the CAV-positive serum. The titer of the recombinant virus was 1011 PFU/L.
CONCLUSION: The adenovirus containing Apoptin gene is successfully constructed, and the virus titer is able to meet the requirements of in vitro and in vivo experiments.
- Citation: Chen L, Jin NY, Li X, Liu LM, Jia P, Liu Y, Gao P, Lu YS, Chi BR. Construction and identification of the recombinant adenovirus expressing Apoptin gene of chicken anemia virus. Shijie Huaren Xiaohua Zazhi 2008; 16(31): 3505-3509
- URL: https://www.wjgnet.com/1009-3079/full/v16/i31/3505.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i31.3505
随着分子生物学、分子遗传学、免疫学等相关学科的发展和渗透, 基因治疗特别是肿瘤基因治疗技术迅速发展, 多种肿瘤基因治疗方法在理论和技术上已趋成熟, 并从实验及基础研究过渡到临床试用阶段. 目前, 肿瘤基因治疗药物的应用前景已不仅取决于其杀伤肿瘤细胞的有效性, 而更加侧重于制剂的抑瘤特异性[1-4]. 由鸡贫血病毒(chicken anemia virus, CAV)上VP3基因编码的凋亡素(Apoptin)能够特异性诱导包括肝癌、淋巴瘤、胆管癌、黑色素瘤、乳腺癌、肺癌、结肠癌等人源肿瘤发生凋亡, 而对成纤维细胞、角质化细胞、平滑肌细胞等正常没有影响[5-7]. 这种特异性地诱导转化细胞和肿瘤细胞凋亡作用不依赖于野生型p53也不受Bcl-2过度表达的影响. 而且Apoptin基因较小, 可以插入多种载体, 具有成为新的肿瘤研究策略的潜力[7-10]. 因此, 本研究以腺病毒为载体, 构建携Apoptin基因的重组腺病毒, 为进一步的体内外实验提供基础.
大肠杆菌感受态菌DH5α、CAV、AAV-293细胞和质粒pVAX1-Apoptin[11]、pTKEGFP、pacAd5 CMV K-N pA、pAd5均由本实验保存. 胎牛血清、DMEM、opti MEM培养基购自Gibco公司; 碱性磷酸酶(AP)标记的羊抗鸡IgY、碱性磷酸酶(AP)标记的羊抗鼠IgG购自华美生物工程公司; β-actin mAb、CAV阳性血清由本实验室制备并保存; 脂质体Lipofectamine2000、TRIzol、Oligo(dT)购自Invitrogen公司.
1.2.1 细胞培养和质粒转染: AAV-293细胞在DMEM培养液(含100 mL/L胎牛血清, 100 U/L青霉素, 100 U/L链霉素)中, 于37℃, 50 mL/L CO2条件下培养至对数生长期, 2.5 g/L胰蛋白酶消化后制备单细胞悬液, 调整细胞浓度至1×108并接种于6孔(2 mL/孔)细胞培养板, 培养24 h后用于转染或病毒接种. 通过脂质体介导法将10 μg线性化的pacAd5-Apoptin和pAd5共转染AAV-293细胞, 即在500 μL opti MEM中, 加入10 μL Lipofectamine2000并混匀; 另取500 μL opti MEM加入线性化产物并混匀, 两者混合后于室温下作用30 min, 将上述混合液滴加入AAV-293细胞中, 于37℃, 50 mL/L CO2条件下培养6 h. 同时设pTKEGFP转染阳性对照.
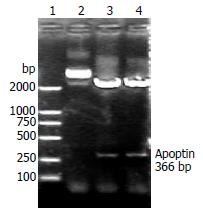
1.2.2 穿梭质粒构建: 用BamHⅠ和SpeⅠ分别双酶切质粒pVAX1-Apoptin和pacAd5 CMV K-N pA. 回收约366 bp的Apoptin线性化的pacAd5 CMV K-N pA, 两者连接后转化大肠杆菌感受态菌DH5α, 挑菌后小量提取质粒, 并用BamHⅠ和SpeⅠ双酶切进行鉴定. 实验方法参照分子克隆[12].
1.2.3 含Apoptin基因的重组腺病毒构建: 用PacⅠ对PacAd5-Apoptin和pAd进行酶切线性化处理, 酶切产物用无水乙醇沉淀回收, 并将线性化产物共转染AAV-293细胞, 培养7-10 d后挑取病毒蚀斑, 经3次冻融后用AAV-293细胞进行蚀斑扩增, 经扩增的重组病毒用于RT-PCR和Western blot鉴定.
1.2.4 RT-PCR检测: 培养接种重组病毒后的AAV-293细胞至80%-90%发生病变时用TRIzol抽提总RNA, 以Oligo(dT)为引物进行反转录以合成cDNA. 以3 μL cDNA为模板, 以Apoptin特异引物进行PCR检测. PCR扩增的反应体系为: 2.5 μL 10×Buffer, 0.5 μL 10 mmol/L dNTP, 上下游引物(10 μmol/L)各1 μL, 1 μL Taq DNA聚合酶, 补加水到25 μL. Apoptin反应条件为: 95℃预变性5 min; 94℃ 1 min, 55℃ 30 s, 72℃ 40 s, 共30个循环; 72℃延伸10 min. PCR产物进行琼脂糖凝胶电泳. 以CAV感染细胞作为阳性对照, 以未感染重组病毒的AAV-293细胞作为阴性对照.
1.2.5 Western blot检测: 培养接种重组病毒后的AAV-293细胞至80%-90%发生病变时收获细胞, 经预冷磷酸盐缓冲液洗涤, 收集至含400 μL裂解缓冲液(50 mmol/L Tris, pH7.4, 250 mmol/L NaCl, 5 mmol/L EDTA, 0.1% Triton X-100, 20 mmol/L β-磷酸甘油, 5 mmol/L NaF, 1 μg/mol亮肽酶素, 200 mg/L胰岛抑素, 1 mg/L胃酶抑素)离心管中, 冰浴30 min后于样品缓冲液(50 mmol/L Tris, pH7.4, 100 mmol/L二硫苏糖醇, 2% SDS, 0.1%溴酚蓝, 10%甘油)中煮沸3 min, 12 000 g, 离心10 min, 上清液经10% SDS-聚丙烯酰胺凝胶电泳分离后电转移至硝酸纤维素膜. 硝酸纤维素膜于含5%脱脂乳封闭2 h, 先后与CAV阳性血清和AP标记的羊抗鸡IgY或β-actin mAb和AP标记的羊抗鼠IgG温育2 h, 并于NBT和BCIP溶液中显色. CAV感染细胞的提取物作为阳性对照, 未感染重组病毒的AAV-293细胞提取物作为阴性对照.
1.2.6 重组腺病毒的滴度测定: 鉴定正确的重组病毒扩增后做连续10倍梯度稀释, 并接种于24孔板培养的AAV-293细胞, 培养3-5 d, 以出现细胞病变的最大稀释倍数为依据, 按以下公式计算病毒滴度: 病毒滴度 = 细胞病变数×稀释倍数/病毒接种量(mL).
穿梭质粒pacAd5-VP3经BamHⅠ和SpeⅠ双酶切后出现366 bp条带(图1), 成功构建了含Apoptin基因的穿梭质粒.
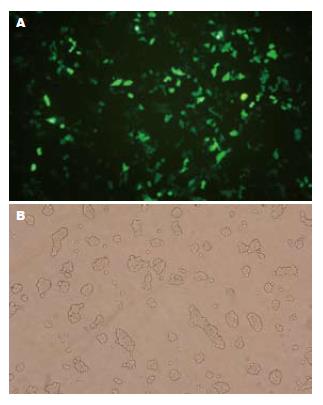
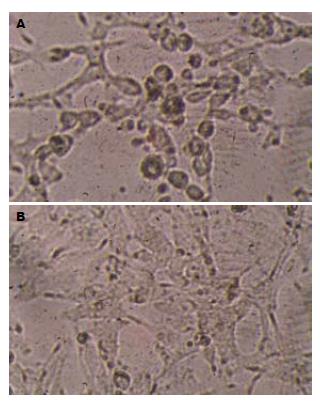
pTKEGFP与线性化的pacAd5-VP3和pAd5分别转染AAV-293细胞转染, 培养24 h后, 可观察到pTKEGFP转染孔细胞呈现明亮绿色荧光(图2), 质粒已成功转染入AAV-293细胞内. 继续培养7-10 d后, pacAd5-Apoptin和pAd5共转染孔出现细胞病毒, 重组病毒已包装完成(图3).
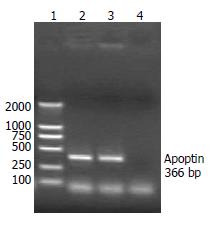
对重组腺病毒感染AAV-293细胞的总RNA进行RT-PCR检测, 可扩增出与CAV感染细胞大小一致的条带, 重组腺病毒中的Apoptin基因得到了正确转录(图4).
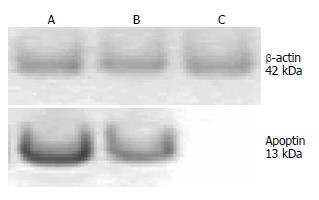
可见相对分子质量13 kDa的特异条带, 与CVA阳性对照一致. 所获得重组腺病毒可有效表达Apoptin蛋白, 该蛋白与CAV阳性血清具有反应原性(图5).
对经筛选和鉴定正确的重组腺病毒进行滴度测定, 重组腺病毒滴度约为1011 PFU/L.
基因治疗的本质就是目的基因、载体与转染的问题, 其关键就是目的基因的选择. 宗旨在于将外源基因导入肿瘤细胞, 使之表达目的蛋白质以达到治疗肿瘤的效果. 腺病毒载体具有滴度高、感染范围广、DNA不整合到宿主染色体、可插入7-8 kb的外源DNA片段等优点, 目前已成为基因治疗、基因功能研究、反义治疗、疫苗开发等领域最为常用的载体之一[13]. 但重组腺病毒污染野生型病毒的问题一直没有得到很好的解决. 本研究采用RAPAdⅠ重组腺病毒系统[14]进行重组腺病毒的构建, 该系统将与腺病毒复制和包装相关信号序列从腺病毒基因组骨架质粒内敲除, 并转移至穿梭质粒中, 使得只有腺病毒基因组骨架质粒与穿梭质粒重组后, 腺病毒才能够包装并增殖. 因此, 应用RAPAdⅠ系统所构建的重组腺病毒在理论上都是经过同源重组的, 这大大降低了野生型腺病毒污染的机会.
细胞凋亡(apoptosis)又称为细胞程序性死亡, 是细胞自主死亡的过程, 也是凋亡相关基因调控的结果. 近年研究发现, 病毒感染是调节细胞凋亡的重要因素, 病毒感染后不仅可通过自身基因的表达激活或抑制细胞凋亡的发生, 也可与细胞凋亡调节基因一起共同参与凋亡的调控. 放疗和化疗是目前常用的肿瘤非手术疗法, 其机制是通过野生型p53的介导细胞凋亡. 触发CAV诱导肿瘤细胞凋亡的因子是由该病毒VP3基因编码的Apoptin蛋白. 目前, Apoptin识别恶性转化细胞的确切机制尚不十分明确, 有待进一步探讨. 但有研究表明Bcl-2家族成员能够促进Apoptin的功能而不是抑制其作用, 说明Apoptin诱导肿瘤细胞凋亡的途径与经典凋亡通路存在差别[15-19]. Apoptin含有一段核定位信号, 使其能够进入转化细胞或恶变细胞的细胞核内[20], 同时引起这类细胞凋亡. 而对正常细胞, Apoptin只存在于核周围的细胞质而不进入细胞核, 不引起正常细胞的凋亡, 对正常细胞无毒性[21-26]. 有研究表明, Apoptin的核定位可能是其诱发细胞凋亡的前提之一[20,27-29]. 由于大部分肿瘤细胞具有p53突变或缺失, 使得传统抗肿瘤方法效果不佳, 因此, 这种非p53依赖性使凋亡蛋白质作为抗肿瘤药物有很好的前景.
为进一步探讨Apoptin基因诱导肿瘤细胞凋亡及区分恶性细胞和正常细胞的机制, 本研究利用RAPAdⅠ重组腺病毒系统成功构建了表达Apoptin基因的重组腺病毒. 实验结果表明, 本研究所构建的重组腺病毒能够有效表达Apoptin基因, 并且所表达Apoptin基因与CAV阳性血清具有反应原性. 重组腺病毒滴度为1011 PFU/L, 能够满足体内外研究的需要.
癌症是一个具有极复杂生物生命变化发生机制的过程, 也是严重威胁人类健康的主要疾病之一. 目前肿瘤患者数量庞大, 并随着诊断手段的发展而逐年增加. 目前对恶性肿瘤的治疗仍多采用手术治疗辅以放化疗的方法, 效果不尽人意, 且有严重不良反应. 基因治疗是近年肿瘤治疗研究热点, 有别于传统方法, 着眼于调动机体自身的抗癌能力, 通过增强固有的抗肿瘤机制达到抑制肿瘤细胞及根治肿瘤的目的, 因此被认为是最有希望攻克癌症的疗法.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
目前, 肿瘤基因治疗药物的应用前景已不仅取决于其杀伤肿瘤细胞的有效性, 而更加侧重于制剂的抑瘤特异性. 由鸡贫血病毒(CAV)上VP3基因编码的凋亡素(Apoptin)能够特异性诱导包括肝癌、淋巴瘤、胆管癌、黑色素瘤、乳腺癌、肺癌、结肠癌等人源肿瘤发生凋亡, 是目前研究的热点.
本研究利用RAPA dⅠ重组腺病毒系统成功构建了表达Apoptin基因的重组腺病毒. 实验结果表明, 本研究所构建的重组腺病毒能够有效表达Apoptin基因, 并且所表达Apoptin基因与CAV阳性血清具有反应原性.
腺病毒载体具有滴度高、感染范围广、DNA不整合到宿主染色体、可插入7-8 kb的外源DNA片段等优点, 目前已成为基因治疗、基因功能研究、反义治疗、疫苗开发等领域最为常用的载体之一.
本研究为肿瘤治疗的前沿课题, 有重要的临床应用前景, 所用方法先进, 实验结果照片清晰, 分辨性好, 讨论较客观, 行文流畅, 具有较好的学术价值.
编辑: 史景红 电编:何基才
| 1. | Fischer U, Schulze-Osthoff K. New approaches and therapeutics targeting apoptosis in disease. Pharmacol Rev. 2005;57:187-215. [PubMed] [DOI] |
| 2. | Maddika S, Wiechec E, Ande SR, Poon IK, Fischer U, Wesselborg S, Jans DA, Schulze-Osthoff K, Los M. Interaction with PI3-kinase contributes to the cytotoxic activity of apoptin. Oncogene. 2008;27:3060-3065. [PubMed] [DOI] |
| 3. | Maddika S, Bay GH, Kroczak TJ, Ande SR, Maddika S, Wiechec E, Gibson SB, Los M. Akt is transferred to the nucleus of cells treated with apoptin, and it participates in apoptin-induced cell death. Cell Prolif. 2007;40:835-848. [PubMed] [DOI] |
| 4. | Backendorf C, Visser AE, de Boer AG, Zimmerman R, Visser M, Voskamp P, Zhang YH, Noteborn M. Apoptin: therapeutic potential of an early sensor of carcinogenic transformation. Annu Rev Pharmacol Toxicol. 2008;48:143-169. [PubMed] [DOI] |
| 5. | Oro C, Jans DA. The tumour specific pro-apoptotic factor apoptin (Vp3) from chicken anaemia virus. Curr Drug Targets. 2004;5:179-190. [PubMed] [DOI] |
| 6. | 李 霄, 金 宁一, 连 海, 陈 立刚, 孙 丽丽, 李 萍. Apoptin基因对人胃癌细胞BGC-823的抑制效应及与凋亡信号转导的关系. 世界华人消化杂志. 2006;14:2991-2996. [DOI] |
| 7. | Rohn JL, Noteborn MH. The viral death effector Apoptin reveals tumor-specific processes. Apoptosis. 2004;9:315-322. [PubMed] [DOI] |
| 8. | van der Eb MM, Pietersen AM, Speetjens FM, Kuppen PJ, van de Velde CJ, Noteborn MH, Hoeben RC. Gene therapy with apoptin induces regression of xenografted human hepatomas. Cancer Gene Ther. 2002;9:53-61. [PubMed] [DOI] |
| 9. | Olijslagers S, Dege AY, Dinsart C, Voorhoeve M, Rommelaere J, Noteborn MH, Cornelis JJ. Potentiation of a recombinant oncolytic parvovirus by expression of Apoptin. Cancer Gene Ther. 2001;8:958-965. [PubMed] [DOI] |
| 10. | Li X, Jin N, Mi Z, Lian H, Sun L, Li X, Zheng H. Antitumor effects of a recombinant fowlpox virus expressing Apoptin in vivo and in vitro. Int J Cancer. 2006;119:2948-2957. [PubMed] [DOI] |
| 11. | 李 霄, 金 宁一, 连 海, 管 国芳, 孙 丽丽, 李 雪梅, 郑 洪玲. 表达新城疫病毒血凝素-神经氨酸酶基因重组禽痘病毒的构建及其抑瘤作用. 科学通报. 2006;51:2252-2257. |
| 13. | Bernt KM, Ni S, Tieu AT, Lieber A. Assessment of a combined, adenovirus-mediated oncolytic and immunostimulatory tumor therapy. Cancer Res. 2005;65:4343-4352. [PubMed] [DOI] |
| 14. | Anderson RD, Haskell RE, Xia H, Roessler BJ, Davidson BL. A simple method for the rapid generation of recombinant adenovirus vectors. Gene Ther. 2000;7:1034-1038. [PubMed] [DOI] |
| 15. | Burek M, Maddika S, Burek CJ, Daniel PT, Schulze-Osthoff K, Los M. Apoptin-induced cell death is modulated by Bcl-2 family members and is Apaf-1 dependent. Oncogene. 2006;25:2213-2222. [PubMed] [DOI] |
| 16. | Russo A, Terrasi M, Agnese V, Santini D, Bazan V. Apoptosis: a relevant tool for anticancer therapy. Ann Oncol. 2006;17 Suppl 7:vii115-vii123. [PubMed] [DOI] |
| 17. | Natesan S, Kataria JM, Dhama K, Bhardwaj N, Sylvester A. Anti-neoplastic effect of chicken anemia virus VP3 protein (apoptin) in Rous sarcoma virus-induced tumours in chicken. J Gen Virol. 2006;87:2933-2940. [PubMed] [DOI] |
| 18. | Schoop RA, Kooistra K, Baatenburg De Jong RJ, Noteborn MH. Bcl-xL inhibits p53- but not apoptin-induced apoptosis in head and neck squamous cell carcinoma cell line. Int J Cancer. 2004;109:38-42. [PubMed] [DOI] |
| 19. | Peng DJ, Sun J, Wang YZ, Tian J, Zhang YH, Noteborn MH, Qu S. Inhibition of hepatocarcinoma by systemic delivery of Apoptin gene via the hepatic asialoglycoprotein receptor. Cancer Gene Ther. 2007;14:66-73. [PubMed] [DOI] |
| 20. | Maddika S, Mendoza FJ, Hauff K, Zamzow CR, Paranjothy T, Los M. Cancer-selective therapy of the future: apoptin and its mechanism of action. Cancer Biol Ther. 2006;5:10-19. [PubMed] |
| 21. | Danen-Van Oorschot AA, Zhang YH, Leliveld SR, Rohn JL, Seelen MC, Bolk MW, Van Zon A, Erkeland SJ, Abrahams JP, Mumberg D. Importance of nuclear localization of apoptin for tumor-specific induction of apoptosis. J Biol Chem. 2003;278:27729-27736. [PubMed] [DOI] |
| 22. | Alvisi G, Poon IK, Jans DA. Tumor-specific nuclear targeting: promises for anti-cancer therapy? Drug Resist Updat. 2006;9:40-50. [PubMed] [DOI] |
| 23. | Poon IK, Oro C, Dias MM, Zhang J, Jans DA. Apoptin nuclear accumulation is modulated by a CRM1-recognized nuclear export signal that is active in normal but not in tumor cells. Cancer Res. 2005;65:7059-7064. [PubMed] [DOI] |
| 24. | He X, Zhang Q, Liu Y, He P. Apoptin Induces Chromatin Condensation in Normal Cells. Virus Genes. 2005;31:49-55. [PubMed] [DOI] |
| 25. | Gdynia G, Lehmann-Koch J, Sieber S, Tagscherer KE, Fassl A, Zentgraf H, Matsuzawa S, Reed JC, Roth W. BLOC1S2 interacts with the HIPPI protein and sensitizes NCH89 glioblastoma cells to apoptosis. Apoptosis. 2008;13:437-447. [PubMed] [DOI] |
| 26. | Han SX, Ma JL, Lv Y, Huang C, Liang HH, Duan KM. Secretory Transactivating Transcription-apoptin fusion protein induces apoptosis in hepatocellular carcinoma HepG2 cells. World J Gastroenterol. 2008;14:3642-3649. [PubMed] [DOI] |
| 27. | Heilman DW, Teodoro JG, Green MR. Apoptin nucleocytoplasmic shuttling is required for cell type-specific localization, apoptosis, and recruitment of the anaphase-promoting complex/cyclosome to PML bodies. J Virol. 2006;80:7535-7545. [PubMed] [DOI] |