修回日期: 2008-10-06
接受日期: 2008-10-14
在线出版日期: 2008-11-08
目的: 构建COX-2基因启动子荧光素酶报告基因重组质粒pGL3-Basic-COX-2-promoter, 并进行功能鉴定.
方法: 根据已知人的COX-2基因启动子序列设计两端引物, 扩增人基因组DNA中的COX-2启动子. 载体质粒pGL3-Basic和COX-2启动子分别用限制性内切酶Hind Ⅲ和BglⅡ双酶切, 将COX-2基因启动子插入到pGL3-Basic报告载体中. 构建的pGL3-Basic-COX-2-promoter重组质粒和内参质粒pRL-SV40瞬时共转染胃癌MKN45细胞, 加入100倍细胞数量的H. pylori共培养不同时间后, 检测双荧光素酶的活性.
结果: 成功构建COX-2基因启动子重组质粒pGL3-Basic-COX-2-promoter, 质粒测序及酶切结果完全正确. 瞬时转染实验显示, COX-2启动子在MKN45细胞中的转录表达随时间的变化而升高, 转染后40 h的双报告基因活性是转染后8 h的3.5倍(P<0.01); 加入H. pylori共培养后, 同时间点的荧光素酶活性明显升高(P<0.05或0.01), 转染后40 h的活性是转染后8 h的5倍(P<0.01).
结论: pGL3-Basic-COX-2-promoter在胃癌MKN45细胞中能被转录激活, 加入H. pylori刺激后COX-2活性显著增强, pGL3-Basic-COX-2-promoter可以用来鉴定和检测细胞中COX-2的水平.
引文著录: 李琦, 周利红, 王炎, 孙珏, 高虹, 范忠泽. pGL3-Basic-COX-2-promoter报告基因重组质粒的构建及其功能鉴定. 世界华人消化杂志 2008; 16(31): 3498-3504
Revised: October 6, 2008
Accepted: October 14, 2008
Published online: November 8, 2008
AIM: To construct COX-2 promoter recombined luciferase reporter gene vector, and to detect its function.
METHODS: Primers were designed based on human COX-2 gene promoter, then COX-2 promoter from human genome DNA was replicated. pGL3-Basic Vector and COX-2 promoter were digested with restriction enzymes Hind Ⅲ and Bgl Ⅱ separately, then COX-2 promoter was inserted into pGL3-Basic Vector. The recombinant vector pGL3-Basic-COX-2-promoter was transiently co-transfected into MKN45 cells with control vector pRL-SV40 respectively. twelve hours later, cells were treated with H. pylori 100 times amount of cells for different length of time, then the activity of dual luciferase was detected.
RESULTS: COX-2 promoter recombined luciferase reporter gene vector was constructed successfully, and the result of sequencing and double digesting of recombined plasmid were completely correct. The experiment of transient transfection showed that the expression of COX-2 promoter in MKN45 cells was increased with time. Activity of dual-luciferase after transfection for 40 h was 3.5 folds of that for 8 h (P < 0.05). When H. pylori was added to medium for co-culture, activity of dual-luciferase was increased up markedly compared with groups that were not added with H. pylori (P < 0.05 or 0.01), and it was 5 folds after transfection for 40 h than 8 h (P < 0.01).
CONCLUSION: pGL3-Basic-COX-2-promoter can be transcribed and activated in MKN45 cells, and activity of COX-2 promoter increases obviously after H. pylori addition. pGL3-Basic-COX-2-promoter can be used to identify and detect the level of COX-2 in cells.
- Citation: Li Q, Zhou LH, Wang Y, Sun J, Gao H, Fan ZZ. Construction of pGL3-Basic-COX-2-promoter reporter gene vector and detection of its function. Shijie Huaren Xiaohua Zazhi 2008; 16(31): 3498-3504
- URL: https://www.wjgnet.com/1009-3079/full/v16/i31/3498.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i31.3498
环氧化酶2(cyclooxygenase-2, COX-2), 又称环氧合酶, 在肿瘤发生、发展和转移的整个过程中起着重要的作用, 参与了肿瘤形成的多个环节. COX-2可由癌基因的激活或抑癌基因的失活而被活化, 活化的COX-2可催化花生四稀酸形成能抑制细胞凋亡的前列腺素(prostaglandins, PGs), 使细胞增殖与凋亡失衡, 从而促进肿瘤的发生发展[1-3]. 因此, 对肿瘤组织或肿瘤细胞中COX-2活性检测可以作为监测肿瘤的发生发展的一个重要手段, 同时COX-2在肿瘤细胞中的表达水平也可以作为抗肿瘤药物筛选的一个重要指标[4]. 幽门螺杆菌(Helicobacter pylori, H. pylori)在慢性胃病或胃癌的形成中起着关键的作用, 1994年WHO将其列为胃癌的Ⅰ类致癌因子, H. pylori感染是导致胃癌发生的高危因素之一[5]. 为探讨H pylori对胃癌细胞COX-2表达的影响, 本研究构建了COX-2启动子重组质粒pGL3-Basic-COX-2-promoter, 将其共转染胃癌细胞, 并与H. pylori共培养后进行双荧光素酶活性的测定, 来检测H. pylori对胃癌细胞COX-2启动子活性的影响.
MKN45细胞株购自中科院上海细胞所、H. pylori引自上海交通大学附属仁济医院消化病研究所; 大肠杆菌感受态细胞DH5α、载体质粒pGL3-Basic、内参质粒pRL-SV40由华东理工大学药学院药理研究室刘建文教授馈赠. 人血基因组DNA纯化试剂盒、组织/细胞基因组DNA纯化试剂盒购自深圳尚能生物科技有限公司; DNA片段中量纯化试剂盒、质粒抽提试剂盒购自美国Axygen公司; Taq DNA聚合酶、dNTP、T4连接酶、限制性内切酶BglⅡ和HindⅢ购自日本TaKaRa公司; 转染脂质体Lipofectamine 2000购自美国Invitrogen公司; 胰蛋白酶、新生牛血清、RPMI 1640干粉培养基购自美国Gibco公司; 琼脂粉(Agar)、胰蛋白胨(Tryptone)、酵母浸出粉(Yeast Extract)购自英国Oxoid公司; 双荧光素酶检测试剂盒(dual luciferase assay system)与化学发光仪(GloMax 20/20 Luminometer)购自美国Promega公司. 电泳仪(MiniproteanIII型)与凝胶成像系统(Gel-Doc EQ)购自美国Bio Rad公司, 银质梯度PCR仪(Mastercycler)、生物分光光度计(RS232c)、高速低温离心机(Centrifuge 5804R)购自德国Eppendorf公司, CO2细胞培养箱(Galaxy S+英国RS Biotech公司), 荧光倒置显微镜(CKX41/CKX-RFA, 日本Olympus公司), 空气浴摇床(SI50, 上海欧比特仪器有限公司), 电热恒温培养箱(DNP 9032, 上海精宏实验设备有限公司).
1.2.1 基因组DNA提取: 含有COX-2启动子基因组DNA提取自正常人外周血白细胞或人胃癌MKN45细胞, 采用血液基因组DNA纯化试剂盒或组织、细胞基因组DNA纯化试剂盒的操作方法进行提取, 结果用10 g/L琼脂糖凝胶电泳检测DNA纯度及完整性, 利用分光光度计测定产物在260 nm的吸收值, 以计算其浓度.
1.2.2 引物设计与合成: 根据已知人的COX-2基因启动子序列设计两端引物(PCR引物合成由上海美季生物技术有限公司完成): 上游(5'端)引物: 包含COX-2基因启动子互补碱基, 一个HindⅢ识别位点, 三个保护碱基, 5'-CCCAAGCTTCCTGGACGTGCTCCTGAC-3'. 下游(3'端)引物: 包含COX-2基因启动子互补碱基, 一个BglⅡ识别位点, 二个保护碱基, 5'-GAAGATCTTCCTCGACCCTCTAAAGACG-3'.
1.2.3 PCR扩增COX-2启动子: 以基因组DNA为模板, 利用常规PCR反应进行扩增; 反应条件为95℃预变性3 min; 循环为94℃变性30 s, 65℃退火45 s, 72℃延伸1 min, 共进行30个循环, 72℃终末延伸5 min. 扩增产物取5 μL用7 g/L琼脂糖凝胶电泳检测; 剩余PCR产物用DNA片段中量纯化试剂盒回收纯化备用.
1.2.4 重组质粒的构建: 用pGL3-Basic载体质粒转化常规制备的大肠杆菌DH5α感受态细胞, 进行大量扩增; 试剂盒抽提法大量制备pGL3-Basic质粒, 电泳检测质粒的纯度和含量. 分别用限制性内切酶HindⅢ和BglⅡ对回收的含COX-2启动子PCR产物和pGL3-Basic载体质粒进行双酶切, 试剂盒直接回收大片段的酶切产物. 将酶切回收后的pGL3-Basic载体质粒和COX-2基因启动子目的片段在0.2 mL的离心管中进行连接反应, 16℃酶连过夜.
取10 μL连接产物直接转化100 μL大肠杆菌DH5α感受态细胞. 经过含有氨苄青霉素的LB平板固体培养基中选择培养. 从转化子的平板上随即挑取10个菌落, 经过不含氨苄青霉素的LB液体培养基扩增培养, 培养后用试剂盒抽提法提取质粒备用; 经过酶切、PCR、测序鉴定.
1.2.5 质粒共转染胃癌MKN45细胞: 将培养于含有100 mL/L新生牛血清、100 kU/L青霉素、100 mg/L链霉素RPMI 1640完全培养基(37℃, 50 mL/L CO2, 饱和湿度)中人胃癌MKN45细胞株, 按1×104个细胞/孔的量在96空板中接种指数生长期的细胞, 在37℃ 5% CO2培养箱中过夜培养, 直到细胞到80%汇片.
在EP管中配置重组质粒PGL3-Basic-COX-2 promoter、内参载体质粒pRL-SV40、转染脂质体Lipofectamine 2000复合物. 将重组质粒PGL3-Basic-COX-2 promoter、内参载体质粒pRL-SV40各5 μL/well(96well)稀释至25 μL/well不含血清和抗生素的RPMI 1640中, 用加样枪混合均匀. 然后将脂质体悬液(0.5 μL/well)加入25 μL/well不含血清和抗生素的RPMI 1640中, 在室温孵育5 min, 最后将两者混合在一起, 充分混匀静置20 min, 使质粒与脂质体充分结合.
分别吸去接种到96孔板中的培养液, 用不含血清和抗生素的RPMI 1640洗一次, 在每个孔中加入60 μL的质粒/脂质体混合物. 在37℃ 50 mL/L CO2培养箱中培养3-5 h后, 吸弃培养板中的转染培养液, 向各孔加入100 μL有血清无抗生素的RPMI 1640培养液, 在37℃ 50 mL/L CO2培养箱中培养18-24 h. 第2天将H. pylori处理组孔中的细胞分别加入H pylori PBS混悬液(H. pylori:MKN45 = 100:1), 处理后8、16、24、32、40、48 h收集样品, 进行双荧光素酶活性检测.
1.2.6 双荧光素酶报告基因活性测定: 将转染有pGL3-Basic-COX-2-promter和pRL-SV40的MKN45细胞经过一定时间的培养后收集, 吸弃培养基, 用PBS洗1次. 加入裂解液20 μL/孔, 室温摇动15 min. 按照双荧光素酶检测试剂盒(Dual Luciferase Assay System)的操作说明书, 取100 μL Luciferase Assay Buffer Ⅱ于1.5 mL的离心管中, 设定化学发光仪延迟2 s, 发光仪测读10 s, 将全部细胞裂解液加入到离心管中, 用加样枪轻轻抽吸2-3次混匀, 不要旋涡振动, 将离心管放入GloMax 20/20 Luminometer化学发光仪中测读萤火虫荧光素酶发光值; 将离心管移出发光仪, 加入100 μL Stop & Glo Reagent, 快速旋涡混匀后, 将离心管重放回发光仪中测读海肾荧光素酶发光值.
统计学处理 统计数据用mean±SD表示, 采用SPSS13.0软件的One-way ANOVA进行统计学分析. P<0.05具有统计学意义.
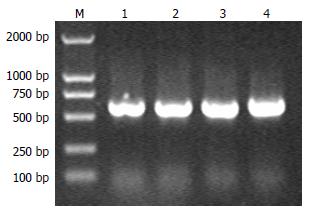
从人血液白细胞或胃癌MKN45细胞中提取出基因组DNA, 设计COX-2启动子序列引物后, 对基因组DNA进行PCR扩增, 得到COX-2启动子基因562 bp目的序列(图1).
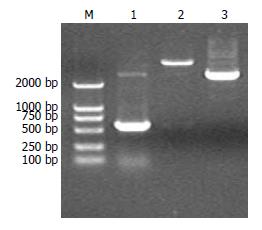
重组质粒DNA测序由上海美季生物技术有限公司完成, 结果与GenBank(gi|4506264)中人COX-2基因启动子序列完全匹配(图2). 同时, 将构建好的pGL3-Basic-COX-2-promoter重组质粒用限制性内切酶BglⅡ和HindⅢ进行双酶切鉴定, 酶切产物电泳可见约4818 bp和562 bp的条带, 与插入的COX-2启动子目的片段和线性pGL3-Basic大小完全一致(图3).
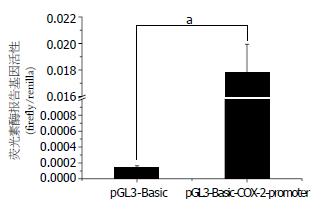
重组质粒pGL3-Basic-COX-2-promoter和内参质粒pRL-SV40共转染人胃癌MKN45细胞后, 测定萤火虫荧光素酶和海肾荧光素酶报告基因活性, 并将两者的比值作为衡量COX-2启动子活性的依据, pRL-SV40作为内参可以消除由于细胞数目及转染效率等不同所带来的组间差异. 结果显示, 与载体质粒pGL3-Basic相比, 重组质粒pGL3-Basic-COX-2-promoter转染MKN45细胞后, COX-2的表达显著增强, 两者相比, 具有显著的统计学意义(P<0.001)(图4).
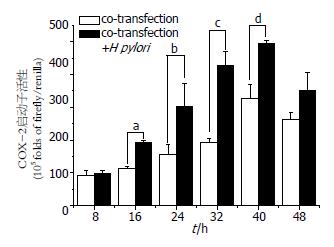
将重组质粒与内参质粒转染MKN45细胞4 h后, 吸弃转染培养液常规培养16-24 h, 分别加入H. pylori PBS混悬液(H. pylori:MKN45 = 100:1), 处理后8、16、24、32、40、48 h收集样品, 进行双荧光素酶活性检测. 结果显示, pGL3-Basic-COX-2-promoter转染MKN45细胞后, COX-2启动子的活性随时间的变化呈现明显的上升趋势, 在转染40 h后达到最大值, 与转染8 h组相比活性增高3.5倍(P<0.01). 转染有pGL3-Basic-COX-2-promoter的MKN45细胞与H. pylori共培养16 h后, COX-2启动子的活性明显增强, 并随时间的变化呈上升的趋势, 40 h达到最大值, 与转染8 h组相比活性增高5倍(P<0.01), 各时间点之间都有明显的统计学意义(P<0.05或P<0.01, 图5).
环氧合酶(Cyclooxygenase, COX)是前列腺素生物合成的重要限速酶, 可将花生四烯酸代谢成各种前列腺素产物[6], 目前研究发现COX至少有COX-1和COX-2两种同工酶[7]. COX-1为结构型(constitutive)基因, 在正常组织和细胞内表达, 参与维持其正常的生理功能; COX-2为诱导型(inducible)基因, 静息时不表达, 当细胞受到各种诱导因子刺激时表达上调, 迅速合成, 是炎症过程中一个重要的诱导酶, 并参与肿瘤的发生及发展, 可作为炎症及肿瘤的一个重要的治疗靶分子[4,6,9]. COX-2的表达在不同的组织、不同的状况下变动很大, 他的主要产物是环前列腺素和PGE2[8]. COX-2基因全长8.3 kb, 由10个外显子和9个内含子组成, 定位于第1号染色体1q25.2-25.3, 由5'端0.8 kb的转录起始点上游区, 6 kb的蛋白质编码区以及1.5 kb 3'端非编码区组成, 转录调控序列包括TATA box序列、CRE(cAMP responsive element)反应元件、Ets-1转录因子位点和C/EBP(CCAAT/enhancer binding protein)反应元件各1个, 激活蛋白质-2(activator protein, AP-2)位点、核转录因子NF-κB(nuclear factor-kappa B)位点各2个, SP1位点3个, 其mRNA约4.5 kb, 基因编码603或604个氨基酸, 含有17个氨基酸残基构成的信号肽[9-10]. COX-2发现于广泛存在于各种肿瘤细胞中, 主要定位于核膜, COX-2产生的PGs产物可进入核内, 调节靶细胞基因的转录水平和影响下游的信号转导. COX-2在肿瘤组织中高表达, 如结直肠腺癌、Lewis肺癌、食道癌、膀胱癌、胰腺癌、肝癌、胃癌、口腔癌、乳腺癌等[11-16], 表达强度与肿瘤组织类型和分化程度密切相关.
人类H. pylori是一种革兰阴性、螺旋状微生物, 在一极有5-6根带鞘鞭毛, 该微生物主要存在于胃黏膜的黏液层, 有时向前穿过黏液层到达其下的上皮细胞. 自从1983年从人胃黏膜中分离出该细菌以来, H. pylori已被认为是慢性活动性胃炎、十二指肠球部溃疡的重要致病因素, 是胃癌的高危因素之一[17]. 1998年, Sawaoka et al[18]首先进行了27例无症状健康体检者胃窦黏膜COX-2表达情况, 证实了H pylori感染诱导胃黏膜COX-2表达. 此后, 国内外相继又有研究人员用不同方法从mRNA、蛋白水平证实了H. pylori感染的胃癌组织COX-2表达水平上调[19-20]. 国内有相关研究认为[21], COX-2的过表达是胃癌发生的早期事件, 随着癌前病变的进展COX-2蛋白表达递增, COX-2不仅与早期胃癌的发生有关, 同时与胃癌的恶性进展密切相关. 卢启明 et al[22]进行的流行病学研究提示, H. pylori感染可导致胃黏膜萎缩, 肠上皮化生及异型增生, 特别是VagA+菌株为高毒菌株, 与胃癌及癌前病变关系更为密切. Caputo et al[23]研究报道, VagA+H. pylori菌株可促进MKN28胃癌细胞COX-2过表达、上调VEGF mRNA及其蛋白表达, COX-2抑制剂可阻断H pylori上调VEGF. Chen et al[24]对71例胃癌切除标本COX-2表达、血管浸润及H. pylori感染状况单因素和多因素分析结果显示, COX-2表达的上调与H. pylori感染相关, 与血管浸润高度一致. 因此, H. pylori感染可能通过COX-2途径参与了H. pylori相关胃炎向癌前病变和胃癌的演进过程, 增加COX-2的表达可能是H. pylori引起胃癌发生的机制之一.
本研究在前期工作的基础上, 通过构建COX-2基因启动子萤火虫荧光素酶重组质粒pGL3-Basic-COX-2-promoter, 并与含海肾荧光素酶的内参质粒pRL-SV40共转染胃癌细胞MKN45细胞, 运用双荧光素酶报告基因法(dual-luciferase reporter assay), 通过检测荧光素酶的表达量反映启动序列的活性, 探讨H. pylori对胃癌细胞中COX-2基因启动子活性的影响及H. pylori对胃癌细胞COX-2表达的作用. 证实COX-2在胃癌细胞中可以稳定表达, 其活性受各种刺激因子的影响, H. pylori便是其中最为常见的因素之一, H. pylori激活pGL3-Basic-COX-2-promoter重组质粒中COX-2启动子的转录, 是胃癌细胞共转染重组质粒后COX-2过表达的重要原因. 重组质粒pGL3-Basic-COX-2-promoter不仅可以用来检测不同的刺激因子对肿瘤组织或肿瘤细胞中COX-2表达的影响, 而且可以作为一个平台筛选以COX-2为靶基因的抗肿瘤药物, 是研究和筛选抗肿瘤药物的一种很有潜力的靶标, 其具体的实验可行性有待于进一步研究.
1998年Sawaoka et al首次发现H. pylori感染诱导胃黏膜COX-2表达后, 国内外相继证实了H. pylori感染的胃癌组织COX-2表达水平上调. 多数研究认为COX-2的过表达是胃癌发生的早期事件, 随着癌前病变的进展, COX-2蛋白表达递增, COX-2不仅与早期胃癌的发生有关, 同时与胃癌的恶性进展密切相关. 因此, H. pylori感染可能通过COX-2途径参与了H pylori相关胃炎向癌前病变和胃癌的演进过程, 增加COX-2的表达可能是H. pylori引起胃癌发生的重要原因.
陈洪, 副教授, 东南大学附属中大医院消化科
COX-2在肿瘤发生、发展和转移的整个过程中起着重要的作用, 参与了肿瘤形成的多个环节. 肿瘤细胞中COX-2的表达可作为抗肿瘤药物靶向筛选的一个重要指标, 寻找快速、灵敏、高效的筛选方法成为目前的一个研究热点.
研究发现胃癌组织中COX-2的过度表达与H. pylori感染呈显著相关, Lim et al研究显示H. pylori可诱导COX-2表达, 认为H. pylori感染是增加胃癌发生危险性的可能机制之一. Sheu et al通过内镜活检免疫组化检测H pylori感染胃癌患者及根除H. pylori后COX-2的表达, 发现H. pylori感染胃癌患者COX-2呈高表达, 根除H pylori一年后COX-2表达在萎缩性胃炎部位消失. Sung et al通过对17例存在肠化生的H. pylori感染患者根除H pylori治疗一年后检测COX-2的变化, 发现H. pylori的根除导致COX-2表达的下调.
本研究采用基因重组技术将COX-2基因启动子连接到具有多克隆位点的pGL3-Basic载体质粒上, 构建能够瞬时表达COX-2活性的重组质粒, 为研究抗肿瘤药物的作用靶点提供了实验平台.
同时检测萤火虫荧光素酶和海肾荧光素酶的活性来反应COX-2基因启动子的转录活性, 可应用于批量筛选以COX-2基因为靶向的抗肿瘤药物, 具有靶点明确、高效快速、反应灵敏等特点.
本研究设计合理, 科学性强, 书写规范、流畅, 具有较好的参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Ko SC, Chapple KS, Hawcroft G, Coletta PL, Markham AF, Hull MA. Paracrine cyclooxygenase-2-mediated signalling by macrophages promotes tumorigenic progression of intestinal epithelial cells. Oncogene. 2002;21:7175-7186. [PubMed] [DOI] |
| 2. | Dannenberg AJ, Altorki NK, Boyle JO, Dang C, Howe LR, Weksler BB, Subbaramaiah K. Cyclo-oxygenase 2: a pharmacological target for the prevention of cancer. Lancet Oncol. 2001;2:544-551. [PubMed] [DOI] |
| 3. | Mestre JR, Mackrell PJ, Rivadeneira DE, Stapleton PP, Tanabe T, Daly JM. Redundancy in the signaling pathways and promoter elements regulating cyclooxygenase-2 gene expression in endotoxin-treated macrophage/monocytic cells. J Biol Chem. 2001;276:3977-3982. [PubMed] [DOI] |
| 4. | Subbaramaiah K, Dannenberg AJ. Cyclooxygenase 2: a molecular target for cancer prevention and treatment. Trends Pharmacol Sci. 2003;24:96-102. [PubMed] [DOI] |
| 5. | Yamac D, Ayyildiz T, Coşkun U, Akyürek N, Dursun A, Seckin S, Koybasioglu F. Cyclooxygenase-2 expression and its association with angiogenesis, Helicobacter pylori, and clinicopathologic characteristics of gastric carcinoma. Pathol Res Pract. 2008;204:527-536. [PubMed] [DOI] |
| 6. | Sheehan KM, O'Connell F, O'Grady A, Conroy RM, Leader MB, Byrne MF, Murray FE, Kay EW. The relationship between cyclooxygenase-2 expression and characteristics of malignant transformation in human colorectal adenomas. Eur J Gastroenterol Hepatol. 2004;16:619-625. [PubMed] [DOI] |
| 7. | Zidar N, Odar K, Glavač D, Jerše M, Zupanc T, Stajer D. Cyclooxygenase in normal human tissues - is COX-1 really a constitutive isoform, and COX-2 an inducible isoform? J Cell Mol Med. 2008; 24 [Epub ahead of print]. [PubMed] |
| 8. | Jia RP, Xu LW, Su Q, Zhao JH, Li WC, Wang F, Xu Z. Cyclooxygenase-2 expression is dependent upon epidermal growth factor receptor expression or activation in androgen independent prostate cancer. Asian J Androl. 2008;10:758-764. [PubMed] [DOI] |
| 9. | Haile RW, Yochim JM, Cortessis VK, Lin J, Levine AJ, Diep A, Danenberg K, Danenberg P. A molecular/epidemiologic analysis of expression of cyclooxygenases 1 and 2, use of nonsteroidal antiinflammatory drugs, and risk of colorectal adenoma. Clin Colorectal Cancer. 2005;4:390-395. [PubMed] [DOI] |
| 10. | von Rahden BH, Brücher BL, Langner C, Siewert JR, Stein HJ, Sarbia M. Expression of cyclo-oxygenase 1 and 2, prostaglandin E synthase and transforming growth factor beta1, and their relationship with vascular endothelial growth factors A and C, in primary adenocarcinoma of the small intestine. Br J Surg. 2006;93:1424-1432. [PubMed] [DOI] |
| 11. | Morris CD, Armstrong GR, Bigley G, Green H, Attwood SE. Cyclooxygenase-2 expression in the Barrett's metaplasia- dysplasia-adenocarcinoma sequence. Am J Gastroenterol. 2001;96:990-996. [PubMed] |
| 12. | Reddy BS, Hirose Y, Lubet R, Steele V, Kelloff G, Paulson S, Seibert K, Rao CV. Chemoprevention of colon cancer by specific cyclooxygenase-2 inhibitor, celecoxib, administered during different stages of carcinogenesis. Cancer Res. 2000;60:293-297. [PubMed] |
| 13. | Denkert C, Köbel M, Pest S, Koch I, Berger S, Schwabe M, Siegert A, Reles A, Klosterhalfen B, Hauptmann S. Expression of cyclooxygenase 2 is an independent prognostic factor in human ovarian carcinoma. Am J Pathol. 2002;160:893-903. [PubMed] |
| 14. | Cheng J, Imanishi H, Liu W, Nakamura H, Morisaki T, Higashino K, Hada T. Involvement of cell cycle regulatory proteins and MAP kinase signaling pathway in growth inhibition and cell cycle arrest by a selective cyclooxygenase 2 inhibitor, etodolac, in human hepatocellular carcinoma cell lines. Cancer Sci. 2004;95:666-673. [PubMed] [DOI] |
| 15. | Sudbø J, Ristimäki A, Sondresen JE, Kildal W, Boysen M, Koppang HS, Reith A, Risberg B, Nesland JM, Bryne M. Cyclooxygenase-2 (COX-2) expression in high-risk premalignant oral lesions. Oral Oncol. 2003;39:497-505. [PubMed] [DOI] |
| 16. | Kase S, Osaki M, Honjo S, Hashimoto K, Adachi H, Tsujitani S, Ito H. Expression of cyclooxygenase-1 and cyclooxygenase-2 in human esophageal mucosa, dysplasia and carcinoma. Pathobiology. 2004;71:84-92. [PubMed] [DOI] |
| 17. | Chang CS, Chen WN, Lin HH, Wu CC, Wang CJ. Increased oxidative DNA damage, inducible nitric oxide synthase, nuclear factor kappaB expression and enhanced antiapoptosis-related proteins in Helicobacter pylori-infected non-cardiac gastric adenocarcinoma. World J Gastroenterol. 2004;10:2232-2240. [PubMed] |
| 18. | Sawaoka H, Kawano S, Tsuji S, Tsuji M, Sun W, Gunawan ES, Hori M. Helicobacter pylori infection induces cyclooxygenase-2 expression in human gastric mucosa. Prostaglandins Leukot Essent Fatty Acids. 1998;59:313-316. [PubMed] [DOI] |
| 19. | Sung JJ, Leung WK, Go MY, To KF, Cheng AS, Ng EK, Chan FK. Cyclooxygenase-2 expression in Helicobacter pylori-associated premalignant and malignant gastric lesions. Am J Pathol. 2000;157:729-735. [PubMed] |
| 20. | Tatsuguchi A, Sakamoto C, Wada K, Akamatsu T, Tsukui T, Miyake K, Futagami S, Kishida T, Fukuda Y, Yamanaka N. Localisation of cyclooxygenase 1 and cyclooxygenase 2 in Helicobacter pylori related gastritis and gastric ulcer tissues in humans. Gut. 2000;46:782-789. [PubMed] [DOI] |
| 22. | 卢 启明, 张 丽萍, 姜 瑞, 张 岫兰, 李 淑兰, 曹 萍, 石 丽清, 陈 翔, 薛 群基. 胃癌高发区人群CagA+幽门螺杆菌与胃黏膜病变的关系. 世界华人消化杂志. 2005;13:408-410. [DOI] |
| 23. | Caputo R, Tuccillo C, Manzo BA, Zarrilli R, Tortora G, Blanco Cdel V, Ricci V, Ciardiello F, Romano M. Helicobacter pylori VacA toxin up-regulates vascular endothelial growth factor expression in MKN 28 gastric cells through an epidermal growth factor receptor-, cyclooxygenase-2-dependent mechanism. Clin Cancer Res. 2003;9:2015-2021. [PubMed] |
| 24. | Chen CN, Hsieh FJ, Cheng YM, Chang KJ, Lee PH. Expression of inducible nitric oxide synthase and cyclooxygenase-2 in angiogenesis and clinical outcome of human gastric cancer. J Surg Oncol. 2006;94:226-233. [PubMed] [DOI] |