修回日期: 2008-01-10
接受日期: 2008-01-15
在线出版日期: 2008-01-28
目的: 探讨脂质体介导的c-myc反义寡核苷酸对导入脆性组氨酸三联体(FHIT)基因的胃癌细胞增殖及凋亡的影响.
方法: 通过脂质体将重组FHIT基因PRC/CMV质粒和空载体转染到人类胃癌细胞系MKN28, 并分别转染c-myc反义寡核苷酸, RT-PCR和Westen blot法检测FHIT基因的转染, Western blot法检测细胞c-myc的表达, MTT法分析细胞增殖, AO/EB染色法和流式细胞分析技术检测细胞凋亡.
结果: 转染FHIT基因后, MKN28细胞检测到FHIT基因片段和FHIT蛋白, 而未转染的细胞及转染空载体的细胞未检测到FHIT基因片段及FHIT蛋白. 转染c-myc反义寡核苷酸后, 对MKN28细胞c-myc的表达有明显的抑制作用, 并呈明显的时间依赖性; c-myc asODN对FHIT+ MKN28细胞抑制率(F = 177.480, P<0.05), 凋亡率(F = 41.500, P<0.05)和凋亡比例明显高于FHIT- MKN28细胞.
结论: 癌基因c-myc的表达抑制联合FHIT基因的表达可以发挥较强的抗肿瘤细胞作用, 为多基因治疗肿瘤提供了理论基础.
引文著录: 刘晓宇, 郭淦华, 段晓明, 陈建, 曹建国, 贺修胜. 反义c-myc寡核苷酸对转染FHIT基因胃癌细胞MKN28的影响. 世界华人消化杂志 2008; 16(3): 240-245
Revised: January 10, 2008
Accepted: January 15, 2008
Published online: January 28, 2008
AIM: To explore the effect of anti-sense c-myc oligodeoxynucleotide on the proliferation and apoptosis of gastric cancer cells transfected with the Frogile histindine triad (FHIT) gene.
METHODS: The FHIT gene was transfected into human gastric cancer MKN28 cells through liposomes. The antis-sense c-myc oligodeoxynucleotide was transfected into the FHIT gene. FHIT gene transfection was detected by RT-PCR and Western blot. Expression of c-myc was detected by Western blot. Proliferation of gastric cancer cells was determined by MTT. Cell apoptosis was detected by AO/EB staining and FCM.
RESULTS: The expression of MKN28 cells transfected with the FHIT gene was observed. However, no FHIT gene segment and FHIT protein were found in the cells transfected with void vector. C-myc transfected with the FHIT gene exhibited significant inhibitory effects on the expression of c-myc protein in MKN28 cells and induced cell apoptosis in a time-dependent manner. However, the inhibition rate (F = 177.480, P < 0.05) (F = 41.500, P < 0.05), apoptosis rate, and apoptosis portion of anti-sense c-myc oligodeoxynucleotide for C-myc were higher than those for FHIT+ MKN28 cells.
CONCLUSION: The expression of c-myc and FHIT oncogenes plays an important role in suppressing the growth of tumor cells and may provide the theoretical basis for the gene therapy of tumors.
- Citation: Liu XY, Guo GH, Duan XM, Chen J, Cao JG, He XS. Effect of anti-sense c-myc oligodeoxynucleotide on MKN28 gastric cancer cells transfected with FHIT gene. Shijie Huaren Xiaohua Zazhi 2008; 16(3): 240-245
- URL: https://www.wjgnet.com/1009-3079/full/v16/i3/240.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i3.240
自肿瘤的基因治疗已成为肿瘤治疗的研究热点, 随着分子生物学的发展, 许多癌基因和抑癌基因被发现. 目前认为癌症的发生是一个多基因参与的多步骤的复杂过程, 抑癌基因的表达抑制和癌基因的过度表达在肿瘤发生发展中起着十分重要的作用. 脆性组氨酸三联体(fragile histindine triad, FHIT)基因被认为是候选抑癌基因, c-myc为已被公认的癌基因. 本实验通过基因转染及反义寡核苷酸技术(antisense oligodeoxynucleotide, asODN), 同时干扰肿瘤细胞中二者的异常表达, 观察其对肿瘤细胞生长和凋亡的影响, 评价基因联合治疗肿瘤的效果.
人类胃高分化管状腺癌细胞系MKN28来自南华大学肿瘤研究所, 存在FHIT基因的表达缺失[1-2]和c-myc基因高表达. 用含100 mL/L胎牛血清的DMEM培养基, 在37 ℃、50 mL/L CO2的细胞培养箱内进行培养. FHIT基因的重组载体(含FHIT基因第5-8个外显子)及其空载体PRC/CMV均由美国俄亥俄州立大学K.Huebner教授惠赠. 针对c-myc mRNA第二外显子起始码AUG后4个密码子合成c-myc反义寡核苷酸链5'-TAACGTTGAGGGGCAT-3', 对所合成的寡核苷酸链进行全硫代硫酸化修饰(上海生工生物工程公司). 细胞培养所用DMEM培养基购于美国GIBCO公司; 脂质体Lipofectamine 2000购于Invitrogen公司; 总RNA/DNA提取试剂盒、RT试剂盒、PCR试剂盒购于Sigma公司; 兔抗人FHIT单克隆抗体购于美国Zymed公司; 兔抗人c-myc抗体购于武汉博士德公司.
1.2.1 FHIT基因转染与单克隆细胞株筛选: 于24孔板内接种MKN28细胞2×105, 37 ℃培养24-48 h, 待细胞融合度达90%-95%时, 用无血清DMEM培养基洗两遍, 按照Lipofectamine2000的使用说明操作, 将适量脂质体和重组质粒、空载体的混合加入24孔板内, 轻轻混匀, 标记为FHIT基因转染组、空载体组, 设未加入脂质体孔为空白对照组. 加入适量无血清的DMEM的培养基, 继续培养24 h, 传代, 换用完全培养基继续培养24 h后, 开始用含G418浓度300 g/L的培养基进行筛选, 待空白组细胞全部死亡时, 降低G418的浓度为150 g/L, 继续筛选14 d后, 形成细胞克隆, 将细胞克隆接种入96孔板, 用有限稀释法稀释, 挑选单克隆继续培养、传代.
1.2.2 RT-PCR: 按照试剂盒说明提取细胞总RNA及合成cDNA. 由上海生工合成PCR引物, 5'端: 5'-GTGGATAGCGGTTTGACT-3', 3'端: 5'-TACAGAGGGCTTGATGAGA-3', 产物长度297 bp. PCR反应体系25 μL, 反应程序如下: 94预变性3 min, 再94 ℃变性30 s, 52 ℃退火30 s, 72 ℃合成1 min, 循环30次; 72 ℃合成5 min, 4 ℃保存. 取4 μL反应产物, 15 g/L琼脂糖凝胶电泳, 紫外分光光度仪观察, 凝胶成像分析系统分析摄像.
1.2.3 Western blot: 加入细胞裂解液, 裂解细胞, 离心提取蛋白. 定量, 上样, 电泳分离蛋白, 转膜, 封闭1.5 h, 孵兔抗人FHIT抗体, 4 ℃过夜, 洗膜后孵二抗, 室温1.5 h, 洗膜, 加发光剂, 压膜, 显影, 定影.
1.2.4 反义c-myc寡核苷酸转染: 将FHIT基因稳定表达的细胞(FHIT+ MKN28)1×107和转染空载体的对照组(FHIT- MKN28)分别接种于250 mL培养瓶, 待细胞融合度达50%, 用无血清DMEM培养基洗两遍. 配制溶液A: 用无血清的DMEM培养基配制浓度为100 mmol/L的c-myc asDON溶液400 μL, 溶液B: 将20 μL的Lipofectin 2000加入无血清DMEM培养基配成200 μL的溶液. 按Lipofectamine 2000的使用说明配置混合液加入细胞, 再加入适量无血清DMEM培养基使c-myc asODN终浓度为10 mmol/L.
1.2.5 转染后c-myc蛋白表达测定: 将上述转染c-myc asDON后细胞分成4组, 分别培养24、48、72、96 h后收集细胞. 提取蛋白, Western blot检测c-myc蛋白表达的变化.
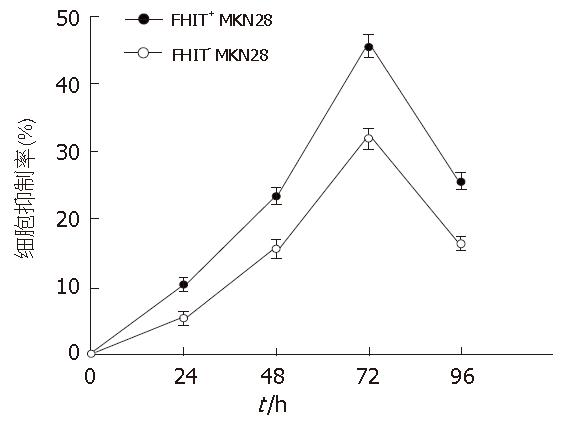
1.2.6 MTT法分析细胞增殖: 取对数生长期FHIT+ MKN28和FHIT- MKN28细胞分别接种于96孔板, 细胞同步化后, 对照组加入无血清培养基, 实验组加人终浓度为10 mmol/L c-myc asODN和10 mL/L Lipofectin 2000的无血清培养基. 24、48、72、96 h后收集细胞, 每孔加入5 g/L MTT(四甲基偶氮唑盐)20 μL继续培养4 h后, 吸去原培养液, 每孔加入100 μL二甲基亚枫, 避光振荡20 min后, 于酶联免疫检测仪测定A570值, 计算出生长抑制率, 生长抑制率的公式为: 抑制率(%) = (对照孔A值-实验孔A值)/对照孔A值×100%.
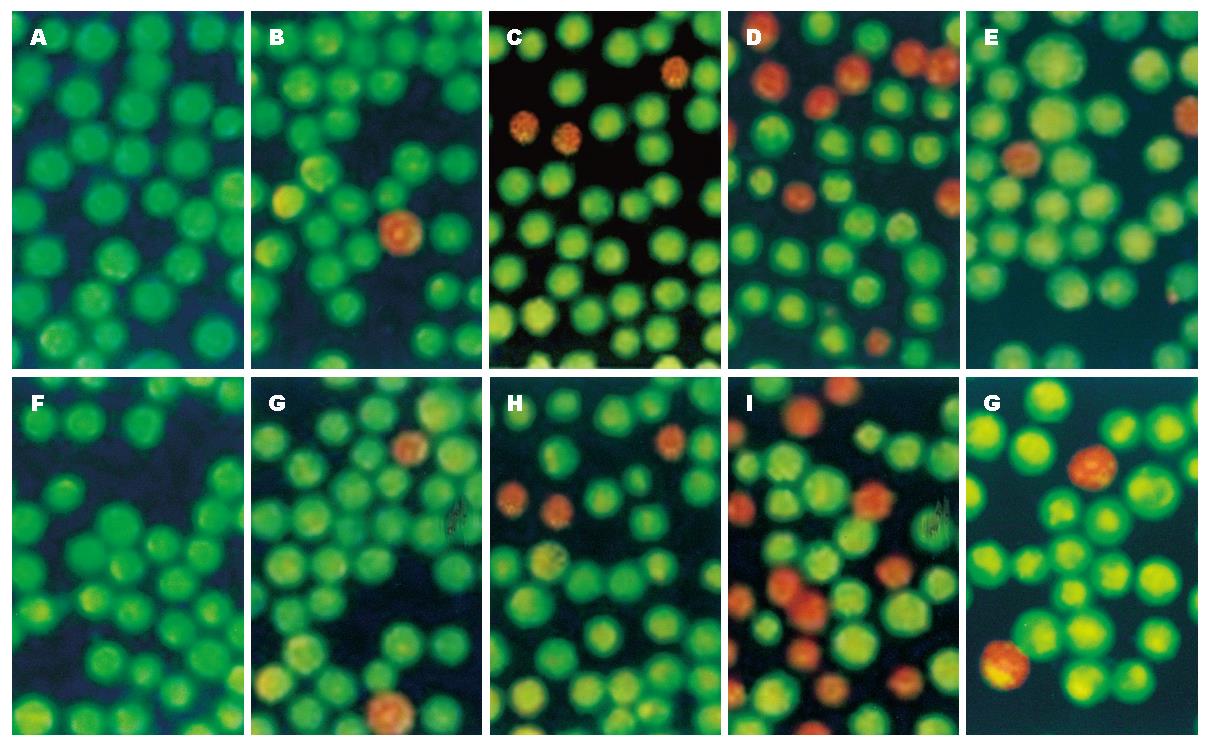
1.2.7 AO/EB染色: 分别收集转染c-myc asODN后24、48、72、96 h FHIT+/- MKN28细胞, 制成细胞悬液, 取细胞悬液95 μL, 加入AO/EB 5 μL, 混匀后吸1滴于洁净玻片上, 立即于490 nm激发波长的的荧光显微镜下观察、摄影. 在荧光显微镜下观察活细胞核染色质着绿色和凋亡细胞核染色质为橘红色.
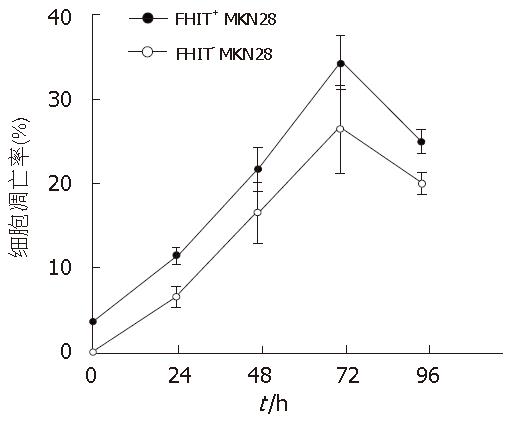
1.2.8 流式细胞分析: 分别收集转染c-myc asODN后24、48、72、96 h FHIT+/- MKN28细胞, 750 mL/L乙醇固定, 流式细胞仪检测, 得出各组细胞的凋亡率.
统计学处理 据用SPSS统计软件处理, 采用方差分析差异显著性. P<0.05为有显著性差异.
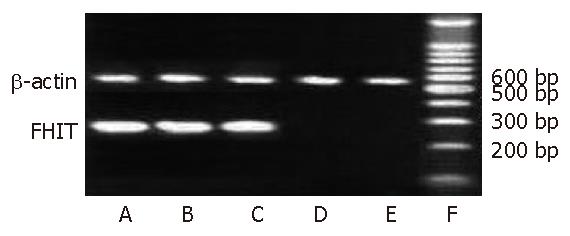
转染FHIT基因的MKN28细胞中检测到FHIT基因片段, 转染空载体及野生型细胞中则未检测到FHIT基因片段(图1, 图2).
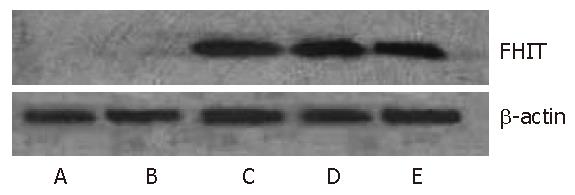
转染FHIT基因的MKN28细胞可检测到fhit蛋白表达, 而转染空载体及其野生型细胞则均未检测到FHIT蛋白的表达(图3).
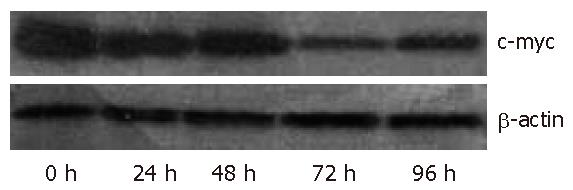
转染c-myc asODN 0、24、48、72、96 h后, MKN28细胞经Western blot检测结果显示, 转染c-myc asODN可明显降低细胞内c-myc的表达, 在72 h后达高峰. 以未转染细胞(转染0 h的细胞)c-myc蛋白表达水平为100%, 转染24、48、72、96 h的c-myc蛋白表达水平分别为72.1%、56.3%、18.1%、30.6%(图4).
MTT法检测结果显示终浓度10 mmol/L的c-myc asODN对FHIT+/- MKN28细胞均有一定的生长抑制作用(F = 100.123, P<0.05), 转染c-myc asODN后72 h抑制作用达高峰, c-myc asODN对FHIT+ MKN28细胞抑制率明显高于FHIT- MKN28细胞(F = 177.480, P<0.05)(图5).
流式细胞仪检测结果显示, FHIT+ MKN28较FHIT- MKN28细胞的凋亡率明显升高(F = 130.606, P<0.05). 转染c-myc asODN后细胞的凋亡率逐渐升高于72 h达到高峰, 且FHIT+ MKN28细胞凋亡率在每个时间段均高于FHIT- MKN28细胞(F = 41.500, P<0.05)(图6).
AO/EB染色结果显示c-myc asODN对FHIT+/- MKN28细胞凋亡均有一定的促进作用(P<0.05), 随着时间的延长, 凋亡现象越明显, 在转染c-myc asODN 72 h最明显. 转染c-myc asODN后的不同时间, FHIT+ MKN28凋亡比例均明显大于FHIT+ MKN28细胞(P<0.05)(图7).
FHIT基因是1996年Ohta et al[3]用外显子捕获法(exon trapping)确定并克隆出来的人类基因, 被视为候选抑癌基因, 该基因的异常改变见于多种肿瘤如肺癌[4]、食管癌[5]、胃癌[6-7]、结肠癌[8]、胰腺癌[9]、肺癌[10]等. 近年的研究表明FHIT具有抑制细胞生长、诱导细胞凋亡、抑制肿瘤生长以及提高肿瘤细胞对部分凋亡作用敏感性等特点, 因此, FHIT基因已成为肿瘤基因治疗的新靶点[4-6,8-9,11-12]. 本实验将FHIT导入MKN28细胞, 证实FHIT蛋白可重新表达, 转染后FHIT+ MKN28凋亡率较抑制率和凋亡率均明显升高, 说明FHIT可促进MKN28细胞凋亡抑制其生长. 同时转导FHIT基因后, 未出现促凋亡和生长抑制的情况也有报道. Ishii et al[5]将FHIT基因转染入食道癌7个细胞系, 其中3个细胞系凋亡及生长没有明显改变, 这说明FHIT基因诱导细胞凋亡的作用受多种因素影响. 可能在部分肿瘤细胞中存在FHIT基因启动凋亡所必需的相关因子[13-16], 这可能与细胞中癌基因及抑癌基因的表达情况有密切的联系. 目前, FHIT基因促凋亡的机制尚不明确. 已有研究表明, FHIT是通过启动caspase 8途径诱导细胞凋亡[5,9,12], 而FHIT基因如何启动了凋亡途径及在这一过程中受哪些因素影响等问题有待于进一步研究.
c-myc原癌基因是一种控制细胞增殖和分化的原癌基因, 其编码产物是参与细胞周期调控最重要的反式作用因子(又称转录因子). 对细胞的生长和增殖进行调控, 具有诱导增殖和凋亡的双重作用. 当致癌因素存在, 使c-myc出现过度表达, 可导致细胞的无限增殖和凋亡抑制, 从而引发肿瘤[17-18], 如在人的肺癌、胃癌、结肠癌、肝癌等肿瘤中均可发现c-myc的异常表达和扩增[17,19-20].
asODN技术即人工合成一段能与相应癌基因互补的核苷酸, 使癌基因表达受抑制, 因而改变肿瘤发生、发展[21-23]. 目前, 已有近10种抗肿瘤asODN完成了实验研究, 正在进行临床实验, 显示了抗肿瘤反义药物的广阔发展前景[24-25]. 研究发现, asODN在适当的条件下, c-myc asODN可以通过和c-myc mRNA结合抑制c-myc基因的表达, 抑制细胞的生长, 甚至促进细胞的凋亡[26-27]. 本实验结果显示脂质体介导转染c-myc asODN后可抑制FHIT+ MKN28及FHIT- MKN28细胞的增殖并诱导其凋亡, 证实了c-myc asODN对胃癌细胞系MKN28的抗肿瘤作用, c-myc的表达下调, 可明显抑制肿瘤细胞的无限增殖, 从而可发挥抑制肿瘤生长的作用. 实验对c-myc asODN作用后不同时间的c-myc蛋白表达以及相应的细胞生长抑制率及凋亡率情况. 实验数据显示, 蛋白表达与细胞生长呈明显正相关, c-myc asODN作用以转染后第72小时作用最强, 为c-myc反义药物的研究提供了药代动力学等实验依据.
以上结果也反映了FHIT与c-myc asODN的抗肿瘤作用没有依赖性, c-myc基因不直接参与FHIT基因的抗肿瘤作用, 二者是通过不同的途径发挥抑制细胞生长及促凋亡作用. Sard et al发现FHIT诱导的凋亡是p53非依赖性的[28], FHIT诱导的凋亡经过caspase通路实现; 而与c-myc相关的凋亡为p53依赖性[29-30], 可能是通过 Fas/APO-1促凋亡途径实现[31]. 结果还显示c-myc asODN对FHIT+ MKN28的生长抑制和凋亡促进作用较强, 为二者联合治疗提供了理论依据. 说明FHIT基因可提高MKN28细胞对其他促凋亡作用的敏感性, 利用FHIT基因这一特性, 可进一步研究FHIT基因转染联合抗癌药物治疗肿瘤的作用效果, 这为临床肿瘤治疗提供了新的思路.
本实验结果证实了FHIT基因及c-myc asODN对胃癌细胞MKN28的抗肿瘤作用, 同时反映二者联合应用可促进这一作用. 说明FHIT基因及c-myc均可以作为一个基因治疗的靶点, 二者联合应用更为癌基因与抑癌基因联合治疗肿瘤提供了实验依据.
肿瘤的基因治疗已成为肿瘤治疗的研究热点, 随着分子生物学的发展, 许多癌基因和抑癌基因被发现. 目前认为癌症的发生是一个多基因参与的多步骤的复杂过程, 抑癌基因的表达抑制和癌基因的过度表达在肿瘤发生发展中起着十分重要的作用.
陈卫昌, 教授, 苏州大学附属第一医院消化内科; 田晓峰, 教授, 大连医科大学附属第二医院普通外科.
FHIT基因诱导细胞凋亡的作用受多种因素影响, 可能在部分肿瘤细胞中存在FHIT基因启动凋亡所必需的相关因子, 这必然与细胞中癌基因及抑癌基因的表达情况有密切的联系. 目前FHIT基因促凋亡的机制尚不明确, FHIT基因如何启动caspase凋亡途径及在这一过程中受哪些因素影响等问题有待于进一步研究.
国外已有报道FHIT基因过表达能增加胰腺癌细胞系对外源性凋亡诱导剂的敏感性. 体内实验结果显示FHIT基因的转导能阻止肿瘤的生长, 延长模型小鼠的生存时间, 抑制暴露致癌环境下小鼠体内肿瘤的产生.
FHIT基因可提高MKN28细胞对其他促凋亡作用的敏感性, 利用FHIT基因这一特性, 可进一步研究FHIT基因转染联合抗癌药物治疗肿瘤的作用效果, 这为临床肿瘤治疗提供了新的思路.
反义寡核苷酸技术: 是根据核酸间结合碱基互补原理, 用人工合成或生物合成的特定互补的反义核酸或他们的化学修饰物与细胞内的核酸相互作用以抑制或封闭其表达.
本文立题明确, 实验设计合理可靠, 论证充分, 有一定指导意义.
编辑: 李军亮 电编: 郭海丽
| 1. | Baffa R, Veronese ML, Santoro R, Mandes B, Palazzo JP, Rugge M, Santoro E, Croce CM, Huebner K. Loss of FHIT expression in gastric carcinoma. Cancer Res. 1998;58:4708-4714. [PubMed] |
| 2. | Lee SH, Kim HS. [Sequence analyses of aberrant FHIT transcripts in gastric cancer cell lines]. Korean J Gastroenterol. 2003;42:476-483. [PubMed] |
| 3. | Ohta M, Inoue H, Cotticelli MG, Kastury K, Baffa R, Palazzo J, Siprashvili Z, Mori M, McCue P, Druck T. The FHIT gene, spanning the chromosome 3p14.2 fragile site and renal carcinoma-associated t(3; 8) breakpoint, is abnormal in digestive tract cancers. Cell. 1996;84:587-597. [PubMed] [DOI] |
| 4. | Rohr UP, Rehfeld N, Geddert H, Pflugfelder L, Bruns I, Neukirch J, Rohrbeck A, Grote HJ, Steidl U, Fenk R. Prognostic relevance of fragile histidine triad protein expression in patients with small cell lung cancer. Clin Cancer Res. 2005;11:180-185. [PubMed] |
| 5. | Ishii H, Dumon KR, Vecchione A, Trapasso F, Mimori K, Alder H, Mori M, Sozzi G, Baffa R, Huebner K. Effect of adenoviral transduction of the fragile histidine triad gene into esophageal cancer cells. Cancer Res. 2001;61:1578-1584. [PubMed] |
| 6. | Stec-Michalska K, Antoszczyk S, Klupinska G, Nawrot B. Loss of FHIT expression in gastric mucosa of patients with family histories of gastric cancer and Helicobacter pylori infection. World J Gastroenterol. 2005;11:17-21. [PubMed] [DOI] |
| 7. | Lee SH, Kim WH, Kim HK, Woo KM, Nam HS, Kim HS, Kim JG, Cho MH. Altered expression of the fragile histidine triad gene in primary gastric adenocarcinomas. Biochem Biophys Res Commun. 2001;284:850-855. [PubMed] [DOI] |
| 8. | Sarli L, Bottarelli L, Azzoni C, Campanini N, Di Cola G, Bader G, Iusco D, Salvemini C, Caruso G, Donadei E. Abnormal Fhit protein expression and high frequency of microsatellite instability in sporadic colorectal cancer. Eur J Cancer. 2004;40:1581-1588. [PubMed] [DOI] |
| 9. | Dumon KR, Ishii H, Vecchione A, Trapasso F, Baldassarre G, Chakrani F, Druck T, Rosato EF, Williams NN, Baffa R. Fragile histidine triad expression delays tumor development and induces apoptosis in human pancreatic cancer. Cancer Res. 2001;61:4827-4836. [PubMed] |
| 10. | Arun B, Kilic G, Yen C, Foster B, Yardley DA, Gaynor R, Ashfaq R. Loss of FHIT expression in breast cancer is correlated with poor prognostic markers. Cancer Epidemiol Biomarkers Prev. 2005;14:1681-1685. [PubMed] [DOI] |
| 11. | Pichiorri F, Trapasso F, Palumbo T, Aqeilan RI, Drusco A, Blaser BW, Iliopoulos D, Caligiuri MA, Huebner K, Croce CM. Preclinical assessment of FHIT gene replacement therapy in human leukemia using a chimeric adenovirus, Ad5/F35. Clin Cancer Res. 2006;12:3494-3501. [PubMed] [DOI] |
| 12. | Dumon KR, Ishii H, Fong LY, Zanesi N, Fidanza V, Mancini R, Vecchione A, Baffa R, Trapasso F, During MJ. FHIT gene therapy prevents tumor development in Fhit-deficient mice. Proc Natl Acad Sci USA. 2001;98:3346-3351. [PubMed] [DOI] |
| 13. | Huiping C, Kristjansdottir S, Bergthorsson JT, Jonasson JG, Magnusson J, Egilsson V, Ingvarsson S. High frequency of LOH, MSI and abnormal expression of FHIT in gastric cancer. Eur J Cancer. 2002;38:728-735. [PubMed] [DOI] |
| 14. | D'Agostini F, Izzotti A, Balansky R, Zanesi N, Croce CM, De Flora S. Early loss of Fhit in the respiratory tract of rodents exposed to environmental cigarette smoke. Cancer Res. 2006;66:3936-3941. [PubMed] [DOI] |
| 15. | Toledo G, Sola JJ, Lozano MD, Soria E, Pardo J. Loss of FHIT protein expression is related to high proliferation, low apoptosis and worse prognosis in non-small-cell lung cancer. Mod Pathol. 2004;17:440-448. [PubMed] [DOI] |
| 16. | Ishii H, Dumon KR, Vecchione A, Fong LY, Baffa R, Huebner K, Croce CM. Potential cancer therapy with the fragile histidine triad gene: review of the preclinical studies. JAMA. 2001;286:2441-2449. [PubMed] [DOI] |
| 17. | Cole MD. The myc oncogene: its role in transformation and differentiation. Annu Rev Genet. 1986;20:361-384. [PubMed] [DOI] |
| 18. | Ryan KM, Birnie GD. Myc oncogenes: the enigmatic family. Biochem J. 1996;314:713-721. [PubMed] [DOI] |
| 19. | Augenlicht LH, Wadler S, Corner G, Richards C, Ryan L, Multani AS, Pathak S, Benson A, Haller D, Heerdt BG. Low-level c-myc amplification in human colonic carcinoma cell lines and tumors: a frequent, p53-independent mutation associated with improved outcome in a randomized multi-institutional trial. Cancer Res. 1997;57:1769-1775. [PubMed] |
| 20. | Smith-Sørensen B, Hijmans EM, Beijersbergen RL, Bernards R. Functional analysis of Burkitt's lymphoma mutant c-Myc proteins. J Biol Chem. 1996;271:5513-5518. [PubMed] [DOI] |
| 21. | Pirollo KF, Rait A, Sleer LS, Chang EH. Antisense therapeutics: from theory to clinical practice. Pharmacol Ther. 2003;99:55-77. [PubMed] [DOI] |
| 22. | Shim H, Dolde C, Lewis BC, Wu CS, Dang G, Jungmann RA, Dalla-Favera R, Dang CV. c-Myc transactivation of LDH-A: implications for tumor metabolism and growth. Proc Natl Acad Sci USA. 1997;94:6658-6663. [PubMed] [DOI] |
| 24. | Crooke ST. Potential roles of antisense technology in cancer chemotherapy. Oncogene. 2000;19:6651-6659. [PubMed] [DOI] |
| 25. | Tamm I, Dörken B, Hartmann G. Antisense therapy in oncology: new hope for an old idea? Lancet. 2001;358:489-497. [PubMed] [DOI] |
| 26. | Wickstrom E. Antisense c-myc inhibition of lymphoma growth. Antisense Nucleic Acid Drug Dev. 1997;7:225-228. [PubMed] [DOI] |
| 27. | Kimura S, Maekawa T, Hirakawa K, Murakami A, Abe T. Alterations of c-myc expression by antisense oligodeoxynucleotides enhance the induction of apoptosis in HL-60 cells. Cancer Res. 1995;55:1379-1384. [PubMed] |
| 28. | Sard L, Accornero P, Tornielli S, Delia D, Bunone G, Campiglio M, Colombo MP, Gramegna M, Croce CM, Pierotti MA. The tumor-suppressor gene FHIT is involved in the regulation of apoptosis and in cell cycle control. Proc Natl Acad Sci USA. 1999;96:8489-8492. [PubMed] [DOI] |
| 29. | Zindy F, Eischen CM, Randle DH, Kamijo T, Cleveland JL, Sherr CJ, Roussel MF. Myc signaling via the ARF tumor suppressor regulates p53-dependent apoptosis and immortalization. Genes Dev. 1998;12:2424-2433. [PubMed] [DOI] |
| 30. | Rupnow BA, Alarcon RM, Giaccia AJ, Knox SJ. p53 mediates apoptosis induced by c-Myc activation in hypoxic or gamma irradiated fibroblasts. Cell Death Differ. 1998;5:141-147. [PubMed] [DOI] |