修回日期: 2008-09-20
接受日期: 2008-09-22
在线出版日期: 2008-10-08
目的: 构建并鉴定大鼠Smad7真核表达质粒, 观察外源Smad7对肝星状细胞HSC-T6的转染, 并进一步研究其对TGF-β1及Ⅰ、Ⅲ型胶原mRNA表达水平的影响.
方法: 采用基因重组技术将Smad7 cDNA插入真核表达载体pcDNA3.1(+), 构建大鼠Smad7真核表达质粒. 脂质体介导转染HSC-T6细胞, 分为正常对照组、空质粒组及转染组, G418筛选, 挑取阳性细胞, 运用Western blot检测Smad7蛋白表达情况, RT-PCR检测Smad7、TGF-β1及Ⅰ、Ⅲ型胶原mRNA的表达水平.
结果: 酶切和测序结果证实Smad7真核表达质粒构建成功. Smad7转染组与正常对照、空质粒组比较, Smad7 mRNA表达显著增加(1.053±0.009 vs 0.984±0.054, 0.986±0.044, P<0.01或0.05), 蛋白水平显著上调(0.083±0.026 vs 0.058±0.050, 0.056±0.064, 均P<0.05); Smad7转染组TGF-β1、Ⅰ型胶原mRNA表达降低(0.961±0.013 vs 1.039±0.013, 1.032±0.037; 0.592±0.096 vs 0.767±0.085, 0.770±0.090, 均P<0.01); Ⅲ型胶原mRNA表达差异无统计学意义. 正常对照、空质粒组Smad7 mRNA和蛋白水平、TGF-β1、Ⅰ、Ⅲ型胶原mRNA表达差异无统计学意义.
结论: Smad7可能参与TGF-β/Smad信号转导, 在一定程度上具有抗纤维化的生物学活性.
引文著录: 杨小艳, 杨勇, 郑勇, 李睿, 周婷, 孙侃, 常向云, 陈卫刚. 大鼠Smad7真核表达质粒的构建及在肝星状细胞中的表达. 世界华人消化杂志 2008; 16(28): 3146-3151
Revised: September 20, 2008
Accepted: September 22, 2008
Published online: October 8, 2008
AIM: To construct rat Smad7 eukaryotic vector, observe whether the extraneous Smad7 gene can transfect HSC-T6 effectively as an anti-fibrosis factor, and to investigate its effect on expression of TGF-β1, collagen Ⅰ and collagen Ⅲ mRNA in rat HSC-T6 cells.
METHODS: Rat Smad7 cDNA was cloned into eukaryotic plasmid pcDNA3.1(+) to construct Smad7/pcDNA3.1(+) plasmid and transfect it into HSC-T6 cells by Lipofectmine2000. The positive clone was selected by G418. The expression level of Smad7 protein was detected using Western blot, and the levels of Smad7, TGF-β1, collagen Ⅰ and Ⅲ mRNA by RT-PCR were further detected using RT-PCR, respectively.
RESULTS: Smad7 eukaryotic vector was successfully constructed and confirmed by endonuilease digestion and sequencing. And Smad7 mRNA and protein expression was significantly higher in Smad7 transfected group than either control or empty vector groups (1.053 ± 0.009 vs 0.984 ± 0.054, 0.986 ± 0.044, P < 0.01 or 0.05; 0.083 ± 0.026 vs 0.058 ± 0.050, 0.056 ± 0.064, all P < 0.05), TGF-β1 and collagen Ⅰ mRNA expression was significantly reduced in Smad7 transfected group than control and empty vector groups (0.961 ± 0.013 vs 1.039 ± 0.013, 1.032 ± 0.037; 0.592 ± 0.096 vs 0.767 ± 0.085, 0.770 ± 0.090, all P < 0.01). There were no statistically significant difference in change of collagen Ⅲ mRNA expression among the three groups. The difference of Smad7 mRNA and protein, TGF-β1, collagen Ⅰand Ⅲ mRNA expression weren't statistically significant between control and empty vector groups.
CONCLUSION: Smad7 maybe has activity of anti-fibrosis through inhibiting TGF-β/Smad signaling.
- Citation: Yang XY, Yang Y, Zheng Y, Li R, Zhou T, Sun K, Chang XY, Chen WG. Construction of eukaryotic expression vector for rat Smad7 and its expression in hepatic stellate cell line HSC-T6. Shijie Huaren Xiaohua Zazhi 2008; 16(28): 3146-3151
- URL: https://www.wjgnet.com/1009-3079/full/v16/i28/3146.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i28.3146
肝纤维化是细胞外基质(extracellular matrix, ECM)在肝脏过多沉积的结果, 其关键环节是肝星状细胞(hepatic stellate cell, HSC)的激活, HSC体外培养自行活化, 模拟了体内纤维化过程, 是很好的肝纤维化模型. 转化生长因子β(transforming growth factor-β, TGF-β)是肝纤维化形成中最重要的细胞因子, 其信号传入依赖Smad完成, Smad7是TGF-β信号转导途径的主要抑制性蛋白, 具有抗纤维化的作用[1-2]. 本实验通过构建Smad7重组质粒, 诱导Smad7基因在HSC中的高表达, 观察其对细胞的影响, 研究其对TGF-β1及Ⅰ、Ⅲ型胶原mRNA的表达水平影响, 了解外源Smad7抗纤维化的效果, 为探索新的基因治疗途径提供实验依据.
pcDNA3.1(+)质粒为本课题组保留; 大肠埃希菌DH5α系石河子大学医学院新疆地方与民族高发病教育部重点实验室所赠; TRIzol Reagent RNA分离液、Lipofectmine2000转染试剂为美国Invitrogen公司产品; 反转录酶及限制性核酸内切酶EcoRⅠ、XhoⅠ购自日本TaKaRa公司; 琼脂糖、UNIQ-10小剂量质粒抽提试剂盒、PCR切胶回收试剂盒为加拿大BBI公司产品; Taq DNA多聚酶、异丙基硫代-B-D半乳糖苷、DNA Marker、二甲亚砜、二硫苏糖醇、甘氨酸、乙二胺四乙酸, 三羟甲基氨基己烷, 十二烷基磺酸钠, TEMED, 丽春红 et al购自上海Sangon; PVDF膜Millipore公司产品; 吐温-20购自Sigma公司; HSC-T6细胞由中国医学科学院肿瘤医院肿瘤研究所提供; 胎牛血清为HyClone公司产品; 1640培养基购自Gibco公司; Smad7 mAb购自R&D公司; 蛋白Marker(SM0671)购自MBI公司; 上海Sangon完成引物合成和基因测序.
1.2.1 大鼠Smad7真核表达质粒的构建: 常规TRIzol法抽提大鼠肝组织总RNA, 逆转录成cDNA, PCR扩增Smad7目的片段, 引物见表1, 下划线示酶切位点(EcoRⅠ、XhoⅠ). CaCl2法诱导DH5α制备感受态细胞. pcDNA3.1(+)及Smad7纯化后产物用EcoRⅠ、XhoⅠ双酶切, 纯化回收后连接, 构建成Smad7/pcDNA3.1(+)重组质粒. 进行重组质粒转化, 同时设阴阳性对照. 转化后Amp(+)培养基上可见单个散在菌落, 随机挑选单克隆, 接种于3 mL Amp(+)LB培养液中, 37 ℃ 250 r/min振摇12-14 h, 取1.5 mL菌液行小剂量质粒抽提, 电泳见阳性克隆质粒样双带, 双酶切鉴定行电泳检测酶切效果, 酶切证实的阳性克隆送上海生工测序.
| 基因 | 上下游引物序列 | 扩增片段长度(bp) |
| Smad7 cDNA | 5'-CTACCGAATTCATGTTCAGGACCAAACGA-3' | 1287 |
| 5'-TTCACCTCGAGGGCTACCGGCTGTTGAAGA-3' | ||
| Smad7 | 5'-CTGTGTTGCTGTGAATCTTAC-3' | 600 |
| 5'-GCTGTAGGCCTTTTCATAGT-3' | ||
| TGF-β1 | 5'-GGACTCTCCACCTGCAAGAC-3' | 300 |
| 5'-CCCCAGAAATCATCGAGAC-3' | ||
| Ⅰ型胶原 | 5'-GACACTGAACCCTTTGTAATG-3' | 399 |
| 5'-GTGAAACTCCCGTCTGCT-3' | ||
| Ⅲ型胶原 | 5'-AGCGGAGAATACTGGGTT-3' | 288 |
| 5'-TGTAATGTTCTGGGAGGC-3' | ||
| GAPDH | 5'-TCCCTCAACATTGTCAGCAA-3' | 309 |
| 5'-AGCTCCACAACGGATACATT-3' |
1.2.2 细胞培养及质粒转染: HSC-T6细胞以2.8×106/L接种于6孔板中(2 mL/孔), 37 ℃, 50 mL/L CO2培养24 h, 随机分为正常对照组、空质粒组和Smad7质粒转染组. 转染前弃去含血清双抗培养基, PBS冲洗后, 每孔加无血清无双抗的1640培养基2 mL, 将质粒24 μL和Lipofectmine2000 20 μL分别用500 μL 1640稀释, 各自混匀静置5 min后, 再混合, 静置20 min. 每孔加入500 μL混合液, 旋转混匀, 放入37 ℃孵育箱中, 6 h后更换为含100 mL/L胎牛血清及0.1 U/L双抗的1640培养液(2 mL/孔), 继续培养.
1.2.3 G418筛选浓度的确定、HSC-T6细胞抗性克隆的筛选: 将细胞以2.8×106/L的密度接种培养板, 24 h后, 将G418与含血清的1640混合, 配成浓度为0-600 mg/L的液体, 隔日换液, 相应孔的浓度保持不变, 培养11 d, 以7-10 d 90%细胞致死量为最佳筛选浓度, 因此确定450 mg/L为最佳筛选浓度. 转染后的HSC-T6细胞加入450 mg/L G418筛选2 wk, 大部分未转染HSC-T6飘浮死亡, 改用浓度为200 mg/L G418, 更换含100 mL/L胎牛血清的1640培养基, 转染携带目的基因的HSC-T6细胞逐步形成克隆.
1.2.4 Western blot及RT-PCR检测正常对照、空质粒及转染组中Smad7表达: 收取细胞总蛋白, -20 ℃保存. Western blot步骤: 40 mL/L浓缩胶, 100 mL/L分离胶, 预染蛋白Marker 3.0 μL, 样本总蛋白20 μg/孔, 加样至100 mL/L SDS-PAGE中电泳60 V, 30 min后改电压为100 V, 90 min至溴酚蓝跑至胶最下面取胶, 同步化将蛋白转移至PVDF膜, 20 V, 50 min. 转膜后以50 mL/L脱脂奶粉TBST室温下封闭4 h; 加入适当浓度的一抗孵育(Smad7 1.0 μg/L, GAPDH 1:1000)室温2 h后, 4 ℃过夜. TBST洗膜3次, 15 min/次, 加入适当浓度的结合HRP的二抗(1:5000)孵育, 室温下轻摇2 h, 洗膜, 显影, 曝光. 细胞总RNA抽提及RT-PCR: TRIzol法提取各组HSC-T6细胞总RNA, 逆转录为cDNA, 进行PCR, 每组同时以GAPDH为内参照, 引物序列见表1. 各组Western blot, RT-PCR结果, 扫描图像后, 用多媒体凝胶成像分析系统测定Smad7蛋白和GAPDH蛋白, Smad7、TGF-β1、Ⅰ、Ⅲ型胶原和GAPDH mRNA积分光密度值, 并计算其比值, 因内参照GAPDH表达恒定, 比值高低可以作为目的基因表达的相对值.
统计学处理 采用SPSS13.0统计软件分析, 数据以mean±SD表示, 多个样本均数比较采用方差分析, P<0.05表示差异有统计学意义.
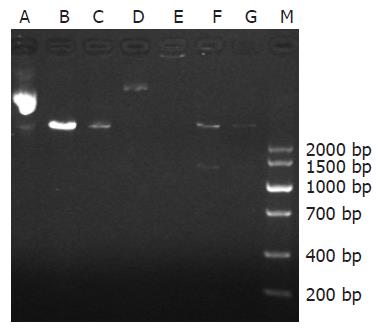
重组质粒双酶切后行琼脂糖凝胶电泳约在DNA Marker 1287 bp和5.4 kb附近可见两条明显条带, 与所需目的片段大小相符, 证实为阳性克隆(图1), 测序结果与GenBank中收录的序列号(NW_047516.2) Smad7的核苷酸序列同源性完全一致.
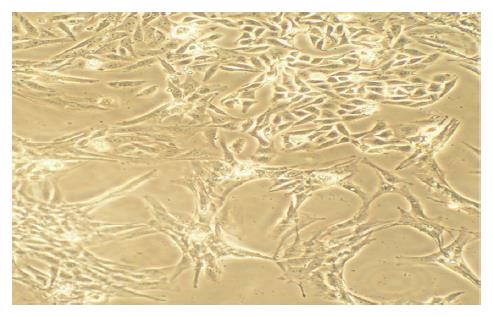
转染后的HSC-T6细胞加入450 mg/L G418筛选2 wk, 大部分未转染HSC-T6飘浮死亡, 改用浓度为200 mg/L G418, 100 mL/L胎牛血清的1640培养基, 转染携带目的基因的HSC-T6细胞逐步形成克隆, HSC-T6细胞呈星形外观, 镜下见脂滴围绕在细胞核周围, 在胞质周围可见明显的细胞骨架, 表现为大量纤维束(图2).
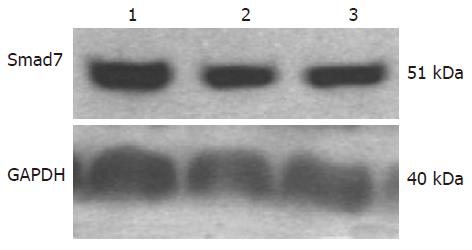
所收集的细胞总蛋白完整清晰, 外源Smad7体外转染HSC-T6细胞后, Smad7蛋白表达水平显著上调, Smad7转染组与正常对照、空质粒组比较: 蛋白水平显著上调(P = 0.020, 0.026), 正常对照组、空质粒组Smad7蛋白水平表达差异无统计学意义(P = 0.644, 图3, 表2).
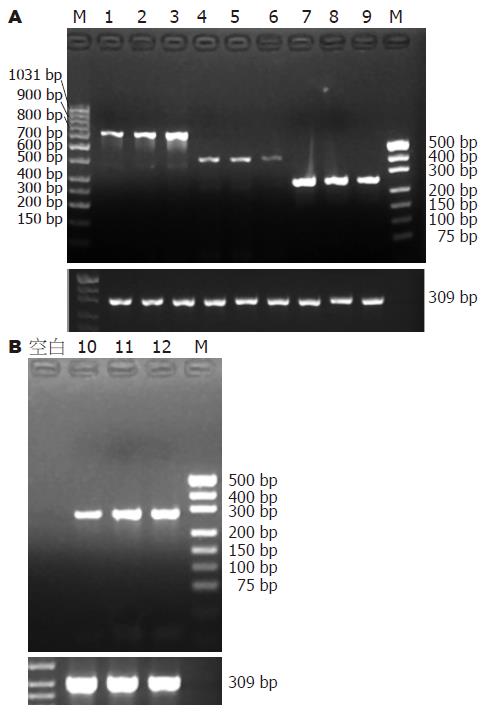
Smad7转染组与正常对照组及空质粒组比较: Smad7 mRNA表达明显增加(P = 0.009, 0.011), TGF-β1及Ⅰ型胶原mRNA表达减少(P = 0.000, 0.000; P = 0.004, 0.004), 而Ⅲ型胶原mRNA表达差异无统计学意义(P = 0.950, 0.438), 正常对照组及空质粒组Smad7、TGF-β及Ⅰ、Ⅲ型胶原mRNA的表达差异无统计学意义(P = 0.944, 0.595, 0.967, 0.950, 图4, 表2).
肝纤维化是一个复杂的多因素作用过程, 以ECM的过度沉积为特征, Ⅰ、Ⅲ型胶原占健康肝脏胶原总量的80%, 在纤维化肝脏中则超过95%, 并以Ⅰ型胶原为主, 因此Ⅰ型胶原可作为反映胶原代谢的重要参数, 用于判断抗肝纤维化治疗的疗效[3].
TGF-β1是TGF-β超家族中对ECM合成与沉积失调而导致纤维化最重要的调节因子, 多种器官纤维化、硬化与之相关[4-7], 可激活HSC合成ECM, 抑制肝细胞再生, 诱导肝细胞凋亡[8]. 研究认为, 通过抑制TGF-β的产生或阻断其生物活性调控HSC以防治肝纤维化, 是器官纤维化的治疗靶标[9]. Breitkopf et al[10]研究表明阻止TGF-β的信号传导可用于慢性肝病的治疗, 可能阻止并逆转肝纤维化.
SMAD蛋白是唯一的TGF-β受体后信使分子, 介导TGF-β信号从细胞膜传入细胞核[1], 肝纤维化中TGF-β/SMAD信号传导是通过与受体依次结合、磷酸化实现的[11]. 首先, TGF-β与细胞膜上Ⅱ和Ⅰ型受体相继结合形成TGF-β-TβRⅠ-TβRⅡ三重复合物, TβRⅡ的激酶区使TβRⅠ磷酸化, 继而磷酸化细胞质中的R-Smads(Smad2和Smad3), 活化后的R-Smads与Smad4形成的复合物, 由胞质转入核内结合特定的序列, 协同转录因子上调或下调靶基因的表达, 产生生物学效应. 如HSC在TGF-β作用下活化, 转化为MFB, 增加合成和分泌胶原等ECM; 同时HSC又以自分泌和旁分泌方式, 上调TGF-β的表达, 加速肝纤维化的进行[12].
Smad7是TGF-β/SMAD信号传导中重要的负性调节因子, Smad7表达为TGF-β自身和其他信号途径所诱导, 提示Smad7在TGF-β信号途径的反馈及交叉调控中起关键作用[2], 其作用机制可能是Smad7可以与R-Smads竞争性同TβRⅠ结合从而抑制了R-Smads活化所介导的TGF-β信号传导, 阻断了TGF-β的作用通道, 导致ECM的合成减少, 发挥抗纤维化的作用.
近年来, 基因治疗成为肝纤维化防治研究热点, 他是通过某种载体把起治疗作用的基因导入靶细胞, 合成具有治疗作用的蛋白, 从而达到治疗疾病的目的.
Dooley et al[13]制备肝纤维化大鼠模型, 将带有Smad7 cDNA的腺病毒注射到模型体内, 实验显示Smad7过度表达, 可有效阻止TGF-β信号传入, 并可以激活(CAGA)(9)-MLP-Luc区域, 从而导致胶原表达减少.
基因克隆时, 选择合适的载体是关键, 同时载体是基因转染的关键. 目前常用的载体有质粒和病毒, 病毒载体感染效率较高, 但是其对细胞有直接的细胞毒性作用, 并可以诱发宿主的免疫反应, 影响目的基因的长期表达[14-17]. 本研究所选载体pcDNA3.1(+)是一个由人类巨细胞病毒启动子控制转录起始的表达质粒, 含氨苄青霉素(Amp)抗性基因, 便于做阳性克隆筛选; 含T7、BGH启动子, 为RNA聚合酶附着作用提供特异性识别位点; 含高效增强子SV40, 是一类能促进基因转录活性的顺式调控元件, 表现为: (1)无方向性; (2)远距离作用; (3)无基因特异性, 这样使其调控的基因可在哺乳动物细胞中获得稳定表达并在一定程度上保证了目的基因的稳定遗传.
我们成功构建Smad7/pcDNA3.1(+)重组质粒, 经酶切结合测序分析, 克隆到pcDNA3.1(+)中Smad7的ORF与GenBank中编码大鼠Smad7基因cDNA序列完全一致. 载体如何导入细胞及何时导入是实验顺利进行的关键. 实验中DNA转染真核细胞的常用方法有: 磷酸钙法、电转染法和基因枪法等, 以脂质体和病毒为载体的转染则常用于在体细胞的转染. 病毒载体由于自身蛋白质有较强的免疫原性而产生细胞毒性. 脂质体能提高分裂细胞和非分裂细胞对核酸的摄取, 并保护其不被降解, 具有操作简单、细胞吸收较好的优点, 并对特定细胞如肝星状细胞具有吸收倾向性, 本实验选用脂质体Lipofectmine2000, 细胞培养培养24 h后转染, 为排除外源性质粒DNA在转染时带来的生物学或免疫学效应, 我们设立了空质粒组. 为提高转导效率, 我们进行了G418筛选阳性克隆.
HSC体外培养自行活化, 模拟了体内纤维化过程, 是很好的肝纤维化模型. 本研究结果显示, Smad7 mRNA及蛋白水平均显著上调, 提示Smad7成功转染HSC-T6细胞, 可有效表达Smad7, 并影响TGF-β1及Ⅰ、Ⅲ型胶原mRNA的表达水平, 与正常对照及空质粒组相比, TGF-β1 mRNA表达降低, 并减少了Ⅰ型胶原mRNA的表达, Ⅰ型胶原合成减少, 可能减少ECM合成, 提示在一定程度上可能减轻肝纤维化.
实验结果显示上调Smad7基因表达对Ⅲ型胶原mRNA水平无明显影响, 这与阮艺华 et al研究结果相一致[18]. 尚有学者研究精氨酸-甘氨酸-天冬氨酸(RGD)三肽, 证实他存在于多种生物细胞外基质中, 能特异性识别细胞表面整合素并与之结合, 从而介导多种重要的生命活动[19-21], 他可以促进HSC胶原酶的表达, 从而增加胶原的降解, 他还具有拮抗TGF-β促进ECM分泌的作用[22-23]. 再者, 肝纤维化时, ECM的量和质均发生显著变化, 就胶原而言, Ⅲ型胶原在纤维化早期即明显增多, 但随纤维化进展, 可逐渐被Ⅰ型胶原替代. 本实验各组间Ⅰ胶原mRNA的表达水平有差异, 而Ⅲ型则无, 是否与纤维化的程度有关, 其机制尚待进一步研究.
总之, 本实验表明外源Smad7可以在HSC- T6细胞有效表达, 由于Smad7高表达能够减少TGF-β信号传入, 并能显著抑制HSCⅠ型胶原mRNA表达, 这为进一步实验及探索新的基因治疗途径提供实验依据.
肝纤维化是细胞外基质(ECM)在肝脏过多沉积的结果, 其关键环节是肝星状细胞(HSC)的激活, HSC体外培养自行活化, 模拟了体内纤维化过程, 是很好的肝纤维化模型. 转化生长因子β(TGF-β)是肝纤维化形成中最重要的细胞因子, 其信号传入依赖Smad完成, Smad7是TGF-β信号转导途径的主要抑制性蛋白, 具有抗纤维化的作用.
周士胜, 教授, 大连大学医学院医学研究中心
近年来, 基因治疗成为肝纤维化防治研究热点, 他是通过某种载体把起治疗作用的基因导入靶细胞, 合成具有治疗作用的蛋白, 从而达到治疗疾病的目的.
实验显示Smad7过度表达, 可有效阻止TGF-β信号传入, 并可以激活(CAGA)(9)-MLP-Luc区域, 从而导致胶原表达减少.
研究Smad7对TGF-β1及Ⅰ、Ⅲ型胶原mRNA的表达水平影响, 了解外源Smad7抗纤维化的效果, 为探索新的基因治疗途径提供实验依据.
本研究技术路线得当, 方法合理, 结论可靠, 具有一定的学术价值.
编辑: 李军亮 电编: 何基才
| 1. | Heldin CH, Miyazono K, ten Dijke P. TGF-beta signalling from cell membrane to nucleus through SMAD proteins. Nature. 1997;390:465-471. [PubMed] [DOI] |
| 2. | Ihn H. Pathogenesis of fibrosis: role of TGF-beta and CTGF. Curr Opin Rheumatol. 2002;14:681-685. [PubMed] [DOI] |
| 3. | 李 才, 张 一宁, 牛 俊奇, 候 芳玉, 黄 三英, 李 广生, 孙 立波, 张 得恒. 器官纤维化基础与临床. 第1版. 北京: 人民卫生出版社 2003; 1-5, 49-51, 58-61. |
| 4. | 李 瑾, 王 宁宁, 谭 若云, 郑 东辉, 任 胜利, 王 笑云, 杨 俊伟. Smad信号传递途径调节肾小管上皮细胞转分化实验. 肾脏病与透析肾移植杂志. 2005;14:230-233. |
| 5. | Ju CR, Xia XZ. The expression of Smad7 in the rats with pulmonary interstitial fibrosis and the therapeutic effect of IL-7. Int J Respir. 2006;26:486-489. |
| 6. | Li Z, Li J. Local expressions of TGF-beta1, TGF-beta1RI, CTGF, and Smad-7 in Helicobacter pylori-associated gastritis. Scand J Gastroenterol. 2006;41:1007-1012. [PubMed] [DOI] |
| 7. | Azuma H, Ehata S, Miyazaki H, Watabe T, Maruyama O, Imamura T, Sakamoto T, Kiyama S, Kiyama Y, Ubai T. Effect of Smad7 expression on metastasis of mouse mammary carcinoma JygMC(A) cells. J Natl Cancer Inst. 2005;97:1734-1746. [PubMed] |
| 8. | Zhu ML, Partin JV, Bruckheimer EM, Strup SE, Kyprianou N. TGF-beta signaling and androgen receptor status determine apoptotic cross-talk in human prostate cancer cells. Prostate. 2008;68:287-295. [PubMed] [DOI] |
| 9. | Schuppan D, Koda M, Bauer M, Hahn EG. Fibrosis of liver, pancreas and intestine: common mechanisms and clear targets? Acta Gastroenterol Belg. 2000;63:366-370. [PubMed] |
| 10. | Breitkopf K, Haas S, Wiercinska E, Singer MV, Dooley S. Anti-TGF-beta strategies for the treatment of chronic liver disease. Alcohol Clin Exp Res. 2005;29:121S-131S. [PubMed] [DOI] |
| 11. | Dooley S, Delvoux B, Streckert M, Bonzel L, Stopa M, ten Dijke P, Gressner AM. Transforming growth factor beta signal transduction in hepatic stellate cells via Smad2/3 phosphorylation, a pathway that is abrogated during in vitro progression to myofibroblasts. TGFbeta signal transduction during transdifferentiation of hepatic stellate cells. FEBS Lett. 2001;502:4-10. [PubMed] [DOI] |
| 12. | Schiffer M, von Gersdorff G, Bitzer M, Susztak K, Böttinger EP. Smad proteins and transforming growth factor-beta signaling. Kidney Int Suppl. 2000;77:S45-S52. [PubMed] [DOI] |
| 13. | Dooley S, Hamzavi J, Breitkopf K, Wiercinska E, Said HM, Lorenzen J, Ten Dijke P, Gressner AM. Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats. Gastroenterology. 2003;125:178-191. [PubMed] [DOI] |
| 14. | Iizuka T, Kanzaki S, Mochizuki H, Inoshita A, Narui Y, Furukawa M, Kusunoki T, Saji M, Ogawa K, Ikeda K. Noninvasive in vivo delivery of transgene via adeno-associated virus into supporting cells of the neonatal mouse cochlea. Hum Gene Ther. 2008;19:384-390. [PubMed] [DOI] |
| 15. | Abbink P, Lemckert AA, Ewald BA, Lynch DM, Denholtz M, Smits S, Holterman L, Damen I, Vogels R, Thorner AR. Comparative seroprevalence and immunogenicity of six rare serotype recombinant adenovirus vaccine vectors from subgroups B and D. J Virol. 2007;81:4654-4663. [PubMed] [DOI] |
| 16. | Khanam S, Rajendra P, Khanna N, Swaminathan S. An adenovirus prime/plasmid boost strategy for induction of equipotent immune responses to two dengue virus serotypes. BMC Biotechnol. 2007;7:10. [PubMed] [DOI] |
| 17. | Perreau M, Mennechet F, Serratrice N, Glasgow JN, Curiel DT, Wodrich H, Kremer EJ. Contrasting effects of human, canine, and hybrid adenovirus vectors on the phenotypical and functional maturation of human dendritic cells: implications for clinical efficacy. J Virol. 2007;81:3272-3284. [PubMed] [DOI] |
| 19. | Conway CL, Walker I, Bell A, Roberts DJ, Brown SB, Vernon DI. In vivo and in vitro characterisation of a protoporphyrin IX-cyclic RGD peptide conjugate for use in photodynamic therapy. Photochem Photobiol Sci. 2008;7:290-298. [PubMed] [DOI] |
| 20. | Madeja Z, Sroka J. Contact guidance of Walker carcinosarcoma cells by the underlying normal fibroblasts is inhibited by RGD-containing synthetic peptides. Folia Histochem Cytobiol. 2002;40:251-260. [PubMed] |
| 21. | Das S, Banerji A, Frei E, Chatterjee A. Rapid expression and activation of MMP-2 and MMP-9 upon exposure of human breast cancer cells (MCF-7) to fibronectin in serum free medium. Life Sci. 2008;82:467-476. [PubMed] [DOI] |
| 22. | Wang LS, Chen YW, Li DG, Lu HM. Arg-gly-asp-mannose-6-phosphate inhibits activation and proliferation of hepatic stellate cells in vitro. World J Gastroenterol. 2006;12:1303-1307. [PubMed] |
| 23. | Du SL, Pan H, Lu WY, Wang J, Wu J, Wang JY. Cyclic Arg-Gly-Asp peptide-labeled liposomes for targeting drug therapy of hepatic fibrosis in rats. J Pharmacol Exp Ther. 2007;322:560-568. [PubMed] [DOI] |