修回日期: 2008-07-15
接受日期: 2008-08-12
在线出版日期: 2008-09-28
目的: 探讨丙咪嗪对结肠癌HT-29细胞的增殖、细胞周期和凋亡的影响及其作用机制.
方法: 按ACTT方法常规培养HT-29细胞, 并以不同浓度(0、1、5、10、25、50和100 μmol/L)丙咪嗪干预, MTT法检测各浓度干预24、48和72 h后的细胞增殖能力; 丙咪嗪以各浓度(0、1、10、50和100 μmol/L)干预HT-29细胞24 h, PI染色后流式细胞仪检测细胞周期分布, Annexin V/PI双染后流式细胞仪和DNA片段梯试验检测细胞凋亡, Western blot检测Eag1蛋白的变化, 逆转录PCR检测p21、p27、CyclinE1和CDK2 mRNA表达水平的变化.
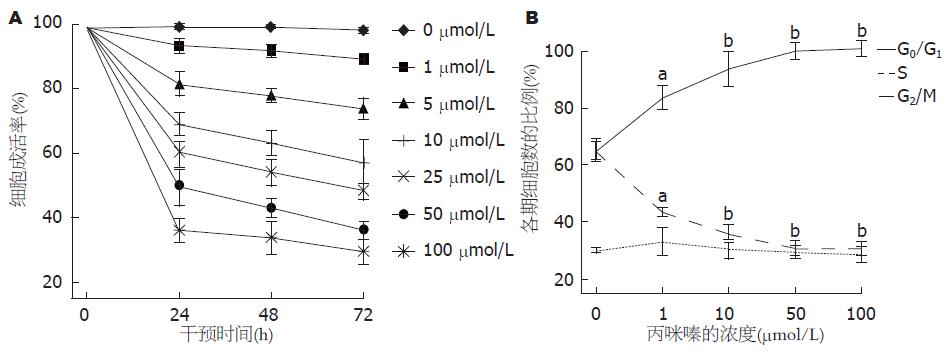
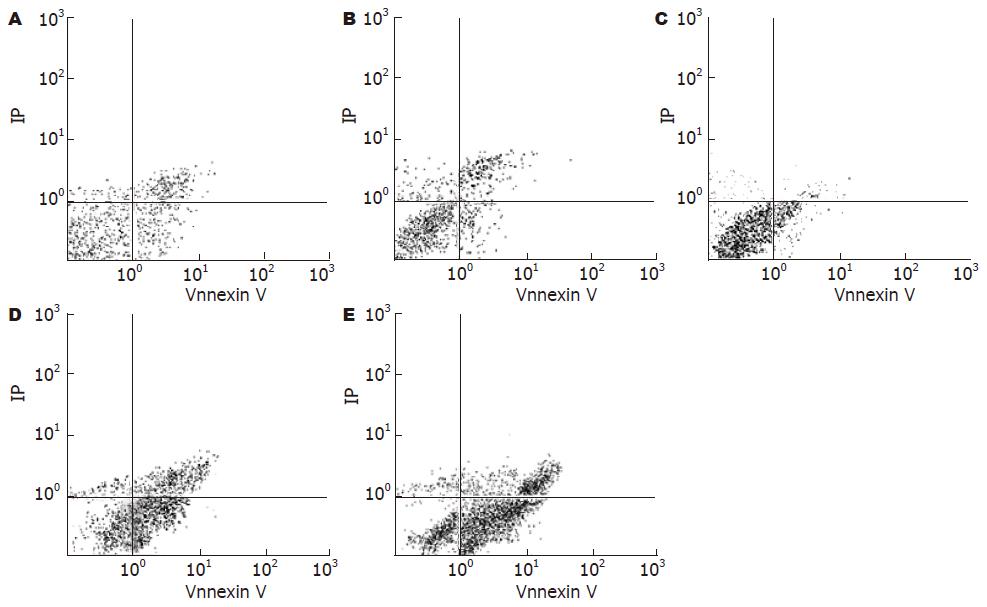
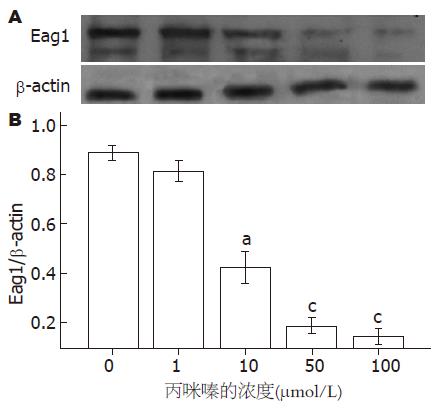
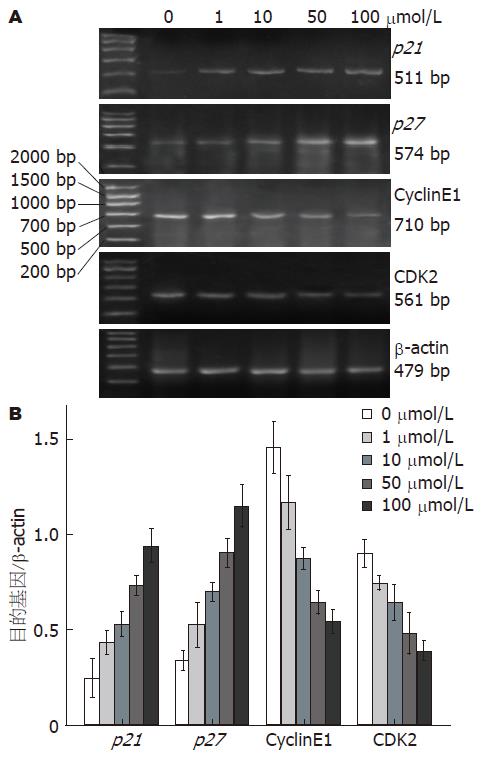
结果: 各浓度丙咪嗪干预HT-29细胞24、48和72 h后, IC50分别为43、32、22 μmol/L; 丙咪嗪以剂量依赖方式诱导HT-29细胞在细胞周期G0/G1期停滞, 随丙咪嗪干预的浓度增加, HT-29细胞的凋亡指数逐渐升高(P<0.01), HT-29细胞中Eag1蛋白的表达水平逐渐下降(P<0.05), p27和p21 mRNA表达水平逐渐增强(P<0.05), CyclinE1和CDK2 mRNA的表达水平逐渐减弱(P<0.05).
结论: 丙咪嗪可抑制HT-29细胞增殖, 阻滞HT-29细胞周期进展, 诱导细胞凋亡. 其作用机制可能与抑制Eag1钾通道的活性, 上调p27和p21表达、下调CyclinE1和CDK2表达有关.
引文著录: 丁祥武, 高山, 王玮, 严娟娟, 罗和生. 丙咪嗪对结肠癌HT-29细胞增殖、凋亡的影响及其机制. 世界华人消化杂志 2008; 16(27): 3043-3049
Revised: July 15, 2008
Accepted: August 12, 2008
Published online: September 28, 2008
AIM: To investigate the effect of imipramine on cell growth, cell cycle and apoptosis of HT-29 colon cancer cells, and to elucidate its molecular mechanism.
METHODS: Human colon cancer HT-29 cells were grown with routine cell cultivation and cells were treated with different concentrations of imiprmine. Cell survival was determined using MTT assay at 24 h, 48 h and 72 h, respectively; cell cycle distribution was assessed by FACS flow cytometery after propidium iodide staining; apoptosis of HT-29 cells was detected using Annexin V/PI methods and DNA ladder assay. Expression level of Eag1 protein was detected by Western blot, and mRNA expressions of p21, p27, CyclinE1 and CDK2 were determined by reverse transcription-polymerase chain reaction.
RESULTS: After treatment with imipramine in HT-29 cells at 24, 48 and 72 h, IC50 were 43, 32 and 22 μmol/L, respectively. Cell viability decreased dose-dependently and time-dependently after treatment with imiprmince in HT 29 cells. Cell cycle arrested during the G0/G1 phase accompanied by the induction of apoptosis in a dose-dependent manner. With imipramine increasing, HT-29 cells apoptosis index gradually increased (P < 0.01). Expression level of Eag1 protein was decreased in a dose-dependent manner (P < 0.05). The p21 mRNA and p27 mRNA were up-regulated (P < 0.05), and CDK2 mRNA and CyclinE1 mRNA were suppressed in imipramine-treated HT-29 cells in a dose-dependent manner (P < 0.05).
CONCLUSION: Imipramine, a non-specific inhibitor of Eag1 potassium channel, induces cell growth inhibition, cell-cycle arrest and apoptosis in HT-29 cells through up-regulation of p27 and/or p21.
- Citation: Ding XW, Gao S, Wang W, Yan JJ, Luo HS. Effect of imipramine on HT-29 cells' proliferation, cell cycle arrest and apoptosis and its mechanism. Shijie Huaren Xiaohua Zazhi 2008; 16(27): 3043-3049
- URL: https://www.wjgnet.com/1009-3079/full/v16/i27/3043.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i27.3043
随着临床药理剂量的阿米替林和去甲丙咪嗪可刺激啮齿类动物肿瘤生长的证实[1-3], 临床上长期应用三环类抗抑郁药(tricyclic antidepressant, TCAs)是否会诱导或促进癌的发生备受关注[4-8].某些药物可能增加某些肿瘤的风险[2-3,9-13], 或与肿瘤的风险无关[8,13-20], 或者具有抗肿瘤作用[7,21-22]. 长期服用丙咪嗪不增加恶性肿瘤的风险[6-8,20], 甚至能逆转大鼠慢性抑郁状态促进的肿瘤生长作用[23].
Eag1基因(KCNH1)在黒腹果蝇作突变检测时发现[24-25]. Eag1钾通道(Kv10.1)具有癌基因的特点, 在多种肿瘤组织异常表达, 是前景乐观的恶性肿瘤诊治靶点[26-31]. Eag1特异性抑制剂能在转录、蛋白和电流水平抑制癌细胞Eag1钾通道, 对体内外癌细胞的增殖均有抑制作用[32-34]. 离子通道激活可引起细胞体积变化和膜电位振荡, 诱导细胞周期的进展和有丝分裂的完成[35-37]; 而抑制胶质前体细胞(glial progenitor cells)钾电流和膜去极化可引起p27和p21的蓄积, 阻滞细胞周期进展[38].
近期研究证实丙咪嗪能抑制肿瘤细胞增殖[22-23,39-40], 其作用机制尚未阐明. 此前研究发现丙咪嗪能相对特异性的阻断Eag1钾电流[25], 发挥对肿瘤细胞的增殖抑制作用[26-27,39-40].
根据以上文献复习, 推测丙咪嗪能促进HT-29细胞增殖抑制和凋亡, 其作用机制可能与通过抑制Eag1表达, 调节细胞周期相关蛋白的表达有关. 本研究旨在验证该假说.
人结肠癌细胞株HT-29细胞购自由中国科学院上海细胞所. McCoy's 5A、胰酶和胎牛血清购自GIBCO公司; Eag1抗体、丙咪嗪、TRIzol试剂购自Sigma公司; Annexin V/PI试剂盒购自Roche公司; 逆转录PCR试剂盒(mRNA Selective PCR Kit Ver. 1.1)购自TaKaRa公司; 引物由上海生工合成.
1.2.1 细胞培养: 人结肠癌细胞系HT-29培养按ATCC培养方法, McCoy's 5A培养基中临时加入1.5 mmol/L L-谷胺酰胺、2.2 g/L碳酸氢钠、100 mL/L胎牛血清、100 kU/L青霉素和链霉素, 在37 ℃、50 mL/L CO2的饱和湿度培养箱内培养; 每3-4天以1:3-1:5传代. 正常生长状态下HT-29细胞形态为上皮样, 单层贴壁生长, 丧失接触抑制与密度抑制.
1.2.2 MTT法: 亚融合状态的细胞消化后制成单细胞悬液, 以每孔4×103个细胞接种于96孔培养板中, 在37 ℃、50 mL/L CO2的培养箱中培养. 24 h后换无血清培养液, 加不同浓度丙咪嗪(终浓度分别为0, 1, 5, 10, 25, 50, 100 μmol/L), 每组每个时间点设4个平行孔; 继续培养第24, 48, 72 h, 每孔加入MTT溶液(5 g/L) 20 μL, 37 ℃孵育4 h后弃培养液; 每孔加入150 μL DMSO振荡10 min; 用酶标仪在490 nm处测定吸光度.
1.2.3 流式细胞分析仪分析细胞周期: 对数生长期HT-29细胞消化后培养液重悬, 调整细胞浓度为4×108/L, 接种于培养瓶; 24 h后换0.5 mL/L胎牛血清的培养基(同步化); 24 h后换100 mL/L胎牛血清的培养基, 加入不同浓度丙咪嗪(终浓度分别为0, 1, 10, 50, 100 μmol/L)继续培养; 收集细胞, 悬浮者直接移至离心管, 贴壁者胰酶消化后移至离心管; 按照试剂盒的说明逐步处理并加PI染液上流式细胞分析仪测定.
1.2.4 流式细胞分析仪检测细胞凋亡: 对数生长期培养细胞中加入不同浓度丙咪嗪(终浓度分别为0, 1, 10, 50, 100 μmol/L)培养24 h, 按Annexin V/PI试剂盒说明和步骤处理后上流式细胞仪检测.
1.2.5 DNA片段分析: 细胞培养和药物干预收集漂浮细胞和贴壁细胞移入无菌的1.5 mL离心管, 洗涤、离心3次后加入100 μL DNA溶解缓冲液, 55 ℃孵育3 h; 加10 μL RNAse A, 37 ℃孵育3 h; 加5 μL 6×DNA加样缓冲液(300 g/L甘油, 2.5 g/L溴酚蓝), 取5 μL在15 g/L琼脂糖凝胶中电泳, 溴化乙啶染色, 凝胶成像系统拍照.
1.2.6 免疫印迹: 提取总蛋白, Bradford法测定浓度; SDS-PAGE凝胶电泳后蛋白质电转移到NC膜, 5%脱脂奶粉封闭90 min后行抗原抗体反应(以新鲜膜封闭液稀释抗体, 抗Eag1抗体浓度为1:500, 二抗为1:2000); 暗室内增强化学发光法X胶片显影.
1.2.7 逆转录PCR: TRIzol法抽提培养细胞总RNA, 凝胶电泳检测总RNA质量, 紫外分光光度仪测量RNA浓度及A260/A280的比值. 二步法完成逆转录PCR. 反应调节参照试剂盒说明书, 根据实验稍作调整. Biometra UNOII PCR扩增仪扩增后, PCR产物用20 g/L琼脂糖凝胶电泳, 溴化乙啶染色后凝胶成像系统拍照.
统计学处理 采用SPSS11.0统计软件进行分析, 定量资料采用t检验或方差分析, P<0.05为差异有显著性意义.
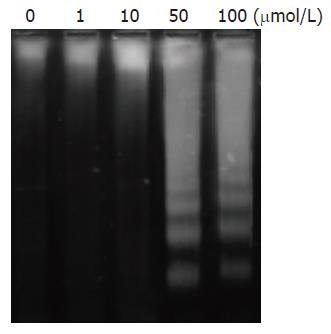
丙咪嗪抑制HT-29细胞的IC50在24、48和72 h分别为43, 32, 22 μmol/L. MTT法检测细胞增殖的变化: 丙咪嗪以浓度和干预时间依赖的方式抑制HT-29细胞增殖(P<0.05, 表1, 图1A). 随丙咪嗪干预的浓度增加, G0/G1期细胞的比例逐渐增加、S期细胞的比例逐渐下降、G2/M期细胞的比例无明显变化, 证实丙咪嗪以剂量依赖方式诱导HT-29细胞在细胞周期G0/G1期停滞(图1B).Annexin V/PI双染后流式细胞仪检测HT-29细胞的生存变化: 随丙咪嗪干预的浓度增加, HT-29细胞的凋亡指数逐渐升高, 证实丙咪嗪可诱导HT-29细胞凋亡(P<0.01, 图2, 表2). 进一步检测发现50, 100 μmol/L组出现DNA片段梯度, 证实丙咪嗪可诱导细胞凋亡(图3).
| 基因 | 登录号 | 引物序列 | 扩增片段 |
| p27 | NM_004064 | 5'-AAGATGTCAAACGTGCGAGTG-3' | |
| 5'-GCTTCTTGGGCGTCTGCT-3' | 574 bp | ||
| p21 | NM_000389 | 5'-CTCAAAGGCCCGCTCTACATC-3' | |
| 5'-GTCACCCTGCCCAACCTTAG-3' | 511 bp | ||
| CyclinE1 | NM_001238 | 5'-CCAAACTCAACGTGCAAGC-3' | |
| 5'-ATGTCGCACCACTGATACCCT-3' | 710 bp | ||
| CDK2 | NM_001798 | 5'-CCATTCTCATCGGGTCCTC-3' | |
| 5'-GGGCTTCAAGAAGGCTATCAG-3' | 561 bp | ||
| β-actin | NM_001101 | 5'-TGACGGGGTCACCCACACTGTGCC-3' | |
| 5'-CCTTCTGCATCCTGTCGGCAATGC-3' | 479 bp |
Eag1蛋白表达水平随丙咪嗪浓度增加而逐渐减弱(图4), 证实丙咪嗪能抑制HT-29细胞Eag1钾通道蛋白的表达.
逆转录PCR检测丙咪嗪干预HT-29细胞后各目的基因mRNA的表达水平, 发现随丙咪嗪浓度增加, p27和p21表达水平逐渐增强, CyclinE1和CDK2表达水平逐渐减弱(各目的基因不同浓度间比较P<0.05, 图5).
本实验探讨丙咪嗪对结肠癌HT-29细胞(该细胞株Eag1钾通道异常表达[30])增殖和凋亡的影响及其可能机制, 发现: 丙咪嗪以剂量和时间依赖方式抑制HT-29细胞的增殖能力; 以剂量依赖性诱导HT-29细胞周期在G0/G1期停滞; 可诱导HT-29细胞凋亡, 这种作用可能与细胞周期的阻滞有关; 可通过上调p27和p21表达, 下调CyclinE1和 CDK2表达, 从而阻滞HT-29细胞周期的进展, 诱导细胞凋亡; 以剂量依赖方式抑制HT-29细胞Eag1蛋白的表达水平, 从而诱导细胞周期停滞、增殖抑制和凋亡.
由于发现某些抗抑郁药可能有促癌作用, 人们对安全应用TCAs作为癌症的辅助治疗药物存在顾虑. 有些学者认为TCAs可能增加某些肿瘤的风险, 如结肠癌[2-3]、乳腺癌[9-11]、非何杰金淋巴瘤[11]、前列腺癌[12]; 也有认为与恶性肿瘤的风险无关, 如乳腺癌[8,13-16]、卵巢癌[17-19]、结肠癌[20]或其他肿瘤[11]; 还认为某些TCAs具有抗肿瘤作用, 尤其是中间环含氮原子时(如丙咪嗪)[7,21-22]; 甚至有认为某些药物(如氟西汀和氯丙咪嗪)具有双重作用(兼有促进和抑制肿瘤生长的作用)[6]. 随着相关研究的深入, 更多证据支持长期应用某些TCAs(如丙咪嗪) 能有效缓解各种癌性疼痛和抑郁/焦虑甚至失眠状态[41-42], 不会增加癌症的风险[6-8,20], 甚至有抗肿瘤作用[6-7,22-23,29].
Arimochi et al[22]检测TCAs对结肠癌HT-29 细胞增殖的影响, 发现丙咪嗪以时间依赖方式抑制HT-29细胞的增殖, 去甲丙咪嗪以药物浓度依赖方式诱导HT-29细胞在G0/G1或G2/M期停滞和凋亡; 他们还发现去甲丙咪嗪的促凋亡作用与线粒体途径无关, 并推测与阻滞细胞周期的进展有关. 这与本实验结果一致, 进一步证实丙咪嗪具有抗肿瘤作用.
细胞周期依赖激酶(cyclin dependent kinases, CDKs)控制绝大多数真核生物细胞周期的进展[43-44], 其中CDK2、CDK4和CDK6等与哺乳动物细胞的G1/S关卡有关[45], 他们受到多层次的调节, 包括细胞周期蛋白(Cyclins)[46-47]、CDKs的磷酸化和去磷酸化、CDKs抑制剂等[48]. p27和p21是普遍的Cyclin-CDKs抑制剂, 能抑制包括CyclinE-CDK2在内的多种G1期Cyclin-CDKs激酶活性, 使细胞不能通过G1/S关卡[45,49-50]. 研究还证实药物诱导细胞周期阻滞可伴随细胞凋亡, 如岩藻黄质(fucoxanthin)作用于结肠癌HCT116细胞[51], 美洛克嗪作用于结肠癌COLO205细胞和HT-29细胞[52]; 凋亡可能是细胞周期停滞的继发事件, 其机制可能与细胞核内p27的蓄积有关[53-55].
Arimochi et al[22]推测去甲丙咪嗪对HT-29细胞的毒性作用与抑制细胞周期的进展有关. 此前也有丙咪嗪诱导神经胶质瘤C6细胞[56-57]和急性髓性白血病 HL-60细胞凋亡的报道[58]. 本实验发现丙咪嗪以剂量依赖方式上调HT-29细胞转录水平p27和p21的表达, 下调CyclinE1和CDK2的表达. 这证实丙咪嗪可能通过调节CDKs抑制剂、Cyclins和CDKs的表达, 诱导肿瘤细胞周期停滞, 发挥其抑制增殖、促进凋亡的作用, 也验证了Arimochi et al[22]的假说.
研究表明钾通道的激活可推动细胞周期从G1期进展[35], 抑制钾电流和膜去极化可调节p27和p21的蓄积, 引起细胞周期停滞[37], 证实钾通道可以直接调节CDKs抑制剂, 与细胞周期进展密切相关. 研究还证实丙咪嗪是相对特异性的Eag1钾通道抑制剂, 能抑制该电流发挥其抗肿瘤作用[39-40,59]. 本实验发现随丙咪嗪浓度增加以及细胞周期停滞和细胞增殖抑制增强, Eag1蛋白表达水平逐渐减弱. 这进一步证实了丙咪嗪可能通过抑制Eag1钾通道, 调节p21等细胞周期相关调节因子的表达, 阻滞细胞周期进展, 诱导凋亡, 发挥其抗肿瘤的作用. 也有学者认为丙咪嗪等TCAs能通过Caspase-3依赖途径诱导人急性髓性白血病HL-60细胞凋亡[58], 因此Eag1钾通道也有可能通过Caspase途径发挥其促进凋亡的作用, 这有待进一步实验证实.
丙咪嗪作为TCAs之一, 能有效缓解癌症引起的抑郁症状, 并可能通过舒缓疼痛的情绪成分和直接影响中枢神经系统而有效的治疗癌性疼痛[60]; 是Eag1特异性相对较高的抑制剂, 可能通过抑制Eag1钾通道而具有抗癌作用, 这也可能是丙咪嗪能有效缓解癌细胞浸润引起的疼痛的机制之一. 丙咪嗪在长期的临床应用中被认为相对安全, 临床医师应该更加重视其在恶性肿瘤患者中的应用.
总之, 本研究发现, 丙咪嗪可抑制HT-29细胞增殖, 阻滞HT-29细胞周期进展, 诱导细胞凋亡. 其作用机制可能与抑制Eag1钾通道的活性, 上调p27和p21表达, 下调CyclinE1和CDK2表达有关.
丙咪嗪作为三环类抗抑郁药, 能有效缓解癌症引起的抑郁症状, 并可能通过舒缓疼痛的情绪成分和直接影响中枢神经系统而有效的治疗癌性疼痛.临床流行病学研究表明长期服用丙咪嗪不增加恶性肿瘤的风险; 体外实验证实丙咪嗪能抑制肿瘤细胞增殖; 动物实验发现丙咪嗪抗抑郁治疗能逆转大鼠慢性抑郁状态促进的肿瘤生长作用.近期研究还发现丙咪嗪能相对特异性的阻断Eag1钾电流, 发挥对肿瘤细胞的增殖抑制作用.
王正康, 教授, 北京中日友好医院普外科
离子通道与恶性肿瘤的研究相关性日益受到重视, 其中以钾通道的研究最为深入. Ether à go-go钾通道(Eag1)由于在体内局限性分布、具有癌基因的特性以及在多种临床肿瘤组织中高频率表达的特点, 已经成为前景乐观的恶性肿瘤诊治的靶点. 目前Eag1钾通道的特异性抑制剂的研发在起步阶段, 未能应用于临床.在目前尚无特异性Eag1钾通道阻断剂的背景下, 丙咪嗪作为特异性相对较高的Eag1钾通道阻断剂, 在长期的临床应用中被认为是相对安全的, 临床医师应该更加重视其在肿瘤临床中的应用.
Eag1钾通道与细胞周期进展关系密切, 可通过与细胞骨架成分的相互作用, Mg2+依赖或Ca2+/钙调蛋白的调节, epsin蛋白的调节, 细胞外基质的调节, 缺氧信号的调节, 胰岛素样生长因子(IGF-1)通过Akt依赖信号途径, 或者MAP激酶信号途径引起Eag1电位感受器出现构象改变等方式, 激活癌细胞Eag1钾通道, 参与调节肿瘤细胞的增殖.
通过复习文献, 推测丙咪嗪抑制癌细胞增殖和/或诱导凋亡的作用机制可能与阻断肿瘤细胞的Eag1钾通道, 阻滞细胞周期的进展有关.本研究旨在验证该假说..
本研究发现丙咪嗪能阻滞细胞周期进展、抑制癌细胞增殖、诱导凋亡; 其作用机制可能与通过抑制Eag1表达, 调节某些细胞周期相关因子的表达有关. 这可能为临床重视丙咪嗪应用于恶性肿瘤的辅助治疗, 开发Eag1钾通道作为癌症的诊疗靶点提供理论依据.
Eag1钾通道: 一种电压门控钾通道, 属于EAG家族(该家族有8个成员). 国际药理联合会(IUPHAR)将其命名为Kv10.1, 基因名(人类基因命名法)为KCNH1.Eag1是在对乙醚麻醉时出现腿震颤的黑腹果蝇作突变检测时发现的一个独立基因位点, 表现为缓慢节律性的腿震颤行为, 随后被命名为ether à go-go. KCNH1编码与细胞兴奋有关的蛋白电压门控钾通道, 对K+和Ca2+有通透性. Eag1钾通道具有特定的电压依赖性和药理学特点. Eag1在脑中丰富表达, 在外周组织少量表达于失去了增殖能力的一些终末期分化细胞. Eag1具有癌基因的特点, 在多种临床肿瘤组织中高频率表达.
本文设计合理, 有一定新意, 提供了有一定价值的信息.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Brandes LJ, Arron RJ, Bogdanovic RP, Tong J, Zaborniak CL, Hogg GR, Warrington RC, Fang W, LaBella FS. Stimulation of malignant growth in rodents by antidepressant drugs at clinically relevant doses. Cancer Res. 1992;52:3796-3800. [PubMed] |
| 2. | Tutton PJ, Barkla DH. Effect of an inhibitor of noradrenaline uptake, desipramine, on cell proliferation in the intestinal crypt epithelium. Virchows Arch B Cell Pathol Incl Mol Pathol. 1989;57:349-352. [PubMed] [DOI] |
| 3. | Iishi H, Tatsuta M, Baba M, Taniguchi H. Enhancement by the tricyclic antidepressant, desipramine, of experimental carcinogenesis in rat colon induced by azoxymethane. Carcinogenesis. 1993;14:1837-1840. [PubMed] [DOI] |
| 5. | Miller LG. Antidepressants and cancer: cause for concern? J Clin Psychopharmacol. 1993;13:1-2. [PubMed] [DOI] |
| 6. | Steingart AB, Cotterchio M. Do antidepressants cause, promote, or inhibit cancers? J Clin Epidemiol. 1995;48:1407-1412. [PubMed] [DOI] |
| 7. | Sternbach H. Are antidepressants carcinogenic? A review of preclinical and clinical studies. J Clin Psychiatry. 2003;64:1153-1162. [PubMed] |
| 8. | Lawlor DA, Jüni P, Ebrahim S, Egger M. Systematic review of the epidemiologic and trial evidence of an association between antidepressant medication and breast cancer. J Clin Epidemiol. 2003;56:155-163. [PubMed] [DOI] |
| 9. | Cotterchio M, Kreiger N, Darlington G, Steingart A. Antidepressant medication use and breast cancer risk. Am J Epidemiol. 2000;151:951-957. [PubMed] |
| 10. | Sharpe CR, Collet JP, Belzile E, Hanley JA, Boivin JF. The effects of tricyclic antidepressants on breast cancer risk. Br J Cancer. 2002;86:92-97. [PubMed] [DOI] |
| 11. | Dalton SO, Johansen C, Mellemkjaer L, Sørensen HT, McLaughlin JK, Olsen J, Olsen JH. Antidepressant medications and risk for cancer. Epidemiology. 2000;11:171-176. [PubMed] [DOI] |
| 12. | Tamim HM, Mahmud S, Hanley JA, Boivin JF, Stang MR, Collet JP. Antidepressants and risk of prostate cancer: a nested case-control study. Prostate Cancer Prostatic Dis. 2008;11:53-60. [DOI] |
| 13. | Coogan PF. Review of the epidemiological literature on antidepressant use and breast cancer risk. Expert Rev Neurother. 2006;6:1363-1374. [PubMed] [DOI] |
| 14. | Tamim H, Boivin JF, Hanley J, Stang M, Collet JP. Risk of breast cancer in association with exposure to two different groups of tricyclic antidepressants. Pharmacoepidemiol Drug Saf. 2006;15:689-697. [PubMed] [DOI] |
| 15. | Wang PS, Walker AM, Tsuang MT, Orav EJ, Levin R, Avorn J. Antidepressant use and the risk of breast cancer: a non-association. J Clin Epidemiol. 2001;54:728-734. [PubMed] [DOI] |
| 16. | Chien C, Li CI, Heckbert SR, Malone KE, Boudreau DM, Daling JR. Antidepressant use and breast cancer risk. Breast Cancer Res Treat. 2006;95:131-140. [PubMed] [DOI] |
| 17. | Dublin S, Rossing MA, Heckbert SR, Goff BA, Weiss NS. Risk of epithelial ovarian cancer in relation to use of antidepressants, benzodiazepines, and other centrally acting medications. Cancer Causes Control. 2002;13:35-45. [PubMed] [DOI] |
| 18. | Coogan- PF, Rosenberg L, Palmer JR, Strom BL, Stolley PD, Zauber AG, Shapiro S. Risk of ovarian cancer according to use of antidepressants, phenothiazines, and benzodiazepines (United States). Cancer Causes Control. 2000;11:839-845. [PubMed] [DOI] |
| 19. | Moorman PG, Berchuck A, Calingaert B, Halabi S, Schildkraut JM. Antidepressant medication use [corrected] and risk of ovarian cancer. Obstet Gynecol. 2005;105:725-730. [PubMed] |
| 20. | Xu W, Tamim H, Shapiro S, Stang MR, Collet JP. Use of antidepressants and risk of colorectal cancer: a nested case-control study. Lancet Oncol. 2006;7:301-308. [PubMed] [DOI] |
| 21. | Sauter C. Cytostatic activity of commonly used tricyclic antidepressants. Oncology. 1989;46:155-157. [PubMed] |
| 22. | Arimochi H, Morita K. Characterization of cytotoxic actions of tricyclic antidepressants on human HT29 colon carcinoma cells. Eur J Pharmacol. 2006;541:17-23. [PubMed] [DOI] |
| 23. | Basso AM, Depiante-Depaoli M, Molina VA. Chronic variable stress facilitates tumoral growth: reversal by imipramine administration. Life Sci. 1992;50:1789-1796. [PubMed] [DOI] |
| 24. | Kaplan WD, Trout WE 3rd. The behavior of four neurological mutants of Drosophila. Genetics. 1969;61:399-409. [PubMed] |
| 25. | Warmke J, Drysdale R, Ganetzky B. A distinct potassium channel polypeptide encoded by the Drosophila eag locus. Science. 1991;252:1560-1562. [PubMed] [DOI] |
| 26. | Camacho J. Ether à go-go potassium channels and cancer. Cancer Lett. 2006;233:1-9. [PubMed] [DOI] |
| 27. | Stühmer W, Alves F, Hartung F, Zientkowska M, Pardo LA. Potassium channels as tumour markers. FEBS Lett. 2006;580:2850-2852. [PubMed] [DOI] |
| 29. | Ding XW, Luo HS, Jin X, Yan JJ, Ai YW. Aberrant expression of Eag1 potassium channels in gastric cancer patients and cell lines. Med Oncol. 2007;24:345-350. [PubMed] [DOI] |
| 30. | Ding XW, Yan JJ, An P, Lü P, Luo HS. Aberrant expression of ether à go-go potassium channel in colorectal cancer patients and cell lines. World J Gastroenterol. 2007;13:1257-1261. [PubMed] |
| 31. | Ding XW, Wang XG, Luo HS, Tan SY, Gao S, Luo B, Jiang H. Expression and prognostic roles of Eag1 in resected esophageal squamous cell carcinomas. Dig Dis Sci. 2008;53:2039-2044. [PubMed] [DOI] |
| 32. | Pardo LA, del Camino D, Sanchez A, Alves F, Brüggemann A, Beckh S, Stühmer W. Oncogenic potential of EAG K(+) channels. EMBO J. 1999;18:5540-5547. [PubMed] [DOI] |
| 33. | Weber C, Mello de Queiroz F, Downie BR, Suckow A, Stühmer W, Pardo LA. Silencing the activity and proliferative properties of the human EagI Potassium Channel by RNA Interference. J Biol Chem. 2006;281:13030-13037. [PubMed] [DOI] |
| 34. | Gómez-Varela D, Zwick-Wallasch E, Knötgen H, Sánchez A, Hettmann T, Ossipov D, Weseloh R, Contreras-Jurado C, Rothe M, Stühmer W. Monoclonal antibody blockade of the human Eag1 potassium channel function exerts antitumor activity. Cancer Res. 2007;67:7343-7349. [PubMed] [DOI] |
| 35. | Wonderlin WF, Strobl JS. Potassium channels, proliferation and G1 progression. J Membr Biol. 1996;154:91-107. [PubMed] [DOI] |
| 36. | Camacho J, Sánchez A, Stühmer W, Pardo LA. Cytoskeletal interactions determine the electrophysiological properties of human EAG potassium channels. Pflugers Arch. 2000;441:167-174. [PubMed] [DOI] |
| 37. | Wang Z. Roles of K+ channels in regulating tumour cell proliferation and apoptosis. Pflugers Arch. 2004;448:274-286. [PubMed] [DOI] |
| 38. | Ghiani CA, Yuan X, Eisen AM, Knutson PL, DePinho RA, McBain CJ, Gallo V. Voltage-activated K+ channels and membrane depolarization regulate accumulation of the cyclin-dependent kinase inhibitors p27(Kip1) and p21(CIP1) in glial progenitor cells. J Neurosci. 1999;19:5380-5392. [PubMed] |
| 39. | Ogata N, Yoshii M, Narahashi T. Psychotropic drugs block voltage-gated ion channels in neuroblastoma cells. Brain Res. 1989;476:140-144. [PubMed] [DOI] |
| 40. | Gavrilova-Ruch O, Schönherr K, Gessner G, Schönherr R, Klapperstück T, Wohlrab W, Heinemann SH. Effects of imipramine on ion channels and proliferation of IGR1 melanoma cells. J Membr Biol. 2002;188:137-149. [PubMed] [DOI] |
| 42. | Theobald DE. Cancer pain, fatigue, distress, and insomnia in cancer patients. Clin Cornerstone. 2004;6 Suppl 1D:S15-S21. [PubMed] [DOI] |
| 43. | Tannoch VJ, Hinds PW, Tsai LH. Cell cycle control. Adv Exp Med Biol. 2000;465:127-140. [PubMed] [DOI] |
| 44. | Owa T, Yoshino H, Yoshimatsu K, Nagasu T. Cell cycle regulation in the G1 phase: a promising target for the development of new chemotherapeutic anticancer agents. Curr Med Chem. 2001;8:1487-1503. [PubMed] |
| 45. | Reed SI. Control of the G1/S transition. Cancer Surv. 1997;29:7-23. [PubMed] |
| 46. | Johnson DG, Walker CL. Cyclins and cell cycle checkpoints. Annu Rev Pharmacol Toxicol. 1999;39:295-312. [PubMed] [DOI] |
| 47. | McGill CJ, Brooks G. Cell cycle control mechanisms and their role in cardiac growth. Cardiovasc Res. 1995;30:557-569. [PubMed] [DOI] |
| 48. | Vidal A, Koff A. Cell-cycle inhibitors: three families united by a common cause. Gene. 2000;247:1-15. [PubMed] [DOI] |
| 49. | Harper JW. Cyclin dependent kinase inhibitors. Cancer Surv. 1997;29:91-107. [PubMed] [DOI] |
| 50. | Nakayama K, Nakayama K. Cip/Kip cyclin-dependent kinase inhibitors: brakes of the cell cycle engine during development. Bioessays. 1998;20:1020-1029. [PubMed] |
| 51. | Das SK, Hashimoto T, Shimizu K, Yoshida T, Sakai T, Sowa Y, Komoto A, Kanazawa K. Fucoxanthin induces cell cycle arrest at G0/G1 phase in human colon carcinoma cells through up-regulation of p21WAF1/Cip1. Biochim Biophys Acta. 2005;1726:328-335. [PubMed] |
| 52. | Lin JC, Ho YS, Lee JJ, Liu CL, Yang TL, Wu CH. Induction of apoptosis and cell-cycle arrest in human colon cancer cells by meclizine. Food Chem Toxicol. 2007;45:935-944. [PubMed] [DOI] |
| 53. | Dijkers PF, Medema RH, Pals C, Banerji L, Thomas NS, Lam EW, Burgering BM, Raaijmakers JA, Lammers JW, Koenderman L. Forkhead transcription factor FKHR-L1 modulates cytokine-dependent transcriptional regulation of p27(KIP1). Mol Cell Biol. 2000;20:9138-9148. [PubMed] [DOI] |
| 54. | Wu M, Bellas RE, Shen J, Yang W, Sonenshein GE. Increased p27Kip1 cyclin-dependent kinase inhibitor gene expression following anti-IgM treatment promotes apoptosis of WEHI 231 B cells. J Immunol. 1999;163:6530-6535. [PubMed] |
| 55. | Drexler HC. The role of p27Kip1 in proteasome inhibitor induced apoptosis. Cell Cycle. 2003;2:438-441. [PubMed] |
| 56. | Slamon ND, Ward TH, Butler J, Pentreath VW. Assessment of DNA damage in C6 glioma cells after antidepressant treatment using an alkaline comet assay. Arch Toxicol. 2001;75:243-250. [PubMed] [DOI] |
| 57. | Spanová A, Kovárů H, Lisá V, Lukásová E, Rittich B. Estimation of apoptosis in C6 glioma cells treated with antidepressants. Physiol Res. 1997;46:161-164. [PubMed] |
| 58. | Xia Z, Bergstrand A, DePierre JW, Nässberger L. The antidepressants imipramine, clomipramine, and citalopram induce apoptosis in human acute myeloid leukemia HL-60 cells via caspase-3 activation. J Biochem Mol Toxicol. 1999;13:338-347. [PubMed] [DOI] |
| 59. | García-Ferreiro RE, Kerschensteiner D, Major F, Monje F, Stühmer W, Pardo LA. Mechanism of block of hEag1 K+ channels by imipramine and astemizole. J Gen Physiol. 2004;124:301-317. [PubMed] [DOI] |
| 60. | Magni G, Conlon P, Arsie D. Tricyclic antidepressants in the treatment of cancer pain: a review. Pharmacopsychiatry. 1987;20:160-164. [PubMed] |