修回日期: 2008-08-26
接受日期: 2008-09-01
在线出版日期: 2008-09-18
目的: 探讨内镜智能分光比色技术(FICE)鉴别大肠肿瘤及非肿瘤性病变的价值.
方法: 选择2007-03/2008-05在我院行结肠镜检查发现大肠新生物及息肉样病变者245例, 分别采用常规放大技术、FICE放大技术及染色放大技术对病变进行腺管开口分型及毛细血管形态观察, 对病变作出诊断, 并与病理组织学诊断相比较.
结果: 在245例患者中发现新生性病变480个, 其中常规放大内镜较FICE放大模式发现病变差异有统计学意义(90.0% vs 98.8%, P<0.01). FICE放大内镜比染色放大内镜更能清晰显示黏膜毛细血管结构形态(P<0.01), 在显示腺管开口方面两者无统计学意义, 且前者对大肠肿瘤性病变的诊断符合率、敏感性、特异性优于后者(92.2% vs 81.0%, 95.3% vs 85.6%, 88.4% vs 75.6%, 均P<0.01).
结论: FICE放大内镜对大肠肿瘤性病变诊断符合率高, 操作简单, 具有良好的临床实用价值.
引文著录: 黄留业, 刘运祥, 吴承荣, 崔俊, 徐宁, 宋波, 衣龙志. FICE技术在大肠病变腺管开口分型及毛细血管形态观察中的价值. 世界华人消化杂志 2008; 16(26): 2952-2958
Revised: August 26, 2008
Accepted: September 1, 2008
Published online: September 18, 2008
AIM: To compare Fuji intelligent chromo endoscopy (FICE) and staining techniques in differential diagnosis for colonic tumor and non-tumor lesions.
METHODS: From March 2007 to May 2008, 245 patients with colon neoplasm or polypoid lesions were included. The patients underwent a magnifying ordinary colonoscopy, a magnifying FICE technique and magnifying staining technique. The pit pattern and blood capillary form of the lesions were examined, an endoscopic diagnosis was made and compared with the pathologic diagnosis.
RESULTS: A total of 480 neoplasms were detected in 245 patients. There was significant difference in detecting lesions between conventional magnifying endoscopy and FICE larger models (90.0% vs 98.8%, P < 0.01). FICE magnifying endoscopy better revealed mucosal structure of capillaries than staining magnifying endoscopy (P < 0.01), but there was not significant difference in revealing duct openings. FICE showed higher coincidence rate of diagnosis, higher sensitivity and specificity of the colorectal cancer than staining techniques (92.2% vs 81.0%, 95.3% vs 85.6%, 88.4% vs 75.6%, all P < 0.01).
CONCLUSION: FICE operates easily with higher coincidence rate of diagnosis and has a satisfactory clinical practical value in diagnosing colonic cancers.
- Citation: Huang LY, Liu YX, Wu CR, Cui J, Xu N, Song B, Yi LZ. Role of Fuji intelligent chromo endoscopy in observation of pit pattern and blood capillary form of colonic lesions. Shijie Huaren Xiaohua Zazhi 2008; 16(26): 2952-2958
- URL: https://www.wjgnet.com/1009-3079/full/v16/i26/2952.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i26.2952
大肠癌是临床常见的恶性肿瘤之一, 近年由于我国发病率明显提高, 早期发现和治疗大肠癌是提高生存率的关键[1-2]. 普通大肠镜仅能观察病变的某些特征, 对病变腺管开口形态及微细血管观察受限. 染色及放大内镜的普及, 使内镜下鉴别肿瘤及非肿瘤成为指导临床治疗与否的重要标准[3-5]. 但染色内镜麻烦耗时, 操作略繁琐, 临床技术要求较高. 新近开发的内镜智能分光比色技术(Fuji intelligent chromo endoscopy, FICE), 采用纳米分光技术, 模拟色素内镜, 可以再现黏膜表层细微结构及毛细血管走向. 本研究的目的是探讨FICE放大内镜鉴别大肠肿瘤及非肿瘤性病变的价值.
收集2007-03/2008-05在我院行结肠镜检查发现大肠新生物及息肉样病变者共245例纳入本研究. 所有患者均应用Fujinon EPX4400主机, EC-590ZWM型放大变焦结肠镜(日本富士能公司), 主机拥有10种波长组合的FICE系统. 染色剂: 0.4%靛胭脂.
1.2.1 排除标准: (1)炎症性肠病患者; (2)家族大肠腺瘤病患者; (3)不能忍受内镜痛苦而未送达回盲部的患者.
1.2.2 术前准备: 所有患者术前6 h服用和爽(聚乙二醇电解质散)行肠道准备. 进镜前肌注20 mg解痉灵.
1.2.3 操作步骤: (1)常规模式进镜至回盲部, 后退镜观察, 发现黏膜异常后, 放大至40-100倍观察腺管开口类型, 评价是否为肿瘤, 并记录大体形态; (2)通过面板开关转换至FICE模式, 应用预先设定的10种RGB波长组合分别观察黏膜, 直至图像显示最为清晰满意, 记录此种波长组合, 后放大至40-100倍观察病灶腺管开口及毛细血管形态, 进行腺管开口分型; (3)用0.4%靛胭脂对病灶进行染色, 观察病灶的大体范围及表面形态, 后放大至40-100倍观察腺管开口形态, 进行腺管开口分型; (4)对病灶多点活检、病理切片、HE染色, 由一位有经验的病理科医生进行病理组织学诊断. 腺管开口类型采用工藤进英及Nagata的分型方法[6-7], 其中, Ⅴ型亚分类: (1)ⅤA型(不定型)腺管开口形态为Ⅲs、ⅢL和Ⅳ型腺管开口形态混杂; (2)ⅤN型(非结构)腺管开口形态为无腺管开口形态或局部见少量腺管开口形态, 但无法明确腺管开口形态性质.
1.2.4 结果判定: 所有病变均行内镜下活检, 病变的诊断最终以病理组织学诊断为金标准. 病理组织学诊断炎性及增生性病灶为非肿瘤病变, 腺瘤及癌为肿瘤性病变. 内镜下判定腺管开口分型Ⅰ型、Ⅱ型的病灶为非肿瘤性病变, ⅢL型、Ⅳ型、Ⅴ型的病灶为肿瘤性病变, 最后与病理组织学相比较. 腺管开口形态及毛细血管结构图像清晰度按下列进行评分: 看不清: 1分; 模糊可辨: 2分; 较清晰: 3分; 非常清晰: 4分; 并将结果进行分析.
统计学处理 采用SPSS10.0统计软件进行分析, 统计方法采用卡方检验及秩和检验, P<0.05表示有统计学意义.
研究期间共245例患者入选, 其中男性138例, 女性107例, 年龄20-86(平均58.3±11.5)岁. 245例患者共发现480个病灶, 其中炎性或增生性息肉257例, 腺瘤196例, 癌22例, 侧向发育型肿瘤5例.
常规放大内镜下发现病变较FICE放大模式发现病变差异有统计学意义(90.0% vs 98.8%, P<0.01), 染色放大后发现病变为100%. 22个癌灶中, 6个早期癌, 16个进展期癌. 进展期癌常规放大内镜、FICE放大内镜及染色放大内镜均发现病变. 病变的检出及漏诊情况(表1).
| 肿瘤大体形态 | 常规放大内镜 | FICE放大内镜 | 染色放大内镜 | 合计 | |||
| 发现 | 漏诊 | 发现 | 漏诊 | 发现 | 漏诊 | ||
| 隆起型 | 324 | 0 | 324 | 0 | 324 | 0 | 324 |
| 平坦型 | |||||||
| Ⅱa | 79 | 19 | 117 | 1 | 112 | 0 | 156 |
| Ⅱb | 2 | 8 | 9 | 3 | 8 | 0 | |
| Ⅱc | 27 | 21 | 24 | 2 | 36 | 0 | |
| 合计 | 432 | 48 | 474 | 6 | 480 | 0 | |
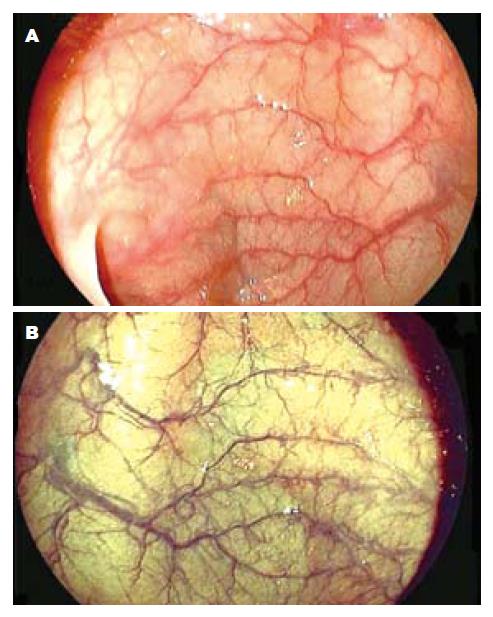
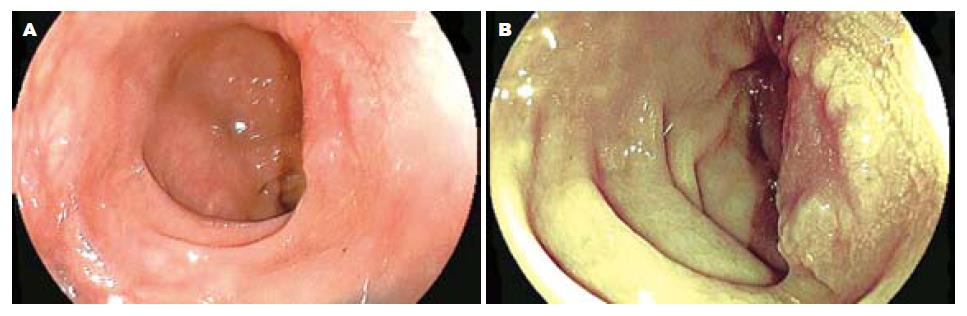
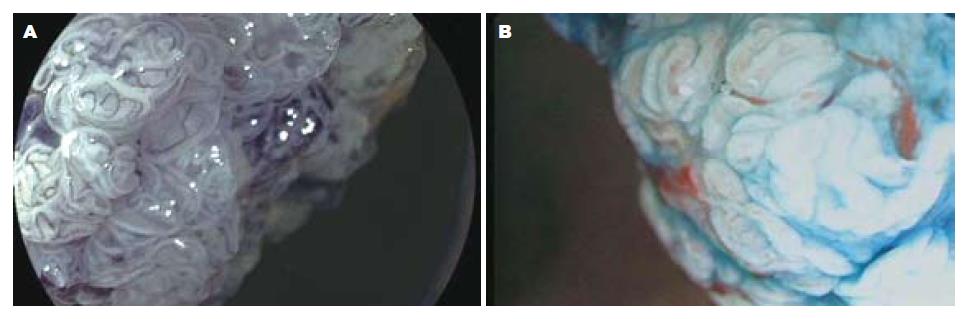
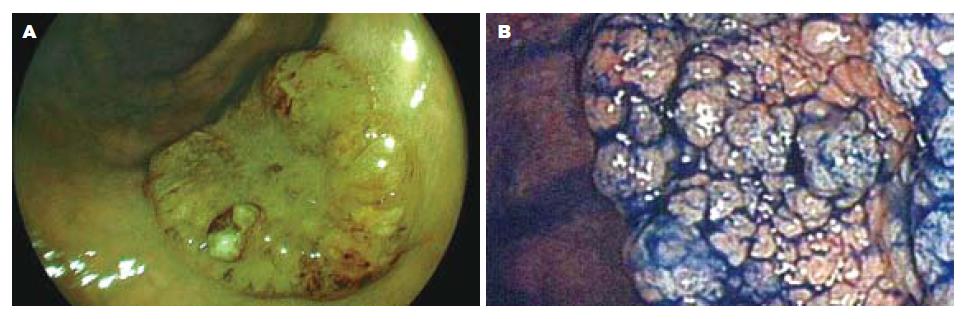
染色放大内镜发现平坦型病变中平坦隆起型Ⅱa 112个, 表面平坦型Ⅱb 8个, 平坦凹陷型Ⅱc 36个. FICE放大模式发现Ⅱa 117个, Ⅱb 9个, Ⅱc 24个. 常规放大内镜发现Ⅱa 79个, Ⅱb 2个, Ⅱc 27个. 图1示正常大肠黏膜常规内镜及FICE内镜图像比较, 图2示侧向发育型肿瘤大体形态的常规内镜及FICE内镜图像比较.
2.3.1 FICE放大内镜与染色放大内镜图像清晰度比较: FICE放大内镜对腺管开口分型的诊断优于常规放大内镜, FICE放大内镜与染色放大内镜图像相比, 能更清晰显示黏膜毛细血管形态结构(P<0.01), 在显示腺管开口方面两者无统计学意义(表2).
| 观察项目 | 1分(个) | 2分(个) | 3分(个) | 4分(个) | 总分 | P值 |
| 腺管开口形态 | ||||||
| FICE放大 | 0 | 0 | 248 | 226 | 1648 | P>0.05 |
| 染色放大 | 0 | 0 | 169 | 311 | 1751 | |
| 毛细血管结构 | ||||||
| FICE放大 | 0 | 0 | 251 | 223 | 1645 | P<0.01 |
| 染色放大 | 36 | 417 | 18 | 9 | 960 |
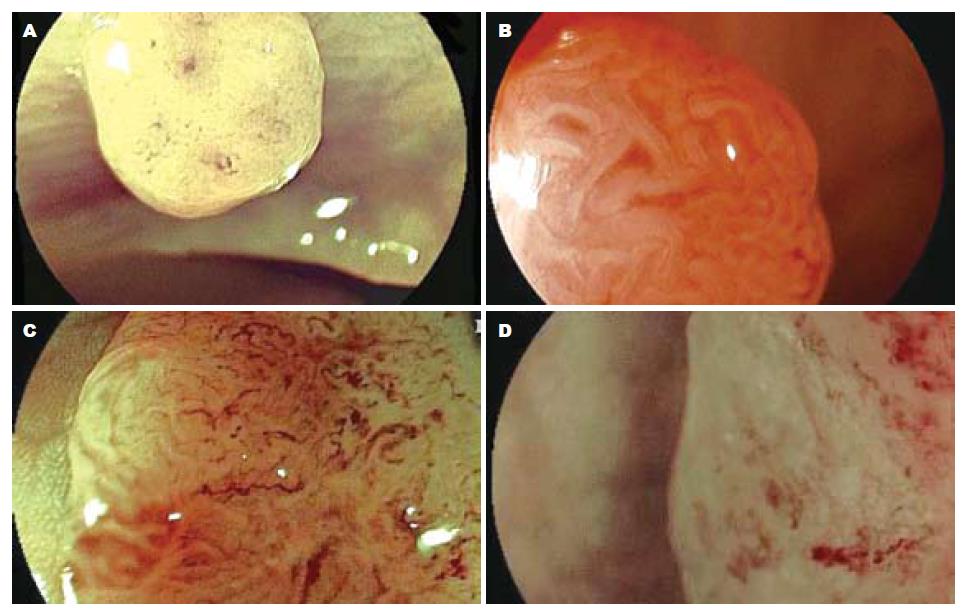
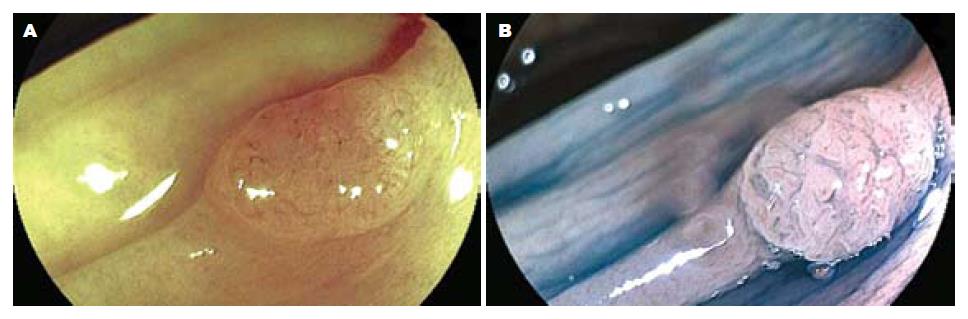
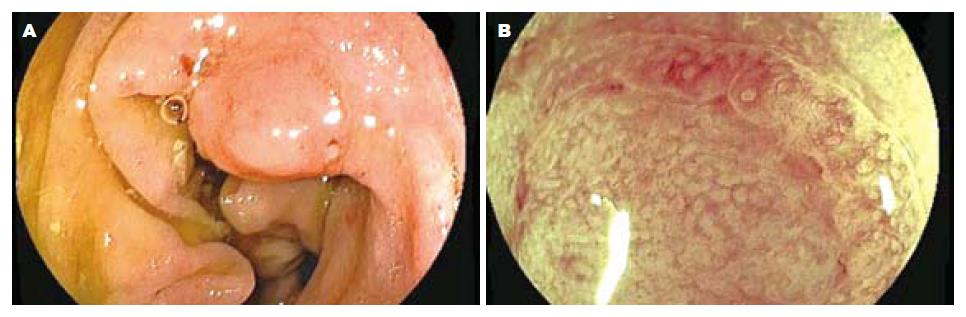
2.3.2 FICE放大内镜、染色放大内镜对病变腺管开口分型及毛细血管形态观察: 染色放大内镜下腺管开口分型判定为Ⅰ型28个; Ⅱ型235个, 即内镜下诊断为非肿瘤性病变263个; ⅢL型140个; Ⅳ型46个, ⅤA型8个, ⅤN型23个, 即内镜下诊断为肿瘤性病变217个. FICE放大模式下Ⅰ型和Ⅱ型腺管开口内镜下诊断为增生性息肉或炎性息肉, 无肿瘤性血管, 与周围黏膜颜色相似, 无树枝状血管网, 少数炎症较重的息肉可呈现点状或细网状毛细血管. FICE放大模式下ⅢL型、Ⅳ型、Ⅴ型腺管开口内镜下诊断为肿瘤样病变, 可见肿瘤血管, 有树枝状、网状浅色毛细血管网, 部分Ⅳ型、Ⅴ型腺管开口病变可见局部毛细血管形态不规则, 扭曲变形, 提示腺瘤癌变可能. FICE放大模式下ⅤN型腺管开口者内镜诊断为癌, 可见肿瘤血管, 直径粗大, 有树枝状深色毛细血管网, 伴有血管网增粗、扭曲、变形、结构紊乱及破坏. FICE放大模式下Ⅰ型和Ⅱ型腺管开口者无树枝状毛细血管或少许浅色毛细血管结构, 共258个病变, 判定为非肿瘤性病变; ⅢL型、Ⅳ型、Ⅴ型腺管开口且有肿瘤血管病变共216个, 判定为肿瘤性病变. FICE放大模式下大肠病变诊断与病理组织学的符合关系见表3. 图3示FICE放大模式下腺管开口分型及毛细血管形态. 图4-6示肿瘤性病变FICE放大内镜与染色放大内镜图像比较. 图7示FICE放大模式下早期癌腺管开口形态及毛细血管结构, 他与周围黏膜界限清晰可辨.
| 腺管开口形态 | n | 毛细血管结构 | n | 病理组织学 | ||
| 炎性或增生性息肉 | 腺瘤 | 癌 | ||||
| Ⅰ型、Ⅱ型 | 258 | 无毛细血管网 | 258 | 246 | 12 | 0 |
| ⅢL型 | 139 | 25 | 114 | 0 | ||
| Ⅳ型 | 56 | 有肿瘤血管、 | 216 | 0 | 55 | 1 |
| ⅤA型 | 6 | 毛细血管网 | 0 | 0 | 5 | |
| ⅤN型 | 15 | 0 | 0 | 16 | ||
| 合计 | 474 | 474 | 271 | 181 | 22 | |
FICE放大内镜对大肠肿瘤性病变诊断的符合率为92.2%(437/474)、敏感性95.3%(246/258)、特异性88.4%(191/216), 染色放大内镜诊断符合率81.0%(389/480)、敏感性85.6%(225/263)、特异性75.6%(164/217). FICE放大内镜对大肠肿瘤性病变的诊断符合率、敏感性、特异性与染色内镜相比有统计学意义(P<0.01), 优于染色放大内镜(表4).
| 病理诊断 | n | FICE放大内镜 | 染色放大内镜 | ||
| 非肿瘤性 | 肿瘤性 | 非肿瘤性 | 肿瘤性 | ||
| 非肿瘤性 | 257 | 246 | 25 | 225 | 53 |
| 肿瘤性 | 223 | 12 | 191 | 38 | 164 |
| 合计 | 480 | 258 | 216 | 263 | 217 |
大肠癌是我国常见的肿瘤之一, 近年来其发病率明显提高, 成为胃肠道肿瘤中导致死亡的主要原因. 因此, 如何早期检测和处理大肠癌已成为医学界亟需解决的问题之一[8-15]. 结肠镜检查是发现早期大肠癌最重要的方法之一, 但常规内镜技术难以发现大肠平坦型病变或凹陷型病变. 近年来, 染色内镜和放大内镜技术开始应用于临床, 明显提高了早期大肠癌的检出率. 对染色黏膜进行大体观察后再采用放大肠镜对大肠腺管开口形态进行仔细观察, 大致判断是否为肿瘤性病变以及病变的浸润程度[16-21].
FICE是一项崭新的内镜诊断工具, 他是利用光谱分析技术原理而成. 光谱分析技术将普通的内镜图像经处理、分析产生一副特定波长的分光图像. 这种分光图像的单一波长被赋予红色(R)、或绿色(G)、或蓝色(B). 不同组合的RGB分光图像再经处理产生FICE特定图像. 可以在400-600 nm之间以5 nm间隔任意选择波长, 不同组合的RGB可呈现不同的颜色及不同层次的深度, 有利于观察黏膜表层结构、毛细血管形态结构, 反映黏膜微细凹凸变化, 增强黏膜表面血管和其他结构的可见度. FICE技术成像系统具有普通电子内镜和FICE两种工作模式, 可用面板按钮、内镜开关或脚踏开关来控制, 操作简单[22-28].
大肠黏膜主要由黏膜和血管组成, 黏膜表面的微细结构及毛细血管结构对诊断病变性质十分重要. 应用染色内镜联合放大内镜根据腺管开口分型, 对肿瘤性病变的诊断与组织病理学诊断的一致性达90%[29-31]. FICE放大模式下可更清晰显示腺管开口形态及毛细血管结构, 有助于提高病变诊断的准确率. 本研究通过FICE及染色内镜对病变的诊断与病理组织学相比较, 结果提示FICE放大内镜对肿瘤性病变判断的符合率为92.2%(437/474), 染色放大内镜符合率为81.0%(389/480), 前者高于后者(P<0.01).
本研究表明FICE在对腺管开口分型观察方面明显优于常规内镜, 与染色内镜相似. FICE放大内镜观察病变毛细血管网结构比染色内镜有更高的优视率. 我们选用FICE R = 540±20 nm, G = 460±25 nm, B = 415±15 nm波长组合, 着重显示黏膜表面结构, 与放大内镜结合, 清晰显示黏膜腺管开口形态. 由于血红蛋白吸收波长在415 nm左右, 更可观察到浅表毛细血管形态. FICE模式下肿瘤性血管较非肿瘤性血管颜色更深, 直径粗大, 伴有血管扭曲变形, 结构紊乱, 部分血管网破坏. 某些息肉或腺瘤表面部分毛细血管网迂曲变形或突然出现粗大扭曲的血管, 提示息肉或腺瘤可能发生癌变, 应高度重视. 染色内镜联合放大虽能清晰观察腺管开口, 但观察毛细血管结构尚有缺陷, 且操作耗时、繁琐, 其应用受到一定限制. FICE可以避免以上缺点, 操作简便, 可瞬间转换, 且增加图像清晰度.
总之, FICE是一种新型内镜诊断技术, 主要着眼于观察消化道黏膜表面的微细腺管形态及微血管形态, 使普通内镜条件下不能识别的异常组织变得清晰可辨, 利于指导靶向活检, 提高诊断肿瘤性病变的准确性.
大肠癌是临床常见的恶性肿瘤之一, 早期发现和治疗是提高生存率的关键. 普通大肠镜对病变腺管开口形态及微细血管观察受限. 新近开发的内镜智能分光比色技术(FICE), 采用纳米分光技术, 可以再现黏膜表层细微结构及毛细血管走向, 有利于提高大肠癌的诊断.
王正康, 教授, 北京中日友好医院普外科
大肠癌是我国常见的肿瘤之一, 如何早期检测和处理大肠癌已成为医学界亟需解决的问题之一. 常规内镜技术难以发现大肠平坦型病变或凹陷型病变. 近年来, 染色内镜和放大内镜技术开始应用于临床, 显著提高了早期大肠癌的检出率.
大肠黏膜隆起性病变或管腔内突起性病变通常称为大肠息肉, 其中80%以上是腺瘤性或增生性息肉. 大肠息肉分为非瘤性息肉和瘤性息肉, 一般认为, 非瘤性息肉不会发生癌变, 临床上可以对其定期结肠镜随诊而不需要特殊处理, 腺瘤性息肉则认为是大肠癌的癌前病变, 癌变率较高, 应该选择切除治疗. 文献荟萃分析认为腺瘤性息肉的患病率与大肠癌发病的危险性呈平行关系, 因此鉴别瘤性息肉与非瘤性息肉对于提高早期大肠癌的检出率和提高大肠癌患者的生存率具有非常重要的临床意义.
FICE放大模式下可更清晰显示腺管开口形态及毛细血管结构, 有助于提高病变诊断的准确率. FICE放大内镜对肿瘤性病变判断的符合率高于染色放大内镜.
FICE是一种新型内镜诊断技术, 主要着眼于观察消化道黏膜表面的微细腺管形态及微血管形态, 使普通内镜条件下不能识别的异常组织变得清晰可辨, 有利于指导靶向活检, 提高诊断肿瘤性病变的准确性.
大肠侧向发育型肿瘤(LST): 指起源于大肠黏膜的一类平坦隆起型病变, 这类病变极少向肠壁深层垂直侵犯, 而主要沿黏膜表面呈侧向浅表扩散, 故称之为侧向发育型肿瘤.
本文探讨了FICE技术诊断大肠肿瘤的价值, 文题新颖、实用性较好, 有一定的学术价值.
编辑: 李军亮 电编: 何基才
| 1. | Tanaka S, Haruma K, Ito M, Nagata S, Oh-e H, Hirota Y, Kunihiro M, Kitadai Y, Yosihara M, Sumii K. Detailed colonoscopy for detecting early superficial carcinoma: recent developments. J Gastroenterol. 2000;35 Suppl 12:121-125. [PubMed] [DOI] |
| 2. | Farrar WD, Sawhney MS, Nelson DB, Lederle FA, Bond JH. Colorectal cancers found after a complete colonoscopy. Clin Gastroenterol Hepatol. 2006;4:1259-1264. [PubMed] [DOI] |
| 3. | Konishi K, Kaneko K, Kurahashi T, Yamamoto T, Kushima M, Kanda A, Tajiri H, Mitamura K. A comparison of magnifying and nonmagnifying colonoscopy for diagnosis of colorectal polyps: A prospective study. Gastrointest Endosc. 2003;57:48-53. [PubMed] [DOI] |
| 4. | Liu HH, Kudo SE, Juch JP. Pit pattern analysis by magnifying chromoendoscopy for the diagnosis of colorectal polyps. J Formos Med Assoc. 2003;102:178-182. [PubMed] |
| 5. | Kato S, Fu KI, Sano Y, Fujii T, Saito Y, Matsuda T, Koba I, Yoshida S, Fujimori T. Magnifying colonoscopy as a non-biopsy technique for differential diagnosis of non-neoplastic and neoplastic lesions. World J Gastroenterol. 2006;12:1416-1420. [PubMed] |
| 6. | Kudo S, Tamura S, Nakajima T, Yamano H, Kusaka H, Watanabe H. Diagnosis of colorectal tumorous lesions by magnifying endoscopy. Gastrointest Endosc. 1996;44:8-14. [PubMed] [DOI] |
| 7. | Nagata S, Tanaka S, Haruma K, Yoshihara M, Sumii K, Kajiyama G, Shimamoto F. Pit pattern diagnosis of early colorectal carcinoma by magnifying colonoscopy: clinical and histological implications. Int J Oncol. 2000;16:927-934. [PubMed] |
| 8. | Hurlstone DP, Kiesslich R, Thomson M, Atkinson R, Cross SS. Confocal chromoscopic endomicroscopy is superior to chromoscopy alone for the detection and characterisation of intraepithelial neoplasia in chronic ulcerative colitis. Gut. 2008;57:196-204. [PubMed] [DOI] |
| 9. | Kanao H, Tanaka S, Oka S, Kaneko I, Yoshida S, Arihiro K, Yoshihara M, Chayama K. Clinical significance of type V(I) pit pattern subclassification in determining the depth of invasion of colorectal neoplasms. World J Gastroenterol. 2008;14:211-217. [PubMed] [DOI] |
| 10. | Tischendorf JJ, Wasmuth HE, Koch A, Hecker H, Trautwein C, Winograd R. Value of magnifying chromoendoscopy and narrow band imaging (NBI) in classifying colorectal polyps: a prospective controlled study. Endoscopy. 2007;39:1092-1096. [PubMed] [DOI] |
| 11. | Emura F, Saito Y, Taniguchi M, Fujii T, Tagawa K, Yamakado M. Further validation of magnifying chromocolonoscopy for differentiating colorectal neoplastic polyps in a health screening center. J Gastroenterol Hepatol. 2007;22:1722-1727. [PubMed] [DOI] |
| 12. | Hurlstone DP, Sanders DS. Recent advances in chromoscopic colonoscopy and endomicroscopy. Curr Gastroenterol Rep. 2006;8:409-415. [PubMed] [DOI] |
| 13. | Hurlstone DP, George R, Brown S. Novel clinical in vivo roles for indigo carmine: high-magnification chromoscopic colonoscopy. Biotech Histochem. 2007;82:57-71. [PubMed] [DOI] |
| 14. | Rex DK. Maximizing detection of adenomas and cancers during colonoscopy. Am J Gastroenterol. 2006;101:2866-2877. [PubMed] [DOI] |
| 15. | Kiesslich R, Neurath MF. Chromo- and magnifying endoscopy for colorectal lesions. Eur J Gastroenterol Hepatol. 2005;17:793-801. [PubMed] [DOI] |
| 16. | Fu KI, Sano Y, Kato S, Fujii T, Nagashima F, Yoshino T, Okuno T, Yoshida S, Fujimori T. Chromoendoscopy using indigo carmine dye spraying with magnifying observation is the most reliable method for differential diagnosis between non-neoplastic and neoplastic colorectal lesions: a prospective study. Endoscopy. 2004;36:1089-1093. [PubMed] [DOI] |
| 17. | Averbach M, Zanoni EC, Corrêa PA, Rossini G, Paccos JL, Alencar ML, Câmara-Lopes LH, Cutait R. [High resolution chromoendoscopy in the differential diagnosis of neoplastic and non-neoplastic polyps]. Arq Gastroenterol. 2003;40:99-103. [PubMed] [DOI] |
| 18. | Hurlstone DP, Cross SS, Adam I, Shorthouse AJ, Brown S, Sanders DS, Lobo AJ. Efficacy of high magnification chromoscopic colonoscopy for the diagnosis of neoplasia in flat and depressed lesions of the colorectum: a prospective analysis. Gut. 2004;53:284-290. [PubMed] [DOI] |
| 19. | Hurlstone DP, Cross SS, Brown S, Sanders DS, Lobo AJ. A prospective evaluation of high-magnification chromoscopic colonoscopy in predicting completeness of EMR. Gastrointest Endosc. 2004;59:642-650. [PubMed] [DOI] |
| 20. | Jiang B, Zhi FC, Liu SD, Han YJ, Pan DS, Zhou D, Wan TM, Zhou DY. [Pit pattern and endoscopic mucosal resection in diagnosis and treatment of colorectal tumors]. Zhonghua Yixue Zazhi. 2003;83:294-297. [PubMed] |
| 21. | Bianco MA, Rotondano G, Marmo R, Garofano ML, Piscopo R, de Gregorio A, Baron L, Orsini L, Cipolletta L. Predictive value of magnification chromoendoscopy for diagnosing invasive neoplasia in nonpolypoid colorectal lesions and stratifying patients for endoscopic resection or surgery. Endoscopy. 2006;38:470-476. [PubMed] [DOI] |
| 22. | Sung JJ, Lau JY, Young GP, Sano Y, Chiu HM, Byeon JS, Yeoh KG, Goh KL, Sollano J, Rerknimitr R. Asia Pacific consensus recommendations for colorectal cancer screening. Gut. 2008;57:1166-1176. [PubMed] [DOI] |
| 23. | Birkner B. Quality assurance for screening colonoscopies. Z Gastroenterol. 2008;46 Suppl 1:S43-S44. [PubMed] [DOI] |
| 24. | Teichmann J, Weickert U, Riemann JF. Gastric fundic gland polyps and colonic polyps - is there a link, really? Eur J Med Res. 2008;13:192-195. [PubMed] |
| 25. | Odze R. A Balancing view: Pathologist-clinician interaction is essential. Am J Gastroenterol. 2008;103:1331-1333. [PubMed] [DOI] |
| 26. | Appelman HD. Con: High-grade dysplasia and villous features should not be part of the routine diagnosis of colorectal adenomas. Am J Gastroenterol. 2008;103:1329-1331. [PubMed] [DOI] |
| 27. | Rex DK, Goldblum JR. Pro: Villous elements and high-grade dysplasia help guide post-polypectomy colonoscopic surveillance. Am J Gastroenterol. 2008;103:1327-1329. [PubMed] [DOI] |
| 28. | Triadafilopoulos G, Li J. A pilot study to assess the safety and efficacy of the Third Eye retrograde auxiliary imaging system during colonoscopy. Endoscopy. 2008;40:478-482. [PubMed] [DOI] |
| 29. | van Rossum LG, van Rijn AF, Laheij RJ, van Oijen MG, Fockens P, van Krieken HH, Verbeek AL, Jansen JB, Dekker E. Random comparison of guaiac and immunochemical fecal occult blood tests for colorectal cancer in a screening population. Gastroenterology. 2008;135:82-90. [PubMed] [DOI] |
| 30. | Choi DH, Park JW, Kim BN, Han KS, Hong CW, Sohn DK, Lim SB, Choi HS, Jeong SY. Colonoscopy in situs inversus totalis patients. Am J Gastroenterol. 2008;103:1311-1312. [PubMed] [DOI] |
| 31. | Tan D, Ross WA. Colorectal polyps: clinical significance of endoscopic and pathologic correlation. Am J Clin Pathol. 2008;129:659-660; author reply 660. [PubMed] |