修回日期: 2008-08-21
接受日期: 2008-08-26
在线出版日期: 2008-09-18
目的: 构建靶向髓细胞白血病基因-1(myeloid cell leukemia-1, mcl-1)的shRNA的真核表达质粒, 并筛选出沉默mcl-1基因效果最明显的shRNA表达质粒.
方法: 设计3对针对mcl-1基因不同位点的shRNA片段, 构建携带此shRNA片段的真核表达质粒(shRNA1-3)并行酶切鉴定和测序分析. 然后通过脂质体将重组质粒转染到肝癌细胞株HepG2中, 48 h后测定转染率, 并分别采用RT-PCR及Western blot检测mcl-1 mRNA和蛋白表达情况.
结果: 重组质粒经酶切鉴定与测序证实构建成功. 质粒在HepG2细胞中的转染率约为64%. shRNA1-3导入HepG2细胞48 h后, mcl-1 mRNA水平和蛋白水平均明显低于空白对照组和阴性对照组(0.61±0.02, 0.56±0.02, 0.46±0.01 vs 0.97±0.01, 0.95±0.00; 0.53±0.01, 0.48±0.03, 0.36±0.01 vs 0.90±0.03, 0.88±0.01, 均P<0.01). 与shRNA1和shRNA2相比, shRNA3对mcl-1 mRNA和蛋白的抑制作用均最强(52.6% vs 36.3%, 42.9%; 63.2% vs 41.5%, 49.6%, 均P<0.01).
结论: 成功构建并筛选出的靶向mcl-1的shRNA真核表达质粒对肝癌细胞HepG2内的mcl-1表达具有明显抑制作用.
引文著录: 李银鹏, 朱惠明, 侯晓华. 靶向mcl-1基因的shRNA真核表达质粒的构建与筛选. 世界华人消化杂志 2008; 16(26): 2940-2945
Revised: August 21, 2008
Accepted: August 26, 2008
Published online: September 18, 2008
AIM: To construct eukaryotic expression plasmids containing short hairpin RNA (shRNA) that target at the myeloid cell leukemia-1 (mcl-1) gene, and to select the plasmids that silence mcl-1 gene most efficiently.
METHODS: Three pairs of shRNAs that target at mcl-1 gene were designed. The eukaryotic expression plasmids (named shRNA1-3) were constructed and identified using restriction enzyme analysis and sequencing analysis. The plasmids were then transfected into HepG2 cells via liposome. The transfection rate of recombinant plasmids was measured 48 h after transfection, and mcl-1 mRNA and protein expression was determined using reverse transcriptase-polymerase chain reaction and Western blotting.
RESULTS: The expression plasmids were confirmed by restriction enzyme analysis and sequencing analysis. The transfection rate of recombinant plasmids in HepG2 cells was approximately 64%. Forty-eight hours after transfection, the mcl-1 mRNA and protein levels of shRNA1-3 group (mRNA: 0.61 ± 0.02, 0.56 ± 0.02 and 0.46 ± 0.01, protein: 0.53 ± 0.01, 0.48 ± 0.03 and 0.36 ± 0.01, respectively) were significantly lower than that of the blank control group (mRNA: 0.61 ± 0.02, 0.56 ± 0.02, 0.46 ± 0.01 vs 0.97 ± 0.01; protein: 0.53 ± 0.01, 0.48 ± 0.03, 0.36 ± 0.01 vs 0.90 ± 0.03, all P < 0.01) and that of the negative control group (mRNA: 0.95 ± 0.00, protein: 0.88 ± 0.01, all P < 0.01). Compared with shRNA1 and shRNA2, shRNA3 had the strongest inhibitory effect on mRNA (52.6% vs 36.3%, 42.9% both P < 0.01) and protein level of Mcl-1 (63.2% vs 41.5%, 49.6%, both P < 0.01).
CONCLUSION: The shRNA eukaryotic expression plasmid targeting at mcl-1 gene is constructed and selected successfully. The mcl-1 mRNA and protein expression was suppressed significantly by this given plasmid.
- Citation: Li YP, Zhu HM, Hou XH. Construction and screening of eukaryotic expression plasmids containing short hairpin RNA targeting at the myeloid cell leukemia-1 gene. Shijie Huaren Xiaohua Zazhi 2008; 16(26): 2940-2945
- URL: https://www.wjgnet.com/1009-3079/full/v16/i26/2940.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i26.2940
细胞凋亡是细胞的正常生理过程, 机体通过细胞凋亡清除老化及受损严重的细胞, 从而维持机体的正常机能. 细胞的凋亡受阻与肿瘤的发生密切相关[1]. 髓细胞白血病基因-1(myeloid cell leukemin-1, mcl-1)是细胞内重要的凋亡调节因子, 具有促进细胞生存, 阻止细胞凋亡的作用[2]. 研究表明, mcl-1在肝癌组织中高表达, 而在癌旁组织中呈低表达状态[3-4], 并与肝癌细胞对化疗药物的耐药相关[5]. 为研究下调mcl-1水平在肝癌治疗中的作用, 本研究构建了靶向mcl-1基因的短发夹状RNA(short hairpin RNA, shRNA)真核表达质粒, 并观察其对HepG2细胞mcl-1表达的抑制作用.
mcl-1 mAb为Promab公司产品; Tubulin pAb购自碧云天生物技术研究所; 辣根过氧化物酶标记的羊抗鼠IgG为武汉三鹰生物技术有限公司产品; PVDF膜为Millipore产品; Supersignal化学发光试剂为Pierce产品; Lipofectamine 2000为Invitrogen公司产品; DMEM高糖培养基、标准小牛血清为Hyclone公司产品, pgenesil-1.1载体为武汉晶赛生物公司产品. 人肝癌细胞株HepG2购自中科院上海细胞所, 在含100 mL/L胎牛血清的DMEM完全培养基中培养, 温度为37 ℃, CO2浓度为50 mL/L.
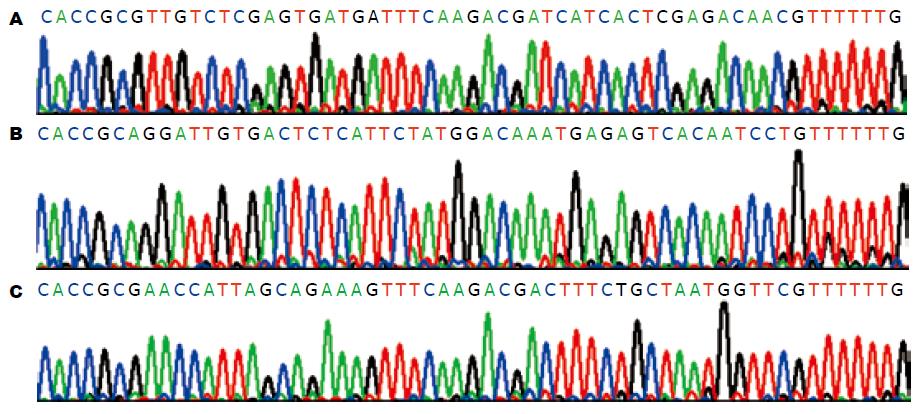
1.2.1 mcl-1 shRNA重组质粒的构建: 根据GenBank中mcl-1 mRNA(NM_021960.3, GI: 33519459)序列, 设计3个长度为19 nt的干扰序列: mcl-1.1: 5'-CGTTGTCTCGAGTGATGAT-3'; mcl-1.2: 5'-CAGGATTGTGACTCTCATT-3'; mcl-1.3: 5'-CGAACCATTAGCAGAAAGT-3', 分别靶向mcl-1基因的864-882、916-934和991-1009位碱基, 根据干扰序列设计并合成编码shRNA序列的DNA单链(表1). 将正义与反义寡核苷酸单链进行退火连接, 用T4 DNA连接酶将双链寡核苷酸与pgenesil-1.1线性载体(含hU6启动子, 其末端分别为GTGG和GAGCT)定向连接, 分别命名为shRNA1、shRNA2、shRNA3. 连接后转化大肠杆菌DH5α, 接种在卡拉霉素抗性LB平板上, 37 ℃培养过夜, 从培养皿中挑取单克隆菌落接种于卡拉霉素抗性的LB培养液中, 37 ℃恒温摇床培养过夜. 用质粒小量抽提试剂盒提取质粒, 所提质粒用SacⅠ做酶切鉴定, 选择酶切鉴定重组成功的质粒送上海英骏公司行DNA测序. 通用阴性对照质粒pgenesil-1.1HK为武汉晶赛生物公司产品, 其编码的siRNA为GACTTCATAAGGCGCATGC, 该序列经过BLAST比较, 与人、鼠基因库无明显同源.
| 编号 | 序列 | |
| shRNA1 | A | 5'-CACCGCGTTGTCTCGAGTGATGATTTCAAGACGATCATCACTCGAGACAACGTTTTTTG-3' |
| B | 5'-AGCTCAAAAAACGTTGTCTCGAGTGATGATCGTCTTGAAATCATCACTCGAGACAACGC-3' | |
| shRNA2 | A | 5'-CACCGCAGGATTGTGACTCTCATTCTATGGACAAATGAGAGTCACAATCCTGTTTTTTG-3' |
| B | 5'-AGCTCAAAAAACAGGATTGTGACTCTCATTTGTCCATAGAATGAGAGTCACAATCCTGC-3' | |
| shRNA3 | A | 5'-CACCGCGAACCATTAGCAGAAAGTTTCAAGACGACTTTCTGCTAATGGTTCGTTTTTTG-3' |
| B | 5'-AGCTCAAAAAACGAACCATTAGCAGAAAGTCGTCTTGAAACTTTCTGCTAATGGTTCGC-3' |
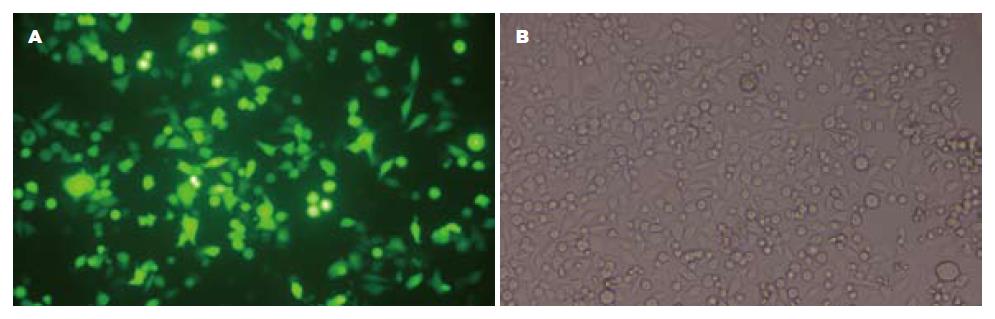
1.2.2 细胞转染: HepG2细胞接种于6孔板内, 培养24 h后将培养基换为无血清无双抗的DMEM培养基, 按照质粒与脂质体比例为1:3制备脂质体Lipofectamine 2000及质粒复合物, 转染细胞时逐滴加入并轻晃混匀, 培养6 h后换为含完全培养基. 重组质粒为试验组, HK为阴性对照, 另设空白对照(转染时只加入等量PBS). 转染48 h后, 荧光显微镜下观察10个视野, 每个视野下计数100个细胞中绿色荧光阳性的细胞, 计算细胞转染率.
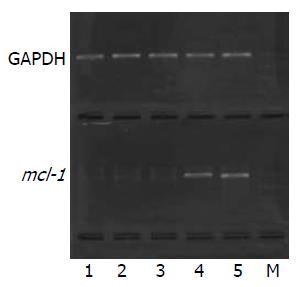
1.2.3 定量RT-PCR检测mcl-1 mRNA: 转染48 h后收集细胞, 提取细胞总RNA, 逆转录得到cDNA后行PCR反应. mcl-1引物:上游引物5'-CTTTTGGCTACGGAGAAGGAG-3', 下游引物5'-GAGTCTGGCGTGAGGGTG-3', 扩增片段大小为116 bp. 以三磷酸甘油醛脱氢酶(GAPDH)为内参, 引物为: 上游引物5'-CATGAGAAGTATGACAACAGCCT-3', 下游引物: 5'-AGTCCTTCCACGATACCAAAGT-3', 扩增片段大小为113 bp. 反应参数设置: 95 ℃变性5 min, 然后开始PCR循环: 95 ℃ 20 s→60 ℃ 20 s→72 ℃ 15 s, 共35个循环, 72 ℃延长3 min, 4 ℃保存. 取10 μL PCR产物在20 g/L琼脂糖凝胶中电泳, 用DL2000 Marker作DNA分子量标准带, 溴乙锭染色, 紫外透射仪上观察并照相. 如出现116 bp的电泳带, 则为mcl-1阳性. 在凝胶成像系统中测出各目的条带吸光度值, 结果以各组mcl-1和自身内参GAPDH吸光度值的比值来反映其相对含量.
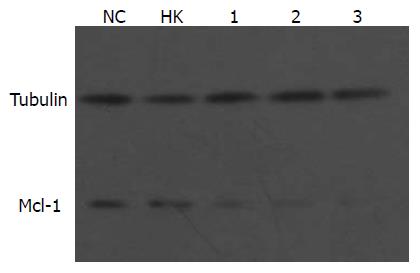
1.2.4 Western blot法检测Mcl-1蛋白的表达: 以Tubulin为内参. 转染48 h后收集细胞提取总蛋白. 将等量蛋白质样品点于SDS-聚丙烯酰胺凝胶小孔进行电泳. 电泳时积层胶90 V, 分离胶140 V. 电泳后于4 ℃, 95 mA恒流转膜2 h, 将转好的PVDF膜用1×TBST洗涤3次后, 将PVDF膜浸入封闭液(1×TBST+5%脱脂奶粉)中室温水平摇床缓慢孵育1 h, 然后根据预染marker所指示大小, 将内参条带与目的条带剪开, 分别加入一抗(1:1000鼠抗人MCL-1单抗, 1:3000鼠抗人Tubulin多抗), 4 ℃过夜, 取出膜用1×TBST洗膜5 min×4次, 加入羊抗鼠IgG/HRP二抗(1:2000)室温孵育1 h, 再用1×TBST洗膜5 min×4次后, 将PVDF膜置于SuperSignal化学发光试剂中反应2 min, 暗室中使X光片曝光, 常规方法显影定影. 结果用Mcl-1与内参Tubulin吸光度比值表示各样本Mcl-1的相对含量.
统计学处理 实验数据以mean±SD表示, 实验所得数据资料采用SPSS13.0统计分析软件进行单因素方差分析(ANOVA)比较各组间差异, P<0.05为有统计学意义.
在插入的目的基因片段里,我们设计了一个SacⅠ的酶切位点, 质粒Pgenesil-1.1本身还带有一个SacⅠ酶切位点, 如若插入正确, 质粒就能被SacⅠ酶切出一条约916 bp的DNA小带. 经酶切鉴定分析, 重组质粒shRNA1-3均符合设计要求, 经测序证实重组质粒中插入的shRNA片段的碱基序列与设计序列完全一致(图1).
重组质粒及阴性对照质粒中含有编码绿色荧光蛋白的基因, 转染48 h后荧光显微镜计数绿色荧光阳性的细胞, 并计算转染率(图2). shRNA1-3及HK转染组的转染率分别为64.00%±3.77%、64.20%±2.10%、63.70%±3.34%和62.5%±2.42%, 各组细胞间转染率无统计学差异(P>0.05).
转染重组质粒48 h后RT-PCR产物电泳结果显示各组内参GAPDH条带亮度相似, 各重组质粒转染组mcl-1 mRNA水平低于HK转染组和空白对照组(图3). 电泳条带吸光度值mcl-1/GAPDH shRNA1-3分别为0.61±0.02、0.56±0.02、0.46±0.01; HK组为0.95±0.00, 空白组为0.97±0.01, 3种重组质粒与HK和空白对照组相比均存在显著性差异(P<0.01), 表明3个重组质粒均不同程度下调mcl-1基因mRNA的表达, 其中以质粒shRNA3抑制效应最强,与质粒shRNA1和shRNA2相比, 有显著性差异(P<0.01). 质粒shRNA1-3对HepG2细胞中mcl-1 mRNA的抑制率分别为36.3%、42.9%和52.6%.
转染48 h后, 各组细胞Tubulin蛋白杂交条带亮度相似, 但Mcl-1条带亮度有明显差异(图4). 重组质粒组的Mcl-1蛋白条带亮度明显低于空白对照组和HK组, 其中质粒shRNA3转染组蛋白条带亮度最弱. Mcl-1/ Tubulin吸光度比值: 质粒shRNA1-3分别为0.53±0.01、0.48±0.03、0.36±0.01, HK组和空白组分别为0.88±0.01和0.90±0.03. 各重组质粒与HK组及空白对照组相比均存在显著性差异(P<0.01). 表明3个重组质粒均可不同程度下调Mcl-1蛋白水平, 尤以质粒shRNA3产生的效应最强, 与质粒shRNA1和shRNA2相比, 有显著性差异(P<0.01). 质粒shRNA1-3对Mcl-1蛋白表达的抑制率分别为41.5%、49.6%和63.2%.
mcl-1是B细胞淋巴瘤基因-2(B cell Lymphoma-2, bcl-2)家族成员之一, 与bcl-2在结构和功能上具有相似性, 主要参维持细胞线粒体膜稳定, 抑制细胞色素C的释放[2], 从而促进细胞的生存, 阻止细胞的凋亡. mcl-1的半衰期较短, 约40 min[6], 对细胞内外环境因素的变化能做出快速反应, 被认为是控制细胞凋亡的上游分子[7], 具有在包括细胞毒制剂作用等各种诱导细胞凋亡的条件下延长造血细胞的生存能力[8], 同时也是肿瘤细胞生存的关键因子[9]. mcl-1在多种肿瘤组织如多发性骨髓瘤[10]、非小细胞肺癌[11]、胆管癌[12-13]中均有过度表达, 高表达mcl-1的转基因鼠淋巴瘤的发生率明显增高[14], 提示mcl-1与肿瘤的发生密切相关. 此外, mcl-1与多发性骨髓瘤的复发[15]、慢性淋巴细胞白血病和结肠癌肝转移的耐药有关[16-17].
在肝癌细胞中, 下调mcl-1水平可增加肝癌细胞对各种化疗药物的敏感性[5], Sieghart et al采用反义技术抑制mcl-1基因的表达可直接促进肝癌细胞的凋亡[4], 而敲除mcl-1基因并不影响正常肝细胞的生长[18], 提示利用抑制mcl-1基因表达的方法治疗肝癌具有一定的肿瘤特异性, 是具有较好应用前景的肝癌治疗靶点.
为了下调肝癌细胞内的mcl-1水平, 本研究采用RNA干扰技术抑制mcl-1基因的表达. RNA干扰是通过siRNA(small interference RNA, siRNA)介导识别并靶向切割同源性靶mRNA分子而沉默靶基因表达, 是具有高度的序列专一性的转录后基因沉默. 由于siRNA在体内的半衰期短, 对基因的抑制作用较短暂[19], 为了能够较长时间抑制mcl-1基因, 我们采用构建shRNA真核表达质粒来沉默mcl-1基因, 即在体外将互补寡核苷酸链退火后连接到shRNA表达载体pgenesil-1.1中, 重组载体转染进细胞后通过RNA聚合酶Ⅲ启动子转录互补DNA序列,从而在体内合成shRNA, 合成的shRNA在Dicer酶的作用下环状区域断裂形成双链siRNA, 进而产生干扰效应. 由于shRNA表达载体可在体内持续产生siRNA, 因此, 可达到长时间沉默mcl-1基因的作用. 此外, 含有hU6启动子的载体对靶基因的沉默效果较好, 沉默时间较久[20], 同时以9个核苷酸序列环为发卡的shRNA产生的基因干扰效果最明显[21], 因此, 我们选用了在shRNA插入片段前有hU6启动子的载体pgenesil-1.1, 并在设计编码shRNA序列的DNA正义链和反义链中设计了有9个核苷酸序列的loop结构. 根据以上设计, 本研究所构建的三个shRNA重组质粒经酶切鉴定和DNA测序证实构建成功后, 转染HepG2细胞, 并利用半定量RT-PCR和Western blot检测重组质粒对mcl-1基因表达的抑制作用, 结果表明, 经重组质粒处理的HepG2细胞mcl-1 mRNA表达和蛋白水平明显低于阴性对照组和空白对照组, 说明所构建的重组质粒能特异性抑制mcl-1基因. 但本研究所构建的3个重组质粒对mcl-1的干扰效果并不一致, 其中以shRNA3抑制mcl-1 mRNA和蛋白表达的作用最为明显, 转染HepG2细胞48 h的抑制率分别达52.6%和63.2%. 这种针对同一基因的不同靶点而产生不同的干扰效果, 提示RNA干扰具有一定的靶点效应, 同时也说明利用RNA干扰进行相关研究前需首先要对干扰序列进行筛选. 本研究成功完成靶向mcl-1 shRNA重组质粒的构建和筛选工作, 为下一步研究mcl-1基因沉默对肝癌细胞的影响提供了坚实的实验基础.
mcl-1是bcl-2家族成员, 主要功能是促进细胞生存, 抑制细胞凋亡. mcl-1在肝癌等多种恶性肿瘤中表达明显增高, 是肿瘤发生和对化疗药物耐药的重要原因之一.
施瑞华, 教授, 南京医科大学第一附属医院消化科
通过抑制mcl-1基因异常表达而达到治疗肿瘤的目的是肿瘤基因治疗领域研究的热点.
消除mcl-1是紫外线照射诱导细胞凋亡的前提, 采用反义核酸技术抑制mcl-1基因能增加多种恶性肿瘤细胞对化疗药物的敏感性并可导致细胞凋亡.
本研究利用RNA干扰的方法, 通过构建shRNA表达质粒下调HepG2内的mcl-1 mRNA和蛋白水平.
构建并筛选出的靶向mcl-1基因的shRNA重组质粒对mcl-1基因有明显的干扰作用, 为下一下研究抑制mcl-1基因对肝癌的作用打下基础.
本课题设计尚合理, 无伦理学问题, 有一定科学性, 如能进一步作深入研究则更好.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Johnstone RW, Ruefli AA, Lowe SW. Apoptosis: a link between cancer genetics and chemotherapy. Cell. 2002;108:153-164. [PubMed] [DOI] |
| 2. | Wang X, Studzinski GP. Antiapoptotic action of 1,25-dihydroxyvitamin D3 is associated with increased mitochondrial MCL-1 and RAF-1 proteins and reduced release of cytochrome c. Exp Cell Res. 1997;235:210-217. [PubMed] [DOI] |
| 3. | Fleischer B, Schulze-Bergkamen H, Schuchmann M, Weber A, Biesterfeld S, Müller M, Krammer PH, Galle PR. Mcl-1 is an anti-apoptotic factor for human hepatocellular carcinoma. Int J Oncol. 2006;28:25-32. [PubMed] |
| 4. | Sieghart W, Losert D, Strommer S, Cejka D, Schmid K, Rasoul-Rockenschaub S, Bodingbauer M, Crevenna R, Monia BP, Peck-Radosavljevic M. Mcl-1 overexpression in hepatocellular carcinoma: a potential target for antisense therapy. J Hepatol. 2006;44:151-157. [PubMed] [DOI] |
| 5. | Schulze-Bergkamen H, Fleischer B, Schuchmann M, Weber A, Weinmann A, Krammer PH, Galle PR. Suppression of Mcl-1 via RNA interference sensitizes human hepatocellular carcinoma cells towards apoptosis induction. BMC Cancer. 2006;6:232. [PubMed] [DOI] |
| 6. | Nijhawan D, Fang M, Traer E, Zhong Q, Gao W, Du F, Wang X. Elimination of Mcl-1 is required for the initiation of apoptosis following ultraviolet irradiation. Genes Dev. 2003;17:1475-1486. [PubMed] [DOI] |
| 7. | Michels J, Johnson PW, Packham G. Mcl-1. Int J Biochem Cell Biol. 2005;37:267-271. [PubMed] [DOI] |
| 8. | Zhou P, Qian L, Kozopas KM, Craig RW. Mcl-1, a Bcl-2 family member, delays the death of hematopoietic cells under a variety of apoptosis-inducing conditions. Blood. 1997;89:630-643. [PubMed] |
| 9. | Zhang B, Gojo I, Fenton RG. Myeloid cell factor-1 is a critical survival factor for multiple myeloma. Blood. 2002;99:1885-1893. [PubMed] [DOI] |
| 10. | Derenne S, Monia B, Dean NM, Taylor JK, Rapp MJ, Harousseau JL, Bataille R, Amiot M. Antisense strategy shows that Mcl-1 rather than Bcl-2 or Bcl-x(L) is an essential survival protein of human myeloma cells. Blood. 2002;100:194-199. [PubMed] [DOI] |
| 11. | Song L, Coppola D, Livingston S, Cress D, Haura EB. Mcl-1 regulates survival and sensitivity to diverse apoptotic stimuli in human non-small cell lung cancer cells. Cancer Biol Ther. 2005;4:267-276. [PubMed] |
| 12. | Yoon JH, Werneburg NW, Higuchi H, Canbay AE, Kaufmann SH, Akgul C, Edwards SW, Gores GJ. Bile acids inhibit Mcl-1 protein turnover via an epidermal growth factor receptor/Raf-1-dependent mechanism. Cancer Res. 2002;62:6500-6505. [PubMed] |
| 13. | Okaro AC, Deery AR, Hutchins RR, Davidson BR. The expression of antiapoptotic proteins Bcl-2, Bcl-X(L), and Mcl-1 in benign, dysplastic, and malignant biliary epithelium. J Clin Pathol. 2001;54:927-932. [PubMed] |
| 14. | Zhou P, Levy NB, Xie H, Qian L, Lee CY, Gascoyne RD, Craig RW. MCL1 transgenic mice exhibit a high incidence of B-cell lymphoma manifested as a spectrum of histologic subtypes. Blood. 2001;97:3902-3909. [PubMed] [DOI] |
| 15. | Wuillème-Toumi S, Robillard N, Gomez P, Moreau P, Le Gouill S, Avet-Loiseau H, Harousseau JL, Amiot M, Bataille R. Mcl-1 is overexpressed in multiple myeloma and associated with relapse and shorter survival. Leukemia. 2005;19:1248-1252. [PubMed] [DOI] |
| 16. | Saxena A, Viswanathan S, Moshynska O, Tandon P, Sankaran K, Sheridan DP. Mcl-1 and Bcl-2/Bax ratio are associated with treatment response but not with Rai stage in B-cell chronic lymphocytic leukemia. Am J Hematol. 2004;75:22-33. [PubMed] [DOI] |
| 17. | Backus HH, van Riel JM, van Groeningen CJ, Vos W, Dukers DF, Bloemena E, Wouters D, Pinedo HM, Peters GJ. Rb, mcl-1 and p53 expression correlate with clinical outcome in patients with liver metastases from colorectal cancer. Ann Oncol. 2001;12:779-785. [PubMed] [DOI] |
| 18. | Opferman JT, Iwasaki H, Ong CC, Suh H, Mizuno S, Akashi K, Korsmeyer SJ. Obligate role of anti-apoptotic MCL-1 in the survival of hematopoietic stem cells. Science. 2005;307:1101-1104. [PubMed] [DOI] |
| 19. | Holen T, Amarzguioui M, Wiiger MT, Babaie E, Prydz H. Positional effects of short interfering RNAs targeting the human coagulation trigger Tissue Factor. Nucleic Acids Res. 2002;30:1757-1766. [PubMed] [DOI] |
| 20. | Mäkinen PI, Koponen JK, Kärkkäinen AM, Malm TM, Pulkkinen KH, Koistinaho J, Turunen MP, Ylä-Herttuala S. Stable RNA interference: comparison of U6 and H1 promoters in endothelial cells and in mouse brain. J Gene Med. 2006;8:433-441. [PubMed] [DOI] |