修回日期: 2008-08-09
接受日期: 2008-08-19
在线出版日期: 2008-09-18
目的: 观察乳酸杆菌对蒙古沙土鼠H pylori感染性胃炎的治疗作用, 探讨乳酸杆菌防治H pylori感染的作用机制.
方法: 通过接种H pylori, 建立蒙古沙土鼠H pylori感染性胃炎动物模型, 将造模成功的32只蒙古沙土鼠随机分为4组, 每组8只. 第1组(抗生素加质子泵抑制剂干预治疗组)、第2组(乳酸杆菌治疗组)、第3组(乳酸杆菌加质子泵抑制剂治疗组)、第4组(生理盐水对照组), 用相应干扰剂分别连续灌胃治疗10 d. 另8只正常蒙古沙土鼠为第5组(空白对照组). 最后1次灌胃4 wk后处死沙鼠, HE染色判断鼠胃黏膜组织学损伤, 并用快速尿素酶试验、Giemsa染色和细菌培养进行H pylori的检测, 免疫组化检测胃黏膜中IL-6、COX-2、和TNF-α蛋白的表达.
结果: 第1组、第2组和第3组之间蒙古沙土鼠的H pylori根除率无显著差异, 但均比第4组的根除率低, 之间差异有显著性(87.5%, 75%, 75% vs 100%, 均P<0.05). 第1组、第2组和第3组蒙古沙土鼠的胃体、胃窦和十二指肠各部位组织胃黏膜慢性炎症评分与第4组相比显著下降(胃体: 1.8±0.54, 2.0±0.48, 1.9±0.50 vs 4.2±1.06, 均P<0.05; 胃窦: 1.5±0.27, 1.4±0.33, 1.7±0.46 vs 4.6±0.74, 均P<0.05; 十二指肠: 1.4±0.41, 1.7±0.29, 1.6±0.52 vs 4.1±0.83, 均P<0.05). 第1组、第2组和第3组蒙古沙土鼠三种炎症因子表达与第4组相比显著下降(COX-2: 3.57±0.32, 3.89±0.51, 2.95±0.76 vs 6.79±1.68, 均P<0.05; IL-6: 2.42±0.60, 2.28±0.71, 1.93±0.52 vs 5.61±0.28, 均P<0.05; TNF-α: 3.30±0.52, 3.65±0.35, 2.84±0.20 vs 6.76±1.63, 均P<0.05).
结论: 乳酸杆菌治疗蒙古沙鼠H pylori感染性胃炎模型的疗效与PPI加抗生素三联疗法相当; 并可显著降低沙鼠胃黏膜的COX-2、IL-6、TNF-α的表达.
引文著录: 陈云华, 汪春莲, 申月明, 谢云, 蔡宇, 刘东. 乳酸杆菌对蒙古沙土鼠幽门螺杆菌感染性胃炎的疗效及其机制. 世界华人消化杂志 2008; 16(26): 2922-2928
Revised: August 9, 2008
Accepted: August 19, 2008
Published online: September 18, 2008
AIM: To evaluate the therapeutic efficacy of Bacillus acidi lactici for H pylori-related gastritis in clean grade Mongolian Gerbil model, and to explore its therapeutic mechanism.
METHODS: A total of 32 Mongolian Gerbil rats were infected with H pylori to establish the gastritis model, and then were randomly divided into 4 groups. Eight normal rats were taken as normal control group. The first group was treated with available trigeminy therapy, the second group Bacillus acidi lactici strains, the third group Bacillus acidi lactici plus PPI, and the fourth group sodium chloride solution for 10 d. Four weeks after the last treatment, the mice were all sacrificed. The infection of H pylori in gastric mucosa of the mice was detected using rapid urease test, Giemsa staining and culture. The histopathological changes in the gastric mucosa of mice were estimated using hematoxylin-eosin staining. Then protein expression of COX-2, IL-6 and TNF-α in gastric mucosa were examined using immunocytochemical staining assay.
RESULTS: Mongolian Gerbil model with H pylori infectious gastritis was successfully established. There was no significant difference in eradication of H pylori among the first, the second group and the third group. However, eradication rate in either of the first three groups was significantly lower than the fourth group (87.5%, 75%, 75% vs 100%, all P < 0.05). The chronic inflammatory response of the fourth group was more serious than the first, second and third group, especially in body of stomach (4.2 ± 1.06 vs 1.8 ± 0.54, 2.0 ± 0.48, 1.9 ± 0.50, all P < 0.05), sinus ventriculi (4.6 ± 0.74 vs 1.5 ± 0.27, 1.4 ± 0.33, 1.7 ± 0.46, all P < 0.05) and duodenum (4.1 ± 0.83 vs 1.4 ± 0.41, 1.7 ± 0.29, 1.6 ± 0.52, all P < 0.05). There was no significant difference between the first, second and third group in the chronic inflammatory response. At protein level, there was no IL-6 expression in the normal group, expressions of COX-2, IL-6, TNF-α in the first, the second and the third group were significantly decreased compared with the fourth group (COX-2: 3.57 ± 0.32, 3.89 ± 0.51, 2.95 ± 0.76 vs 6.79 ± 1.68, all P < 0.05; IL-6: 2.42 ± 0.60, 2.28 ± 0.71, 1.93 ± 0.52 vs 5.61 ± 0.28, all P < 0.05; TNF-α: 3.30 ± 0.52, 3.65 ± 0.35, 2.84 ± 0.20 vs 6.76 ± 1.63, all P < 0.05), but were significantly increased compared with the control group.
CONCLUSION: The therapy of Bacillus acidi lactici for H pylori-related gastritis was effective, equal to the available trigeminy therapy. Bacillus acidi lactici therapy for Helicobacter pylori-related gastritis decreases the expression of COX-2, IL-6 and TNF-α in gastric mucosa.
- Citation: Chen YH, Wang CL, Shen YM, Xie Y, Cai Y, Liu D. Effect and Mechanism of Lactobacillus on treating Mongolian Gerbil with Helicobacter pylori infectious gastritis. Shijie Huaren Xiaohua Zazhi 2008; 16(26): 2922-2928
- URL: https://www.wjgnet.com/1009-3079/full/v16/i26/2922.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i26.2922
胃幽门螺杆菌(Helicobacter pylori, H pylori)感染是慢性胃炎、消化性溃疡以及胃癌、胃黏膜组织淋巴瘤(mucosa-associated lymphoid tissue, MALT)等疾病的重要致病因素. 目前, 广泛应用的以抗生素为主的三联疗法存在着耐药H pylori大量出现以及导致肠道菌群失调等缺点, 面对H pylori治疗上的困境, 迫切需要一些新的治疗方法来改变或完善现有的抗菌治疗方案.
随着微生态学的发展, 人们对H pylori的研究逐渐深入. 研究发现, 许多乳酸杆菌不但具有高效体外抑杀H pylori能力, 而且在体内能够明显降低H pylori的感染密度和减轻炎症反应[1-2]. 作为胃内常驻菌之一, 乳酸杆菌可能在H pylori的感染和致病中起着一定作用. 为此, 本研究通过建立蒙古沙土鼠H pylori感染性胃炎模型, 拟用从健康人胃肠道黏液中分离出的乳酸杆菌来治疗H pylori感染的鼠胃炎模型, 比较乳酸杆菌与传统三联疗法根除H pylori的疗效, 并观察治疗后炎症因子IL-6、COX-2、TNF-α表达的变化, 初步探讨乳酸杆菌防治H pylori感染的作用机制.
8 wk龄清洁级蒙古沙土鼠60只, 雌雄各半, 体质量60±10 g, 购自于上海生物制品研究所, 24 ℃恒温恒湿, 12 h光照和12 h暗室清洁级动物饲养环境, 沙鼠饮水经煮沸消毒, 饲料经60Co照射消毒. H pylori标准株SS1由中国疾病预防控制中心传染病所惠赠. 治疗用乳酸杆菌为本实验室从健康人胃肠道黏膜中分离, 经细菌形态、生化鉴定、代谢终产物测定, 证实其为乳酸杆菌. 心脑浸液干粉(批号20050621)与布氏肉汤干粉(批号20050228)系青岛高科园海博生物技术有限公司出品, 无菌脱纤维羊血(批号001516)购自湘临检验中心, 胎牛血清(批号20050630)系北京鼎国生物试剂有限公司出品, 快速尿素酶试剂盒系福建三强生物化工有限公司出品. 泮立苏针剂(40 mg/支, 批号060805)系杭州中美华东制药有限公司出品, 克拉霉素片剂(250 mg/片, 批号06042802)系天津药业焦作有限公司出品, 氨苄青霉素针剂(0.5 g/支, 批号060307)系华北制药股份有限公司出品.
1.2.1 制备H pylori培养基: 心脑浸液血平板: 称取心脑浸液干粉19.25 g加入500 mL蒸馏水溶解后, 加琼脂粉10 g, 121 ℃高压蒸气灭菌20 min, 待冷却至55 ℃左右加入50 mL无菌脱纤维羊血, 混匀后浇注无菌培养皿, 冷却后4 ℃冷藏备用. MRS固体培养基: 蛋白胨5 g, 牛肉粉5 g, 酵母浸粉2.5 g, 葡萄糖10 g, K2HPO4 2.5 g, 柠檬酸铵1 g, NaCl 2.5 g, MgSO4 0.25 g, MnSO4 0.1 g, Tween-80 0.5 g加蒸馏水500 mL溶解后加琼脂粉10 g, 121 ℃高压蒸气灭菌20 min, 浇注无菌培养皿, 置4 ℃冰箱备用.
1.2.2 H pylori培养和菌液制备:H pylori培养增菌: H pylori复苏后取长势良好者密集划线接种于心脑浸液血平板, 置于厌养箱中微需氧环境(50 mL/L O2, 850 mL/L N2, 100 mL/L CO2)培养3-5 d. 菌悬液制备: 无菌接种环从心脑浸液血平板上收集H pylori菌落于无菌生理盐水成混悬液, 采用比浊法调整菌悬液终浓度为1×1012 CFU/L.
1.2.3 益生菌悬液、药液的配制: 无菌接种环收集MRS培养平板上的菌株, 用无菌生理盐水配成悬液,比浊法调整菌悬液终浓度为1×1012 CFU/L. 小鼠的药物剂量按人与各种动物之间的用药剂量换算. 泮立苏针剂(40 mg)用100 mL无菌生理盐水稀释成浓度为0.4 g/L的溶液, 每只小鼠每天每次给0.5 mL ig. 氨苄青霉素(0.5 g)用25 mL无菌生理盐水稀释成浓度为20 g/L的溶液, 每只鼠每天每次给0.5 mL ig. 克拉霉素(0.25 g)用5 mL无菌生理盐水稀释成浓度为50 g/L的溶液, 每只鼠每天每次给0.5 mL ig.
1.2.4 实验动物分组及治疗: (1)造模: 清洁级蒙古沙土鼠42只, 接种SS1 H pylori菌液, 0.4 mL/只(约含SS1 H pylori为1×10 CFU/mL), 所有动物灌喂前禁食12 h, 再予SS1 H pylori菌悬液ig, 1 次/d, 连续7 d. 阴性对照组为18只沙鼠, 用生理盐水代替H pylori菌液. 接种后4, 8 wk随机各处死5只小鼠, 取胃黏膜评估其H pylori感染及炎症情况, 排除沙鼠有无H pylori的自然感染. (2)分组: 将造模成功的32只沙鼠随机分成4组, 每组8只. 空白对照8只. 所有小鼠于最后一次ig后4 wk处死. 第1组(抗生素+质子泵抑制剂治疗组): 自第4-10天, 每天先禁食12 h, 予泮立苏液0.5 mL及氨苄青霉素0.5 mL加克拉霉素0.5 mL ig, 灌完胃后再禁食3-4 h, 1次/d, 连续7 d. 第2组(乳酸杆菌治疗组): 自第1-10天, 每日先禁食12 h, 予乳酸杆菌悬液0.6 mL/只ig, 细菌数为1×109 CFU/mL, ig后再禁食3-4 h, 1 次/d, 连续10 d. 第3组(乳酸杆菌+质子泵抑制剂治疗组): 自第1-10天, 每天先禁食12 h, 予1×1012 CFU/L乳酸杆菌悬液0.6 mL/只加泮立苏溶液0.5 mL/只ig, 灌完胃后再禁食3-4 h, 1 次/d, 连续10 d. 第4组(生理盐水对照组): 自第1-10天, 每天予生理盐水0.6 mL/只ig, 1 次/d, 连续10 d. 第5组(空白对照组): 正常蒙古沙土鼠, 不予以任何干预. 小鼠的处理: 所有蒙古沙土鼠于治疗后4 wk处死, 用断颈法处死小鼠后立即解剖, 取出胃腔, 去除前胃, 沿大弯侧剪开, 取完整的胃组织(包括胃窦、胃体等)和十二指肠: 一半胃体、胃窦、十二指肠黏膜用100 g/L的甲醛液固定后送病理科行HE染色和Giemsa染色, 另一半组织行快速尿素酶试验(观察时间5 min)、涂片及H pylori细菌培养.
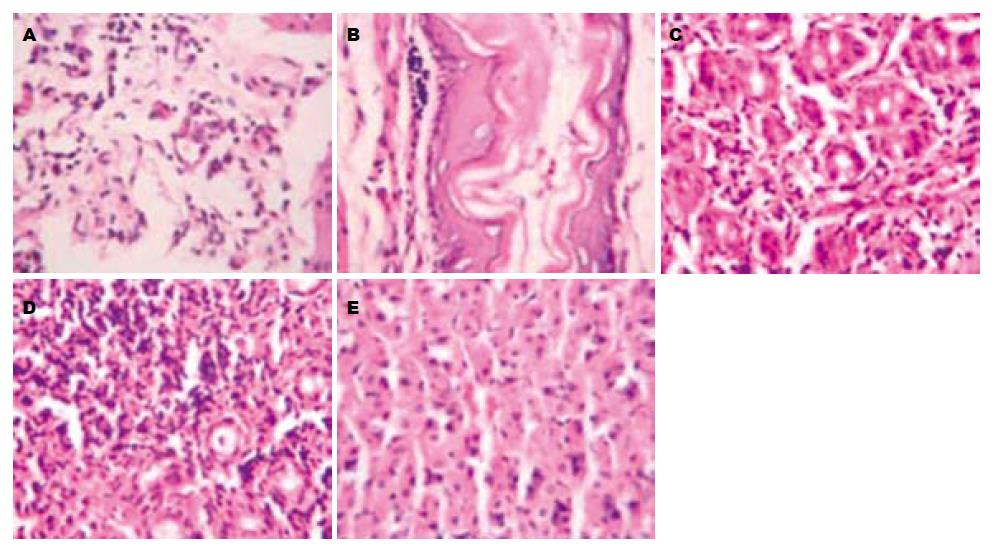
1.2.5 H pylori细菌检测: (1)快速尿素酶试验: 小鼠处死后取胃及十二指肠组织少许, 用无菌生理盐水500 μL研磨成匀浆, 取50 μL置于液体尿素酶试剂中, 室温下观察5 min, 指示剂变红为阳性. (2)H pylori培养: 取沙鼠胃及十二指肠组织匀浆50 μL, 涂布在心脑浸液血平板上, 37 ℃微需氧培养3-7 d, 观察菌落形态, 取可疑菌落行革兰氏染色镜检和快速尿素酶试验. (3)Giemsa染色: 黏膜组织常规固定、包埋、脱水、染色、封片, 病理科医师双盲检测. (4)病理组织学检查: 各组蒙古沙土鼠处死后取胃体、胃窦及十二指肠组织用40 g/L甲醛固定, 常规HE染色, 病理科医生双盲阅片.
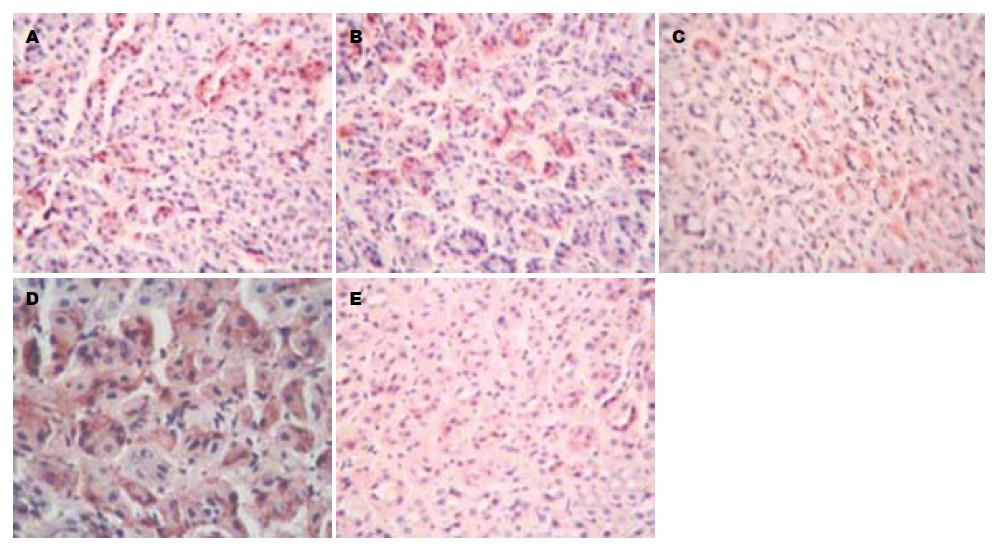
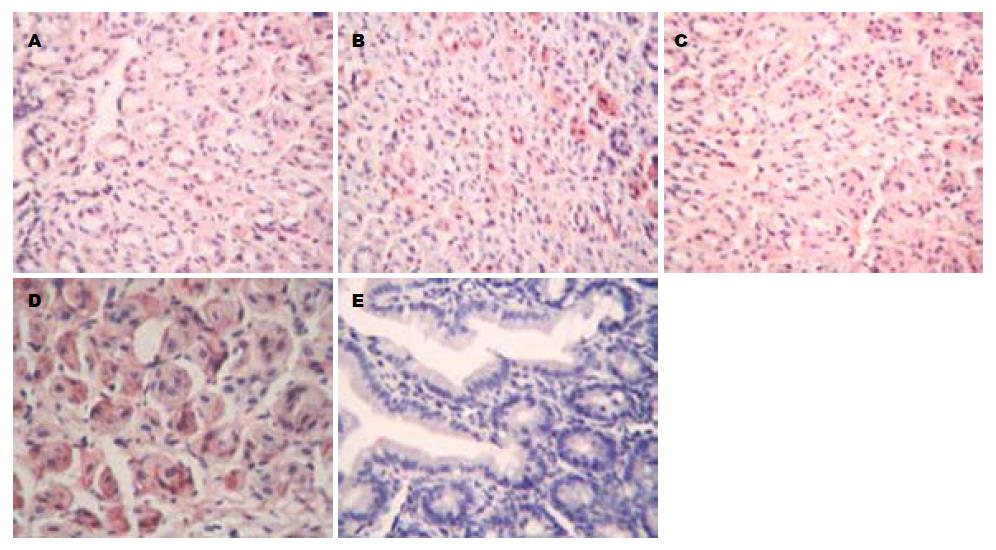
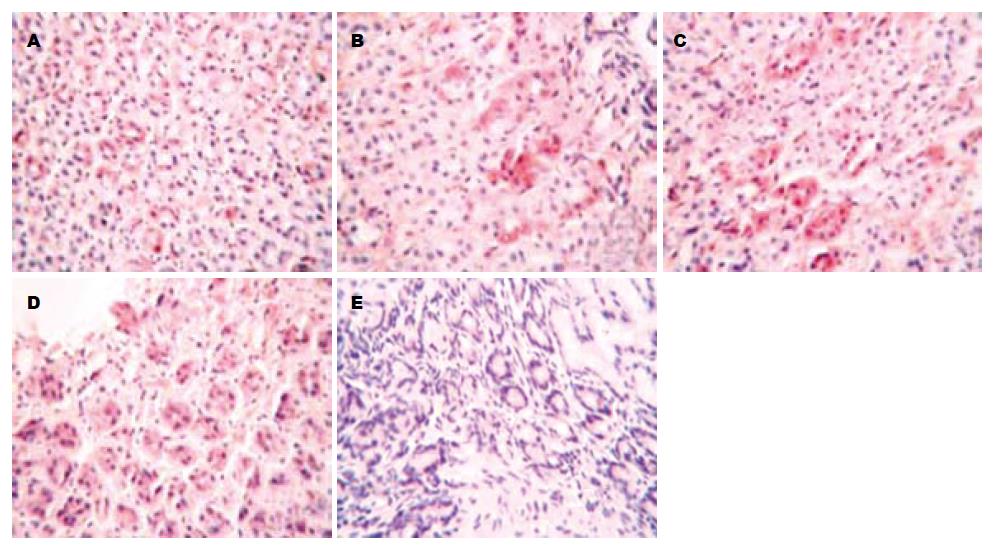
1.2.6 免疫组化检测: 采用免疫组化SABC法测定各组蒙古沙土鼠胃黏膜IL-6、COX-2、TNF-α的表达, 其中阴性对照切片用PBS液替代一抗.
1.2.7 判断标准:H pylori感染阳性标准: H pylori细菌培养、快速尿素酶试验、Giemsa组织学染色检查3项检查中至少有2项阳性为H pylori感染阳性. H pylori根除标准: 治疗停止后1 mo做H pylori细菌培养、快速尿素酶试验、Giemsa组织学染色检查3项均阴性为H pylori根除. H pylori定植的判断标准、胃黏膜慢性炎症的评分标准参照文献[3-4]. 免疫组化评分标准: IL-6、COX-2、TNF-α均为胞质表达, 首先按染色强度记分: 0分为无色, 1分为少量浅红色颗粒, 2分为红色颗粒, 3分为深红色粗颗粒. (染色深浅需与背景着色相对比). 再按阳性细胞所占的百分比记分: 0分为阴性, 1分为阳性细胞≤10%, 2分为阳性细胞占11%-50%, 3分为阳性细胞占51%-75%, 4分为阳性细胞>75%. 染色强度与阳性细胞百分比的乘积>3分才算阳性反应(+). 取5个视野的评分结果的均值作为该切片的免疫组化评分.
统计学处理 计量数据以mean±SD表示. 统计学分析应用SPSS13.0统计软件, 计量资料采用LSD法处理, 计数资料应用卡方检验及四格表精确概率检验法(双侧检验)进行数据处理,以P<0.05为差异有统计学意义.
第1组蒙古沙土鼠的H pylori根除率最高, 第1组、第2组和第3组蒙古沙土鼠的H pylori根除率与第4组相比显著升高(P<0.05), 第1组、第2组和第3组蒙古沙土鼠的H pylori根除率之间无显著性差异(P>0.05, 表1).
| 分组 | 尿素酶试验 | 细菌培养 | Giemsa染色 | H pylori定植 | H pylori根除率(%) |
| 1 | 12.5 | 0.0 | 12.5 | 12.5 | 87.5 |
| 2 | 25.0 | 12.5 | 25.0 | 25.0 | 75.0 |
| 3 | 25.0 | 25.0 | 25.0 | 25.0 | 75.0 |
| 4 | 100.0 | 100.0 | 100.0 | 100.0 | 0.0 |
| 5 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
第1组、第2组和第3组蒙古沙土鼠的胃体、胃窦和十二指肠各部位组织胃黏膜慢性炎症评分与第4组相比显著下降(P<0.05), 但与第5组相比仍有显著性差异(P<0.05), 第2组和第3组蒙古沙土鼠的胃体、胃窦和十二指肠各部位组织胃黏膜慢性炎症评分与第1组相比无显著性差异(P>0.05, 表2, 图1).
第1组、第2组和第3组蒙古沙土鼠COX-2、IL-6、TNF-α的表达评分与第4组相比显著下降(P<0.05), 但与第5组相比仍有显著性差异(P<0.05), 第2组和第3组蒙古沙土鼠COX-2、IL-6、TNF-α的表达评分与第1组相比无显著性差异(P>0.05, 表3, 图2-4).
| 分组 | COX-2 | IL-6 | TNF-α |
| 1 | 3.57±0.32 | 2.42±0.60 | 3.30±0.52 |
| 2 | 3.89±0.51 | 2.28±0.71 | 3.65±0.35 |
| 3 | 2.95±0.76 | 1.93±0.52 | 2.84±0.20 |
| 4 | 6.79±1.68 | 5.61±0.28 | 6.76±1.63 |
| 5 | 0.27±0.03 | 0 | 0.21±0.04 |
众所周知, H pylori可导致胃部多种疾病发生, 是慢性活动性胃炎、消化性溃疡的重要病因,与胃黏膜相关淋巴样组织淋巴瘤(MALT)及胃癌关系密切. 近年运用质子泵抑制剂加二种抗生素联合治疗H pylori感染虽具有积极的临床意义,但是抗生素的联合大量应用导致肠道正常菌群失调, 肠道微生态环境发生不良变化, 出现腹胀、纳差、腹泻及便秘等一系列消化道症状[5-6], 且停药后易复发和再感染, 耐药菌株的迅速增加使根除下降. 面对H pylori治疗上的困境, 迫切需要一些新的治疗方法来改变或完善现有的抗菌治疗方案.
近年的研究发现, H pylori并不是以前传统意义上的绝对致病菌, 他与胃黏膜上皮细胞保持密切联系, 是胃的原籍菌[7]. Khulusi et al[8]证实, 当胃窦部的H pylori密度小于105时, 并不能导致胃及十二指肠溃疡的形成, 并提出导致胃炎形成的H pylori并不具有严格的致病性与非致病性的区别, 胃炎的严重程度和活动度与胃内细菌数量具有相关性, 更与胃内微生态环境和机体因素具有很大的关系.
随着微生态学的兴起, 近年来使用益生菌治疗H pylori感染及其相关性疾病也已成为热点. 最新研究表明, 乳酸杆菌对H pylori有抑制作用. Sgouras et al[9]研究发现干酪乳杆菌Shirota菌株能显著下降H pylori SS1感染蒙古沙土鼠胃窦和胃体黏膜的H pylori定植水平. Gotteland研究显示酵母益生菌可干扰H pylori在人体内的增殖过程, Linsalata et al[10]将29例H pylori感染患者随机分为L.brevis(CD2)菌株组和安慰剂组, 治疗1 mo后发现L.brevis(CD2)虽不能根除H pylori, 但可以减少胃内H pylori数量. Wang et al[2]给59位感染了H pylori的志愿者规则摄入含双歧杆菌Bb12和嗜酸乳杆菌La5的酸乳, 发现酸乳治疗6 wk后患者H pylori尿素酶活性显著下降, 提示酸乳能有效抑制人体H pylori的感染.
本研究采用从健康人胃肠道黏膜中分离出的乳酸杆菌菌株治疗H pylori感染的蒙古沙土鼠胃炎模型, 比较乳酸杆菌与传统三联疗法的根除H pylori的疗效, 结果表明乳酸杆菌治疗组H pylori根除率稍低于传统三联疗法, 但二者差异无显著性, 提示乳酸杆菌菌株在体内亦能有效抑制H pylori, 起到良好的治疗作用. 病理检查结果显示: 乳酸杆菌治疗组或者质子泵抑制剂加乳酸杆菌治疗组蒙古沙土鼠胃体、胃窦、十二指肠各部位的炎症均明显减轻, 各部位组织胃黏膜慢性炎症评分虽高于传统三联疗法, 但二者无差异显著性, 进一步证明了用乳酸杆菌制剂治疗H pylori感染性胃炎的可行性.
关于H pylori的致病机制, 已有的研究总体来说分为三个方面, 一方面是对H pylori毒力因子的研究; 一方面是对H pylori感染宿主后引起的炎症及免疫反应的研究; 另一方面是对宿主因素的研究[11-12]. H pylori感染后, H pylori与宿主相互作用, 介导机体对细菌的免疫反应而导致肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)、IL-1、IL-6、IL-8等多种细胞因子表达上调, 其中IL-6、COX-2、TNF-α在H pylori的致病机制中倍受关注.
有研究报导, 幽门螺杆菌感染胃肠黏膜产生的炎症反应损伤与IL-6、IL-8的过量产生有关[13], H pylori感染组的血清IL-6的含量较无H pylori感染组的含量明显升高[14-15]. 有研究认为COX-2在慢性H pylori感染中具有重要作用[16], 与H pylori阴性患者相比, H pylori阳性患者胃黏膜中COX-2 mRNA和蛋白表达明显增强, 根除H pylori后COX-2表达下降, 且COX-2水平与慢性炎症的程度呈正相关. Martins et al[17]研究也提示H pylori及其毒素可直接诱导细胞株表达COX-2. TNF-α是一种多功能的细胞因子, 主要由巨噬细胞和T细胞产生, 参与多种生理病理过程. Yamaoka et al[18]研究发现, 在慢性胃炎、消化性溃疡患者中, H pylori阳性患者胃窦黏膜上皮细胞TNF-α mRNA表达阳性率高于H pylori阴性患者, 且与H pylori密度、炎性细胞浸润程度呈正比; TNF-α会增加H pylori感染引起胃上皮细胞过度凋亡的作用, 造成胃黏膜上皮细胞凋亡与增殖平衡失调, 这可能是引起消化性溃疡、萎缩性胃炎、胃癌的重要机制[19].
本实验通过观察各组治疗后IL-6、COX-2、TNF-α表达的变化, 初步探讨乳酸杆菌治疗H pylori感染性胃炎的机制, 实验结果显示: 含有乳酸杆菌治疗组可以显著的降低三种细胞因子的表达, 其中质子泵抑制剂加乳酸杆菌治疗组抑制效果最强, 这为乳酸杆菌治疗H pylori感染性胃炎提供了实验依据.
至今, 益生菌在上消化道的生物学特性和行为尚未完全明确, 目前在临床应用方面尚存在许多需要解决的问题, 如菌株的选择, 其剂量、疗程及如何与其他药物联合应用, 这些均有待更深入的研究.
H pylori作为慢性胃炎、消化性溃疡甚至胃癌的主要致病因素, 随着耐药率的增加、长期不合理应用抗生素可引起胃肠功能紊乱及胃肠道菌群失调等不良反应. 微生态疗法恰是从一个崭新的角度解决了传统疗法存在的多种问题, 他不仅可以抗感染, 还能调节机体的免疫机能、平衡胃肠道正常菌群、降低抗生素的副作用等多种生物学功能. 因此, 益生菌的运用将对H pylori相关疾病的防治具有重要的意义.
高泽立, 副教授, 上海交通大学医学院附属第三人民医院感染科; 黄恒青, 主任医师, 福建省第二人民医院 消化内科
近年来运用益生菌治疗H pylori感染受到了国内外学者广泛的关注, 较多的研究表明: 益生菌防治H pylori感染机制主要与产生抑制H pylori的物质, 抑制H pylori的定植, 抑制H pylori感染后的炎症及免疫反应等作用有关.
Sgouras et al学者研究发现干酪乳杆菌Shirota菌株能显著下降HpSS1感染蒙古沙土鼠胃窦和胃体黏膜的H pylori定植水平; Wang et al的研究中给59位感染了H pylori的志愿者规则摄入含双歧杆菌Bb12和嗜酸乳杆菌La5的酸乳, 发现酸乳治疗6 wk后患者H pylori尿素酶活性显著下降, 提示酸乳能有效抑制人体H pylori的感染.
本研究通过建立蒙古沙土鼠H pylori感染性胃炎模型, 拟用从健康人胃肠道黏液中分离出的乳酸杆菌来治疗H pylori感染的鼠胃炎模型, 比较乳酸杆菌与传统三联疗法根除H pylori的疗效, 并观察治疗后炎症因子COX-2、IL-6、TNF-α表达的变化, 初步探讨乳酸杆菌防治H pylori感染的作用机制.
本实验通过观察各组治疗后, 发现乳酸杆菌能有效抑制H pylori的定植, 并显著抑制炎症因子的表达, 为进一步研究乳酸杆菌治疗H pylori相关性疾病提供了实验依据.
1 微生态学: 研究正常微生物群的结构、功能及其与宿主相互依赖和相互制约关系的一门新兴学科.
2 益生菌系: 能促进肠道内菌群平衡、对宿主起到有益作用的活的微生态制剂.
本文比较乳酸杆菌与传统三联疗法的根除H pylori的疗效, 内容较新颖, H pylori感染有一定疗效, 值得临床及科研工作者进一步探讨.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Gotteland M, Poliak L, Cruchet S, Brunser O. Effect of regular ingestion of Saccharomyces boulardii plus inulin or Lactobacillus acidophilus LB in children colonized by Helicobacter pylori. Acta Paediatr. 2005;94:1747-1751. [PubMed] [DOI] |
| 2. | Wang KY, Li SN, Liu CS, Perng DS, Su YC, Wu DC, Jan CM, Lai CH, Wang TN, Wang WM. Effects of ingesting Lactobacillus- and Bifidobacterium-containing yogurt in subjects with colonized Helicobacter pylori. Am J Clin Nutr. 2004;80:737-741. [PubMed] |
| 3. | Iakovenko EP, Grigor'ev PIa, Iakovenko AV, Agafonova NA, Prianishnikova AS, Sheregova EN, Vasil'ev IV, Komleva IuV, Oprishchenko IV, Anashkin VA. [Effects of probiotic bifiform on efficacy of Helicobacter pylori infection treatment]. Ter Arkh. 2006;78:21-26. [PubMed] |
| 4. | Sheu BS, Wu JJ, Lo CY, Wu HW, Chen JH, Lin YS, Lin MD. Impact of supplement with Lactobacillus- and Bifidobacterium-containing yogurt on triple therapy for Helicobacter pylori eradication. Aliment Pharmacol Ther. 2002;16:1669-1675. [PubMed] [DOI] |
| 5. | Archimandritis A, Souyioultzis S, Katsorida M, Tzivras M. Clostridium difficile colitis associated with a 'triple' regimen, containing clarithromycin and metronidazole, to eradicate Helicobacter pylori. J Intern Med. 1998;243:251-253. [PubMed] [DOI] |
| 7. | Ushiyama A, Tanaka K, Aiba Y, Shiba T, Takagi A, Mine T, Koga Y. Lactobacillus gasseri OLL2716 as a probiotic in clarithromycin-resistant Helicobacter pylori infection. J Gastroenterol Hepatol. 2003;18:986-991. [PubMed] [DOI] |
| 8. | Khulusi S. Helicobacter pylori and surgery. Helicobacter pylori is merely suppressed by bile. BMJ. 1998;317:679; author reply 680. [PubMed] |
| 9. | Sgouras DN, Panayotopoulou EG, Martinez-Gonzalez B, Petraki K, Michopoulos S, Mentis A. Lactobacillus johnsonii La1 attenuates Helicobacter pylori-associated gastritis and reduces levels of proinflammatory chemokines in C57BL/6 mice. Clin Diagn Lab Immunol. 2005;12:1378-1386. [PubMed] [DOI] |
| 10. | Linsalata M, Russo F, Berloco P, Caruso ML, Matteo GD, Cifone MG, Simone CD, Ierardi E, Di Leo A. The influence of Lactobacillus brevis on ornithine decarboxylase activity and polyamine profiles in Helicobacter pylori-infected gastric mucosa. Helicobacter. 2004;9:165-172. [PubMed] [DOI] |
| 11. | Sánchez Ceballos F, Taxonera Samsó C, García Alonso C, Alba López C, Sainz de Los Terreros Soler L, Díaz-Rubio M. [Prevalence of Helicobacter pylori infection in the healthy population of Madrid (Spain)]. Rev Esp Enferm Dig. 2007;99:497-501. [PubMed] |
| 14. | Kuzuhara T, Suganuma M, Oka K, Fujiki H. DNA-binding activity of TNF-αlpha inducing protein from Helicobacter pylori. Biochem Biophys Res Commun. 2007;362:805-810. [PubMed] [DOI] |
| 15. | Saijo Y, Yoshioka E, Fukui T, Kawaharada M, Sata F, Sato H, Kishi R. H pylori seropositivity and cytokine gene polymorphisms. World J Gastroenterol. 2007;13:4445-4451. [PubMed] |
| 17. | Martins FP, Artigiani Neto R, Oshima CT, Costa PP, N M F, Ferrari AP. Over-expression of cyclooxygenase-2 in endoscopic biopsies of ectopic gastric mucosa. Braz J Med Biol Res. 2007;40:1447-1454. [PubMed] [DOI] |