修回日期: 2008-08-03
接受日期: 2008-08-04
在线出版日期: 2008-09-08
目的: 研究IFNγ修饰的树突状细胞(dendritic cell, DC)对T淋巴细胞增殖和分化的影响以及后者对肝癌HepG2细胞的杀伤作用.
方法: 构建携带人IFNγ基因的重组复制缺陷型腺病毒载体(Ad-IFNγ), 用其感染人外周血单个核细胞来源的DC, 观察后者表型和吞噬功能的变化. 再用反复冻融裂解法提取的肝癌HepG2细胞抗原致敏DC, 将其与自身T淋巴细胞共同培养, 观察T淋巴细胞的增殖和分化情况以及活化T细胞对HepG2细胞的杀伤作用.
结果: Ad-IFNγ转染后24 h, 各组DC的吞噬能力差异无统计学意义(F = 2.31, P = 0.13). Ad-IFNγ转染的DC培养上清中有IFNγ的高表达, 其表达量显著高于另外两组(P<0.01). Ad-IFNγ-DC促进T细胞增殖的能力明显强于Ad-LacZ-DC和NTDC(P<0.01). 以HepG2细胞抗原致敏时, Ad-IFNγ-DC活化的T淋巴细胞对HepG2细胞的杀伤率在E:T = 20:1和E:T = 50:1时分别为43.64%±3.51%和48.87%±4.83%, 显著高于Ad-LacZ-DC和NTDC组(P<0.01).
结论: IFNγ的修饰能促进DC成熟, 增强DC促进T淋巴细胞增殖的作用, 诱导细胞免疫, 增强T细胞的细胞毒作用, 使T细胞能有效地杀伤肿瘤细胞.
引文著录: 薛刚, 程莹, 曹永宽, 王培红, 张国虎, 龚加庆, 黄文林, 田伏洲. IFNγ基因修饰的树突状细胞在肝癌免疫治疗中的应用. 世界华人消化杂志 2008; 16(25): 2820-2825
Revised: August 3, 2008
Accepted: August 4, 2008
Published online: September 8, 2008
AIM: To construct an adenoviral vector expressing human interferon γ (IFNγ) for transfecting human monocyte-derived dendritic cells (Ad-IFNγ-DC), and then to detect the anti-hepatic cancer ability of whole cell lysates pulsed Ad-IFNγ-DC acting as adjuvant.
METHODS: The recombinant adenoviral vector carrying IFNγ gene (Ad-IFNγ) was constructed and transfected into Ad-IFNγ-DC. After transfection, the IFNγ protein expression and cytokines secretion by DC were detected and DC phenotypes were assayed with flow cytometry; the phagocytic ability of DC was assayed using FITC-dextran uptake method. Subsequently, the capability of antigen pulsed Ad-IFNγ-DC to promote T cell proliferation and differentiation was detected using 3H-TdR incorporation and RT-PCR/ELISA method respectively. Finally, the ability of T cells to kill HepG2 cells was detected with lactate dehydrogenase release assay.
RESULTS: Ad-IFNγ did not impact the phagocytic function of DC 24 h after transfection (F = 2.31, P = 0.13). DC transfected with Ad-IFNγ expressed IFNγ protein successfully (P < 0.01). Antigen pulsed Ad-IFNγ-DC stimulated T cell proliferation and enhanced expression of interleukin-2 (IL-2) and T-bet from the T cells (P < 0.01). Finally, the abilities of tumor antigen loaded Ad-IFNγ-DC primed T cells to kill HepG2 cells were 43.64% ± 3.51% and 48.87% ± 4.83% as the ratio of E/T was 20:1 and 50:1, respectively, which were stronger than those in the Ad-LacZ-DC and NTDC primed T cells (P < 0.01).
CONCLUSION: Ad-IFNγ transfection can promote DC maturation, enhance its capacities of antigen presentation and T cell stimulation, induce Th1 polarization and strengthen anti-HepG2 cell immunities.
- Citation: Xue G, Cheng Y, Cao YK, Wang PH, Zhang GH, Gong JQ, Huang WL, Tian FZ. Use of interferon γ gene modified dendritic cells in immunotherapy for hepatic cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(25): 2820-2825
- URL: https://www.wjgnet.com/1009-3079/full/v16/i25/2820.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i25.2820
γ-干扰素(IFNγ), 又称免疫干扰素, 具有抑制病毒复制、抑制细胞分裂和免疫调节的作用, 在机体免疫应答和抗肿瘤免疫反应中发挥着极其重要的作用. 本文旨在探讨IFNγ基因修饰对DC表型和功能的影响, 以及后者作为佐剂对T细胞增殖分化的影响和活化T细胞对肝癌HepG2细胞的免疫杀伤作用.
Ficoll-PlqueTM Plus密度梯度离心液(Amersham Bio., Sweden), CD14标记的免疫磁株(Miltenyi Biotec, Germany), PE-CD14(BD.Pharmigen, USA), PE-CD14、PE-CD3、FITC-CD86、FITC-CD83、FITC-HLA-DR、FITC-CD14、PE-CD80、PE-CD1a、PE-CD11c及PE-CCR7(BD.Pharmigen, USA), 重组人GM-CSF(Peprotech Inc.UK), RPMI 1640(Invitrogen, USA), 6孔培养板中、25 cm2培养瓶(Falcon, USA), 流式细胞仪(Beckman Coulter, USA), IFNγ、IL-12p70、IL-10液相芯片法检测试剂盒(Linco Research, Inc. USA), 乳酸脱氢酶释放法检测试剂盒(CytoTox 96® Non-Radioactive Cytotoxicity Assay kit, Promega, USA).
1.2.1 人外周血单个核细胞来源DC的分离和培养: 抽取健康志愿者外周静脉血50 mL, 肝素抗凝, 用Ficoll-PlqueTM Plus和CD14标记的免疫磁株分离CD14+和CD14-的外周血单个核细胞(PBMC), 收集CD14+细胞, 取少量用PE-CD14标记后流式细胞仪检测纯度. 其余细胞用含5%人AB血清、100 U/L青霉素、100 mg/L链霉素、2 mmol/L谷氨酰胺、30 µg/L重组人IL-4和100 µg/L重组人GM-CSF的RPMI 1640重悬成2×109细胞/L, 于6孔培养板中、37 ℃、50 mL/L CO2培养箱中培养, 培养第3天半量补充IL-4和GM-CSF.
1.2.2 T淋巴细胞的分离和培养: 制备尼龙毛柱(nylon-wool column), 将前一步中分离的CD14-的PBMC用尼龙毛柱分离出T淋巴细胞, 取少量细胞用PE-CD3标记, 流式细胞仪检测T细胞的纯度. 其余细胞用含20 kU/L重组人IL-2(IL-2, Peprotech Inc. UK)和5%人AB血清的RPMI 1640重悬, 25 cm2培养瓶中维持培养.
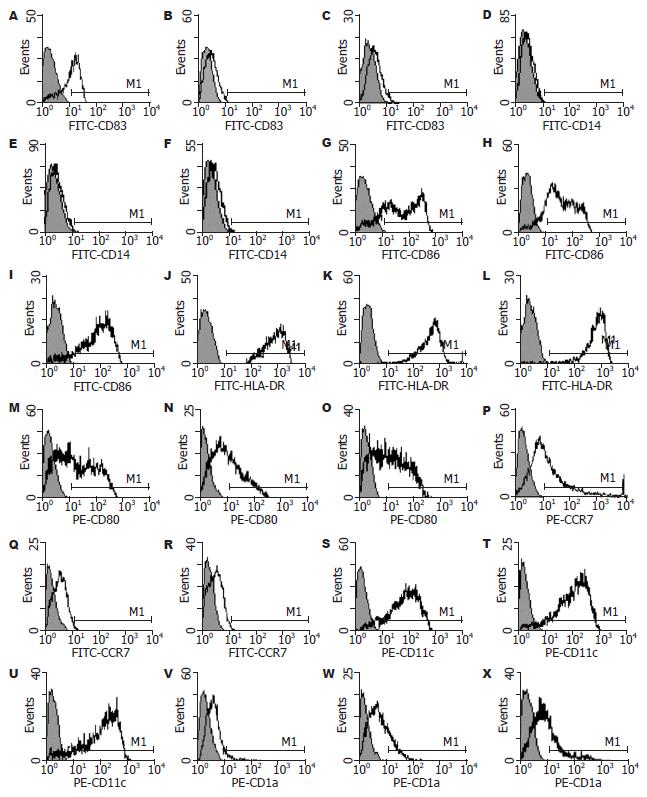
1.2.3 Ad-IFNγ转染对DC吞噬功能和表型的影响: 体外连接法构建Ad-IFNγ并鉴定[1]. 收集培养第6天的DC, 无血清、无抗生素RPMI 1640重悬, 按MOI(感染复数) = 50、离心法[2]转染Ad-IFNγ(Ad-IFNγ-DC), 以Ad-LacZ作无关病毒对照组(Ad-LacZ-DC, 实验室保存, 携带β-半乳糖苷酶基因), 用无血清、无抗生素RPMI 1640作非病毒转染对照组(NTDC). 转染后24 h, 收集部分细胞, 用FITC-Dextran摄取法检测DC的吞噬功能. 转染后48 h, 收集各组细胞, 分别用FITC-CD86、FITC-CD83、FITC-HLA-DR、 FITC-CD14、PE-CD80、PE-CD1a、PE-CD11c和PE-CCR7等荧光抗体标记, 流式细胞仪检测DC的表型.
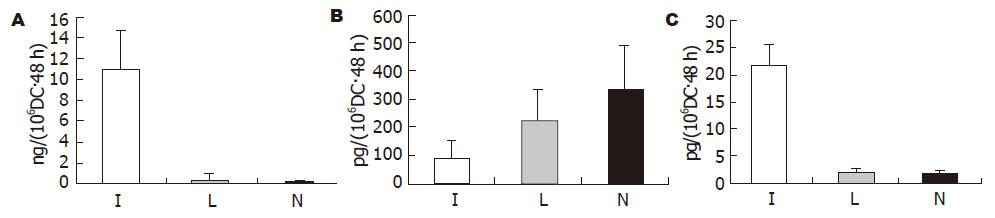
1.2.4 Ad-IFNγ转染后DC分泌细胞因子的变化: Ad-IFNγ转染后48 h, 收集细胞培养上清, 液相芯片法检测各组DC培养上清中IFNγ、IL-12p70和IL-10的含量.
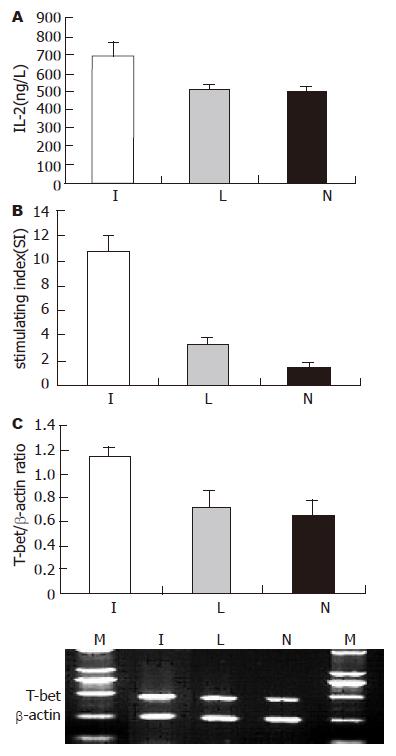
1.2.5 Ad-IFNγ-DC作为佐剂对T淋巴细胞的刺激作用: 收集转染后24 h的DC, 用含IL-4和GM-CSF的培养基重悬细胞成5×108/L, 加入HepG2全细胞裂解物100 mg/L[3], 继续培养24 h, 加入丝裂霉素A 25 mg/L, 37 ℃孵育30 min. 重悬DC为1×108/L, 与T淋巴细胞在96孔培养板中按DC:T = 1:20混合培养, 每组设3个复孔. 96 h后3H-TdR(上海原子能研究所)掺入法检测T淋巴细胞的增殖程度, 计算刺激指数SI = (实验组cpm-机器本底cpm)/(对照组cpm-机器本底cpm). ELISA法检测混合细胞培养上清中IL-2的浓度; 半定量RT-PCR法检测培养细胞中T-bet的表达.
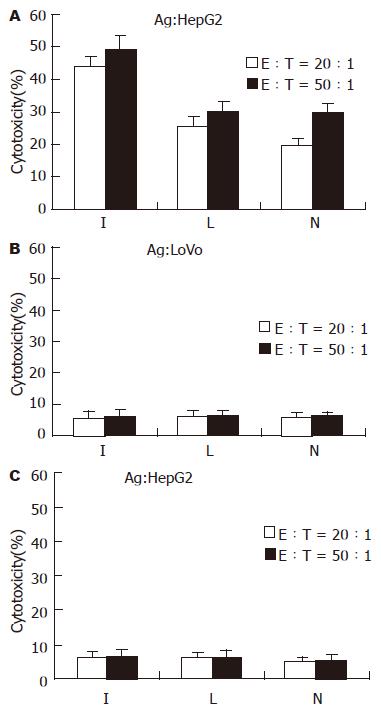
1.2.6 Ad-IFNγ-DC活化的T淋巴细胞对HepG2细胞的杀伤作用: 以肝癌HepG2细胞株为靶细胞, HepG2细胞裂解物(以结肠癌LoVo细胞裂解物作非特异抗原对照, 以结肠癌LoVo细胞为对照杀伤细胞)致敏的Ad-IFNγ-DC活化的T淋巴细胞为效应细胞, 按操作指南, 以效靶比分别为20:1和50:1、乳酸脱氢酶释放法检测T淋巴细胞对HepG2细胞的杀伤效应, 计算杀伤率.
统计学处理 所有数据以mean±SD表示, 应用SPSS11.5统计软件分析, 各实验组之间的比较采用单因素的方差分析和多组均数间的多重比较. P<0.05为差异有显著性.
外周静脉血经密度梯度离心和免疫磁珠阳性选择出的CD14+的PBMC纯度可达92.4%. 上述CD14+的PBMC在IL-4和GM-CSF的诱导下第3天, 可见细胞形态不规则, 大小不一致, 部分细胞聚集成团, 边缘出现毛刺状外观. 培养第6天, 更多的细胞出现更为明显的毛刺状外观, 呈现出树突状细胞的典型光镜下改变. CD14-的PBMC经过尼龙毛柱分离纯化所得T淋巴细胞的纯度可达94.8%, 可以满足下一步实验的需要.
Ad-IFNγ转染后24 h, FITC-Dextran摄取法检测发现各组DC的吞噬能力分别为: Ad-IFNγ-DC: (80.83±7.98)%、Ad-LacZ-DC: (82.57±6.95)%、NTDC: (86.23±4.90)%, 其差异无统计学意义(F = 2.31, P = 0.13). 流式细胞仪检测发现各组DC(未经抗原物质刺激)中共刺激分子CD80和CD86、主要组织相容性复合物HLA-DR以及CD11c的表达均维持在较高的水平, CD14则呈低表达. 与其他两组相比, CD83、CCR7在Ad-IFNγ-DC的表达明显上调, 同时其CD1a的表达则有明显的降低(P<0.05, 图1).
液相芯片检测发现, 在Ad-IFNγ转染的DC培养上清中有IFNγ的高表达, 其表达量显著高于另外两组(P<0.01, 图2). 此外, Ad-IFNγ-DC组培养上清中增强免疫的细胞因子IL-12p70的表达也明显高于Ad-LacZ组和NTDC组; 而抑制免疫的细胞因子IL-10的表达则明显低于后两组(P<0.01, 图2).
3H-TdR掺入法检测T细胞的增殖状况, 结果显示, Ad-IFNγ-DC促进T细胞增殖的能力明显强于Ad-LacZ-DC和NTDC(P<0.01, 图3). 半定量RT-PCR检测T-bet的表达, 发现Ad-IFNγ-DC刺激的T细胞表达T-bet的水平明显高于Ad-LacZ-DC和NTDC刺激的T细胞(P<0.01, 图3); ELISA法检测混合细胞培养上清中IL-2的含量也发现Ad-IFNγ-DC刺激的T细胞分泌IL-2的能力明显高于Ad-LacZ-DC和NTDC刺激的T细胞(P<0.01, 图3).
乳酸脱氢酶(LDH)释放法检测T淋巴细胞对肿瘤细胞的杀伤率, 结果显示, 以HepG2细胞抗原致敏时, Ad-IFNγ-DC活化的T淋巴细胞对HepG2细胞的杀伤率在E:T = 20:1和E:T = 50:1时分别为(43.64±3.51)%和(48.87±4.83)%, 显著高于Ad-LacZ-DC和NTDC组, 而对LoVo细胞的杀伤率在各组之间无显著性差异(P<0.01, 图4); 以LoVo细胞抗原冲击时, Ad-IFNγ-DC活化的T淋巴细胞对HepG2细胞的杀伤率在E:T = 20:1和E:T = 50:1时分别为(5.61±2.21)%和(6.23±1.82)%, 与Ad-LacZ-DC和NTDC组相比无显著差异(P>0.05, 图4). 此外, HepG2细胞抗原致敏时各组的杀伤率均明显高于LoVo细胞抗原致敏时(P<0.01, 图4).
DC是体内功能最强大的专一性抗原递呈细胞, 其摄取、加工和递呈抗原给淋巴细胞从而引起和维持原发免疫反应的功能使其成为肿瘤免疫治疗(肿瘤疫苗)的最佳选择[4]. 体外分离和繁殖DC技术的发展又令DC作为肿瘤免疫治疗疫苗成为可能[5].
一般来说, 将CD14+的单核细胞(前体DC)在含GM-CSF和IL-4的培养基中培养5-7 d可以得到未成熟DC, 后者在含细菌促炎因子或T细胞来源的刺激物如TNFα、IL-1β、IFNα、IFNγ和PGE2等的培养基中继续培养2-3 d就能获得成熟DC. 我们发现, Ad-IFNγ基因转染后, IFNγ蛋白能在DC中得到高水平的表达, 同时Ad-IFNγ-DC表面有高水平的CD80、CD86、CD11c和HLA-DR表达, 成熟DC的标志物CD83和CCR7在其表面的表达也有明显的上调, 提示Ad-IFNγ-DC分泌的IFNγ蛋白能够作为一种自分泌因子在一定程度上促进DC的表型成熟, 这与其他学者的研究结果-IFNγ能介导DC的成熟一致[6]. 这种Ad-IFNγ的转染能上调DC表面共刺激分子和MHC表达和促进DC成熟的能力将有助于DC向T淋巴细胞传递抗原信息(第一信号)和第二信号, 有利于促进T细胞的增殖和活化.
此外, 与NTDC相比, 病毒转染后24 h, DC对FITC-Dextran的吞噬作用无明显变化, 提示在转染Ad-IFNγ后24 h内, 腺病毒的转染及其所携带的基因并不明显地影响DC的吞噬功能, 此结果使在病毒转染后24 h给予DC抗原冲击成为可能. 在既往的研究中, 我们发现肝癌HepG2细胞全细胞裂解物致敏的DC所活化的T淋巴细胞对该肿瘤细胞有明显的杀伤效应[2]. 因此, 在本研究中, 我们再次用HepG2细胞株的全细胞裂解物来致敏被IFNγ修饰的DC, 结果发现, Ad-IFNγ转染能显著提高抗原冲击的DC分泌细胞因子IL-12p70, 同时也能显著能减少IL-10的分泌. IL-12是一种具有促进炎症和免疫调节功能的多效细胞因子, 能增强T细胞和NK细胞的增殖和毒性, 诱导IFNγ、TNFα、IL-2、IL-3、IL-8以及CSF的生成, 是一种强有力的Ⅰ型免疫反应的诱导剂, 能直接和间接地诱导CD4+和CD8+的Ⅰ型细胞的增殖, 进而启动特异性T淋巴细胞反应并抑制Th2细胞的生成[7]. 而IL-10则能阻碍DC的分化成熟, 抑制DC在肿瘤内的聚集, 下调IL-12的产生以及共刺激分子、黏附分子和MHCⅡ的表达, 并能抑制Th1型细胞因子的产生和T细胞的增殖[8]. 因此Ad-IFNγ能诱导DC分泌IL-12p70, 抑制DC分泌IL-10的功能提示Ad-IFNγ的修饰可诱导免疫反应向Th1型分化, 增强T细胞的溶细胞活性.
进一步研究发现, Ad-IFNγ-DC能明显促进T淋巴细胞的增殖, 这个结果可能是DC表达的IFNγ蛋白直接引起的, 也可能是IFNγ促进DC成熟或上调IL-12p70等细胞因子分泌而导致的. 此外, Ad-IFNγ-DC能上调T细胞对T-bet和IL-2的表达, 再次提示其能使T细胞向Th1分化, 有利于诱导出强有力的细胞免疫.
最后, 我们发现携带肿瘤抗原信息的Ad-IFNγ-DC活化的T淋巴细胞对肿瘤细胞有明显地特异性杀伤作用, 该作用强于Ad-LacZ-DC组和NTDC组, 提示Ad-IFNγ-DC作为免疫佐剂可有效提高T细胞的抗肿瘤免疫反应, 为进一步研究其在体功能和临床应用提供了依据.
新近发现, IFNγ具有促进DC的分化和成熟以及上调DC分泌IL-12的能力. 而DC摄取、加工和递呈抗原给淋巴细胞从而引起和维持原发免疫反应的功能使其成为肿瘤免疫治疗(肿瘤疫苗)的最佳选择, 体外分离和繁殖DC技术的发展又令DC作为肿瘤疫苗的制备成为可能.
刘彬彬, 副研究员, 复旦大学附属中山医院、复旦大学肝癌研究所; 吕明德, 教授, 中山大学附属第一医院肝胆外科
2004年, Pan et al报道IFNγ作为一种自分泌因子可促进DC的成熟. 2008年, 薛刚 et al报道IFNγ修饰的DC可增强T细胞对结肠癌LoVo细胞的杀伤作用.
本文首先应用IFNγ修饰的DC刺激T淋巴细胞, 发现IFNγ-DC可促进T细胞增殖, 并诱导T细胞向Th1分化. IFNγ的修饰可明显增强肝癌细胞抗原负载的DC所活化的T细胞对肝癌细胞的杀伤作用.
本研究通过基因修饰的方式增强了DC的功能, 为基于DC的肿瘤免疫治疗和生物治疗提供了新的方向, 为DC抗肿瘤作用的研究和临床应用奠定了基础.
IFNγ: 又称免疫干扰素, 除了抑制病毒复制, 抑制细胞分裂的作用外, 还具有免疫调节作用, 可上调MHCⅠ和MHCⅡ的表达、促进Th1细胞增殖、促进抗原的递呈、促进可诱导的一氧化氮合酶(iNOS)的合成、调节白细胞-内皮细胞的相互作用等.
本研究设计合理, 文章撰写条理清晰, 具有一定的学术价值.
编辑: 李军亮 电编: 郭海丽
| 2. | Nishimura N, Nishioka Y, Shinohara T, Ogawa H, Yamamoto S, Tani K, Sone S. Novel centrifugal method for simple and highly efficient adenovirus-mediated green fluorescence protein gene transduction into human monocyte-derived dendritic cells. J Immunol Methods. 2001;253:113-124. [PubMed] [DOI] |
| 4. | Steinman RM, Pack M, Inaba K. Dendritic cells in the T-cell areas of lymphoid organs. Immunol Rev. 1997;156:25-37. [PubMed] [DOI] |
| 5. | Lodge PA, Jones LA, Bader RA, Murphy GP, Salgaller ML. Dendritic cell-based immunotherapy of prostate cancer: immune monitoring of a phase II clinical trial. Cancer Res. 2000;60:829-833. [PubMed] |
| 6. | Pan J, Zhang M, Wang J, Wang Q, Xia D, Sun W, Zhang L, Yu H, Liu Y, Cao X. Interferon-gamma is an autocrine mediator for dendritic cell maturation. Immunol Lett. 2004;94:141-151. [PubMed] [DOI] |
| 7. | Rodolfo M, Colombo MP. Interleukin-12 as an adjuvant for cancer immunotherapy. Methods. 1999;19:114-120. [PubMed] [DOI] |
| 8. | Bellone G, Turletti A, Artusio E, Mareschi K, Carbone A, Tibaudi D, Robecchi A, Emanuelli G, Rodeck U. Tumor-associated transforming growth factor-beta and interleukin-10 contribute to a systemic Th2 immune phenotype in pancreatic carcinoma patients. Am J Pathol. 1999;155:537-547. [PubMed] |