修回日期: 2008-07-24
接受日期: 2008-07-29
在线出版日期: 2008-08-28
目的: 探讨胆汁性肝硬化大鼠肾脏病理组织学改变、肾脏细胞凋亡及其机制.
方法: 应用胆总管结扎(CBDL)技术制备大鼠胆汁性肝硬化模型. 将SD大鼠随机分为: 假手术组(SO)、CBDL 2 wk组与5 wk组. 显微镜下观察肝脏和肾脏组织学改变; 生化法测定内生肌酐清除率(Ccr), 比色法测定肾组织丙二醛(MDA)含量, TUNEL法检测肾组织细胞凋亡, 免疫组化测定Bcl-2, Bax蛋白的表达.
结果: CBDL大鼠2 wk发生肝纤维化, 5 wk则形成肝硬化; 5 wk时肾小管上皮细胞有脱落、坏死; 电镜下基底膜不规则增厚, 系膜增宽, 上皮细胞足突融合. 模型大鼠5 wk组Ccr明显降低, 较2 wk组与SO组有显著性差异(1.10±0.03 vs 1.40±0.03, 1.80±0.02, P<0.05或0.01), 肾组织丙二醛5 wk组较2 wk组与SO组显著性增高(4.07±0.51 vs 2.32±0.85, 0.79±0.37, 均P<0.01); 模型大鼠5 wk组肾组织凋亡指数显著性高于2 wk组和SO组(68.36%±8.71% vs 24.08%±2.59%, 11.43%±2.77%; 均P<0.01). SO组、2 wk组及5 wk组Bcl-2逐渐下降, Bax表达则逐渐升高, 各组间有显著差异(P<0.05).
结论: 胆汁性肝硬化大鼠存在肾病理组织学改变与细胞凋亡; 凋亡抑制蛋白Bcl-2低表达和凋亡诱导蛋白Bax高表达在肾损害中起作用.
引文著录: 王利娜, 姜慧卿, 杨晶, 王玉珍, 吕晓萍. 胆汁性肝硬化大鼠肾细胞凋亡及其机制. 世界华人消化杂志 2008; 16(24): 2702-2707
Revised: July 24, 2008
Accepted: July 29, 2008
Published online: August 28, 2008
AIM: To investigate the renal pathological changes, cell apoptosis and expression of Bcl-2 and Bax proteins in rats with hepatic cirrhosis induced by common bile duct ligation (CBDL).
METHODS: Hepatic cirrhosis was induced by CBDL in SD rats. Thirty rats were randomized to 3 groups: sham operation group, 2-wk CBDL group and 5-wk CBDL. Hepatic and renal tissues were collected for pathohistological observation under microscope; the creatinine clearance rate (Ccr) and renal malonaldehyde (MDA) content were measured by biochemical method and spectrophotometric method, respectively; the apoptosis of renal cells was detected by TUNEL method; finally, the levels of Bcl-2 and Bax protein expression were examined by immunohistochemistry.
RESULTS: Hepatic histological examination showed that hepatic fibrosis occurred in 2-wk CBDL group and biliary cirrhosis in 5-wk CBDL. In the 5-wk CBDL group, desquamation and necrosis of renal tubule epithelia were found by HE staining, and irregular thickening of glomerular basement membrane, mesangial expansion and fusion of epithelial foot processes were observed by electron microscopy. The Ccr significantly decreased (1.10 ± 0.03 vs 1.40 ± 0.03, 1.80 ± 0.02; P < 0.05 or 0.01) while MDA content increased (4.07 ± 0.51 vs 2.32 ± 0.85, 0.79 ± 0.37, both P < 0.01) in the 5-wk CBDL group in comparison with that in the 2-wk CBDL group or sham operation group. The apoptotic rate of renal cells was significantly higher in the 5-wk CBDL group than that in the 2-wk CBDL group or sham operation group (68.36% ± 8.71% vs 24.08% ± 2.59%, 11.43% ± 2.77%; both P < 0.01). Bcl-2 protein decreased while Bax protein increased by turns in sham operation group, 2-wk CBDL group and 5-wk CBDL group (P < 0.05).
CONCLUSION: There are renal histopathological changes and cell apoptosis in rats with CBDL-induced hepatic cirrhosis, and low expression of Bcl-2 protein and high expression of Bax protein play important roles in the renal injury induced by CBDL cirrhosis.
- Citation: Wang LN, Jiang HQ, Yang J, Wang YZ, Lv XP. Increased renal cell apoptosis and its mechanism in rats with biliary cirrhosis. Shijie Huaren Xiaohua Zazhi 2008; 16(24): 2702-2707
- URL: https://www.wjgnet.com/1009-3079/full/v16/i24/2702.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i24.2702
肝硬化失代偿期常伴有肾功能障碍, 并认为系全身血流动力学紊乱所致的功能性改变[1-4]. 其主要因素是内脏循环动脉扩张, 激发强烈的维持内环境稳定的神经内分泌反应, 最终导致肾脏血管收缩和肾脏功能障碍[5-6]. 细胞凋亡是肾脏缺血再灌注性损伤的主要机制之一, 随着肝硬化的进展肾脏有无形态学改变, 对认识肝硬化肾损伤的本质有重要意义[7-8]. 本研究采用胆总管结扎(common bile duct ligation, CBDL)制备胆汁性肝硬化大鼠模型, 旨在探讨胆汁性肝硬化大鼠肾脏的组织病理学改变, 肾脏组织细胞凋亡和凋亡相关基因蛋白Bcl-2、Bax的表达.
实验动物选用成年健康♂Sprague Dawley大鼠, 共30只, 体质量350-400 g, 清洁级, 由河北医科大学实验动物中心提供. TUNEL试剂盒购自美国金丰泰公司, Bcl-2和Bax试剂盒由美国Santa Cruz公司提供.
1.2.1 模型建立与分组: 将30只大鼠随机分为: (1)假手术组(sham operation, SO)10只, 施行假手术, 即仅分离胆总管不作结扎和剪断; (2)实验组大鼠20只, 应用CBDL技术制备胆汁性肝硬化动物模型[9], 术后2 wk与5 wk分别随机处死大鼠.
1.2.2 标本取材: 将动物麻醉处死, 留取肝、肾组织各200 mg置于液氮中. 另切取小块肝脏和肾组织浸入1%和4%戊二醛溶液中, 常规方法分别制备1 μm电镜切片和5 μm病理切片.
1.3.1 肝肾组织学变化: 分别采用光学显微镜和电子显微镜观察.
1.3.2 生化指标检测: 各组大鼠处死前在大鼠代谢笼中放置24 h以收集尿液, 测量24 h尿量. 取冻存血清及尿液按试剂盒说明书检测血肌酐和尿肌酐, 计算内生肌酐清除率(endogenous creatinine clearance rate, Ccr).
1.3.3 肾组织丙二醛含量检测: 准确称取肾组织块0.5 g, 加4.5 mL生理盐水制成10%组织匀浆. 取100 μL标本, 按试剂盒说明采用硫代巴比妥酸比色法测定丙二醛含量.
1.3.4 TUNEL法检测细胞凋亡: 按试剂盒说明书进行操作, 每批检测均包括阴性对照(只加标记液), 以卵巢阳性片作阳性对照. 200倍光镜视野下进行阳性细胞计数分析. 每张切片选10个视野进行摄像分析, 测量每个视野内阳性细胞数和总细胞数, 计算细胞凋亡指数.
1.3.5 免疫组化染色法检测Bax、Bcl-2基因蛋白: 肾标本脱蜡水化后按试剂盒说明书进行操作, DAB显色, 苏木精复染, 中性树胶封片. 每组不同时相点分别选6个大鼠标本各1张切片. 在200倍光镜视野下随机选择背景和阳性组织区域各3处, 应用HPIAS-1000高清晰度彩色病理图文分析系统, 分别测量其灰度值, 计算阳性组织相对灰度值(阳性组织灰度值/背景灰度值).
统计学处理 计量资料以mean±SD表示, 用SPSS13.0软件进行统计分析. 多组数据间比较用单因素方差分析检验(One-way ANOVA), 组间均数比较采用DUNNETT法, 两组均数间差异采用t检验, P<0.05即认为有统计学意义.
各组动物模型均成功建立, 其中1只大鼠2 wk时死于腹腔感染, 1只5 wk时死于瘀胆性肝病恶液质; SO组全部存活. 模型组大鼠5 wk组较其他组毛色蓬乱, 活动减少, 食欲减退, 体重减轻, 腹部膨隆; 2 wk组大鼠表现不明显, 仅个别大鼠体重减轻; SO组无明显变化.
2.2.1 肝脏大体形态学变化: 模型组大鼠5 wk组术中可见腹水, 肝脏体积明显缩小, 质硬, 色暗, 表面颗粒样隆起; 2 wk组大鼠均无腹水, 肝脏体积无明显变化, 有的略增大, 质稍硬, 表面无隆起; SO组大鼠肝脏质柔软, 色泽鲜艳, 表面光滑.
2.2.2 肝脏组织病理学变化: HE及Masson三色染色显示, SO组大鼠肝小叶结构完整, 肝板排列整齐. 模型组大鼠2 wk时, 肝板正常排列消失, 小叶结构紊乱, 门管区小胆管面积扩大, 肝小叶内亦有纤维组织增生; 5 wk大鼠肝脏广泛纤维组织增生, 中央静脉周围出现胶原纤维沉积, 肝小叶结构紊乱甚至形成假小叶.
2.3 内生肌酐清除率 模型大鼠5 wk组Ccr(1.10±0.03 mL/(min·100 g)明显降低, 较2 wk组(1.40±0.03 mL/(min·100 g), P<0.05)与SO组(1.80±0.02 mL/(min·100 g), P<0.01)有显著性差异, 且各时相组间有明显性差异(P<0.05). 表明Ccr在大鼠肝硬化病变进程中呈进行性下降.
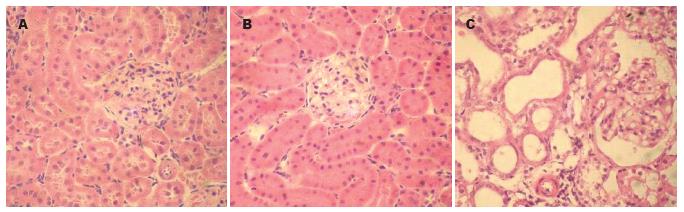
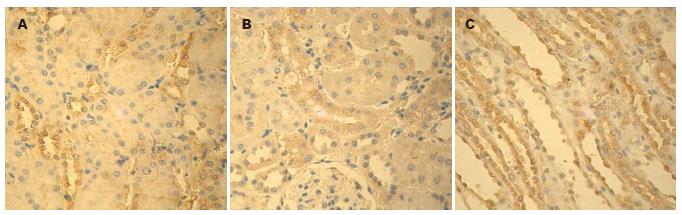
2.4.1 光镜下观察: SO组大鼠肾脏无显著变化. 模型大鼠2 wk组肾近曲小管上皮细胞浊肿、肾小球肿胀、肾小球囊腔狭窄、肾小管上皮细胞刷状缘丢失; 5 wk时肾脏近曲小管上皮细胞变性水肿、肾小球囊腔狭窄明显加重, 肾小管上皮细胞刷状缘丢失甚至坏死、脱落和细胞聚集(图1).
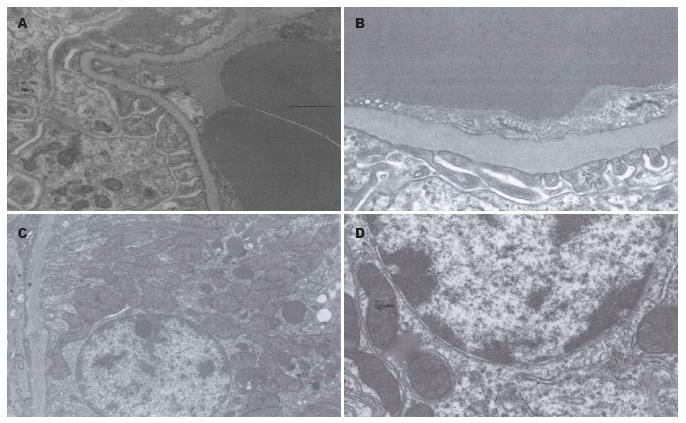
2.4.2 大鼠肾脏组织电镜观察: 放大5000倍观察模型大鼠5 wk组, 近曲小管游离面微绒毛数量减少, 排列不整, 细胞质内有大小不等的空泡; 放大15 000倍观察, 线粒体肿胀, 嵴减, 部分线粒体嵴融合, 部分膜融合和消失, 粗面内质网部分膜旁核糖体融合拟或脱颗粒, 核膜双层, 部分双层核膜融合和消失. 基底膜增厚, 厚薄不均, 广泛的足突融合现象, 毛细血管窗孔大部分融合. 相同倍数下观察SO组大鼠肾组织无明显异常变化(图2).
SO组大鼠丙二醛含量为0.79±0.37 nmol/mg.pro, 模型大鼠2 wk组为2.32±0.85 nmol/mg.pro, 5 wk组达4.07±0.51 nmol/mg.pro, 组间比较有显著性统计学差异(P<0.01); 其中5 wk组较2 wk组与SO组显著性增高(P<0.01), 2 wk组与SO组间有显著性差异(P<0.05). 表明随着大鼠肝硬化的进展, 肾组织丙二醛含量逐渐增加.
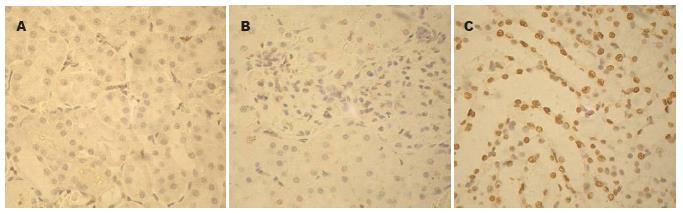
TUNEL法检测显示, 细胞核染色为棕色颗粒状为凋亡细胞. 模型大鼠5 wk组肾组织凋亡指数为68.36%±8.71%, 显著性高于2 wk组(24.08%±2.59%, P<0.01)和SO组(11.43±2.77, P<0.01); 2 wk组与SO组比较亦有差异(P<0.01). 表明随着肝脏病变的不断进展肾细胞凋亡逐渐增加(图3, 表1).
肝硬化时机体发生一系列病理生理学变化, 其中内毒素血症、全身及肾血流动力学改变等均对肾脏功能产生一定影响, 主要是由于内脏循环动脉扩张, 通过神经内分泌的过度调节反应, 最终导致肾脏血管收缩、钠水潴留等[3,5,8,10]. 目前认为肝肾综合征(hepatal renal syndrome, HRS)系肾血管收缩造成肾脏明显低灌流的结果, 肾脏低灌流是动脉循环灌流不足的表现, 而后者的出现是全身动脉扩张的极端表现[5,11-13].
长期以来, 人们认为肝硬化特别是HRS时, 肾功能损伤为功能性肾衰竭[14]; 肝硬化进程中肾脏组织究竟有无病理学变化研究非常之少.
本实验研究结果显示, CBDL大鼠5 wk时, 随着肝硬化病变的加重, 肾脏表现为肾小管上皮细胞变性、坏死、脱落和细胞聚集, 甚至出现肾小管大片组织坏死现象, 表明大鼠肾脏有组织病理学变化. 此实验结果与刘祥德 et al[15]的研究结果相似, 可见"细胞坏死"是胆汁性肝硬化大鼠肾脏细胞死亡的方式之一. 梗阻性黄疸发生后机体发生了一系列病理变化,其中低血压、低血容量、内毒素血症、高胆红素血症、肾血管纤维素沉积、全身及肾血流动力学改变等均对肾脏功能产生一定的影响[16-18], 胆红素的升高及全身血液动力学的改变对肾脏损害较大,但目前关于黄疸发生后肾脏本身的损伤机制及继发性变化则没有较深入研究. 基于本实验采用CBDL肝硬化模型, 我们认为肾组织的严重坏死不能除外胆汁淤积的影响.
细胞凋亡是细胞内死亡程序活化而导致的细胞自杀. 细胞凋亡的发生一方面是损害因素导致凋亡抑制基因低表达和促凋亡基因高表达, 反之亦然[19-20]. 当机体受损细胞发生凋亡时, 其凋亡相关蛋白的表达必定发生变化, 其表达变化具有始动作用拟或继发性改变, 而凋亡抑制蛋白和凋亡促进蛋白的表达比率决定了凋亡是否发生[21-22], 其中Bcl-2家族备受重视. Bcl-2、Bcl-xL和Bax是该家族中的重要成员, 他们主要通过线粒体途径参与凋亡调控, 当细胞受到死亡信号刺激, 与Bcl-2或Bcl-xL相结合的Bax就会被置换出来, 线粒体膜通透性增加, 释放出一系列物质, 最终导致细胞死亡[23]. 最新研究认为可以决定凋亡发生的亚细胞结构为线粒体, 因为线粒体的结构、功能改变与凋亡的发生与否明显相关, 而稳定线粒体内外膜有各种因素, 如原癌基因Bcl-2能够防止凋亡的发生, 而线粒体与半胱天冬酶级联酶相互影响可以导致凋亡.
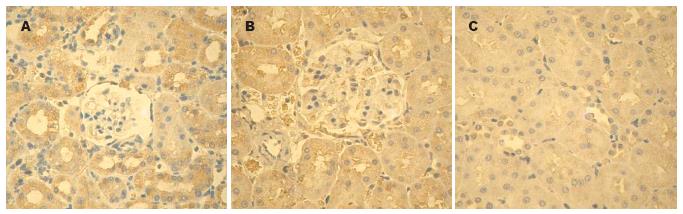
本实验应用电镜观察5 wk组CBDL大鼠肾脏, 发现线粒体肿胀, 嵴减, 部分线粒体嵴融合, 以及其他亚细胞器的明显形态学改变; 同时应用TUNEL染色技术对CBDL大鼠肾组织凋亡研究结果显示, 5 wk时细胞凋亡率明显增加. 本实验从基因蛋白表达上研究发现, CBDL大鼠5 wk时肾脏Bcl-2蛋白表达显著降低, 并且细胞凋亡的逐渐增加与Bcl-2降低的变化趋势相平行, 说明凋亡抑制蛋白Bcl-2在CBDL大鼠肾脏细胞凋亡发生中起作用. 与此同时, CBDL大鼠5 wk时肾脏组织Bax表达水平显著升高, 亦与细胞凋亡逐渐增多的趋势一致. 进一步证明CBDL肝硬化大鼠存在肾脏组织细胞凋亡, 细胞凋亡可能系此类大鼠肾脏细胞死亡的主要方式; 肾细胞凋亡与凋亡抑制蛋白Bcl-2低表达和凋亡诱导蛋白Bax高表达有关.
Bax与Bcl-2作为细胞凋亡调控基因, 其基因表达产物蛋白质可以通过抗氧化途径、氧化应激调节诱导凋亡发生, 已有多项研究结果支持自由基增加可以诱导细胞凋亡[24]. 本实验模型大鼠5 wk组肾脏组织丙二醛含量显著性升高; 大鼠肾脏组织丙二醛水平随肝硬化的进展呈进行性升高, 并且丙二醛含量与细胞凋亡呈同步性变化. 表明肝硬化大鼠肾组织细胞凋亡发生与肾脏自由基增加有关.
总之, 本实验发现CBDL大鼠随着肝硬化的进展, 在胆汁淤积型肝硬化大鼠中肾脏存在病理组织学改变并呈逐渐加重趋势. 肾细胞凋亡系CBDL大鼠肾脏损伤的发生机制之一, 促凋亡相关基因蛋白表达增加和抑制凋亡蛋白表达减少是细胞凋亡发生的直接生物学因素, 氧化应激与自由基增加是肾脏损伤的重要原因.
早在19世纪末期就有人对HRS的临床表现进行了描述. 肝移植可使肝硬化合并肝肾综合征的肾脏重新获得正常的肾功能. 由此证实了肝肾综合征时肾功的损伤为功能性肾衰竭. 但是肝硬化过程中肾脏组织到底有无病理变化研究非常少, 研究肾脏有无形态学改变, 对认识肝硬化肾损伤的本质有重要意义.
张锦生, 教授, 复旦大学上海医学院病理学系; 刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科.
细胞凋亡是肾脏缺血再灌注性损伤的主要机制之一, 随着肝硬化的进展肾脏有无形态学改变, 对认识肝硬化肾损伤的本质有重要意义.
目前认为肝肾综合征HRS系肾血管收缩造成肾脏明显低灌流的结果, 肾脏低灌流是动脉循环灌流不足的表现, 而后者的出现是全身动脉扩张的极端表现.
本研究采用胆总管结扎CBDL制备胆汁性肝硬化大鼠模型, 观察胆汁性肝硬化肾脏的病理变化, 检测与细胞凋亡相关的肾组织中丙二醛的含量、肾脏组织凋亡情况, 并同时检测和凋亡有关的基因蛋白Bcl-2、Bax表达水平.
本研究为阐明胆汁性肝纤维化、肝硬化时肝肾综合征的病理基础提供了实验依据, 具有一定的学术价值. 但该文的研究方法较简单.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Salerno F, Gerbes A, Ginès P, Wong F, Arroyo V. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut. 2007;56:1310-1318. [PubMed] [DOI] |
| 2. | Gerbes AL, Gulberg V. Progress in treatment of massive ascites and hepatorenal syndrome. World J Gastroenterol. 2006;12:516-519. [PubMed] |
| 3. | Arroyo V, Jiménez W. Complications of cirrhosis. II. Renal and circulatory dysfunction. Lights and shadows in an important clinical problem. J Hepatol. 2000;32:157-170. [PubMed] [DOI] |
| 4. | Arroyo V, Terra C, Ginès P. New treatments of hepatorenal syndrome. Semin Liver Dis. 2006;26:254-264. [PubMed] [DOI] |
| 5. | Liu H, Gaskari SA, Lee SS. Cardiac and vascular changes in cirrhosis: pathogenic mechanisms. World J Gastroenterol. 2006;12:837-842. [PubMed] |
| 6. | Wong F, Pantea L, Sniderman K. Midodrine, octreotide, albumin, and TIPS in selected patients with cirrhosis and type 1 hepatorenal syndrome. Hepatology. 2004;40:55-64. [PubMed] [DOI] |
| 7. | Wong F, Blendis L. New challenge of hepatorenal syndrome: prevention and treatment. Hepatology. 2001;34:1242-1251. [PubMed] [DOI] |
| 8. | Wadei HM, Mai ML, Ahsan N, Gonwa TA. Hepatorenal syndrome: pathophysiology and management. Clin J Am Soc Nephrol. 2006;1:1066-1079. [PubMed] [DOI] |
| 9. | Miyazono M, Garat C, Morris KG, Carter EP. Decreased renal heme oxygenase-1 expression contributes to decreased renal function during cirrhosis. Am J Physiol Renal Physiol. 2002;283:F1123-F1131. [PubMed] |
| 10. | Arroyo V, Colmenero J. Ascites and hepatorenal syndrome in cirrhosis: pathophysiological basis of therapy and current management. J Hepatol. 2003;38 Suppl 1:S69-S89. [PubMed] [DOI] |
| 11. | Wen Y, Cui W, Liu P. Type I inositol 1, 4, 5-triphosphate receptors increase in kidney of mice with fulminant hepatic failure. World J Gastroenterol. 2007;13:2344-2348. [PubMed] |
| 12. | Turban S, Thuluvath PJ, Atta MG. Hepatorenal syndrome. World J Gastroenterol. 2007;13:4046-4055. [PubMed] |
| 13. | Cárdenas A. Hepatorenal syndrome: a dreaded complication of end-stage liver disease. Am J Gastroenterol. 2005;100:460-467. [PubMed] [DOI] |
| 14. | Betrosian AP, Agarwal B, Douzinas EE. Acute renal dysfunction in liver diseases. World J Gastroenterol. 2007;13:5552-5559. [PubMed] |
| 16. | Utkan ZN, Utkan T, Sarioglu Y, Gönüllü NN. Effects of experimental obstructive jaundice on contractile responses of dog isolated blood vessels: role of endothelium and duration of bile duct ligation. Clin Exp Pharmacol Physiol. 2000;27:339-344. [PubMed] [DOI] |
| 17. | Papakostas C, Bezirtzoglou E, Pitiakoudis M, Polychronidis A, Simopoulos C. Endotoxinemia in the portal and the systemic circulation in obstructive jaundice. Clin Exp Med. 2003;3:124-128. [PubMed] [DOI] |
| 18. | Tanaka Y, Kobayashi Y, Gabazza EC, Higuchi K, Kamisako T, Kuroda M, Takeuchi K, Iwasa M, Kaito M, Adachi Y. Increased renal expression of bilirubin glucuronide transporters in a rat model of obstructive jaundice. Am J Physiol Gastrointest Liver Physiol. 2002;282:G656-G662. [PubMed] |
| 19. | Cağlikülekci M, Pata C, Apa DD, Dirlik M, Tamer L, Yaylak F, Kanik A, Aydin S. The effect of N-acetylcysteine (NAC) on liver and renal tissue inducible nitric oxide synthase (iNOS) and tissue lipid peroxidation in obstructive jaundice stimulated by lipopolysaccharide (LPS). Pharmacol Res. 2004;49:227-238. [PubMed] [DOI] |
| 20. | Kucuk C, Sozuer E, Ikizceli I, Avsarogullari L, Keceli M, Akgun H, Muhtaroglu S. Role of oxygen free radical scavengers in acute renal failure complicating obstructive jaundice. Eur Surg Res. 2003;35:143-147. [PubMed] [DOI] |
| 21. | Mizuno S, Nakamura T. Prevention of neutrophil extravasation by hepatocyte growth factor leads to attenuations of tubular apoptosis and renal dysfunction in mouse ischemic kidneys. Am J Pathol. 2005;166:1895-1905. [PubMed] |
| 22. | Xie Q, Lin T, Zhang Y, Zheng J, Bonanno JA. Molecular cloning and characterization of a human AIF-like gene with ability to induce apoptosis. J Biol Chem. 2005;280:19673-19681. [PubMed] [DOI] |