修回日期: 2008-07-10
接受日期: 2008-07-21
在线出版日期: 2008-07-28
目的: 分析1例胰蛋白酶原基因新突变慢性胰腺炎患者的分子生物学特征.
方法: 收集患者的一般资料, 并对胰腺炎易感基因-胰蛋白酶原基因(protease serine 1, PRSS1)进行PCR扩增, 纯化后直接测序. 进行文献回顾, 初步分析其发病原因.
结果: 慢性胰腺炎患者的胰蛋白酶原基因3号外显子区存在c.369C→T突变为杂合性突变, 造成p.141 Ala→Pho. 携带胰蛋白酶原基因突变的胰腺炎患者与普通的胰腺炎患者具有一样的胰腺酶谱规律.
结论: PRSS1基因3号外显子的c.369C→T杂合性突变与胰腺炎有关.
引文著录: 郜峰, 肖肖, 庄则豪, 刘奇才. 胰蛋白酶原基因新突变胰腺炎患者的临床分子生物学特征. 世界华人消化杂志 2008; 16(21): 2428-2430
Revised: July 10, 2008
Accepted: July 21, 2008
Published online: July 28, 2008
AIM: To analyze the mutation of protease serine 1 (PRSS1) gene in patients with chronic pancreatitis (CP).
METHODS: The general data of one female CP patient were collected, and the PRSS1 gene were amplified using polymerase chain reaction (PCR) and then sequenced. Meanwhile, the related literatures were retrospectively analyzed in order to investigate the pathogenic mechanism.
RESULTS: We found c.369 C→T mutation in exon 3 of PRSS1 gene and this mutation resulted in an amino change (p.141 Ala→Pho). There was no difference in the enzyme spectrum (AMY, LIPA and CRP) between this female patient and general CP patients.
CONCLUSION: The mutation of c.369 C→T in PRSS1 gene may be related to CP.
- Citation: Gao F, Xiao X, Zhuang ZH, Liu QC. Clinical and molecular characteristics of pancreatitis patients with novel mutation of protease serine 1 gene. Shijie Huaren Xiaohua Zazhi 2008; 16(21): 2428-2430
- URL: https://www.wjgnet.com/1009-3079/full/v16/i21/2428.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i21.2428
胰腺炎近年来发病率呈上升趋势[1], 发病率为10-70/10万人, 其中重症胰腺炎(severe acute pancreatitis, SAP)病死率可高达15%-20%[2], 严重威胁我国人民的健康. 西方及亚太大多数国家的胰腺炎与嗜酒有关, 而在我国是以胆道疾病为主要原因, 其他病因有胰酶自身消化、细菌感染、白细胞过度激活和血循环障碍等. 随着研究的进展, 基因遗传背景在胰腺炎病因中的作用日益受到人们的关注, 基于此我们对胰腺炎患者的胰蛋白酶原基因进行全长测序, 发现1例胰蛋白酶原基因新突变位点的慢性胰腺炎病例, 现报道如下[7-9].
患者, 女, 22岁, 以"持续性腹痛, 进食后加剧"为主诉收治入院. 胰腺炎的诊断标准: (1)上腹痛反复发作、胰区有压痛或触及包块、胰腺功能检查、胰腺影像学检查有阳性发现者; (2)有明显的胰腺钙化灶或结石; (3)有胰腺组织学变化.
1.2.1 DNA提取: 知情同意后, 取胰腺炎患者和三例健康人的外周血2 mL, EDTA抗凝. 用Biosping公司生产的试剂盒提取DNA, 按使用说明书操作.
1.2.2 PCR引物及PCR反应: 采用自行设计的引物上游引物5'-GGTCCTGGGTCTCATACCTT-3', 下游引物5'-GGGTAGGAGGCTTCACACTT-3', PCR反应体积为50 μL, 含1 μL样品DNA, 上游引物0.4 μL,下游引物0.4 μL, 1 μL dNTP, 10×PCR缓冲液5 μL, 4 μL Mg2+, 1 U Tag酶, 在PE9700热循环仪上94 ℃ 5 min预变性后, 94℃ 5 min→94℃ 1 min→52℃ 1 min→72℃ 1 min→72℃ 7 min, 循环30次.
1.2.3 PCR产物纯化和回收: 使用Tiangen公司胶回收试剂盒, 按使用说明操作, 回收产物.
1.2.4 测序: PCR产物直接测序由上海生工生物技术服务有限公司完成.
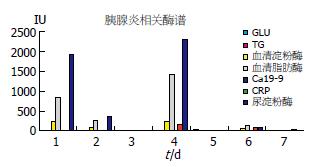
1.2.5 临床资料收集: 收集该胰腺炎患者不同时期血糖(GLU), 急性时相反应蛋白(CRP), 血淀粉酶(AMY), 血脂肪酶(LIPA), 甘油三酯(TG), 糖类抗原(CA19-9). 记录其他临床一般资料(年龄、性别、发病年龄、病程、并发症及治疗情况).
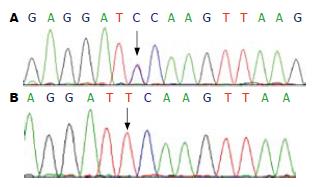
对PCR产物进行DNA测序. 结果与NCBI网站上公布的PRSSI DNA标准序列(GI: 1616765)比对, 证实PRSS1基因3号外显子存在c.369 C→T杂合性突变(图1).
患者的血糖、TG、Ca19-9水平未见明显升高; 血清脂肪酶、血清(尿)淀粉酶、CRP均为反应炎症的指标, 同时增高可反应炎症加剧. 其病后7 h血淀粉酶迅速增高, 6 d恢复正常, 尿淀粉酶升高较晚, 下降缓慢, 持续2 wk(图2).
PRSS1基因位于7号染色体长臂3区5段(7q35), 1996年Whitcomb et al[3-5]发现, 遗传性慢性胰腺炎是由于第7染色体长臂上的阳离子胰蛋白酶原基因的突变; 阳离子胰蛋白酶原所起的作用是水解食物中含有赖-精氨酸残基的蛋白质, 同时他在激活、灭活其他消化酶的过程中起关键作用[6]. 目前, 已有一些胰蛋白酶原基因突变的报告, 其中R122H突变最常见[1]. 基于此我们对该胰腺炎患者的胰蛋白酶原基因进行检测发现PRSS1基因3号外显子存在c.369 C→T杂合性突变, 由于氨基酸的转变, 改变了胰蛋白酶原基因上Ca2+的结合位点, 胰蛋白酶原受Ca2+激活成胰蛋白酶, 胰腺中含有的Ca2+可使胰蛋白酶原激活而导致胰腺的自身消化, 引发胰腺炎.
胆囊结石、酒精、高脂血症、ERCP、创伤等多种原因可导致急性胰腺炎. 目前TG升高引起的SAP有上升趋势, 亚特兰大急性型胰腺炎临床诊断及分级标准(1992)中的重症胰腺炎[10-11], 发病72 h内, TG高于6.8 mmol/L, 排除其他病因诊断为高脂血症性重症胰腺炎. 该患者的TG略增高, 可以排除高脂血症性胰腺炎. 感染性胰腺炎: 急性胰腺炎继发于急性传染性疾病者多数较轻, 随感染痊愈而自行消退, 如传染性单核细胞增多症、细菌感染、急性流行性腮腺炎和肺炎衣原体感染等. 常可伴有特异性抗体浓度升高, 和白细胞增高. 该患者特异性抗体浓度正常, 且病情较重, 故可排除感染性胰腺炎. 酒精性胰腺炎: 由于胰岛周围的小静脉被纤维化的组织压迫, 胰岛分泌的胰岛素不能进入血液循环, 可发生糖尿病. 该患者血糖浓度略高或正常, 且无酗酒史, 故可排除酒精性胰腺炎.
PRSS1基因突变与胰腺炎发病的关联, 目前已受到国际胰腺病学专家的一致认可, 据可查文献显示约有150个胰蛋白酶原基因突变的胰腺炎家系被报道, 而散发病例目前已超过400例, 其中在欧美主要是以PRSS1基因的2号和3号外显子突变为主[12-14], 在蒙古利亚人种(特别是汉族人)最近的研究表明其突变热点与国外文献报道存在较大差异, 主要是以杂合性突变为主. 对胰腺炎基因易感的研究, 将为急、慢性胰腺炎的治疗带来新的线索.
胰腺炎是一种危害人类健康的常见疾病, 近几年来发病率呈上升趋势, 其个体易感性与基因的遗传多态性有关, 而且基因遗传多态影响着病情的发展. 胰蛋白酶原基因(PRSS1)是目前少数明确与胰腺炎发病相关的基因之一.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科.
国外大量的研究已证明遗传性胰腺炎和特发性胰腺炎患者中存在PRSS1基因突变热点, 国内近年来也陆续有人发现PRSS1基因突变的遗传性胰腺炎家系.
国内这方面的研究尚不多, 本研究处国内领先水平, 不足之处为仅观察1例患者.
编辑: 李军亮 电编:吴鹏朕
| 1. | Whitcomb DC, Gorry MC, Preston RA, Furey W, Sossenheimer MJ, Ulrich CD, Martin SP, Gates LK Jr, Amann ST, Toskes PP, Liddle R, McGrath K, Uomo G, Post JC, Ehrlich GD. Hereditary pancreatitis is caused by a mutation in the cationic trypsinogen gene. Nat Genet. 1996;14:141-145. [PubMed] [DOI] |
| 3. | Lee TY, Oh HC, Kim MH, Kwon S, Lee SS, Seo DW, Lee SK. [Three cases of hereditary pancreatitis in two households in the same family associated with R122H mutation in cationic trypsinogen gene]. Korean J Gastroenterol. 2007;49:395-399. [PubMed] |
| 4. | Sahin-Tóth M, Tóth M. Gain-of-function mutations associated with hereditary pancreatitis enhance autoactivation of human cationic trypsinogen. Biochem Biophys Res Commun. 2000;278:286-289. [PubMed] [DOI] |
| 5. | 刘 奇才, 郜 峰, 庄 则豪, 杨 滨, 林 寿榕, 伊 强. 中国遗传性胰腺炎患者胰蛋白酶原基因多位点杂合突变及其临床 特征. 生物化学与生物物理进展. 2007;34:1269-1278. |
| 6. | Liu QC, Cheng ZJ, Yang Y, Ou QS. [A novel mutation of PRSS1 gene in a Chinese hereditary pancreatitis family]. Yi Chuan. 2007;29:1067-1070. [PubMed] [DOI] |
| 7. | Chandak GR, Idris MM, Reddy DN, Mani KR, Bhaskar S, Rao GV, Singh L. Absence of PRSS1 mutations and association of SPINK1 trypsin inhibitor mutations in hereditary and non-hereditary chronic pancreatitis. Gut. 2004;53:723-728. [PubMed] [DOI] |
| 8. | Le Maréchal C, Masson E, Chen JM, Morel F, Ruszniewski P, Levy P, Férec C. Hereditary pancreatitis caused by triplication of the trypsinogen locus. Nat Genet. 2006;38:1372-1374. [PubMed] [DOI] |
| 9. | Etemad B, Whitcomb DC. Chronic pancreatitis: diagnosis, classification, and new genetic developments. Gastroenterology. 2001;120:682-707. [PubMed] [DOI] |
| 10. | Howes N, Lerch MM, Greenhalf W, Stocken DD, Ellis I, Simon P, Truninger K, Ammann R, Cavallini G, Charnley RM. Clinical and genetic characteristics of hereditary pancreatitis in Europe. Clin Gastroenterol Hepatol. 2004;2:252-261. [PubMed] [DOI] |
| 11. | Teich N, Ockenga J, Hoffmeister A, Manns M, Mossner J, Keim V. Chronic pancreatitis associated with an activation peptide mutation that facilitates trypsin activation. Gastroenterology. 2000;119:461-465. [PubMed] [DOI] |
| 12. | Sahin-Toth M. Human cationic trypsinogen. Role of Asn-21 in zymogen activation and implications in hereditary pancreatitis. J Biol Chem. 2000;275:22750-22755. [PubMed] [DOI] |
| 13. | Teich N, Ockenga J, Keim V, Mossner J. Genetic risk factors in chronic pancreatitis. J Gastroenterol. 2002;37:1-9. [PubMed] [DOI] |