修回日期: 2007-12-04
接受日期: 2008-01-06
在线出版日期: 2008-01-18
目的: 采用RNA干扰(RNAi)技术抑制肝癌细胞系HepG2肝素酶(Hpa)的表达, 体内观察其对肿瘤生长的抑制作用.
方法: 以脂质体介导的方法将构建的2个抗Hpa短发卡式RNA(Hpa-shRNA)真核表达载体稳定转染人肝癌细胞株HepG2(高表达Hpa), 并设空载体对照组; 流式细胞技术鉴定转染稳定性, Western blot及RT-PCR检测肝素酶蛋白和mRNA表达; 将干扰组和对照组的肿瘤细胞皮下接种裸鼠, 比较各组肿瘤的体质量和体积大小, 免疫组化法检测肝素酶在肿瘤组织的表达.
结果: 与空载体组相比, 干扰后的HepG2细胞中Hpa mRNA和蛋白表达明显降低, 干扰组裸鼠的肿瘤生长速度明显变慢, 统计结果表明干扰组在抑制肿瘤生长方面与空载体组、空白对照组存在显著差异(P<0.05), 两干扰组无显著差异(P>0.05).
结论: 应用RNAi技术沉默Hpa基因可以有效下调肝癌肿瘤细胞中Hpa mRNA及蛋白的表达, 抑制体内肿瘤生长.
引文著录: 檀英霞, 刘志玄, 李素波, 田曙光, 卞丽红, 宫锋. RNA干扰对肝素酶在肝癌细胞中表达及其肿瘤生长抑制的作用. 世界华人消化杂志 2008; 16(2): 138-143
Revised: December 4, 2007
Accepted: January 6, 2008
Published online: January 18, 2008
AIM: To investigate the inhibitory effect of siRNA on heparanase expression in HepG2 cells in vitro and in vivo.
METHODS: Human hepatocellular carcinoma (HCC) cell line HepG2, which has naturally high levels of endogenous heparanase, was transfected with a plasmid expressing siRNA directed against human heparanase mRNA (experiment-al groups). An empty vector was designed as a control. The stability of transfection was analyzed by flow cytometry. RT-PCR and Western blotting were used to confirm the efficient silencing of heparanase gene expression. Cells transfected with siRNA vectors were inoculated subcutaneously into nude mice to test the proliferation of tumor cells. Heparanase expression in tumor was tested by immunohistochemistry.
RESULTS: Compared with cells transfected with empty vector, HepG2 cells transfected with the anti-heparanase siRNA vectors had a significant decrease in heparanase expression. In vivo, tumors produced by cells transfected with the anti-heparanase siRNA vectors grew much slower than those arising from cells transfected with the empty vector. There were significant differences in the inhibitory effect on tumor growth between the experimental and control groups (P < 0.05), but there were no significant differences between the experimental groups.
CONCLUSION: Down-regulating the expression of heparanase by RNA interference can significantly reduce the expression of heparanase in HepG2 human HCC cells, which leads to inhibition of proliferation of HCC cells in vivo.
- Citation: Tan YX, Liu ZX, Li SB, Tian SG, Bian LH, Gong F. Silencing of heparanase by siRNA inhibits tumor growth of human hepatocellular carcinoma in vitro and in vivo. Shijie Huaren Xiaohua Zazhi 2008; 16(2): 138-143
- URL: https://www.wjgnet.com/1009-3079/full/v16/i2/138.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i2.138
肝素酶(heparanase, Hpa)是一种β-D-葡萄糖苷酸内切酶, 能特异性识别、裂解细胞外基质(ECM)和基底膜(BM)的主要成分硫酸肝素蛋白多糖(HSPG)的硫酸肝素(HS)侧链, 进而破坏由细胞外基质和基底膜组成的屏障结构, 在肿瘤细胞浸润、转移和肿瘤血管形成过程中起重要作用[1-4]. 已有大量研究证明Hpa对肿瘤扩散及转移有促进作用. 研究者先后检验多种肿瘤(胃癌[5-6]、肝癌[7-9]、胰腺癌[10]、结肠癌[11]、乳腺癌[12]、卵巢癌[13]、血液系肿瘤[14]、前列腺癌[15]、膀胱癌[16]、淋巴瘤及黑色素瘤[17-18]、口腔鳞状细胞癌[19])细胞内Hpa mRNA表达水平, 均发现肿瘤恶性程度越高, 转移潜能越大, 生长速度越快的肿瘤细胞, 其Hpa mRNA的表达水平越高, 而良性肿瘤mRNA则低水平表达, 瘤旁正常组织则不表达. 因此, 肝素酶作为肿瘤治疗及预防肿瘤转移的新靶点已为研究者关注.
本实验采用RNA干扰(RNAi)技术抑制肝癌细胞中Hpa的表达, 体内观察其对肿瘤生长的抑制作用. 我们选用并合成两对Hpa-siRNA, 构建siRNA的真核表达载体, 稳定转染肝癌细胞株HepG2, 通过RT-PCR、Western blot、裸鼠动物成瘤试验、免疫组化等方法检测siRNA的干扰效果及对肝癌细胞生长的影响, 为针对以肝素酶为靶点的抗肿瘤治疗提供新的研究结果.
两段siRNA为商品化序列, 购自吉泰生物技术公司, pGCsi RNAi载体系统购自上海吉凯生物技术有限公司; Lipofectamine2000购自Gibco BRL公司; 反转录试剂盒购自Invitrogen公司; 兔抗肝素酶多抗购自Santa Cruz公司; 流式细胞仪(BD, FACSCalibur); 鼠抗人肝素酶mAb由本室制备; 辣根过氧化物酶(HRP)标记的羊抗鼠聚合体, DAB显色试剂盒购自中杉生物技术公司; ♀4-5周龄裸鼠由本院实验动物中心提供.
1.2.1 构建Hpa-siRNA真核表达载体: 采用Ambion公司的Cenix Bioscience开发的设计软件设计并合成了两对针对Hpa的siRNA(为商品化序列), 载体为带有U6启动子、绿色荧光蛋白(GFP)基因和Neo基因的pGCsi RNAi系统, 构建2个针对Hpa的短发卡式RNA(Hpa-shRNA)真核表达载体. 将含有Hpa-siRNA序列的DNA oligos退火(90 ℃温育4 min, 70 ℃ 10 min, 慢慢冷却到10 ℃), 接入线性化的pGCsi载体(BamHⅠ和Hind Ⅲ酶切), 构建的载体命名为pGCsi-Hpa1和pGCsi-Hpa2(表1).
| Hpa-siRNA | siRNA核苷酸序列 |
| Hpa-siRNA1 | GGAAUCAACCUUUGAAGAGTT |
| CUCUUCAAAGGUUGAUUCCTT | |
| Hpa-siRNA2 | GGAGAUUCUGUAAACUUAATT |
| UUAAGUUUACAGAAUCUCCTC |
1.2.2 稳定转染HepG2细胞: 取对数生长期肝癌细胞株HepG2(本室保存), 用0.25%的胰酶(0.25 g胰酶加入到100 mL PBS中)消化细胞, 接种于6孔板(5×105/孔), 用含100 mL/L胎牛血清的DMEM培养基培养至90%融合, Lipofectamine2000介导法进行转染, 实验方法按照说明书进行. 实验分为3组: GFP空载组, 只转染空载体pGCsi(带GFP报告基因); 阳性对照组, 共转染pGCsi和带有GFP-siRNA的pGCsi载体(验证载体的有效干扰性能); 干扰组, 分别转染pGCsi-Hpa1和pGCsi-Hpa2载体, 分别命名为Hpa-si1组、Hpa-si2. 转染48 h后, 加入G418(100 mg/L), 待单克隆长成后, 镜下挑取单克隆细胞于96孔板培养, 荧光显微镜下挑取细胞克隆, 移至24孔板、6孔板, 最后于培养瓶中培养, 流式细胞仪(FACSCalibur)检测各组GFP荧光率, 保留荧光强度高的细胞株用于后续研究.
1.2.3 RT-PCR: 收集GFP空载组、Hpa-si1干扰组、Hpa-si2干扰组细胞各5×106, 按TRIzol说明书提取细胞总RNA, 用SuperScriptTM First-Strand Synthesis System for RT-PCR试剂盒按说明书进行RT-PCR. PCR引物(Hpa全长引物): 上游引物: 5'-ccgaattccaggacgtcgtggacc-3', 下游引物: 5'-cgcctaggtcagatgcaagcagca-3', 产物用10 g/L琼脂糖凝胶电泳鉴定, β-actin为内参. PCR反应条件: 95 ℃预变性5 min, 94 ℃变性2 min, 58 ℃退火30 s, 72 ℃延伸90 s, 30个循环, 72 ℃延伸10 min.
1.2.4 Western blotting分析: Hpa蛋白检测: 收集GFP空载组、Hpa-si1干扰组、Hpa-si2干扰组细胞各5×106, 加入细胞裂解液, 提取细胞总蛋白, 用BCA试剂盒检测蛋白质浓度, 等量蛋白上样, 进行10 g/L SDS-PAGE电泳, 转PVDF膜, 50 g/L脱脂奶粉封闭, TBS-T室温洗涤, 依次与兔抗肝素酶多抗(1:100)为一抗, 辣根过氧化物酶(HRP)标记的羊抗兔IgG(1:500)反应, 化学发光法(ECL)曝光显影, 冲洗胶片, β-actin为内参, 操作方法同上.
1.2.5 裸鼠皮下成瘤试验: 收集GFP空载组、Hpa-si1干扰组、Hpa-si2干扰组细胞和未转染的HepG2细胞, PBS洗2遍, 0.25%的胰酶消化细胞, PBS洗涤重悬并计数, 选择4-5周龄胸腺缺失裸鼠(20只, 每组5只, 本院实验动物中心), 背部皮下接种, 每只约1×106个细胞, 隔天测量瘤体大小和鼠体质量.
接种第19天, 将裸鼠处死, 解剖, 完整切取实体瘤, 称质量后(新鲜湿质量)40 g/L甲醛固定, 常规石蜡包埋, 切片(委托军事医学科学院二所病理室制备).
1.2.6 免疫组化检测不同组肿瘤肝素酶表达水平: 将GFP空载组、Hpa-si1干扰组、Hpa-si2干扰组的瘤组织切片放入65 ℃烤箱烘烤40 min, 常规方法脱蜡, 加入30 mL/L H2O2浸泡10 min, 清水洗两次, 柠檬酸缓冲液高压锅法抗原修复, 冷却至室温, PBS-T洗涤, 100 mL/L小牛血清PBTS-T 37 ℃. 鼠抗人肝素酶单抗37 ℃温育1 h, PBS-T洗涤, HRP标记的二抗聚合物37 ℃ 30 min, DAB显色, 苏木精复染, 封片剂封片, 于400倍显微镜下观察.
统计学处理 采用SPSS v13.0统计软件进行t检验, 数据以mean±SD表示, P<0.05具有统计学意义.
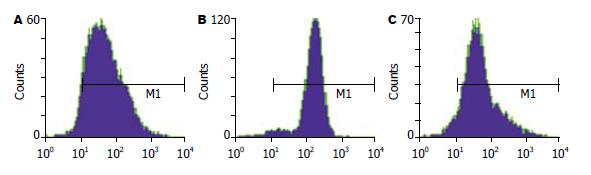
荧光显微镜下观察, 除阳性对照组, 即共转染pGCsi和pGCsi-GFP-siRNA载体组没有荧光, 其余各组克隆均有荧光. 说明GFP-siRNA发挥了干扰作用, 证明了吉凯公司合成的载体有效. 由此通过G418加压筛选所获得的Hpa-siRNA表达的阳性细胞可用于后续研究.
流式细胞术分析结果表明, GFP空载组、Hpa-si1和Hpa-si2干扰组细胞的GFP表达均为阳性, 间接说明Hpa-siRNA表达稳定性好, 可用于后续研究(图1).
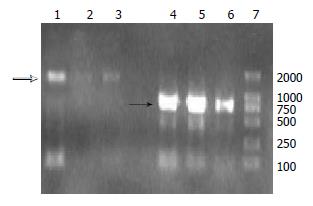
为明确siRNA转染对靶基因的影响, 我们进行RT-PCR和Western blot检测. RT-PCR结果表明: 三组细胞Hpa mRNA的特异扩增片段长度为1.6 kb左右, 与理论设计扩增长度一致(空心箭头, 图2), Hpa-siRNA稳定转染HepG2细胞后, Hpa基因mRNA转录水平较空载组明显下调.
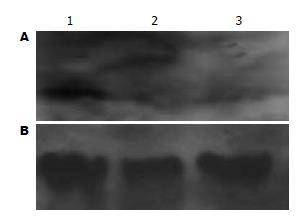
Western blot检测也得出类似结果, 三组细胞均有Hpa蛋白表达(图3), Hpa-siRNA稳定转染HepG2细胞后, Hpa蛋白表达水平较空载组明显下降. 实验结果表明Hpa-siRNA基因转染抑制了HepG2细胞肝素酶的表达.
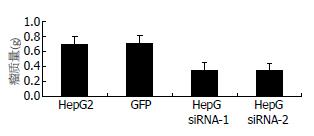
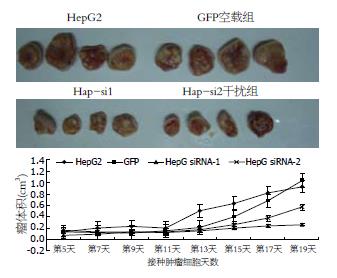
裸鼠接种HepG2细胞(空白对照组)、GFP空载组、Hpa-si1和Hpa-si2干扰组肿瘤细胞19 d时, 脱颈处死, 解剖取瘤称质量, 取每组平均值作图, 如图4所示. 数据经SPSS v13.0软件一维方差分析: HepG2组和GFP空载组间无显著差异(P>0.05); Hpa-si1和Hpa-si2干扰组间无显著差异(P>0.05), 空白对照组、GFP空载组与RNA干扰组差异显著(P<0.05). 实验数据说明GFP基因不影响靶基因Hpa mRNA表达, 空白对照组、GFP空载组与Hpa-si1和Hpa-si2干扰组肿瘤质量差别具有统计学意义.
与肿瘤质量结果一致, 空白对照与GFP空载组肿瘤体积无显著差异(P>0.05), 空白对照组、GFP空载组与RNA干扰组差异显著(P<0.05). 从肿瘤生长趋势图可以看出, 初期各组肿瘤生长速度差异不明显, 而后期空白对照组、GFP组肿瘤生长速度快, Hpa-si1和Hpa-si2干扰组速度较慢, 尤其在第11天之后差距明显, 说明其对肝素酶表达水平的抑制影响了肿瘤细胞的成瘤性(图5). 肿瘤质量和大小的统计数据说明, Hpa-siRNA能够抑制肿瘤在体内的生长.
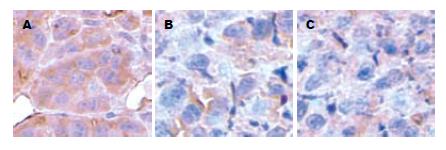
SO, AEP及倒置显微镜下观察, 三组细胞中均出现棕褐色颗粒状染色, 提示各组细胞均有肝素酶表达(图6), GFP空载组瘤组织为肝素酶强阳性, 而Hpa-si1和Hpa-si2干扰组为弱阳性. 与体外实验结果一致, RNA干扰在体内降低了肿瘤细胞肝素酶表达水平, 结合成瘤试验, 提示肝素酶的表达水平与肿瘤生长速度和肿瘤质量成正比.
肿瘤局部浸润和转移是影响手术效果和生存期的主要原因. 肿瘤浸润和转移是个复杂的多步骤的连续过程, 其中肿瘤细胞的恶性增殖和细胞外基质降解是其中的重要步骤. Hpa通过降解BM和ECM中的HSPG, 破坏限制肿瘤转移的屏障, 释放活性物质, 产生链式反应, 加快血管生成, 加强肿瘤细胞的运动能力, 促进肿瘤生长和转移, 已成为肿瘤研究者关注的指标之一[1-2,20-23]. 此外, 由于肝素酶活性与白细胞迁移进入炎区有关, 抑制肝素酶活性也可能成为治疗炎症疾病的一个新策略, 故针对Hpa的研究意义重大[24-26].
随着有关Hpa分子生物学特性、结构与功能、对肿瘤转移的促进作用与机制等研究的不断深入, 肝素酶已成为抗癌药物的重要靶点, 目前Hpa抑制剂和针对Hpa的核酸治疗是研究热点[27-30].
Hpa抑制剂的研发多集中于硫酸多糖类物质或结构类似于多糖的负离子多聚物. 因为Hpa的底物HSPG具有以上两个结构特点, 即含硫酸基团和糖链并带负电荷. 故凡具备上述特点的生物或化学物质均有可能与HSPG竞争结合Hpa结合位点, 阻止Hpa作用于底物, 抑制其活性. 核酸治疗, 指通过Hpa反义寡脱氧核苷酸(AS-ODN)、核酶和RNAi技术使肝素酶基因沉默.
针对Hpa基因的siRNA技术已显示了对肿瘤的生长和转移良好的抑制作用. 我们前期的免疫组化结果表明, 肝癌细胞株HepG2高表达Hpa, 本研究的目的是探讨下调Hpa基因对肝癌细胞生物学行为的影响. 由于siRNA较单链反义寡核苷酸显示了更好的稳定性与基因沉默效果, 因此我们采用RNAi技术, 特异性下调肝癌细胞Hpa的表达, 采用RT-PCR和Western blot方法分析靶基因Hpa mRNA及蛋白质水平的变化, 结果表明Hpa siRNA对HepG2细胞表达Hpa有较强的抑制作用, 成功地获得了稳定表达Hpa-siRNA的肝癌细胞株.
为了观察Hpa siRNA对肝癌细胞在体内生长的抑制效果, 我们通过接种裸鼠成瘤试验, 对瘤组织进行了质量、体积、免疫组化分析. 经统计学分析表明干扰组在抑制肿瘤生长方面与空载组、空白对照组存在显著差异(P<0.05), 两干扰组无显著差异(P>0.05); RNA干扰后的肝癌细胞在裸鼠体内生长速度明显下降, 干扰组的Hpa表达水平明显降低, 不仅验证了肝素酶在恶性肿瘤的发生过程中的促进作用, 还显示出Hpa siRNA在肿瘤临床治疗方面具有研究价值和发展前景.
总之, 本实验通过合成针对Hpa的siRNA, 有效抑制了肝癌细胞Hpa基因的表达, 抑制了肝癌细胞在裸鼠体内的生长, 为今后进一步研究肝素酶对细胞生物行为的影响及肿瘤治疗提供了一个有效的方法.
研究证明肝素酶(Hpa)在肿瘤细胞浸润、转移和肿瘤血管的形成过程中起重要作用, 肿瘤恶性程度越高, Hpa mRNA的表达水平越高, 转移潜能越大; 动物实验表明抑制肝素酶的表达, 肿瘤转移明显受抑制. 因此, 肝素酶作为肿瘤治疗及预防肿瘤转移的新靶点已被研究者关注.
郝春秋, 副教授, 中国人民解放军第四军医大学唐都医院传染科(全军感染病防治中心)
肝素酶同多种恶性肿瘤的转移、侵袭和预后相关, 可望成为肿瘤转移治疗的一个新的基因靶点.
目前以肝素酶为靶标的肿瘤治疗方法主要有3种: (1)Hpa抑制剂: 如硫酸昆布多糖(LS)、磷酸甘露糖戊糖硫酸盐(PI-88), PI-88已经进入Ⅱ期临床试验; (2)免疫治疗: Hpa基因修饰的树突状细胞(DC)疫苗; (3)核酸治疗: 通过反义寡脱氧核苷酸(AS-ODN)、核酶和小干扰RNA(siRNA)技术使肝素酶基因沉默.
利用RNAi技术抑制肿瘤肝素酶基因表达的研究已有报道, 但未见肝素酶-siRNA抑制肝癌细胞HepG2在裸鼠体内生长的研究报道.
本研究结果表明应用RNAi技术沉默Hpa基因可以有效下调肝癌肿瘤细胞中Hpa mRNA及蛋白的表达, 抑制体内肿瘤生长, 研究结果为研究肝素酶对细胞生物行为的影响及其在肿瘤转移中的作用机制提供了实验数据.
本文整体结构清晰, 层次分明, 实验设计基本合理, 对比恰当, 图片清晰, 结果可信, 文献引用得当.
编辑: 程剑侠 电编:郭海丽
| 1. | Vlodavsky I, Friedmann Y, Elkin M, Aingorn H, Atzmon R, Ishai-Michaeli R, Bitan M, Pappo O, Peretz T, Michal I. Mammalian heparanase: gene cloning, expression and function in tumor progression and metastasis. Nat Med. 1999;5:793-802. [PubMed] |
| 2. | Hulett MD, Freeman C, Hamdorf BJ, Baker RT, Harris MJ, Parish CR. Cloning of mammalian heparanase, an important enzyme in tumor invasion and metastasis. Nat Med. 1999;5:803-809. [PubMed] |
| 3. | Gong F, Jemth P, Escobar Galvis ML, Vlodavsky I, Horner A, Lindahl U, Li JP. Processing of macromolecular heparin by heparanase. J Biol Chem. 2003;278:35152-35158. [PubMed] |
| 4. | Maxhimer JB, Quiros RM, Stewart R, Dowlatshahi K, Gattuso P, Fan M, Prinz RA, Xu X. Heparanase-1 expression is associated with the metastatic potential of breast cancer. Surgery. 2002;132:326-333. [PubMed] |
| 5. | Wang Z, Xu H, Jiang L, Zhou X, Lu C, Zhang X. Positive association of heparanase expression with tumor invasion and lymphatic metastasis in gastric carcinoma. Mod Pathol. 2005;18:205-211. [PubMed] |
| 6. | Tang W, Nakamura Y, Tsujimoto M, Sato M, Wang X, Kurozumi K, Nakahara M, Nakao K, Nakamura M, Mori I. Heparanase: a key enzyme in invasion and metastasis of gastric carcinoma. Mod Pathol. 2002;15:593-598. [PubMed] |
| 9. | El-Assal ON, Yamanoi A, Ono T, Kohno H, Nagasue N. The clinicopathological significance of heparanase and basic fibroblast growth factor expressions in hepatocellular carcinoma. Clin Cancer Res. 2001;7:1299-1305. [PubMed] |
| 10. | Koliopanos A, Friess H, Kleeff J, Shi X, Liao Q, Pecker I, Vlodavsky I, Zimmermann A, Buchler MW. Heparanase expression in primary and metastatic pancreatic cancer. Cancer Res. 2001;61:4655-4659. [PubMed] |
| 11. | Friedmann Y, Vlodavsky I, Aingorn H, Aviv A, Peretz T, Pecker I, Pappo O. Expression of heparanase in normal, dysplastic, and neoplastic human colonic mucosa and stroma. Evidence for its role in colonic tumorigenesis. Am J Pathol. 2000;157:1167-1175. [PubMed] |
| 12. | Cohen I, Pappo O, Elkin M, San T, Bar-Shavit R, Hazan R, Peretz T, Vlodavsky I, Abramovitch R. Heparanase promotes growth, angiogenesis and survival of primary breast tumors. Int J Cancer. 2006;118:1609-1617. [PubMed] |
| 13. | Ginath S, Menczer J, Friedmann Y, Aingorn H, Aviv A, Tajima K, Dantes A, Glezerman M, Vlodavsky I, Amsterdam A. Expression of heparanase, Mdm2, and erbB2 in ovarian cancer. Int J Oncol. 2001;18:1133-1144. [PubMed] |
| 14. | Bitan M, Polliack A, Zecchina G, Nagler A, Friedmann Y, Nadav L, Deutsch V, Pecker I, Eldor A, Vlodavsky I. Heparanase expression in human leukemias is restricted to acute myeloid leukemias. Exp Hematol. 2002;30:34-41. [PubMed] |
| 15. | Ogishima T, Shiina H, Breault JE, Tabatabai L, Bassett WW, Enokida H, Li LC, Kawakami T, Urakami S, Ribeiro-Filho LA. Increased heparanase expression is caused by promoter hypomethylation and up-regulation of transcriptional factor early growth response-1 in human prostate cancer. Clin Cancer Res. 2005;11:1028-1036. [PubMed] |
| 16. | Gohji K, Hirano H, Okamoto M, Kitazawa S, Toyoshima M, Dong J, Katsuoka Y, Nakajima M. Expression of three extracellular matrix degradative enzymes in bladder cancer. Int J Cancer. 2001;95:295-301. [PubMed] |
| 17. | Pikas DS, Li JP, Vlodavsky I, Lindahl U. Substrate specificity of heparanases from human hepatoma and platelets. J Biol Chem. 1998;273:18770-18777. [PubMed] |
| 18. | Vlodavsky I, Fuks Z, Bar-Ner M, Ariav Y, Schirrmacher V. Lymphoma cell-mediated degradation of sulfated proteoglycans in the subendothelial extracellular matrix: relationship to tumor cell metastasis. Cancer Res. 1983;43:2704-2711. [PubMed] |
| 19. | Kurokawa H, Katsube K, Podyma KA, Ikuta M, Iseki H, Nakajima M, Akashi T, Omura K, Takagi M, Yanagishita M. Heparanase and tumor invasion patterns in human oral squamous cell carcinoma xenografts. Cancer Sci. 2003;94:277-285. [PubMed] |
| 20. | Vlodavsky I, Friedmann Y. Molecular properties and involvement of heparanase in cancer metastasis and angiogenesis. J Clin Invest. 2001;108:341-347. [PubMed] |
| 21. | Marchetti D, Li J, Shen R. Astrocytes contribute to the brain-metastatic specificity of melanoma cells by producing heparanase. Cancer Res. 2000;60:4767-4770. [PubMed] |
| 22. | Gohji K, Katsuoka Y, Okamoto M, Kamidono S, Kitazawa S, Toyoshima M, Dong J, Nakajima M. Human heparanase: roles in invasion and metastasis of cancer. Hinyokika Kiyo. 2000;46:757-762. [PubMed] |
| 23. | Goldshmidt O, Zcharia E, Cohen M, Aingorn H, Cohen I, Nadav L, Katz BZ, Geiger B, Vlodavsky I. Heparanase mediates cell adhesion independent of its enzymatic activity. FASEB J. 2003;17:1015-1025. [PubMed] |
| 24. | Bame KJ. Heparanases: endoglycosidases that degrade heparan sulfate proteoglycans. Glycobiology. 2001;11:91R-98R. [PubMed] |
| 25. | Irony-Tur-Sinai M, Vlodavsky I, Ben-Sasson SA, Pinto F, Sicsic C, Brenner T. A synthetic heparin-mimicking polyanionic compound inhibits central nervous system inflammation. J Neurol Sci. 2003;206:49-57. [PubMed] |
| 26. | Benezra M, Ishai-Michaeli R, Ben-Sasson SA, Vlodavsky I. Structure-activity relationships of heparin-mimicking compounds in induction of bFGF release from extracellular matrix and inhibition of smooth muscle cell proliferation and heparanase activity. J Cell Physiol. 2002;192:276-285. [PubMed] |
| 27. | Miao HQ, Elkin M, Aingorn E, Ishai-Michaeli R, Stein CA, Vlodavsky I. Inhibition of heparanase activity and tumor metastasis by laminarin sulfate and synthetic phosphorothioate oligodeoxynucleotides. Int J Cancer. 1999;83:424-431. [PubMed] |
| 28. | Parish CR, Freeman C, Brown KJ, Francis DJ, Cowden WB. Identification of sulfated oligosaccharide-based inhibitors of tumor growth and metastasis using novel in vitro assays for angiogenesis and heparanase activity. Cancer Res. 1999;59:3433-3441. [PubMed] |
| 29. | Edovitsky E, Elkin M, Zcharia E, Peretz T, Vlodavsky I. Heparanase gene silencing, tumor invasiveness, angiogenesis, and metastasis. J Natl Cancer Inst. 2004;96:1219-1230. [PubMed] |
| 30. | Zhang Y, Li L, Wang Y, Zhang J, Wei G, Sun Y, Shen F. Downregulating the expression of heparanase inhibits the invasion, angiogenesis and metastasis of human hepatocellular carcinoma. Biochem Biophys Res Commun. 2007;358:124-129. [PubMed] |