修回日期: 2008-04-18
接受日期: 2008-04-28
在线出版日期: 2008-07-08
目的: 探讨tankyrase与端粒酶在肝细胞肝癌发生、发展过程中的动态变化及其相关性.
方法: SD大鼠随机分为对照组(n = 42)和造模组(n = 42), 二乙基亚硝胺诱导大鼠肝细胞肝癌模型. 给药后3, 6, 9, 12, 15, 18, 21 wk随机处死对照组及造模组中的6只大鼠. 采用Western blot法检测tankyrase和端粒酶逆转录酶(telomerase reverse transcriptase, TERT)的表达; 免疫荧光方法原位检测细胞内TERT的表达; TRAP法检测端粒酶活性; 免疫组化方法检测细胞增殖活性(Ki-67).
结果: 在肝细胞癌变过程中, 相对于端粒酶、TERT及Ki-67在正常组织和癌前病变中的低水平表达, tankyrase在肝炎期表达就显著增加. 但至肝硬化, 特别是肝癌期几种检测指标的表达均至高峰. Tankyrase与端粒酶活性和TERT的表达呈正相关(r = 0.898, P = 0.038; r = 0.943, P = 0.016), 但与细胞的增殖活性无相关性; 而细胞增殖活性与端粒酶和TERT呈正相关(r = 0.986, P = 0.002; r = 0.93, P = 0.022).
结论: Tankyrase可能是调控端粒酶行使功能的因素之一. Tankyrase、端粒酶、TERT和Ki-67均与肝细胞肝癌的发生、发展密切相关.
引文著录: 陈颖, 孔庆忠. Tankyrase与端粒酶在大鼠肝癌发生中的表达变化. 世界华人消化杂志 2008; 16(19): 2086-2091
Revised: April 18, 2008
Accepted: April 28, 2008
Published online: July 8, 2008
AIM: To explore the dynamic states of and relationship between tankyrase and telomerase reverse transcriptase (TERT) in hepatocellular carcinoma (HCC) development in rats.
METHODS: SD rats were assigned randomly to control group (n = 42) and model group (n = 42). HCC model was induced by diethyl nitrosoamine (DENA). Twelve rats from both groups were randomly executed at 3, 6, 9, 12, 15, 18, 21 wk for further test. The expression of tankyrase and TERT was detected using Western blot and immunofluorescence analysis, whereas telomerase activity and the expression of Ki-67 were assayed using TRAP and immunohistochemical methods, respectively.
RESULTS: Compared with the low expression level of telomerase and TERT in normal tissue and precancerous lesions, the expression level of tankyrase was significantly increased in inflammatory stage, as well as in hepatocirrhotic stage, especially in HCC stage, in which stage peak values of all these factors were obtained . The expression of tankyrase was positively correlated with telomerase and TERT (r = 0.898, P = 0.038; r = 0.943, P = 0.016), but no relationship was found between tankyrase and Ki-67. However, Ki-67 was positively correlated with telomerase and TERT (r = 0.986, P = 0.002; r = 0.93, P = 0.022).
CONCLUSION: Over-expression of tankyrase might be one of the factors that regulates telomerase function as telomere elongation. Tankyrase, TERT, telomerase and Ki-67 are closely related to HCC progression.
- Citation: Chen Y, Kong QZ. Expression alteration of tankyrase and telomerase in HCC development in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(19): 2086-2091
- URL: https://www.wjgnet.com/1009-3079/full/v16/i19/2086.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i19.2086
端粒长度在维持染色体末端结构的完整性、染色体复制及调控细胞衰老和癌症发生等诸多细胞生物学过程中都发挥着重要作用. 其受到端粒酶和端粒特异结合蛋白的双重调控[1]. 端粒酶是由端粒酶逆转录酶(telomerase reverse transcriptase, TERT)和端粒酶RNA(telomerase RNA, TR)组成的核糖核蛋白复合体, 其通过在染色体末端添加TTAGGG六聚体重复序列以维持端粒长度的稳定, 借此防止染色体末端融合. 而TRF1、TRF2、Tin2及tankyrase等一些端粒结合蛋白则可通过与端粒DNA的结合, 维持并调控端粒末端结构. 这些蛋白的表达和/或功能异常均可引起端粒结构的改变, 从而导致端粒功能的丧失, 最终为那些通过端粒酶的表达来恢复端粒功能的细胞提供了选择优势.
Tankyrase是poly(ADP-ribose)polymerase (PARP)家族成员之一, 其通过调控端粒酶与端粒的结合, 间接参与端粒长度的调控[2]. 在肿瘤发生过程中tankyrase与端粒酶的相关性尚存争议. 鉴于目前未有关于tankyrase及其与端粒酶在肝癌发生中的相关报道, 我们探讨tankyrase和端粒酶在肝癌发生不同时期的动态变化及相关性, 以期为今后更深入地研究肿瘤发生机制及诊治积累资料.
Sprague-Dawley(SD)大鼠购于河南郑州大学实验动物中心; 二乙基亚硝胺、PI购于Sigma; Ki-67抗体购于NeoMarkers; TERT, tankyrase, actin抗体、化学发光试剂盒购于Santa Cruz; 碱磷酶标记IgM, PVTM, DAB检测试剂盒购于北京中杉金桥; NBT/BCIP试剂盒购于华美生物工程公司; Telo TAGGG Telomerase PCR ELISA试剂盒购于Roche. 3 mo平均体质量为120±5 g的♂SD大鼠在22±3℃, 湿度40%-70%, 间隔12 h光照的条件下饲养. 适应环境1 wk后, 随机分为对照组(n = 42)和造模组(n = 42). 根据Solt-Farber方法, 以2 g/L的二乙基亚硝胺(diethyl nitrosoamine, DENA)制备肝癌模型, 15 wk后停药. 根据大鼠肝癌的诊断标准由两位病理医生进行病理分型[3]. 造模组的病变可大致分为3阶段: 炎症期(12 wk之前)、肝硬化期(15 wk)和肝癌期(18-21 wk). 分别在给药后3、6、9、12、15、18、21 wk随机处死对照组及造模组中的6只大鼠. 取少量新鲜肝组织置于40 mL/L的多聚甲醛, 4℃固定过夜后行石蜡包埋和HE染色. 其余组织迅速放入液氮中冷冻, 随后置-80℃保存.
1.2.1 Ki-67表达的检测: 组织切片经柠檬酸抗原修复液修复, 100 mL/L山羊血清封闭. Ki-67抗体(RM-9106)(1:80)37℃孵育2 h后以PVTM检测试剂盒(PV-6001)标记二抗, DAB(ZLI-9032)显色. 以PBS代替一抗作阴性对照. 每组实验重复3次, 每张切片至少观察5个视野. IDA-2000高清晰度数码图像分析系统(中科院北京空海科技有限公司)进行光密度分析.
1.2.2 TERT蛋白表达的检测: 组织切片置柠檬酸抗原修复液修复, 200 mL/L山羊血清封闭后, 加抗TERT抗体(sc-7212)(1:600)4℃孵育过夜. FITC标记的二抗(ZF-0311)(1:400)25℃孵育40 min, 20 mL/L PI室温标记细胞核后封片, 激光共聚焦显微镜检测. PBS代替一抗作为阴性对照. 每张切片至少采集10个视野, 记数1000个细胞. 根据Dinser et al的免疫荧光半定量方法对TERT蛋白的表达强度进行相对荧光强度分析[4-5]. 相对荧光强度 = 荧光强度×面积/细胞总数. 每组实验重复3次.
1.2.3 TERT和tankyrase蛋白表达的检测: 细胞总蛋白75 µg在60 mL/L SDS-PAGE中恒压电泳后转移至硝酸纤维素膜上并用50 mL/L的脱脂奶粉封闭. 分别加入TERT(sc-7212)(1:300), tankyrase(sc-8337)(1:500)和actin(sc-1616)(1:1000)一抗4℃孵育过夜. 碱磷酶标记的二抗(ZB-2308)(1:1000)以NBT/BCIP试剂盒检测TERT的表达. 辣根过氧化物酶标记的二抗以化学发光法(sc-2048)检测tankyrase的表达. actin作为内对照, Labworks 4.0软件(UVP, Inc. USA)定量分析二者的表达强度. 每组实验重复3次.
1.2.4 端粒酶活性的检测: 用Telo TAGGG Telomerase PCR ELISA试剂盒以telomeric repeat amplification protocol(TRAP)方法检测端粒酶活性. 操作步骤按说明书. 端粒酶相对活性 = (样本A450nm-A690nm/阳性对照A450nm-A690nm)×100. 每组实验重复3次.
统计学处理 实验数据均用mean±SD表示, SPSS11.0软件对实验数据进行方差分析(ANOVA)和Spearman相关分析, P<0.05有显著性差异.
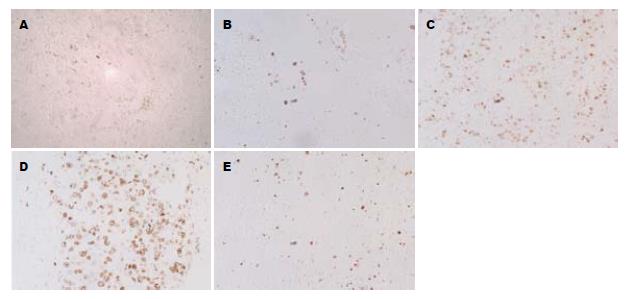
诱癌过程中细胞增殖活性逐渐增强(图1). 对照组未见Ki-67阳性表达的细胞, 造模组从诱癌的3 wk起即可见零星分布的阳性细胞. 肝硬变至肝癌期阳性细胞主要分布在增生结节中. 定量分析表明炎症后期Ki-67的表达量分别是诱癌3 wk的1.13-1.89倍. 其在肝硬变期的表达量急增至炎症期的2.7倍. 这种高水平表达一直持续到诱癌结束并有极显著差异(P<0.001), 提示细胞增生极度活跃(表1). 而癌旁组织中Ki-67的表达无统计学意义.
对照组及造模组的炎症期和癌旁组织中端粒酶活性较低并维持在相对稳定的水平, 端粒酶相对活性介于23.3%-41%之间. 随着病变的演进, 端粒酶活性在肝硬化期急增至62.8%(P = 0.02)并在其后的癌症发生过程中持续保持这一高水平(P<0.01)而癌旁组织无显著性差异(表1).
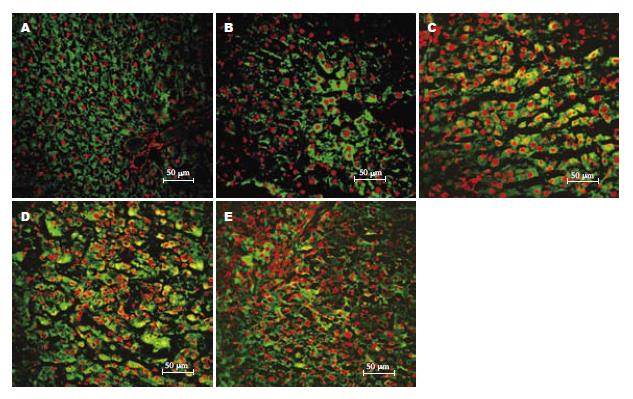
炎症期TERT蛋白表达强度较对照组中升高但尚未达到显著性差异水平. 而至肝硬化和肝癌期其表达量为13.22-17.38, 是对照组的2.95-3.88倍, 有显著性差异(P = 0.044和P<0.001)(图2). 为证实免疫荧光结果, 我们又用Western blot方法进一步验证TERT的表达(图3). 结果发现, TERT蛋白表达变化与免疫荧光方法所得结果基本一致(表1).
Tankyrase蛋白在整个诱癌过程中呈先上升后下降再上升的表达变化趋势(图4). 对照组中tankyrase蛋白少量表达, 炎症早期(诱癌3 wk)其表达量显著增加(P<0.001), 至后期(12 wk)又下降至正常水平(P = 0.834). 但在肝硬化及肝癌阶段其表达量又激增, 此时的表达量是正常组织的3.1-5.8倍(P<0.001). 而癌旁组织tankyrase的表达无统计学意义(表1).
Tankyrase蛋白的表达与TERT(P = 0.016, r = 0.943)和端粒酶(P = 0.038, r = 0.898)的表达变化呈正相关关系, 而与Ki-67之间却无相关性(P = 0.069, r = 0.849). 统计学分析显示TERT与端粒酶二者呈正相关(P = 0.006, r = 0.97). 与TERT蛋白的表达和Ki-67的显著性相关(P = 0.022, r = 0.93)相比, 端粒酶活性与Ki-67之间的相关性达到了极显著性水平(P = 0.002, r = 0.986).
端粒酶可通过维持端粒长度使细胞越过Hay-flick极限, 促使细胞永生化及癌变. 正常体细胞中端粒酶活性受到严格的调控, 而80%以上的肿瘤细胞中端粒酶活性却显著升高[6]. 端粒酶活性的调控主要涉及TR和TERT. 由于TR在多种组织中都高表达, 而TERT在正常细胞中的表达通常受到抑制, 仅在永生和肿瘤细胞中表达上调, 因此通常将TERT的表达作为调控端粒酶活性的限速步骤. 鉴于目前未有关于TERT蛋白在肿瘤发生过程中动态变化的报道, 我们首先对端粒酶与TERT蛋白在肝癌发生中的变化进行了初步研究. 结果表明, 端粒酶活性伴随肝癌的发生、发展逐步升高. 正常肝组织、炎症期和癌旁组织中端粒酶活性较低, 至肝硬化和肝癌期端粒酶活性急剧升高. 对TERT蛋白表达的定量分析结果显示其表达变化与端粒酶活性升高的趋势基本一致, 且二者呈正相关关系[7-8]. 提示TERT可能调节端粒酶活性. 对细胞增殖活性的研究发现, 细胞增殖活性与端粒酶活性和TERT表达同步升高, 呈正相关. 因抗增殖活性因子可抑制TERT和端粒酶活性, 进而促进肿瘤细胞的分化[9-10], 所以我们推测诱癌早期端粒酶活性可能促进了细胞增生. 而后期端粒酶活性的激增可能导致端粒功能的恢复和基因组稳定性的增加, 促使细胞生存能力进一步增强, 使细胞向永生化直至癌变方向发展. 同时我们还观察到同一增生结节和癌巢中单细胞内TERT及Ki-67的异质性表达现象, 提示在癌变过程中癌细胞发展的不同步性. 推测很可能只有那些增殖活性和端粒酶活性都相对较高的细胞促进并维持肿瘤生长.
在由端粒酶介导的端粒延伸的癌细胞中, tankyrase等端粒相关蛋白也可通过调控端粒酶与端粒的结合, 而诱导端粒延伸[2,11-16]. 我们采用Western blot方法分析了tankyrase在癌症发生过程中的动态变化, 结果显示tankyrase在诱癌过程中出现两次表达高峰, 与正常组织中tankyrase的表达相比均有显著差异. 这两次表达高峰之间, 即在由炎症期向肝硬化和肝癌期转换时tankyrase表达量却降至正常肝组织表达水平, 且癌旁组织中tankyrase的表达与正常组织相比并无显著性差异. 提示很可能有不同类型的tankyrase参与癌的发生. 目前研究发现, tankyrase有1和2种. Tankyrase1表达的高低与端粒长度的维持密切相关. 其表达过低, 肿瘤细胞可不依赖端粒长度和端粒酶活性而被阻滞在有丝分裂后期. 相反, 其长期过表达则有可能诱导端粒长度以一种依赖tankyrase的PARP催化活性和端粒酶活性的方式延伸[12,17]. 与tankyrase1相反, 体内实验表明, tankyrase2的高表达与端粒长度的维持无关, 但可通过耗竭NAD+, 而诱导以细胞坏死为特征的细胞死亡[18-19]. 此外tankyrase-2在肿瘤细胞中未有差异性表达而仅具有自身抗原的特性[20-21]. 鉴于炎症期观察到大量的细胞坏死, 因此此时tankyrase的高表达极有可能与tankyrase2的高表达相关, 而肝硬变和肝癌时tankyrase的高表达很可能由tankyrase1介导[22-23]. 由于目前未有分别针对tankyrase1和2的特异性商业抗体, 这一推测有待今后进一步的研究证实. 与多个小组的研究结果相一致, 我们还发现, tankyrase不仅在癌细胞中表达升高, 而且还与端粒酶活性和TERT蛋白的表达呈正相关[24-25]. 提示tankyrase可能通过ADP-核糖基化端粒长度的负调控子TRF1(telomeric repeat binding factor 1), 从而抑制TRF1与端粒的结合, 促进端粒酶与端粒的结合, 间接调控端粒酶全酶的完整性和活性, 这一过程可能更依赖于TERT蛋白的高表达[26]. 引人深思的是, tankyrase蛋白的表达升高却与细胞的增殖活性无关.
肿瘤细胞中端粒的缩短可导致肿瘤细胞的衰老和死亡, 目前已将端粒酶作为肿瘤治疗的靶点[27-29]. 但研究发现端粒酶抑制剂不能完全抑制端粒酶活性, 所残留的端粒酶活性和部分缩短的端粒又可引起靶细胞对端粒酶抑制剂的耐受性. 抑制tankyrase活性的升高不仅可以使端粒末端得到保护, 还可阻断端粒酶与端粒的结合, 进而诱导癌细胞的衰老, 并增加端粒酶抑制剂的药理学效应[17,30-31]. 因此更为详尽的阐明tankyrase在肿瘤发生中的作用, 特别是不同类型的tankyrase在肿瘤发生中的作用将对肿瘤发生机制的认识及肿瘤的诊治有着积极、重要意义.
癌症的发生是一个多因素相互作用的极其复杂的过程. 虽然迄今为止在癌症领域的研究已取得了令人可喜的成绩, 但对其发病机制的了解仍相当有限. 鉴于目前未有关于tankyrase及其与端粒酶在肝癌发生中的相关报道, 本文探讨tankyrase和端粒酶在肝癌发生不同时期的动态变化及相关性, 以期为今后更深入地研究肿瘤发生机制及诊治积累资料.
王鲁, 副教授, 复旦大学附属中山医院肝外科, 复旦大学肝癌研究所
探寻肝癌发生机制是肝癌研究领域的一大热点, 因而寻找与此相关的分子和新的干预治疗靶点具有重要意义.
多个研究小组的研究提示tankyrase与端粒酶在肿瘤发生中具有相关性.
本研究首次对tankyrase在肝癌发生过程中的动态变化进行了研究.
本研究初步探明了tankyrase和端粒酶在肝癌发生过程中的变化. 为下一步以二者为靶点的分子治疗奠定了基础, 并对肝癌的诊断、治疗及预后有着积极意义.
本文实验设计合理, 数据图表可靠, 学术价值较好.
编辑: 潘伯荣 电编:郭海丽
| 1. | Artandi SE, DePinho RA. A critical role for telomeres in suppressing and facilitating carcinogenesis. Curr Opin Genet Dev. 2000;10:39-46. [PubMed] [DOI] |
| 2. | Smith S, Giriat I, Schmitt A, de Lange T. Tankyrase, a poly(ADP-ribose) polymerase at human telomeres. Science. 1998;282:1484-1487. [PubMed] [DOI] |
| 3. | Squire RA, Levitt MH. Report of a workshop on classification of specific hepatocellular lesions in rats. Cancer Res. 1975;35:3214-3223. [PubMed] |
| 4. | Dinser R, Kreppel F, Zaucke F, Blank C, Paulsson M, Kochanek S, Maurer P. Comparison of long-term transgene expression after non-viral and adenoviral gene transfer into primary articular chondrocytes. Histochem Cell Biol. 2001;116:69-77. [PubMed] |
| 5. | Lau WK, Yeung CW, Lui PW, Cheung LH, Poon NT, Yung KK. Different trends in modulation of NMDAR1 and NMDAR2B gene expression in cultured cortical and hippocampal neurons after lead exposure. Brain Res. 2002;932:10-24. [PubMed] [DOI] |
| 6. | Bodnar AG, Ouellette M, Frolkis M, Holt SE, Chiu CP, Morin GB, Harley CB, Shay JW, Lichtsteiner S, Wright WE. Extension of life-span by introduction of telomerase into normal human cells. Science. 1998;279:349-352. [PubMed] [DOI] |
| 7. | Satra M, Gatselis N, Iliopoulos D, Zacharoulis D, Dalekos GN, Tsezou A. Real-time quantification of human telomerase reverse transcriptase mRNA in liver tissues from patients with hepatocellular cancer and chronic viral hepatitis. J Viral Hepat. 2007;14:41-47. [PubMed] [DOI] |
| 8. | Shimojima M, Komine F, Hisatomi H, Shimizu T, Moriyama M, Arakawa Y. Detection of telomerase activity, telomerase RNA component, and telomerase reverse transcriptase in human hepatocellular carcinoma. Hepatol Res. 2004;29:31-38. [PubMed] [DOI] |
| 9. | Xu D, Erickson S, Szeps M, Gruber A, Sangfelt O, Einhorn S, Pisa P, GrandEr D. Interferon alpha down-regulates telomerase reverse transcriptase and telomerase activity in human malignant and nonmalignant hematopoietic cells. Blood. 2000;96:4313-4318. [PubMed] |
| 10. | Rama S, Suresh Y, Rao AJ. Regulation of telomerase during human placental differentiation: a role for TGFbeta1. Mol Cell Endocrinol. 2001;182:233-248. [PubMed] [DOI] |
| 11. | Ohyashiki JH, Hayashi S, Yahata N, Iwama H, Ando K, Tauchi T, Ohyashiki K. Impaired telomere regulation mechanism by TRF1 (telomere-binding protein), but not TRF2 expression, in acute leukemia cells. Int J Oncol. 2001;18:593-598. [PubMed] |
| 12. | Cook BD, Dynek JN, Chang W, Shostak G, Smith S. Role for the related poly(ADP-Ribose) polymerases tankyrase 1 and 2 at human telomeres. Mol Cell Biol. 2002;22:332-342. [PubMed] [DOI] |
| 13. | Loayza D, De Lange T. POT1 as a terminal transducer of TRF1 telomere length control. Nature. 2003;423:1013-1018. [PubMed] [DOI] |
| 14. | Smith S, de Lange T. Tankyrase promotes telomere elongation in human cells. Curr Biol. 2000;10:1299-1302. [PubMed] [DOI] |
| 15. | Shervington A, Patel R, Lu C, Cruickshanks N, Lea R, Roberts G, Dawson T, Shervington L. Telomerase subunits expression variation between biopsy samples and cell lines derived from malignant glioma. Brain Res. 2007;1134:45-52. [PubMed] [DOI] |
| 16. | Hsiao SJ, Smith S. Tankyrase function at telomeres, spindle poles, and beyond. Biochimie. 2008;90:83-92. [PubMed] [DOI] |
| 17. | Seimiya H, Muramatsu Y, Ohishi T, Tsuruo T. Tankyrase 1 as a target for telomere-directed molecular cancer therapeutics. Cancer Cell. 2005;7:25-37. [PubMed] [DOI] |
| 18. | Kaminker PG, Kim SH, Taylor RD, Zebarjadian Y, Funk WD, Morin GB, Yaswen P, Campisi J. TANK2, a new TRF1-associated poly(ADP-ribose) polymerase, causes rapid induction of cell death upon overexpression. J Biol Chem. 2001;276:35891-35899. [PubMed] [DOI] |
| 19. | Hsiao SJ, Poitras MF, Cook BD, Liu Y, Smith S. Tankyrase 2 poly(ADP-ribose) polymerase domain-deleted mice exhibit growth defects but have normal telomere length and capping. Mol Cell Biol. 2006;26:2044-2054. [PubMed] [DOI] |
| 20. | Kuimov AN, Kuprash DV, Petrov VN, Vdovichenko KK, Scanlan MJ, Jongeneel CV, Lagarkova MA, Nedospasov SA. Cloning and characterization of TNKL, a member of tankyrase gene family. Genes Immun. 2001;2:52-55. [PubMed] [DOI] |
| 21. | Monz D, Munnia A, Comtesse N, Fischer U, Steudel WI, Feiden W, Glass B, Meese EU. Novel tankyrase-related gene detected with meningioma-specific sera. Clin Cancer Res. 2001;7:113-119. [PubMed] |
| 22. | Gelmini S, Quattrone S, Malentacchi F, Villari D, Travaglini F, Giannarini G, Della Melina A, Pazzagli M, Nicita G, Selli C. Tankyrase-1 mRNA expression in bladder cancer and paired urine sediment: preliminary experience. Clin Chem Lab Med. 2007;45:862-866. [PubMed] [DOI] |
| 23. | Gelmini S, Poggesi M, Pinzani P, Mannurita SC, Cianchi F, Valanzano R, Orlando C. Distribution of Tankyrase-1 mRNA expression in colon cancer and its prospective correlation with progression stage. Oncol Rep. 2006;16:1261-1266. [PubMed] |
| 24. | Xu D, Zheng C, Bergenbrant S, Holm G, Bjorkholm M, Yi Q, Gruber A. Telomerase activity in plasma cell dyscrasias. Br J Cancer. 2001;84:621-625. [PubMed] [DOI] |
| 25. | MacNamara B, Wang W, Chen Z, Hou M, Mazur J, Gruber A, Porwit-MacDonald A. Telomerase activity in relation to pro- and anti-apoptotic protein expression in high grade non-Hodgkin's lymphomas. Haematologica. 2001;86:386-393. [PubMed] |
| 26. | Donigian JR, de Lange T. The role of the poly(ADP-ribose) polymerase tankyrase1 in telomere length control by the TRF1 component of the shelterin complex. J Biol Chem. 2007;282:22662-22667. [PubMed] [DOI] |
| 28. | Shay JW. Meeting report: the role of telomeres and telomerase in cancer. Cancer Res. 2005;65:3513-3517. [PubMed] [DOI] |
| 29. | Parkinson EK, Minty F. Anticancer therapy targeting telomeres and telomerase : current status. BioDrugs. 2007;21:375-385. [PubMed] |
| 30. | Seimiya H. The telomeric PARP, tankyrases, as targets for cancer therapy. Br J Cancer. 2006;94:341-345. [PubMed] [DOI] |