修回日期: 2008-04-30
接受日期: 2008-05-05
在线出版日期: 2008-07-08
目的: 构建转基因细胞模型HepG2/HBx, 观察HBx基因对HepG2细胞增殖、周期和凋亡的影响, 探讨细胞周期蛋白P21在其中的作用和意义.
方法: 应用脂质体转染和G418筛选构建稳定表达HBx的转基因细胞HepG2/HBx, RT-PCR和Western blot鉴定HBx mRNA与蛋白的表达. 分别以四唑蓝(MTT)比色法、流式细胞术检测HepG2/HBx细胞及对照组HepG2与HepG2/pcDNA3.1细胞(转染空载体pcDNA3.1的HepG2细胞)的增殖、周期和凋亡. 另半定量RT-PCR检测各组细胞中细胞周期蛋白P21与抑癌基因p53 mRNA的表达.
结果: HepG2/HBx细胞中有HBx mRNA和蛋白的表达. HepG2/HBx细胞生长速度加快. HepG2/HBx中G0/G1期细胞比例较对照组显著减少(43.34%±3.11% vs 57.69±4.28%, P<0.01), S期细胞比例明显增加(28.69%±1.17% vs 22.41%±1.99%, P<0.05), 同时还发现与对照组相比其凋亡率也显著降低(1.19%±0.06% vs 5.43%±0.42%, P<0.001). 细胞周期蛋白p21 mRNA在HepG2/HBx细胞中的表达较对照组细胞显著降低(0.16±0.05 vs 0.78±0.15, P<0.001), 而p53表达则无显著变化.
结论: HBx基因可下调细胞周期蛋白P21 mRNA的表达, 可能参与HBx基因加速HepG2细胞周期进程、促进细胞增殖以及抑制细胞凋亡的作用.
引文著录: 郭晓榕, 程斌, 郑要初, 林松挺, 黎培员. HBx基因下调p21对HepG2细胞增殖与凋亡的影响. 世界华人消化杂志 2008; 16(19): 2080-2085
Revised: April 30, 2008
Accepted: May 5, 2008
Published online: July 8, 2008
AIM: To establish gene-transfected cell strain HepG2/HBx and study the effect of HBx on cell cycle, proliferation and apoptosis of HepG2 cells as well as the potential regulative role of p21.
METHODS: HBx was transfected into HepG2 cells and G418 selection was used to obtain the positive clones of HepG2/HBx cells. Then HBx mRNA expression and protein expression were detected using RT-PCR and western blot analysis respectively. MTT assay and flow cytometry were adopted to measure the proliferation, cell cycle and apoptosis of HepG2/HBx, HepG2 and HepG2/pcDNA3.1 (HepG2 cells transfected with pcDNA3.1) cells. Semi-quantified RT-PCR was used to evaluate the expression of p21 and p53 in three groups.
RESULTS: The expression of mRNA and protein of HBx in HepG2/HBx cells was confirmed by RT-PCR and western blot respectively. The proliferation of HepG2/HBx cells was accelerated. The proportion of HepG2/HBx cells decreased significantly in G0/G1 phase (43.34% ± 3.11% vs 57.69 ± 4.28%, P < 0.01), but increased remarkably in S phase (28.69% ± 1.17% vs 22.41% ± 1.99%, P < 0.05) and the apoptosis rate of HepG2/HBx cells was at a significantly lower level (1.19% ± 0.06% vs 5.43% ± 0.42%, P < 0.001). Compared with HepG2 and HepG2/pcDNA3.1 cells, the expression of p21 mRNA in HepG2/HBx was down-regulated (0.16 ± 0.05 vs 0.78 ± 0.15, P < 0.001), while there was no significant difference in the expression of p53 gene.
CONCLUSION: The HBx gene down-regulates the expression of p21 mRNA, which may play an important role in accelerating cell cycle, improving growth and inhibiting apoptosis of HepG2 cells.
- Citation: Guo XR, Cheng B, Zheng YC, Lin ST, Li PY. Effects of down-regulation of p21 by HBx gene on HepG2 cell proliferation and apoptosis. Shijie Huaren Xiaohua Zazhi 2008; 16(19): 2080-2085
- URL: https://www.wjgnet.com/1009-3079/full/v16/i19/2080.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i19.2080
乙型肝炎病毒(hepatitis B virus, HBV)慢性感染与原发性肝癌(hepatocellular carcinoma, HCC)的发生密切相关[1-2]. 乙肝病毒x(hepatitis B virus x protein, HBx)蛋白具有多种生物学功能, 可与宿主细胞的多种蛋白相互作用, 调控宿主细胞基因表达, 进而影响宿主细胞的信号转导、细胞增殖与分化等, 其对肝细胞周期与凋亡的影响是HBV致HCC发生的重要机制之一[3-4]. p21是一种通用的细胞周期依赖性激酶抑制剂, 可控制细胞周期G1/S调控点, 抑制细胞增殖; p53是一种重要的抑癌基因, 可参与细胞周期蛋白的调控[5-9]. 因此, 研究HBx基因对细胞周期及凋亡的影响及可能的调控机制有助于阐明乙肝相关性肝癌的发生机制. 我们通过脂质体转染构建稳定表达HBx的转基因细胞模型HepG2/HBx, 观察HBx基因对HepG2细胞周期及凋亡的影响, 探讨细胞周期相关基因p21与p53在HBx致乙肝相关性肝癌发生机制中的作用和意义.
肝癌细胞系HepG2为本实验室保存细胞株, 重组质粒pcDNA3.1(+)/v5-hisB-HBx由上海中国人民解放军第二军医大学遗传研究所何晓文教授惠赠; DH5α由西班牙Navarra大学癌症基因研究所钱程教授提供; Effectene转染试剂盒(invitrogen); 聚合酶等(TaKaRa); 鼠mAb(ABCam). Annexin V-FITC凋亡检测试剂盒为宝灵曼公司产品. HBx、p21、p53及内参β-actin引物均由上海Sangon生物工程有限公司合成.
1.2.1 HepG2细胞的转染与筛选: 重组质粒pc DNA3.1(+)/v5-hisB-HBx经酶切、PCR及测序鉴定后按Effectene说明书进行转染操作, 48 h后用含500 mg/L G418的选择培养基筛选阳性克隆, 挑取克隆扩大培养并将G418浓度减至250 mg/L维持筛选, 以获取稳定表达HBx的转基因细胞株HepG2/HBx, 实验设空白对照组为HepG2细胞与空载体对照组HepG2/pcDNA3.1细胞(转染pcDNA3.1的HepG2细胞).
1.2.2 转基因细胞株HepG2/HBx的鉴定: RT-PCR检测HBx mRNA的表达: 提取各组细胞总RNA逆转录生成cDNA, 取2 mL cDNA作模板扩增HBx基因片段, HBx基因上游引物为: 5'-CGGAATTCCGATGGCTGCTAGGCTGTG-3', 下游引物为: 5'-CCCTCGAGGGGTTGCATGGTGCTGGT-3', 反应条件如下: 94℃预变性10 min, 94℃变性45 s, 52℃退火1 min, 72℃延伸1 min, 扩增30个循环, 20 g/L琼脂糖凝胶电泳后成像观察. Western blot检测HBx蛋白的表达: 以细胞裂解液充分裂解各组细胞, 100℃加热5 min, 4℃ 12 000 r/min离心2 min, 吸上清上样后行SDS-PAGE电泳, 半干转印于NC膜上, 室温封闭1 h, 加入鼠单克隆第一抗体, 4℃孵育过夜, 加入羊抗鼠的第二抗体, 室温孵育1 h, 采用Odyssey双色红外激光成像系统检测.
1.2.3 MTT法检测细胞的增殖活性: 各组细胞消化后制成单细胞悬液, 以1×104细胞/孔接种于96孔板, 共4板, 各设6复孔, 另设一空白对照孔. 培养24 h后, 取出1板每孔加MTT溶液(5 g/L)20 mL, 置培养箱继续培养4 h, 吸弃孔内上清液, 每孔加入150 mL的DMSO, 振摇15 min后在490 nm波长下分别测定各孔吸光度(A值), 取其均数作为本次A值的计数值. 培养48、72、96 h后再重复上述步骤, 以时间为横轴, A值为纵轴绘制各组细胞生长曲线图.
1.2.4 PI染色法检测细胞周期分布: 收集3组对数生长期的细胞, 每个样本细胞总数为2×106, 加入-20℃ 750 mL/L乙醇固定过夜, 取出离心后PBS重悬, 300目尼龙网过滤, 加入10 g/L Rnase 37℃孵育15 min, 再加入碘化丙锭(PI)避光染色30 min, 采用美国BD公司FACSort型流式细胞仪检测细胞周期分布情况.
1.2.5 Annexin V/PI标记法检测细胞凋亡: 分别收集上述三组细胞制成单细胞悬液, 每个样本细胞总数为1×105, 离心弃去培养液, 按Annexin V-FITC凋亡检测试剂盒说明进行操作, 美国BD公司FACSort型流式细胞仪检测细胞凋亡率.
1.2.6 RT-PCR半定量检测p21与p53 mRNA表达: TRIzol法提取HepG2/HBx、HepG2/pcDNA3.1以及HepG2细胞总RNA, 各取5 μg逆转录为cDNA. 以2 μL cDNA为模板, 行PCR扩增p21与p53基因片段与内参β-actin, 各基因片段引物设计以及扩增条件见表1. 15 g/L琼脂糖凝胶电泳后成像观察并进行灰度分析, 所有测量重复3次, 取其平均值, 以p21、p53与β-actin的灰度比值作为p21与p53的相对表达量.
| 基因 | 引物序列 | PCR扩增片段(bp) | 反应条件 | ID |
| β-actin | 5'-GGA CTT CGA GCA AGA GAT GG-3' | 404 | 94℃变性5 min; 94℃ 30 s, 60℃ 1 min, | 60 |
| 5'-ACA TCT GCT GGA AGG TGG AC-3' | 72℃ 1 min, 循环30次; 72℃延伸10 min | |||
| p21 | 5'-TTG ATT AGC AGC GGA ACA-3' | 270 | 94℃变性5 min; 94℃ 60 s, 55℃ 1 min, | 1026 |
| 5'-TAC AGT CTA GGT GGA GAA ACG-3' | 72℃ 1 min, 循环28次; 72℃延伸5 min | |||
| p53 | 5'-GCG CAC AGA GGA AGA GAA TC-3' | 501 | 94℃变性5 min; 94℃ 60 s, 58℃ 1 min, | 7157 |
| 5'-GGC CAA CTT GTT CAG TGG AG-3' | 72℃ 1 min, 循环30次; 72℃延伸7 min |
统计学处理 数据采用mean±SD表示. 运用SPSS13.0软件来进行统计学处理, 组间采用方差分析, 以P<0.05为差异有统计学意义.
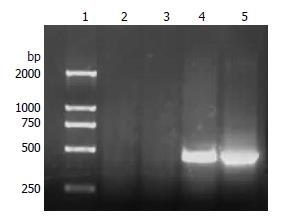
RT-PCR显示, HepG2/HBx细胞与重组质粒pcDNA3.1/HBx可见长465 bp的HBx条带, 而空白对照组HepG2细胞与空载体对照组HepG2/pcDNA3.1细胞均未见HBx条带(图1); Western blot显示实验组可见HBx蛋白表达条带, 而空白及空载体对照组则显示HBx蛋白表达条带(图2). 表明稳定表达HBx的转基因细胞株HepG2/HBx构建成功.
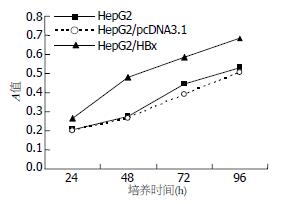
MTT法检测各组细胞A值发现, HepG2/pcDNA3.1与HepG2细胞生长速度基本一致, 而HepG2/HBx细胞在48、72、96 h各时间点的A值均明显高于对照组HepG2/pcDNA3.1细胞和HepG2细胞(P<0.001), 提示转染HBx基因后的HepG2细胞生长速度明显加快(图3), 表明HBx可能对HepG2细胞具有促增殖作用.
经PI染色法流式细胞术检测发现, 与对照组HepG2/pcDNA3.1和HepG2细胞相比, 转染HBx基因后的HepG2/HBx细胞G0/G1期细胞比例明显减少(P = 0.004), S期和G2/M期细胞比例显著增多(S期: P = 0.032; G2/M期: P = 0.015), 而HepG2/pcDNA3.1与HepG2细胞的细胞周期分布情况则无明显差异(P>0.05, 表2), 表明HBx基因可促进G0/G1期细胞向S期和G2/M转化, 具有加速细胞周期进程的作用.
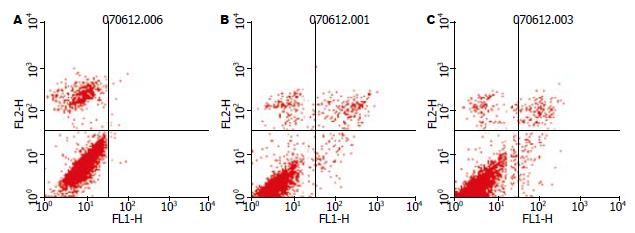
经Annexin V/PI标记法流式细胞术检测发现, 转染HBx基因后的HepG2/HBx细胞凋亡率为1.19%±0.06%, 与两对照组HepG2/pcDNA3.1细胞(4.91%±0.18%)和HepG2细胞(5.43%±0.42%)相比显著降低(P<0.001), 差异有统计学意义, 而后两者间无显著差异(P>0.05), 显示HBx具有抑制细胞凋亡的作用(图4).
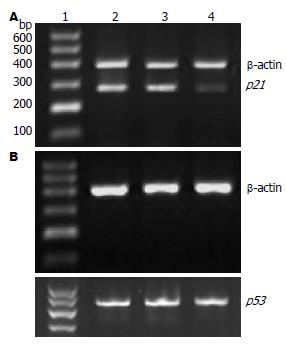
p21基因与β-actin基因RT-PCR共扩增, 结果显示, 转染HBx的HepG2/HBx细胞p21 mRNA的表达(0.16±0.05)较对照组HepG2(0.78±0.15)与HepG2/pcDNA3.1(0.69±0.21)细胞明显降低(图5A), 差异有统计学意义(P<0.001), 提示HBx可下调p21基因mRNA的表达. p53基因与β-actin基因RT-PCR共扩增的结果发现, HepG2/HBx细胞p53基因的表达(0.76±0.13)与对照组HepG2(0.73±0.21)和HepG2/pcDNA3.1(0.81±0.09)细胞相比差异无统计学意义(P>0.05)(图5B), 表明HBx对p53 mRNA的表达无明显影响.
HBx基因是HBV基因组中最小的开放读码框, 其所编码的HBx蛋白可作为反式激活因子激活多种信号转导通路, 如Ras、MAPK、PI3K-Akt、Src、JAK/STAT、Notch/Jagged、NF-κB[10-20], 影响细胞增殖、周期和凋亡, 参与肝细胞的恶性转化与癌变[21-28]. Benn et al的研究发现, HBx基因可下调Chang氏肝细胞的G1/S和G2/M检测点状态, 促进细胞增殖, 并增强肝癌细胞的抗凋亡能力, 这可能是肝癌细胞呈现较强恶性表型的机制之一[29]. 新近研究发现转染HBx基因的HepG2细胞对紫外线损伤更加敏感, 凋亡率增加, 细胞周期阻滞于G2/M期[30]. 为进一步探讨HBx蛋白在HCC发生中的作用机制, 本课题特构建稳定表达HBx的转基因细胞株HepG2/HBx, 首先观察HBx基因对HepG2细胞增殖、周期和凋亡的影响, 结果发现转染HBx基因的HepG2/HBx细胞生长速度明显高于对照组HepG2与HepG2/pcDNA3.1细胞, 表明HBx可促进HepG2细胞的增殖. 流式细胞术检测结果显示HepG2/HBx细胞G0/G1期细胞比例显著减少, S期和G2/M期细胞比例明显增多, 提示HBx可促进G0/G1期细胞向S期和G2/M转化, 加速细胞周期进程. 同时我们还通过Annexin V/PI标记法流式细胞术观察细胞凋亡, 发现HepG2/HBx细胞凋亡率较两对照组细胞显著降低, 提示HBx可抑制HepG2细胞的凋亡. 因此, 我们在HepG2细胞进行的HBx转基因研究再次证实了HBx可加速细胞周期进程、抑制细胞凋亡, 促进细胞增殖, 这与国内外文献报道基本一致[29-30].
p21是一种通用的细胞周期依赖性激酶抑制剂, 可与所有的细胞周期蛋白依赖性激酶(CDK2、4、6)复合物相结合, 控制细胞周期G1/S调控点, 抑制细胞增殖, 在肿瘤的发生发展过程中起着重要作用. 新近研究发现, P21蛋白的表达存在P53依赖性和非P53依赖性两条调节途径. 国内彭绍华 et al应用免疫组织化学法检测HCC组织中HBx蛋白和P21蛋白的表达发现, HBx蛋白表达的增高伴随着P21蛋白表达的下降, 表明HBx蛋白可下调P21蛋白的表达[31]. 晚近也有研究表明, HBx还可通过不依赖P53的途径调节P21蛋白的表达. Ahn et al[32]报道表明, P53反应元件位于人p21启动子的转录起始位点上方-2285和-1394位置, 而HBx抑制p21启动子位点位于转录起始位点上方-63和-21位置. P53蛋白是目前认为与肿瘤发生密切相关的抑癌基因之一, 主要在细胞核内发挥作用, Diao et al发现, 在人类原代培养的肝细胞中, HBx蛋白可抑制Fas介导的细胞凋亡, 在缺乏P53蛋白的红白血病细胞中, HBx蛋白也可抑制Fas介导的细胞凋亡, 这种抑制作用与依赖SEK1的SAPK/JNK信号传导通路有关, 而与P53蛋白无关[33]. Lee et al发现HBx蛋白可激活PI3K, 通过PI3K-Akt-Bad信号传导通路, 抑制Caspase3的活性, 最终抑制细胞的凋亡, 这种抑制作用也与P53蛋白无关[34].
我们在HBx转基因细胞证实HBx可加速细胞周期进程、抑制细胞凋亡的基础上, 进一步通过RT-PCR检测了HepG2/HBx与HepG2/pcDNA3.1和HepG2细胞中细胞周期蛋白相关基因p21 mRNA的表达, 结果发现转染HBx基因的HepG2细胞(HepG2/HBx)p21表达显著下降, 提示HBx可下调肿瘤抑制基因p21的表达, 表明HBx可能通过对p21基因的转录抑制作用, 减少P21蛋白表达, 有利于细胞从G0/G1期向S期和G2/M期的转化, 从而加速细胞周期进程, 促进细胞增殖, 这与Park et al的报道一致[35]. 同时, 我们采用RT-PCR技术还检测了这三组细胞p53基因mRNA的表达, 发现三组细胞间p53基因的表达水平无显著差异. 推测HBx可能通过非P53依赖性途径下调P21蛋白的表达, 削弱细胞周期G1/S控制点的调控作用, 促进G0/G1期细胞向S期细胞的转化, 从而加速HepG2细胞的增殖与生长; 另外, 其抑制HepG2细胞凋亡的作用也可能与P53蛋白无关, 这与Diao和Lee et al的研究结果相一致[33-34]. 因此, 我们的研究初步证实了HBx基因可能通过非P53依赖途径下调细胞周期蛋白P21的表达而加速细胞周期进程、促进细胞增殖、抑制细胞凋亡, 从而参与乙肝相关性肝癌的发生机制. 关于HBx基因通过何种或哪些途径调控细胞周期蛋白P21的表达还有待于今后进一步研究.
乙肝病毒x可通过反式活化作用等调控宿主细胞基因表达, 影响细胞信号转导、细胞增殖与分化等参与乙肝相关性肝癌的发生发展, 但其确切机制尚未完全阐明, 从分子水平探讨其发生机制有利于指导其临床防治.
田晓峰, 教授, 大连医科大学附属第二医院普通外科
p21是一种细胞周期依赖性激酶抑制因子, 可控制细胞周期G1/S调控点, 抑制细胞增殖. HBx基因对肝细胞周期与增殖的影响是乙肝相关性肝癌发生的重要机制之一, p21在HBx致肝细胞癌发生机制中的作用尚不清楚.
本研究采用RT-PCR技术在HBx转基因细胞HepG2/HBx中证实HBx基因可能通过下调细胞周期蛋白P21表达参与加速HepG2细胞周期进程、促进细胞增殖、抑制细胞凋亡, 有助于从分子水平了解乙肝相关性肝细胞癌的发生机制.
本研究发现HBx通过下调p21表达促进HepG2细胞增殖、抑制细胞凋亡, 为深入探讨HBx致肝细胞恶性转化和癌变机制提供了理论基础.
本研究技术路线明确, 方法先进, 图表清晰, 结论可靠, 具有一定的科学性.
编辑: 李军亮 电编:何基才
| 1. | Ganem D, Prince AM. Hepatitis B virus infection--natural history and clinical consequences. N Engl J Med. 2004;350:1118-1129. [PubMed] [DOI] |
| 2. | Marusawa H, Matsuzawa S, Welsh K, Zou H, Armstrong R, Tamm I, Reed JC. HBXIP functions as a cofactor of survivin in apoptosis suppression. EMBO J. 2003;22:2729-2740. [PubMed] [DOI] |
| 3. | Xu ZH, Zhao MJ, Li TP. p73beta inhibits transcriptional activities of enhancer I and X promoter in hepatitis B virus more efficiently than p73alpha. World J Gastroenterol. 2002;8:1094-1097. [PubMed] |
| 4. | Su F, Theodosis CN, Schneider RJ. Role of NF-kappaB and myc proteins in apoptosis induced by hepatitis B virus HBx protein. J Virol. 2001;75:215-225. [PubMed] [DOI] |
| 5. | Elmore LW, Hancock AR, Chang SF, Wang XW, Chang S, Callahan CP, Geller DA, Will H, Harris CC. Hepatitis B virus X protein and p53 tumor suppressor interactions in the modulation of apoptosis. Proc Natl Acad Sci U S A. 1997;94:14707-14712. [PubMed] [DOI] |
| 6. | Lin Y, Nomura T, Yamashita T, Dorjsuren D, Tang H, Murakami S. The transactivation and p53-interacting functions of hepatitis B virus X protein are mutually interfering but distinct. Cancer Res. 1997;57:5137-5142. [PubMed] |
| 7. | Chen X, Ko LJ, Jayaraman L, Prives C. p53 levels, functional domains, and DNA damage determine the extent of the apoptotic response of tumor cells. Genes Dev. 1996;10:2438-2451. [PubMed] [DOI] |
| 8. | Ahn JY, Jung EY, Kwun HJ, Lee CW, Sung YC, Jang KL. Dual effects of hepatitis B virus X protein on the regulation of cell-cycle control depending on the status of cellular p53. J Gen Virol. 2002;83:2765-2772. [PubMed] |
| 9. | Arbuthnot P, Capovilla A, Kew M. Putative role of hepatitis B virus X protein in hepatocarcinogenesis: effects on apoptosis, DNA repair, mitogen-activated protein kinase and JAK/STAT pathways. J Gastroenterol Hepatol. 2000;15:357-368. [PubMed] [DOI] |
| 10. | Jung JK, Arora P, Pagano JS, Jang KL. Expression of DNA methyltransferase 1 is activated by hepatitis B virus X protein via a regulatory circuit involving the p16INK4a-cyclin D1-CDK 4/6-pRb-E2F1 pathway. Cancer Res. 2007;67:5771-5778. [PubMed] [DOI] |
| 11. | Reed MF, Zagorski WA, Knudsen ES. RB activity alters checkpoint response and chemosensitivity in lung cancer lines. J Surg Res. 2007;142:364-372. [PubMed] [DOI] |
| 12. | Lau WM, Ho TH, Hui KM. p16INK4A-silencing augments DNA damage-induced apoptosis in cervical cancer cells. Oncogene. 2007;26:6050-6060. [PubMed] [DOI] |
| 13. | Chen J, Siddiqui A. Hepatitis B virus X protein stimulates the mitochondrial translocation of Raf-1 via oxidative stress. J Virol. 2007;81:6757-6760. [PubMed] [DOI] |
| 14. | Gao J, Chen C, Hong L, Wang J, Du Y, Song J, Shao X, Zhang J, Han H, Liu J. Expression of Jagged1 and its association with hepatitis B virus X protein in hepatocellular carcinoma. Biochem Biophys Res Commun. 2007;356:341-347. [PubMed] [DOI] |
| 15. | Gao J, Song Z, Chen Y, Xia L, Wang J, Fan R, Du R, Zhang F, Hong L, Song J. Deregulated expression of Notch receptors in human hepatocellular carcinoma. Dig Liver Dis. 2008;40:114-121. [PubMed] [DOI] |
| 16. | Purow BW, Haque RM, Noel MW, Su Q, Burdick MJ, Lee J, Sundaresan T, Pastorino S, Park JK, Mikolaenko I. Expression of Notch-1 and its ligands, Delta-like-1 and Jagged-1, is critical for glioma cell survival and proliferation. Cancer Res. 2005;65:2353-2363. [PubMed] [DOI] |
| 17. | Rand MD, Grimm LM, Artavanis-Tsakonas S, Patriub V, Blacklow SC, Sklar J, Aster JC. Calcium depletion dissociates and activates heterodimeric notch receptors. Mol Cell Biol. 2000;20:1825-1835. [PubMed] [DOI] |
| 18. | Nam Y, Aster JC, Blacklow SC. Notch signaling as a therapeutic target. Curr Opin Chem Biol. 2002;6:501-509. [PubMed] [DOI] |
| 19. | Yao J, Duan L, Fan M, Yuan J, Wu X. Notch1 induces cell cycle arrest and apoptosis in human cervical cancer cells: involvement of nuclear factor kappa B inhibition. Int J Gynecol Cancer. 2007;17:502-510. [PubMed] [DOI] |
| 20. | Aguilera C, Hoya-Arias R, Haegeman G, Espinosa L, Bigas A. Recruitment of IkappaBalpha to the hes1 promoter is associated with transcriptional repression. Proc Natl Acad Sci U S A. 2004;101:16537-16542. [PubMed] [DOI] |
| 21. | Bouchard MJ, Puro RJ, Wang L, Schneider RJ. Activation and inhibition of cellular calcium and tyrosine kinase signaling pathways identify targets of the HBx protein involved in hepatitis B virus replication. J Virol. 2003;77:7713-7719. [PubMed] [DOI] |
| 22. | Bouchard MJ, Schneider RJ. The enigmatic X gene of hepatitis B virus. J Virol. 2004;78:12725-12734. [PubMed] [DOI] |
| 23. | Höhne M, Schaefer S, Seifer M, Feitelson MA, Paul D, Gerlich WH. Malignant transformation of immortalized transgenic hepatocytes after transfection with hepatitis B virus DNA. EMBO J. 1990;9:1137-1145. [PubMed] |
| 24. | Becker SA, Lee TH, Butel JS, Slagle BL. Hepatitis B virus X protein interferes with cellular DNA repair. J Virol. 1998;72:266-272. [PubMed] |
| 25. | Benn J, Schneider RJ. Hepatitis B virus HBx protein activates Ras-GTP complex formation and establishes a Ras, Raf, MAP kinase signaling cascade. Proc Natl Acad Sci U S A. 1994;91:10350-10354. [PubMed] [DOI] |
| 26. | Hu YP, Hu WJ, Zheng WC, Li JX, Dai DS, Wang XM, Zhang SZ, Yu HY, Sun W, Hao GR. Establishment of transgenic mouse harboring hepatitis B virus (adr subtype) genomes. World J Gastroenterol. 2001;7:111-114. [PubMed] |
| 27. | Shin EC, Shin JS, Park JH, Kim H, Kim SJ. Expression of fas ligand in human hepatoma cell lines: role of hepatitis-B virus X (HBX) in induction of Fas ligand. Int J Cancer. 1999;82:587-591. [PubMed] [DOI] |
| 28. | Shih WL, Kuo ML, Chuang SE, Cheng AL, Doong SL. Hepatitis B virus X protein inhibits transforming growth factor- beta -induced apoptosis through the activation of phosphatidylinositol 3-kinase pathway. J Biol Chem. 2000;275:25858-25864. [PubMed] [DOI] |
| 29. | Benn J, Schneider RJ. Hepatitis B virus HBx protein deregulates cell cycle checkpoint controls. Proc Natl Acad Sci U S A. 1995;92:11215-11219. [PubMed] [DOI] |
| 30. | Lee AT, Ren J, Wong ET, Ban KH, Lee LA, Lee CG. The hepatitis B virus X protein sensitizes HepG2 cells to UV light-induced DNA damage. J Biol Chem. 2005;280:33525-33535. [PubMed] [DOI] |
| 32. | Ahn JY, Chung EY, Kwun HJ, Jang KL. Transcriptional repression of p21(waf1) promoter by hepatitis B virus X protein via a p53-independent pathway. Gene. 2001;275:163-168. [PubMed] [DOI] |
| 33. | Diao J, Khine AA, Sarangi F, Hsu E, Iorio C, Tibbles LA, Woodgett JR, Penninger J, Richardson CD. X protein of hepatitis B virus inhibits Fas-mediated apoptosis and is associated with up-regulation of the SAPK/JNK pathway. J Biol Chem. 2001;276:8328-8340. [PubMed] [DOI] |
| 34. | Lee YI, Kang-Park S, Do SI, Lee YI. The hepatitis B virus-X protein activates a phosphatidylinositol 3-kinase-dependent survival signaling cascade. J Biol Chem. 2001;276:16969-16977. [PubMed] [DOI] |