修回日期: 2008-05-19
接受日期: 2008-05-30
在线出版日期: 2008-06-18
目的: 鉴定新的食管鳞癌肿瘤相关抗原.
方法: 食管癌EC0156细胞总蛋白先经亚组分预分离, 有效富集胞质、胞膜和胞核等组分蛋白; 胞质组分蛋白经SDS-PAGE分离后分别与食管癌患者血清或健康志愿者血清共孵育, 分离血清结合蛋白条带; 胶内酶解阳性蛋白条带, 肽段经色谱分离后用SynaptTM HDMS质谱鉴定. 候选蛋白进一步Western blot经免疫组化验证.
结果: 总蛋白经亚组分分离后, 不同组分蛋白均得到有效富集. 食管癌患者血清能与EC0156细胞胞质蛋白结合, 即选择性识别肿瘤相关抗原. 其中, 43 kDa蛋白条带与食管癌血清(41.4%, 12/29)和对照(3.6%, 1/28)结合阳性率具有明显差异. 从该蛋白条带中共鉴定到磷酸甘油酸激酶、β-actin、蛋白酶体26 s亚基、S-腺苷高半胱氨酸水解酶和磷酸核糖酰氨基咪唑羧化酶5个高可信度蛋白. 磷酸甘油酸激酶(PGK1)定位于胞质和胞核, 在食管癌组织中高表达(69.23%, 18/26).
结论: 改良血清蛋白质组分析策略(mSERPA)可有效分离鉴定肿瘤相关抗原. PGK1是食管癌候选肿瘤相关抗原, 在食管癌发生发展中可能发挥重要作用.
引文著录: 高红军, 周兰萍, 毛友生, 王伟, 乔媛媛, 刘芳, 蔡毅然, 赵晓航. 食管鳞癌肿瘤相关抗原磷酸甘油酸激酶1的鉴定. 世界华人消化杂志 2008; 16(17): 1866-1872
Revised: May 19, 2008
Accepted: May 30, 2008
Published online: June 18, 2008
AIM: To investigate and identify novel tumor-associated antigens in esophageal squamous cell carcinoma (ESCC).
METHODS: Modified serological proteome analysis (mSERPA) strategy was used to separate and identify the candidate proteins. The subcellular protein fractions (cytosolic, membrane and nuclear fractions) of ESCC cell lines and EC0156 cells were extracted first and then cytosolic proteins were separated using SDS-PAGE. The separated proteins were incubated with different serum of ESCC patients (29 cases) or healthy controls (28 cases) respectively, and then one of the positive bands in 43 kDa was excised followed by in-gel tryptic digestion. Separated peptides were identified using a high definition mass spectrometry (HDMS). Western blot and immunohistochemical staining (IHC) were used to validate possible candidates.
RESULTS: Successful compartmental protein extraction was demonstrated by specific organelle markers. Serum samples of ESCC patients bound EC0156 cytoplasmic protein, suggesting selective recognition of tumor-associated antigen. 43 kDa protein band showed significantly higher positive binding rate with serum of ESCC patients (41.4%, 12/29) than with serum of healthy individuals (3.6%, 1/28). Five high-confidence proteins were identified from the 43 kDa band using HDMS including phosphoglycerate kinase 1 (PGK1), β-actin, proteasome 26S subunit, S-adenosylhomocysteine hydrolase and hosphoribosylaminoimidazole carboxylase. Immunohistochemistry. Western blot analysis showed that PGK1 was located in both cytoplasm and nucleus, and had a higher expression in cancer tissues (69.23%, 18/26) than in normal esophageal epithelia.
CONCLUSION: The mSERPA strategy is useful for tumor-associated antigen identification. As a new candidate of tumor-associated antigen, PGK1 was over-expressed in ESCC which may play a role in tumorigenesis of ESCC.
- Citation: Gao HJ, Zhou LP, Mao YS, Wang W, Qiao YY, Liu F, Cai YR, Zhao XH. Phosphoglycerate kinase 1 as a candidate of tumor-associated antigen identified from esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(17): 1866-1872
- URL: https://www.wjgnet.com/1009-3079/full/v16/i17/1866.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i17.1866
胃食管癌是我国常见恶性肿瘤之一, 居恶性肿瘤死亡率第四位. 5年生存率只有25%-30%, 如果早期发现, 及时治疗, 5年生存率可达70%以上[1]. 因而, 早期发现, 早期治疗是提高食管癌治愈率、改善疗效的关键. 在我国食管癌的主要组织学类型是食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC).
食管癌缺乏特异血清学标志.目前, 食管癌相关血清标志有癌胚抗原(carcinoembryonic antigen, CEA), 细胞角蛋白片段19(cytokeratin 19 fragments, CYFRA 21-1)和鳞状细胞癌相关抗原(squamous cell carcinoma associated antigen, SCC antigen). 但是, 这些标志诊断食管癌的敏感度仅为17%, 43.9%和26.8%, 效果不理想, 不能满足临床诊断需要[2]. 20世纪70年代发现肿瘤患者体内可以检测到自身抗体和/或自身反应性T淋巴细胞, 由此表明肿瘤存在自身抗原[3]. 疾病自身抗原的分离鉴定对研究自身免疫病, 肿瘤的发病机制, 机体免疫功能与疾病发生发展和转归的相互关系至关重要. 同时, 也是发展有效疫苗、诊断试剂、治疗性抗体, 及其筛选有效药物靶标的重要前提[4].
Prasannan et al于2000年报道了一种称为血清蛋白质组分析(serological proteome analysis, SERPA)的分离鉴定自身抗原的方法[5]. 以蛋白质二维电泳(two-dimensional electrophoresis, 2-DE)和免疫印记分析(Western blot)为基础, 联合蛋白谱鉴定筛选自身抗原. 与常用血清自身抗原筛选方法, 即重组cDNA表达文库血清学分析方法(serological analysis of recombinant cDNA expression libraries, SEREX)[4,6-8]相比, SERPA主要优点是避免了构建cDNA文库和预杂交消除非特异性结合的步骤, 所用时间短; 系统保持着蛋白质的转录后修饰, 可以更好地展现抗原决定簇. 目前已有一些用SERPA技术筛选自身抗原的相关研究[5,9-19]. SERPA的主要不足是, 工作量大、由2-DE本身的一些缺陷如分离极酸、极碱蛋白和水溶性差的膜蛋白能力有限, 只能鉴定丰度相对较高的抗原, 灵敏度有限等.
为避免SERPA技术的缺陷, 提高低丰度抗原鉴定的可能性, 避免血清污染与肿瘤异质性, 本研究采用改良SERPA法(modified serological proteome analysis, mSERPA), 即以食管癌细胞亚细胞蛋白组份为抗原, 经一维SDS聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)分离后以食管癌患者和健康对照血清为一抗进行免疫印记分析, 筛选具有特异性信号的蛋白条带, 后者经酶解、质谱鉴定分离肿瘤自身抗原, 进一步经大样本免疫组织化学验证. 用mSERPA技术分离鉴定了食管鳞癌血清肿瘤相关抗原磷酸甘油酸激酶(phosphoglycerate kinase 1, PGK1).
1.1.1 标本来源: 采集中国医学科学院肿瘤医院和中国人民解放军海军总医院胸外科2004-10/2007-04接受单纯手术治疗的29例食管鳞癌患者术前静脉血和26例配对食管鳞癌新鲜组织标本. 28例健康志愿者清晨空腹外周血. 其中, 食管癌病例包括24例男性和5例女性, 年龄范围41-73岁, 平均年龄59岁, 中位年龄58岁; 健康志愿者包括20例男性和8例女性, 年龄范围40-70岁, 平均年龄55岁, 中位年龄54岁. 健康志愿者均经系统健康体检, 无上消化道相关疾病史和恶性肿瘤家族史. 所有病例取材得到知情同意, 术前未行放疗或化疗.
另外26例(与29例血清标本不是一组病例)新鲜组织标本一经分离, 迅速去除坏死组织和血管等结缔组织, 分别切取、分离癌和远端切缘的正常食管黏膜, 放入预冷的生理盐水内, 洗3-4次. 称质量, 分装, 放入液氮速冻后转入-80℃冰箱保存. 用于免疫组化分析的经40 g/L甲醛固定后石蜡包埋.
1.1.2 细胞培养: 人食管鳞癌细胞系ECO156由本实验室建系[20], 细胞培养于含100 mL/L胎牛血清的DMEM培养基, 在37℃、50 mL/L CO2条件下培养.
1.1.3 主要试剂: DMEM培养基购自Gibco/BRL公司; 丙烯酰胺、N, N'甲叉双丙烯酰胺购自BBI公司; 四甲基乙二胺、过硫酸铵购自Sigma公司; 胰酶购自Promega公司; 乙腈、HPLC超纯水购自Agilent公司; 亮肽素、抑酞酶购自Fluka公司; 聚偏氟乙烯(PVDF)膜购自Amersham Pharmacia Biotech公司; Aprotinin购自Roche公司; Coomassie Plus Protein Assay蛋白定量试剂盒购自Pierce公司; ProteoExtractTM亚细胞蛋白组份提取试剂盒购自Merck公司; S-P试剂盒购自迈新公司; 辣根过氧化物酶标记的山羊抗人、抗兔和抗鼠二抗、兔抗山羊二抗和DAB试剂盒购自中杉金桥公司; 兔抗人PGK1抗体购自Abnova公司; 小鼠抗人α-tubulin抗体, 山羊抗人AIF抗体, 兔抗人GLI-1抗体和ECL试剂盒购自Santa Cruz公司; 真空无抗凝剂采血管购自BD公司.
1.2.1 血清分离: 清晨空腹抽取肘静脉血约4 mL, 放入4℃冰箱保存, 30 min后4℃ 1500 r/min离心10 min, 小心吸取上清转入2 mL离心管中, 10 000 g, 4℃离心15 min, 将同一例样品的血清混合后分装于0.5 mL离心管中, 迅速至干冰中, 后转入-80℃冰箱保存. 处理过程在4 h内完成. 应用时所有样本冻融≤2次.
1.2.2 细胞系亚细胞蛋白组份提取: 培养的EC0156细胞待长满培养皿的80%-90%时, 用4℃预冷的PBS缓冲液漂洗3次, 用ProteoExtract亚细胞蛋白提取试剂盒按说明书操作步骤将EC0156细胞裂解蛋白分成胞质、胞膜系统和细胞核等三个亚组份蛋白, 分别蛋白定量后分装冻存.
1.2.3 Western blot分析: (1)肿瘤自身抗原筛选: 200 μg胞质组份蛋白样品经12%的SDS-PAGE分离以后, 湿转法转印至PVDF膜上. 将转印了蛋白质的PVDF膜分别切割为4 mm宽的小条, 做好标记后将每个小条分别放入8通道的杂交盘中. 5%的脱脂牛奶室温封闭3 h后, 分别与1:200稀释的食管癌或健康对照血清(一抗)于室温孵育3 h, 用洗膜液(20 mmol/L Tris-HCl, pH7.5; 50 mmol/L NaCl; 0.1% Tween-20)洗膜, 5 min×6次; 与辣根过氧化物酶标记的山羊抗人(1:3000)二抗室温孵育1 h. 再经TBST溶液洗膜, 5 min×6次后ECL化学发光检测. 作用3 min左右, 暗室曝光. 结果经ChampGel 3000(Sage Creation公司)灰度扫描. (2)亚组份蛋白分离效果检测: 15 μg不同组份蛋白上样, 以120 g/L SDS-PAGE分离, 转膜后分别与抗α-tubulin(1:200)、AIF(1:2000)和GLI-1(1:200)室温孵育3 h. 洗膜后分别与对应二抗(1:3000稀释)孵育后曝光. (3)PGK1在EC0156亚细胞组分中的表达: 15 μg总蛋白以120 g/L SDS-PAGE分离, 转膜后分别与抗人PGK1抗体(1:200)和辣根过氧化物酶标记的山羊抗兔的二抗(1:3000)检测PGK1在不同亚细胞组份中的表达.
1.2.4 蛋白酶解和质谱鉴定: 切取目的条带经胰酶酶解[21-22]、反相色谱分离, 肽段经Synapt® HDMS(ESI-Q-TOF MS)质谱分析, 用Mascot搜索引擎搜索NCBInr数据库, 获知氨基酸序列.
1.2.5 免疫组织化学染色及其结果评分: 包含癌和癌旁正常上皮的组织切片经二甲苯脱蜡, 梯度乙醇水化后, 浸入3%的H2O2中10 min, 以阻断内源性过氧化物酶活性.切片经PBS冲洗后, 将其置入0.01 mol/L, pH6.0的柠檬酸缓冲液沸水浴10 min, 以充分暴露抗原.切片室温冷却30 min后, PBS冲洗, 滴加山羊非免疫血清, 室温封闭15 min, 然后滴加小鼠抗人PGK1 mAb(1:50稀释), 4℃孵育过夜. 阴性对照采用小鼠的非免疫血清替代. 切片经PBS冲洗后, 滴加生物素标记的第二抗体, 室温孵育10 min, PBS冲洗, 而后滴加辣根过氧化物酶标记的链亲和素抗体, 室温孵育10 min, PBS冲洗. 切片组织经DAB溶液显色约2-3 min后, PBS终止反应, 再经苏木素复染、自来水冲洗返蓝. 经梯度乙醇脱水、二甲苯透明后, 中性树脂封片.
结果用以下标准评价表达程度, 包括染色强度和观察结果评分. 着色强度评分: 未着色(0分)、浅黄色(1分)、浅棕色(2分)和深棕色(3分); 观察结果评分, 即阳性细胞占病变细胞的百分比: <5%(0分); 5%-25%(1分); 26%-50%(2分); 51%-75%(3分)和>75%(4分). 染色强度评分和观察结果评分的乘积为表达程度, 表达增强(9-12分)、表达减弱(5-8分)、明显减弱(0-4分). 本研究以胞质出现均匀分布的棕黄色颗粒和表达强度综合得分>4分为表达阳性.
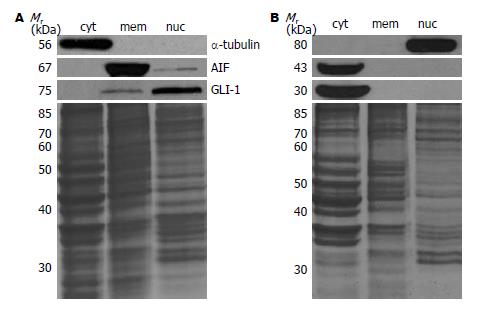
食管鳞癌细胞EC0516总蛋白经分步提取后, 分别用Western blot检测细胞质、胞膜和细胞核等标志分子在不同组份中的表达情况. 结果表明(图1A), 胞质蛋白标志分子管蛋白(α-tubulin)[23]仅在胞质蛋白组份中被检测到; 细胞质膜系统蛋白标志分子凋亡诱导因子(apoptosis-inducing factor, AIF)[24-25]主要出现在膜组份, 同时在细胞核组份也有少量表达; 细胞核标志分子胶质瘤相关癌基因同源蛋白1(glioma-associated oncogene homolog 1, GLI-1)[26-27]主要出现在细胞核组份中, 膜组份蛋白中也有少量表达. 结果表明, 经过蛋白预处理后, 不同细胞亚组份蛋白均得到了有效富集.
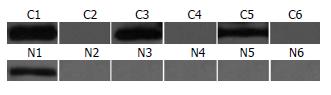
EC0156细胞胞质组份蛋白经一维SDS-PAGE分离、转膜后, 分别与29例食管癌患者和28例健康对照血清进行Western blot分析. 结果发现, 食管癌患者血清能与部分肿瘤细胞胞质组份蛋白产生免疫印迹反应而与正常对照血清形成明显差异, 其中之一是分子质量为43 kDa的蛋白. 该蛋白与41.4%(12/29)的食管癌血清呈阳性反应, 仅与3.6%(1/28)的对照血清呈较弱结合, 可能为食管癌候选的肿瘤相关抗原(图2).
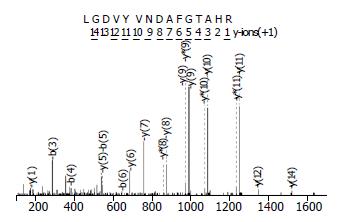
食管癌EC0156细胞胞质组份蛋白经一维SDS-PAGE分离, 考马斯亮兰染色, 切取分子质量大约为43 kDa的蛋白条带. 将蛋白经胰蛋白酶酶解后, 提取的肽段再经Synapt®HDMS质谱(Waters公司)鉴定. 所得数据用Mascot搜索引擎搜索NCBInr数据库. 共计检索到5个高可信度的蛋白(Mascot score>30)按照得分由高到低依次为磷酸甘油酸激酶(phosphoglycerate kinase 1, PGK1)、β-actin、蛋白酶体26s亚基(proteasome 26S subunit), S-腺苷高半胱氨酸水解酶(S-adenosylhomocysteine hydrolase)和磷酸核糖酰氨基咪唑羧化酶(phosphoribosylaminoimidazole carboxylase). 选取PGK1做进一步验证, PGK1的质谱鉴定结果如图3所示.
食管鳞癌EC0156细胞胞质、细胞膜系统和胞核等亚细胞组份蛋白经SDS-PAGE分离、转膜后分别与抗PGK1抗体孵育, 检测PGK1在不同亚细胞组份蛋白中得的表达. 结果发现PGK1主要表达于胞质和细胞核组份, 细胞核组份中PGK1为分子质量80 kDa蛋白, 胞质组份表现为43 kDa和30 kDa的异构体, 细胞膜系统未检测到PGK1的表达(图1B).
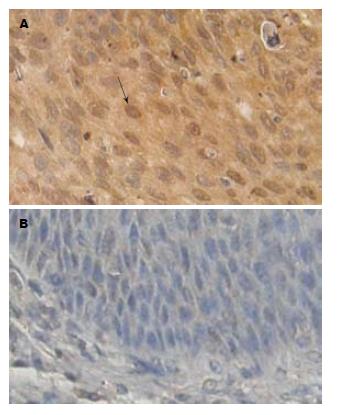
用免疫组化的方法检测了PGK1在26对配对食管癌组织和癌旁食管上皮中的表达(图4). 其中高分化食管癌14例, 中分化食管癌8例, 低分化食管癌4例. 结果表明PGK1在78.57%高分化(11/14)、50%中分化(4/8)和75%低分化(3/4)食管癌组织中表达明显升高. 与正常食管上皮相比, 食管癌中PGK1表达阳性率为69.23%(18/26), 正常食管上皮组织PGK1表达率为7.7%(2/26).
分离鉴定肿瘤相关抗原(tumor associated antigens, TAAs)有可能发现新的辅助早诊, 预后判断和疗效监测的候选肿瘤标志. 本研究通过先行分离食管癌EC0516细胞胞质、膜系统和细胞核等不同细胞亚组份蛋白, 使目的蛋白得到富集并经SDS-PAGE分离后, 与食管癌患者和健康对照血清杂交, 筛选并获得特异性结合蛋白即肿瘤自身抗原PGK1.Pereira-Faca等曾用类似策略鉴定了肺癌相关抗原14-3-3 theta[28].
磷酸甘油酸激酶(phosphoglycerate kinase PGK)是糖酵解的关键酶, 存在于所有生物体并在进化中高度保守, 该酶缺乏可引起生物体代谢紊乱. PGK是单体的、高度柔曲性的糖酵解酶, 主要由两个球形结构域构成, 在与底物结合过程中发生显著的构象改变, 产生催化效应.多数生物体内含2-3种PGK同工酶, 他们在生物体内分布不一, 具有独特的生物学功能[29]. PGK1是一种分泌型糖酵解酶, 催化1, 3-二磷酸甘油酸1位碳上的高能磷酸基团转移到ADP分子上形成ATP[30]. 目前报道了13个PGK1突变体, 均为单个氨基酸突变或缺失[31]. PGK基因突变可导致许多种疾病, 最常见的是慢性贫血, 如遗传性球形红细胞溶血性贫血, 同时可伴有智力减退、神经功能的紊乱和肌肉病变[32]. 近期研究表明PGK1也与肿瘤发生发展密切相关[33-34]. PGK1在70%胰腺导管腺癌(n = 63)和胰腺癌患者血清高表达[35]. Shichijo et al通过筛选结肠癌患者的肿瘤浸润淋巴细胞以发现肿瘤相关抗原、HLA-A2限制性和肿瘤反应性细胞毒性T细胞, 发现PGK1的表位多肽很可能是HLA-A2(+)结肠癌患者特异免疫治疗的靶分子[36]. Chen et al用ELISA方法检测肺癌患者血清PGK1水平, 发现肺癌血清PGK1水平明显升高(91.45%, 107/117), 而且PGK1表达水平与不良预后有关[37].
Chuthapisith et al研究了对化疗敏感与否的两株乳腺癌细胞系的差异蛋白谱, 发现PGK1表达与肿瘤对化疗药物敏感性有关[38]. Wang et al研究表明, PGK1是CXCL12/CXCR4信号通路的关键下游靶基因, 参与调节肿瘤血管生成而与肿瘤生长与转移密切相关[39].
迄今, 尚无有关PGK1与食管鳞癌相关的报道. 我们的研究表明PGK1是食管癌的肿瘤相关抗原, 在部分食管癌外周血可以检测到PGK1自身抗体. 免疫组化分析结果发现, PGK1在78%(11/14)高分化、50%(4/8)中分化和75%(3/4)的低分化食管癌组织中高表达, 主要定位于细胞质和细胞核. 为进一步证明PGK1在食管癌EC0516细胞中的定位, 采用Western blot方法检测了PGK1在EC0156细胞系的亚细胞蛋白组份中的表达, 结果表明与免疫组化细胞定位结果一致, 即PGK1同时存在于食管癌细胞的胞质和细胞核中. 同时发现, 胞质中除了分子质量为43 kDa的PGK1表达蛋白外, 还存在一个分子质量为30 kDa的异构体, 而细胞核中的PGK1呈现分子质量为80 kDa的表达蛋白. 目前认为PGK1主要定于细胞质, 分子质量为43 kDa. 30 kDa可能是该蛋白的截短表达形式或降解片段, 80 kDa形式可能是该蛋白与其他相互作用蛋白或DNA等紧密结合的复合体[40-41]. Kumble et al的研究表明, 在Hela细胞的核基质中PGK1与annexinⅡ紧密结合发挥DNA多聚酶起始识别因子的功能, 参与调节细胞的DNA复制[42]. 有趣的是Brichory et al对肺腺癌细胞A549的研究发现, annexinⅡ是肺癌相关抗原, 在肺癌组织中表达明显升高[10]. 肿瘤细胞的DNA复制功能活跃, 而机体失去了对调节DNA复制功能密切相关的两个调控蛋白的调控, 同时PGK1与annexinⅡ间可能存在反馈调节现象. 本实验同样检测到核型PGK1的表达, 提示PGK1转位到细胞核中可能与细胞的恶性转化行为相关. 本研究结果与上述其他肿瘤研究工作结果一致, PGK1在可能食管鳞癌的发生、发展及转移过程中起重要的作用, 是候选的肿瘤相关抗原之一, 为深入理解食管癌癌变机制, 发现新的候选肿瘤标志具有科学意义.
食管癌是我国常见恶性肿瘤之一, 居我国恶性肿瘤死亡第4位. 5年生存率只有25%-30%, 如果早期发现, 及时治疗, 5年生存率可达70%以上. 因而, 早期发现, 早期治疗是提高食管癌治愈率、改善疗效的关键. 20世纪70年代发现肿瘤患者体内可以检测到自身抗体和(或)自身反应性T淋巴细胞, 证实了肿瘤抗原的存在.
王健生, 副教授, 西安交通大学医学院第一附属医院肿瘤外科
分离鉴定肿瘤相关抗原及其自身抗体是肿瘤标志研究的热点. 血清蛋白质组分析(SERPA)是分离鉴定自身抗原的重要技术策略之一, 以蛋白质二维电泳(2-DE)和免疫印记(Western blot)分析为基础, 联合谱鉴定筛选自身抗原, 其主要缺点是工作量大、分离极酸、极碱蛋白和水溶性差的膜蛋白受限, 灵敏度较低.
Pereira-Faca et al在《癌症研究》杂志上发表了一篇鉴定肺癌肿瘤相关抗原的文章. 该文章应用混合的细胞系蛋白作为抗原来源, 血清筛选前对细胞蛋白组份做了预分离, 降低蛋白的复杂性. 鉴定到肺癌的肿瘤相关抗原14-3-3 theta, 联合annexin 1预测出55%(10/18)的受试者具有发生肺癌的风险.
为避免SERPA的缺陷, 提高低丰度抗原鉴定的可能性, 本研究采用改良SERPA法(mSERPA), 以食管癌细胞亚细胞蛋白组份为抗原, 经一维SDS-PAGE分离后以食管癌患者和健康对照血清为一抗进行免疫印记分析, 筛选具有特异信号的蛋白条带, 并经质谱鉴定肿瘤自身抗原. 用mSERPA技术分离鉴定了食管鳞癌相关抗原磷酸甘油酸激酶(PGK1).
肿瘤相关抗原(TAA): 指肿瘤和相应正常细胞均表达, 但是含量在细胞癌变时明显增高的抗原. 此类抗原只表现出量的变化而无严格肿瘤特异性.
本研究方法合理, 对照可靠, 结果明确, 具有一定的科学性, 可读性和创新性.
编辑: 李军亮 电编:郭海丽
| 2. | Kawaguchi H, Ohno S, Miyazaki M, Hashimoto K, Egashira A, Saeki H, Watanabe M, Sugimachi K. CYFRA 21-1 determination in patients with esophageal squamous cell carcinoma: clinical utility for detection of recurrences. Cancer. 2000;89:1413-1417. [PubMed] [DOI] |
| 3. | Shiku H, Takahashi T, Resnick LA, Oettgen HF, Old LJ. Cell surface antigens of human malignant melanoma. III. Recognition of autoantibodies with unusual characteristics. J Exp Med. 1977;145:784-789. [PubMed] [DOI] |
| 4. | Gunawardana CG, Diamandis EP. High throughput proteomic strategies for identifying tumour-associated antigens. Cancer Lett. 2007;249:110-119. [PubMed] [DOI] |
| 5. | Prasannan L, Misek DE, Hinderer R, Michon J, Geiger JD, Hanash SM. Identification of beta-tubulin isoforms as tumor antigens in neuroblastoma. Clin Cancer Res. 2000;6:3949-3956. [PubMed] |
| 6. | Sahin U, Tureci O, Schmitt H, Cochlovius B, Johannes T, Schmits R, Stenner F, Luo G, Schobert I, Pfreundschuh M. Human neoplasms elicit multiple specific immune responses in the autologous host. Proc Natl Acad Sci U S A. 1995;92:11810-11813. [PubMed] [DOI] |
| 7. | Fernandez Madrid F, Tang N, Alansari H, Karvonen RL, Tomkiel JE. Improved approach to identify cancer-associated autoantigens. Autoimmun Rev. 2005;4:230-235. [PubMed] [DOI] |
| 8. | Wang X, Yu J, Sreekumar A, Varambally S, Shen R, Giacherio D, Mehra R, Montie JE, Pienta KJ, Sanda MG. Autoantibody signatures in prostate cancer. N Engl J Med. 2005;353:1224-1235. [PubMed] [DOI] |
| 9. | Klade CS, Voss T, Krystek E, Ahorn H, Zatloukal K, Pummer K, Adolf GR. Identification of tumor antigens in renal cell carcinoma by serological proteome analysis. Proteomics. 2001;1:890-898. [PubMed] [DOI] |
| 10. | Brichory FM, Misek DE, Yim AM, Krause MC, Giordano TJ, Beer DG, Hanash SM. An immune response manifested by the common occurrence of annexins I and II autoantibodies and high circulating levels of IL-6 in lung cancer. Proc Natl Acad Sci U S A. 2001;98:9824-9829. [PubMed] [DOI] |
| 11. | Brichory F, Beer D, Le Naour F, Giordano T, Hanash S. Proteomics-based identification of protein gene product 9.5 as a tumor antigen that induces a humoral immune response in lung cancer. Cancer Res. 2001;61:7908-7912. [PubMed] |
| 12. | Le Naour F, Misek DE, Krause MC, Deneux L, Giordano TJ, Scholl S, Hanash SM. Proteomics-based identification of RS/DJ-1 as a novel circulating tumor antigen in breast cancer. Clin Cancer Res. 2001;7:3328-3335. [PubMed] |
| 13. | Le Naour F, Brichory F, Misek DE, Brechot C, Hanash SM, Beretta L. A distinct repertoire of autoantibodies in hepatocellular carcinoma identified by proteomic analysis. Mol Cell Proteomics. 2002;1:197-203. [PubMed] [DOI] |
| 14. | Kellner R, Lichtenfels R, Atkins D, Bukur J, Ackermann A, Beck J, Brenner W, Melchior S, Seliger B. Targeting of tumor associated antigens in renal cell carcinoma using proteome-based analysis and their clinical significance. Proteomics. 2002;2:1743-1751. [PubMed] [DOI] |
| 15. | Seliger B, Menig M, Lichtenfels R, Atkins D, Bukur J, Halder TM, Kersten M, Harder A, Ackermann A, Beck J. Identification of markers for the selection of patients undergoing renal cell carcinoma-specific immunotherapy. Proteomics. 2003;3:979-990. [PubMed] [DOI] |
| 16. | Hong SH, Misek DE, Wang H, Puravs E, Giordano TJ, Greenson JK, Brenner DE, Simeone DM, Logsdon CD, Hanash SM. An autoantibody-mediated immune response to calreticulin isoforms in pancreatic cancer. Cancer Res. 2004;64:5504-5510. [PubMed] [DOI] |
| 17. | Canelle L, Bousquet J, Pionneau C, Deneux L, Imam-Sghiouar N, Caron M, Joubert-Caron R. An efficient proteomics-based approach for the screening of autoantibodies. J Immunol Methods. 2005;299:77-89. [PubMed] [DOI] |
| 18. | Cui JW, Li WH, Wang J, Li AL, Li HY, Wang HX, He K, Li W, Kang LH, Yu M. Proteomics-based identification of human acute leukemia antigens that induce humoral immune response. Mol Cell Proteomics. 2005;4:1718-1724. [PubMed] [DOI] |
| 19. | Li C, Xiao Z, Chen Z, Zhang X, Li J, Wu X, Li X, Yi H, Li M, Zhu G. Proteome analysis of human lung squamous carcinoma. Proteomics. 2006;6:547-558. [PubMed] [DOI] |
| 20. | Wang Q, Xu Y, Zhao X, Chang Y, Liu Y, Jiang L, Sharma J, Seo DK, Yan H. A facile one-step in situ functionalization of quantum dots with preserved photoluminescence for bioconjugation. J Am Chem Soc. 2007;129:6380-6381. [PubMed] [DOI] |
| 21. | http://www. proteomics.com.cn/2005/info_lib.htm. |
| 22. | Zhang G, Spellman DS, Skolnik EY, Neubert TA. Quantitative phosphotyrosine proteomics of EphB2 signaling by stable isotope labeling with amino acids in cell culture (SILAC). J Proteome Res. 2006;5:581-588. [PubMed] [DOI] |
| 23. | Yu J, Wang Z, Kinzler KW, Vogelstein B, Zhang L. PUMA mediates the apoptotic response to p53 in colorectal cancer cells. Proc Natl Acad Sci U S A. 2003;100:1931-1936. [PubMed] [DOI] |
| 24. | Kohli M, Yu J, Seaman C, Bardelli A, Kinzler KW, Vogelstein B, Lengauer C, Zhang L. SMAC/Diablo-dependent apoptosis induced by nonsteroidal antiinflammatory drugs (NSAIDs) in colon cancer cells. Proc Natl Acad Sci U S A. 2004;101:16897-16902. [PubMed] [DOI] |
| 25. | Susin SA, Lorenzo HK, Zamzami N, Marzo I, Snow BE, Brothers GM, Mangion J, Jacotot E, Costantini P, Loeffler M. Molecular characterization of mitochondrial apoptosis-inducing factor. Nature. 1999;397:441-446. [PubMed] [DOI] |
| 26. | Xuan YH, Jung HS, Choi YL, Shin YK, Kim HJ, Kim KH, Kim WJ, Lee YJ, Kim SH. Enhanced expression of hedgehog signaling molecules in squamous cell carcinoma of uterine cervix and its precursor lesions. Mod Pathol. 2006;19:1139-1147. [PubMed] |
| 27. | Kogerman P, Grimm T, Kogerman L, Krause D, Unden AB, Sandstedt B, Toftgard R, Zaphiropoulos PG. Mammalian suppressor-of-fused modulates nuclear-cytoplasmic shuttling of Gli-1. Nat Cell Biol. 1999;1:312-319. [PubMed] [DOI] |
| 28. | Pereira-Faca SR, Kuick R, Puravs E, Zhang Q, Krasnoselsky AL, Phanstiel D, Qiu J, Misek DE, Hinderer R, Tammemagi M. Identification of 14-3-3 theta as an antigen that induces a humoral response in lung cancer. Cancer Res. 2007;67:12000-12006. [PubMed] [DOI] |
| 30. | Blake CC, Rice DW. Phosphoglycerate kinase. Philos Trans R Soc Lond B Biol Sci. 1981;293:93-104. [PubMed] [DOI] |
| 31. | Valentin C, Birgens H, Craescu CT, Brodum-Nielsen K, Cohen-Solal M. A phosphoglycerate kinase mutant (PGK Herlev; D285V) in a Danish patient with isolated chronic hemolytic anemia: mechanism of mutation and structure-function relationships. Hum Mutat. 1998;12:280-287. [PubMed] [DOI] |
| 32. | Fujii H, Yoshida A. Molecular abnormality of phosphoglycerate kinase-Uppsala associated with chronic nonspherocytic hemolytic anemia. Proc Natl Acad Sci U S A. 1980;77:5461-5465. [PubMed] [DOI] |
| 33. | Yeh CS, Wang JY, Chung FY, Lee SC, Huang MY, Kuo CW, Yang MJ, Lin SR. Significance of the glycolytic pathway and glycolysis related-genes in tumorigenesis of human colorectal cancers. Oncol Rep. 2008;19:81-91. [PubMed] |
| 34. | Lay AJ, Jiang XM, Daly E, Sun L, Hogg PJ. Plasmin reduction by phosphoglycerate kinase is a thiol-independent process. J Biol Chem. 2002;277:9062-9068. [PubMed] [DOI] |
| 35. | Hwang TL, Liang Y, Chien KY, Yu JS. Overex-pression and elevated serum levels of phos-phoglycerate kinase 1 in pancreatic ductal adeno-carcinoma. Proteomics. 2006;6:2259-2272. [PubMed] [DOI] |
| 36. | Shichijo S, Azuma K, Komatsu N, Ito M, Maeda Y, Ishihara Y, Itoh K. Two proliferation-related proteins, TYMS and PGK1, could be new cytotoxic T lymphocyte-directed tumor-associated antigens of HLA-A2+ colon cancer. Clin Cancer Res. 2004;10:5828-5836. [PubMed] [DOI] |
| 37. | Chen G, Gharib TG, Wang H, Huang CC, Kuick R, Thomas DG, Shedden KA, Misek DE, Taylor JM, Giordano TJ. Protein profiles associated with survival in lung adenocarcinoma. Proc Natl Acad Sci U S A. 2003;100:13537-13542. [PubMed] [DOI] |
| 38. | Chuthapisith S, Layfield R, Kerr ID, Hughes C, Eremin O. Proteomic profiling of MCF-7 breast cancer cells with chemoresistance to different types of anti-cancer drugs. Int J Oncol. 2007;30:1545-1551. [PubMed] |
| 39. | Wang J, Wang J, Dai J, Jung Y, Wei CL, Wang Y, Havens AM, Hogg PJ, Keller ET, Pienta KJ. A glycolytic mechanism regulating an angiogenic switch in prostate cancer. Cancer Res. 2007;67:149-159. [PubMed] [DOI] |
| 40. | Aldrich HC, McDowell L, Barbosa MF, Yomano LP, Scopes RK, Ingram LO. Immunocytochemical localization of glycolytic and fermentative enzymes in Zymomonas mobilis. J Bacteriol. 1992;174:4504-4508. [PubMed] |
| 41. | Fossel ET, Solomon AK. Ouabain-sensitive interaction between human red cell membrane and glycolytic enzyme complex in cytosol. Biochim Biophys Acta. 1978;510:99-111. [PubMed] [DOI] |
| 42. | Kumble KD, Vishwanatha JK. Immunoelectron microscopic analysis of the intracellular distribution of primer recognition proteins, annexin 2 and phosphoglycerate kinase, in normal and transformed cells. J Cell Sci. 1991;99:751-758. [PubMed] |