修回日期: 2008-04-16
接受日期: 2008-05-04
在线出版日期: 2008-06-18
目的: 观察重组腺病毒载体Ad-PD-L1转染供体C57BL/6(H-2b)小鼠树突状细胞(DC)对受体DBA/2(H-2d)小鼠淋巴细胞增殖和激活的影响.
方法: 构建腺病毒穿梭质粒pShuttle-GFP-CMV(-)-PD-L1和腺病毒骨架质粒pAdxsi-GFP-CMV-PD-L1, 对重组腺病毒Ad-PD-L1进行包装、扩增和纯化. 分离培养供体C57BL/6小鼠的DC, 分为3组: 腺病毒载体Ad-PD-L1转染组(A组), 空载体转染组(B组)和对照组(C组). Western blot检测转染后各组细胞PD-L1的表达. 分离受体DBA/2小鼠的淋巴细胞, 用羧基荧光素二醋酸琥珀酰亚胺酯(CFSE)标记, 将供体C57BL/6小鼠的DC和受体DBA/2小鼠淋巴细胞混合培养, 流式细胞仪观察淋巴细胞的增殖情况.
结果: 酶切及测序证实含PD-L1的重组腺病毒载体Ad-PD-L1构建成功. 转染供体C57BL/6小鼠的DC后其PD-L1的表达升高37%(P<0.05), 将转染了PD-L1的DC与受体DBA/2小鼠的淋巴细胞进行共培养. 与对照组相比, PD-L1表达升高后, 明显地抑制了淋巴细胞的增殖和活化. 受体DBA/2小鼠的淋巴细胞增殖降低41%(P<0.01).
结论: 转染供体C57BL/6小鼠DC后通过共刺激通路PD-1/PD-L1抑制了受体DBA/2小鼠淋巴细胞的增殖和激活.
引文著录: 朱研, 李涛, 朱继业, 陈建飞, 冷希圣. 重组腺病毒Ad-PD-L1转染供体小鼠树突状细胞对受体小鼠淋巴细胞激活的影响. 世界华人消化杂志 2008; 16(17): 1859-1865
Revised: April 16, 2008
Accepted: May 4, 2008
Published online: June 18, 2008
AIM: To investigate the effect of recombinant adenovirus Ad-PD-L1 transfection of donor mouse C57BL/6 (H-2b) dendritic cells on the activation of receptor mouse DBA/2(H-2d) lymphocytes.
METHODS: pShuttle-GFP-CMV(-) plasmid and adenovirus bone plasmid pAdxsi-GFP-CMV-PD-L1 were constructed. The recombinant adenovirus Ad-PD-L1 was packed, amplied and purified. Dendritic cells derived from donor mouse C57BL/6 bone marrow were isolated and cultured. The cells ware divided into 3 groups. Group A and Group B were transfected with recombinant adenovirus Ad-PD-L1-GFP and Ad-GFP respectively, and Group C served as blank control group. The expression of PD-L1 was monitored by GFP fluorescence in the infected cells and identified by Western blot. The lymphocytes of receptor mouse DBA/2 were isolated, and then labeled by carboxyfluorescein succinimidylester (CFSE). After co-cultured with the dendritic cells in the three groups, flow cytometry was used to observe the proliferation and activation of lymphocytes from DBA/2 mice.
RESULTS: Enzyme digestion and sequencing confirmed the successful construction of recombinant adenovirus Ad-PD-L1. After transfection with Ad-PD-L1, PD-L1 expression of dendritic cells was verified by Western blot. The expression of PD-L1 in the dendritic cells infected with Ad-PD-L1 was increased by 37% (P < 0.05). After co-cultured with the lymphocytes from DBA/2 mice, the proliferation and activation of receptor lymphocytes were suppressed remarkably, and the proliferation rate was decreased by 41% as compared with that in the control group.
CONCLUSION: Transfection of donor mouse dendritic cells with recombinant adenovirus suppresses the proliferation and activation of lymphocytes from receptor mice through PD-1/PD-L1 co-stimulatory pathway.
- Citation: Zhu Y, Li T, Zhu JY, Chen JF, Leng XS. Effect of recombinant adenovirus Ad-PD-L1 transfection of donor mouse dendritic cells on the activation of receptor mouse lymphocytes. Shijie Huaren Xiaohua Zazhi 2008; 16(17): 1859-1865
- URL: https://www.wjgnet.com/1009-3079/full/v16/i17/1859.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i17.1859
胃同种异体移植排斥主要是受体的淋巴细胞被激活后进而攻击、破坏新植入的供体器官, 使其丧失功能的细胞免疫应答过程. 共刺激信号在同种异体移植的急性排斥反应中对T淋巴细胞的活化起到重要作用[1-2]. 目前已经证明, 改变共刺激信号能够成功地诱导免疫耐受[3]. PD-1/PD-L1(programmed death-1)程序性死亡分子-1/程序性死亡分子-配体1是一个重要的共刺激通路, 在免疫系统中扮演负调控(negative regulation)角色[4-13]. 增强抗原呈递细胞(如树突状细胞)上PD-L1的表达, 则能通过PD-1/PD-L1共刺激通路抑制效应T细胞的活化和增生, 诱导免疫耐受现象. 我们构建含小鼠PD-L1基因的重组腺病毒载体, 转染供体C57BL/6小鼠骨髓来源的树突状细胞(dendritic cell, DC), 增加其表面的PD-L1表达, 再与受体DBA/2小鼠的淋巴细胞混合培养, 通过PD-1/PD-L1共刺激通路来抑制受体淋巴细胞的激活, 防止大量效应性T淋巴细胞的产生, 从而达到防止急性排斥反应发生的目的.
C57BL/6小鼠和DBA/2小鼠, 6-8 wk龄, SPF级, ♂, 购自维通利华公司, 普通饲料喂养, 自由进食水. 质粒pSport 1-mCD274购自ATCC(美国标准生物品收藏中心). pShuttle-GFP-CMV(-)和pAdxsi质粒以及DH5a菌株超级化学感受态购自北京诺赛基因组研究中心有限公司. 限制性内切酶I-ceuⅠ, I-sceⅠ, XhoⅠ, KpnⅠ, BglⅡ购自New England Biolabs公司, CIP酶(Alkaline Phosphatase, Calf Intestinal)购自Promega公司, DNA聚合酶为pfx DNA polymerase购自Invitrogen公司, T4 DNA连接酶购自New England Biolabs公司, 小提质粒试剂盒购自安徽优晶公司, 凝胶回收试剂盒购自天根生化公司. 重组小鼠粒细胞巨噬细胞集落刺激因子(rmGM-CSF)购自PeproTech公司, LPS和丝裂霉素C购自Sigma公司, 胎牛血清和RPMI 1640培养基购自Hyclone公司. PE-抗小鼠CD11c, PE-抗小鼠TER119, PE-抗小鼠Gr1, PE-抗小鼠B220 mAb购自eBioscience公司. Anti-PE MicroBead购自美天尼公司. CFSE购自美国Molecular Probes公司.
BglⅡ和KpnⅠ分别双酶切腺病毒穿梭质粒pShuttle-GFP-CMV(-)和pSPORT1-PD-L1, 凝胶回收线性化的pShuttle-GFP-CMV(-)和PD-L1片段, 高效连接液连接(22℃, 3 h), 转化DH5α感受态细菌, 在卡那霉素抗性的LB平板上培养过夜, 挑选转化的菌落, 提取质粒, BglⅡ和KpnⅠ双酶切筛选并鉴定阳性克隆, 同时送检北京诺赛基因组研究中心有限公司测序分析. 构建腺病毒穿梭质粒pShuttle-GFP-CMV(-)-PD-L1. 另外, I-ceuⅠ和I-sceⅠ分别双酶切pShuttle-GFP-CMV(-)-PD-L1和空的腺病毒骨架质粒pAdxsi, 凝胶回收GFP-CMV-PD-L1表达框片断和线性化的pAdxsi, 高效连接液连接(22℃, 3 h), 转化DH5α感受态细菌, 在氨苄青霉素抗性的LB平板上培养过夜, 挑选转化的菌落, 提取质粒, XhoⅠ单酶切筛选并鉴定阳性克隆. 构建腺病毒骨架质粒pAdxsi-GFP-CMV-PD-L1. PacⅠ线性化pAdxsi-GFP-CMV-PD-L1, 酶切产物转染于事先准备好的6孔板细胞中(两个孔). 在酶切的小管中, 先加生理盐水200 μL, 另取一个EP管加入生理盐水200 μL, 同时加入转染试剂2 μL, 5 min后将两管混合, 混匀后静置15 min, 分别取200 μL DNA和转染试剂的混合物加入六孔板细胞中(活细胞密度保证90%以上)培养孔中轻轻混合, 继续培养12 h后更换完全培养基. 13 d后直至90%以上293细胞出现细胞病变(cytopathic effect, CPE). 收集上清继续感染293细胞以扩增病毒. 重组腺病pAdxsi-GFP-CMV-PD-L1纯化采用氯化铯密度梯度离心法. 收集后的病毒进行透析, 每次用200×体积的透析Buffer, 透析3次, 间隔1 h换1次液. 透析后分装成若干小管, -80℃保存. 取纯化后的Adxsi-GFP-mCD274病毒液10 μL, 加pH8.0的Tris-HCl 90 μL稀释, 以100 μL pH8.0的Tris-HCl作为空白对照, 用分光光度计测A260及A260/A280的值. 病毒颗粒数(VP) = (A260)×稀释倍数×1.1×1012. 采用改进的TCID50法检测病毒感染性滴度.
1.2.1 供体C57BL/6小鼠骨髓DC的分离和培养: 小鼠颈椎脱臼处死, 750 mL/L乙醇浸泡10 min, 无菌取双侧股骨和胫骨, 用RPMI 1640培养基冲洗出骨髓细胞. 离心, 弃上清后向沉淀中加入无菌Tris-NH4Cl溶解红细胞. 过滤网, 加入MACS Buffer, 离心, 去上清, 重悬细胞沉淀成为单细胞悬液, 与PE-TER119抗体、PE-Gr1抗体、PE-B220抗体及抗-PE磁珠孵育. 4℃反应10 min, 离心洗涤后将细胞悬液加入MS磁分离柱中并按照说明书进行分离纯化. 以含20 μg/L GM-CSF和100 mL/L FCS的RPMI 1640将细胞悬浮后, 分至24孔细胞培养板中(0.5×106/孔). 置37℃, 50 mL/L CO2中培养. 隔天半量换液, 7 d时收获细胞.
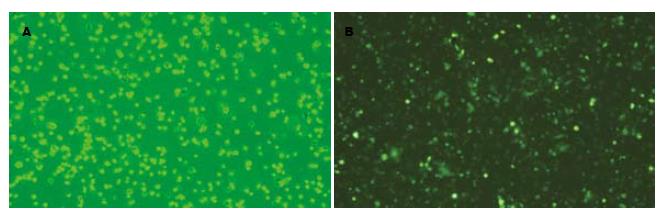
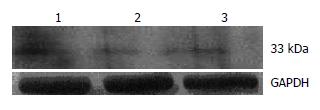
1.2.2 重组腺病毒Ad-PD-L1转染DC: 将收获的DC计数后调整为2×109/L接种于六孔细胞培养板中, 每孔加入0.5 mL. 细胞分为3组: (1)PD-L1组: RPMI 1640+重组腺病毒载体Ad-PD-L1; (2)阴性对照组: RPMI 1640+空腺病毒载体Ad-GFP; (3)空白对照组: RPMI 1640. 孔内加入腺病毒后, 每隔10-15 min摇匀1次. 2 h后, 每孔中培养液加至1.5-2 mL, 37℃, 50 mL/L CO2中孵育. 培养10-16 h后, 每孔加入1 mg/L的LPS诱导DC成熟. 细胞转染48 h后, 通过荧光显微镜和流式细胞仪检测GFP, 确定细胞转染效率. 同时检测细胞凋亡情况. 重组腺病毒Ad-PD-L1转染DC后48 h, 提取各组细胞的总蛋白, 行Western blot检测各组细胞PD-L1的表达.
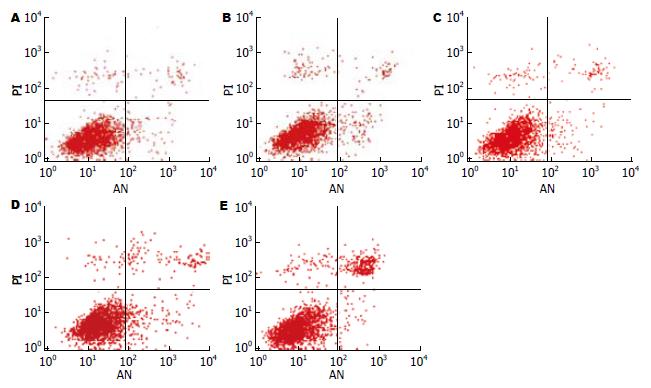
1.2.3 混合淋巴细胞培养反应并观察改变供体C57BL/6小鼠的DC的PD-L1表达对受体DBA/2小鼠淋巴细胞激活和增殖的影响: 颈椎脱臼法处死DBA/2小鼠, 取其脾脏置于少量RPMI 1640培养液中, 研磨筛滤成单细胞悬液, 再用小鼠淋巴细胞分离液分离混合淋巴细胞, 置37℃, 50 mL/L CO2中培养4 h. 参照文献[14]的方法, 采用羧基荧光素二醋酸琥珀酰亚胺酯(CFSE)对淋巴细胞进行标记. 用含100 mL/L FCS的RPMI 1640培养基悬浮细胞至2×109/L, 以100 μL/孔加入96孔板. 收集转染了48 h的3组DC, 用25 mg/L丝裂霉素C 37℃处理30 min, 洗涤3次作为刺激细胞, 与淋巴细胞以1:5的比例加入96孔培养板中, 每孔体积200 μL, 每组设3个复孔. 继续培养96 h, 收集细胞, 流式细胞仪检测CFSE荧光变化.
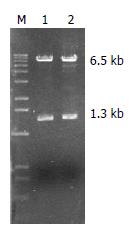
根据pSPORT1-PD-L1质粒的图谱可知, 小鼠PD-L1基因插在SalⅠ和NotⅠ之间, 用EcoRⅠ单酶切或KpnⅠ+BglⅡ双酶切, 分别可得到约6.5 kb和1.3 kb的2个片段(图1). 进行DNA双向测序, 经测序结果分析软件及同源性比较分析证实, 与文献[19]报道PD-L1cDNA序列一致. 表明我们已成功获得PD-L1cDNA.
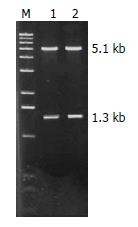
将pSport1-mCD274用BglⅡ+KpnⅠ双酶切, 切胶回收含PD-L1基因的1.3 kb的片段, 定向插入用同样双酶切的穿梭质粒pShuttle-GFP-CMV(-), 分别提取2个阳性转化菌落质粒, 经BglⅡ+KpnⅠ酶切鉴定, 均得到1.3 kb和5.1 kb两个片段, 证明插入片段正确(图2), 将阳性质粒命名为pShuttle-GFP-CMV(-)-PD-L1. 经测序证明, 与文献报道的PD-L1 cDNA序列一致, 表明构建成功.
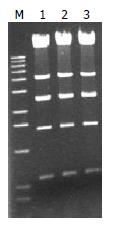
构建成功的pShuttle-GFP-CMV(-)-PD-L1质粒经I-CeuⅠ+ I-SceⅠ双酶切, 跑胶回收2.4 kb片段. 用同样的双酶切pAdxsi载体, 将酶切处理好的载体片段和插入片段进行连接, 转化化学感受态细胞DH5a菌株, 提取3个阳性转化菌落质粒, 经XhoⅠ酶切后分别可见14, 11.8, 4, 2.6, 2.47, 1.45, 0.6 kb 7条带(图3), 证明载体构建成功. 得到最终所需要的腺病毒骨架质粒将其命名为pAdxsi-GFP-CMV-PD-L1.
A260/A280的正常范围: 1.20-1.30. 检测结果为1.28符合正常范围. 测得A260为0.595, 体积2 mL. 总病毒颗粒数为: 0.595×10×1.1×1012×2 = 1.3×1013 VP, 感染性滴度测定结果为2×1014 PFU/L.
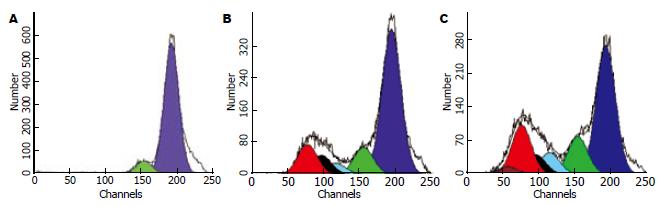
根据六孔培养板中DC数, 按照MOI = 100, 200, 400, 600分别加入不同量的腺病毒载体, 综合细胞转染效率(分别为22.8%, 30.8%, 36.1%, 40.2%, 图4)以及转染后细胞凋亡比例(分别为2.26%, 4.68%, 5.39%, 10.9%, 图5)选择最适MOI值, 最终选择MOI = 400进行转染.
荧光显微镜下观察, 在绿色荧光激发通道GFP受激发, 转染了腺病毒载体的DC发出明亮的绿色荧光(图6). pAdxsi-GFP-CMV-PD-L1重组腺病毒感染后用Western blot检测表明: 供体C57BL/6小鼠DC的PD-L1表达比对照组升高了37%(P<0.05, 图7).
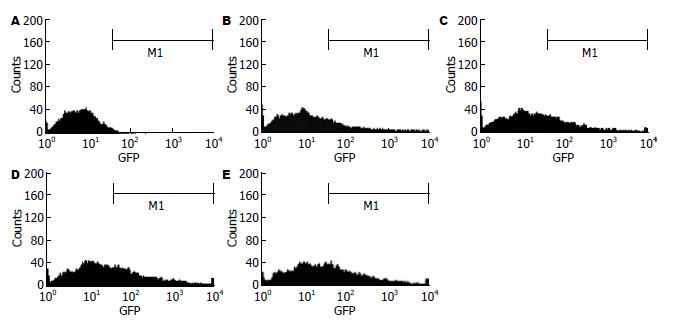
重组腺病毒Ad-PD-L1转染的供体C57BL/6小鼠的DC与受体DBA/2小鼠的淋巴细胞进行混合培养后, 明显抑制了受体淋巴细胞的增殖和活化. 与对照组相比, PD-L1表达升高后, 受体DBA/2小鼠的淋巴细胞增殖降低了41%(P<0.01, 图8).
PD-L1分子是B7超家族的一员, 主要表达于抗原呈递细胞如树突状细胞(DC), 其受体PD-1主要在活化的T淋巴细胞, B细胞、髓系细胞和胸腺细胞中表达. PD-L1和PD-1的结合可以抑制T细胞受体介导的T细胞增殖和细胞因子的分泌, 是T细胞活化的负性调控信号[14-18]. 目前已经有研究证实, 靶向给予PD-L1-Ig明显抑制心脏移植物的排斥反应, 提高移植物的存活率[19]. 表明通过PD-L1/PD-1共刺激信号可以降低T细胞介导的免疫应答, 从而诱导免疫耐受. 在未成熟树突状细胞(immature DC, iDC)上由于B7分子表达相对较低, PD-L1的表达相对较高, 因此导致PD-L1/PD-1信号通路在iDC上发挥着重要作用-即可产生对T细胞的抑制效应. 而成熟树突状细胞(mature DC, mDC)上由于B7和MHC分子呈高表达, 在此情况下PD-L1/PD-1信号通路的抑制功能受到削弱, 导致刺激因子与抑制因子的平衡趋向于刺激效应, 从而使T细胞活化和增殖[20]. 在本研究中, 我们构建了含PD-L1基因的腺病毒真核表达载体Ad-PD-L1, 转染供体C57BL/6小鼠骨髓来源的mDC, 增加其表面的PD-L1表达, 再与受体DBA/2小鼠的淋巴细胞混合培养, 通过PD-1/PD-L1共刺激通路来抑制受体淋巴细胞的激活, 防止大量效应性T淋巴细胞的产生, 从而达到防止急性排斥反应发生的目的. 我们发现, 腺病毒载体Ad-PD-L1转染供体C57BL/6小鼠的mDC后其PD-L1的表达升高了37%(P<0.05), 将转染了PD-L1的DC与受体DBA/2小鼠的淋巴细胞进行共培养. 与对照组相比, PD-L1表达升高后, 明显地抑制了淋巴细胞的增殖和活化. 受体DBA/2小鼠的淋巴细胞增殖降低了41%(P<0.01).
为了确保对DC的转染效率, 我们采用了腺病毒作为运载工具. 重组腺病毒载体以其高效转染性与安全性, 成为目前应用最广泛的基因工程载体[21]. 他的宿主范围广, 且既能感染处于分裂增殖期的细胞, 又能感染静止期的细胞. 而且缺陷型重组腺病毒载体由于不整合入细胞染色体基因组, 从而具有毒性低和安全性高的优点, 另外还具有病毒滴度高和装载容量大等特点[22]. 我们所使用的Adxsi载体系统又具有一些独特的优点: (1)I-CeuⅠ和I-SceⅠ是属于内含子编码的归位内切酶, 能识别较长的非回文序列, 在人和小鼠的基因组内几乎没有出现. 而且用这两个酶一起使用, 在后续的连接效率会很高, 避免了同源重组方案(如Adeasy系统)的重组效率低以及非特异重组等缺点. (2)采用氯化铯密度梯度超速离心法可保证有活性的病毒比率提高, VP:PFU的比值为32, 而一般的阴离子交换柱的方法纯化的腺病毒的VP:PFU比值在50-100之间. 本实验所构建的腺病毒载体中带有绿色荧光蛋白基因, 通过GFP的表达可确定该病毒载体对树突细胞的转染效率, 同时我们还检测了不同MOI值感染DC后其凋亡情况. 我们发现随着病毒量的增加即复感染指数(MOI)的增大转染效率也随之增大. 但当MOI为600时, 凋亡DC的比率明显增加. 因此, 我们采用MOI值400对DC进行转染. 重组腺病毒Ad-PD-L1转染供体C57BL/6小鼠的DC后, 与受体DBA/2小鼠的淋巴细胞进行混合培养. 检测受体小鼠淋巴细胞的增殖, 我们采用了活体染料羧基荧光素二醋酸琥珀酰亚胺酯(carboxyfluorescein succinimidylester, CFSE), CFSE是一种带负电荷并具有强荧光的可穿过细胞膜的荧光染料, CFSE进入细胞后可以不可逆地与细胞内的氨基结合偶联到细胞蛋白质上. 当细胞分裂时, CFSE标记荧光可平均分配到两个子代细胞中, 因此在一个增殖的细胞群中, 各连续传代细胞以亲代细胞荧光强度的一半而递减为特征, 并可以利用流式细胞术在488 nm激发光下进行分析[23]. 追踪器官移植中免疫细胞的活化、分裂、增殖、凋亡一直是移植免疫研究的重点, 在CFSE标记技术出现之前, 免疫细胞的研究主要是依靠3H-TdR掺入法和MTT法. 这两种方法只能在群体水平上检测细胞增殖, 并且只能局限于体外实验, 而CFSE标记技术能检测免疫反应的动态变化, 体内或体外追踪某个细胞亚群甚至单个细胞的分裂增殖, 为免疫细胞的增殖分析提供了更加全面的资料.
总之, 我们成功构建了含小鼠PD-L1基因的重组腺病毒载体, 并采用重组腺病毒Ad-PD-L1转染供体C57BL/6小鼠树突细胞, 通过共刺激通路PD-1/PD-L1抑制了受体淋巴细胞的激活. 为进一步的体内免疫耐受实验打下了良好的基础.
器官移植术后的急性排斥反应是受体淋巴细胞激活后攻击、破坏新植入的供体器官, 使其丧失功能的细胞免疫应答过程. 淋巴细胞的活化需要双信号刺激, 一个是抗原肽-MHC分子-CD3/TCR复合物, 另一个是共刺激信号, 由抗原呈递细胞表面的共刺激分子与T细胞膜上的配体结合提供共刺激信号, 是T淋巴细胞活化所必须的. 通过改变抗原呈递细胞表面分子表达来阻断共刺激信号是目前免疫耐受研究的热点. PD-1/PD-L1是一个重要的共刺激通路, 在免疫系统中扮演负调控角色. 增强抗原呈递细胞(如树突状细胞)上PD-L1的表达, 则能通过PD-1/PD-L1共刺激通路抑制效应T细胞的活化和增生, 诱导免疫耐受现象.
仇毓东, 副教授, 南京大学医学院附属鼓楼医院肝胆外科
通过共刺激途径诱导免疫耐受是目前移植免疫研究最活跃的领域之一. 针对抗原呈递细胞, 如树突状细胞(DC), 采用反义寡核苷酸、或单克隆抗体等封闭共刺激通路是目前常用的研究方法.
目前已经证明, 阻断共刺激信号能够成功地诱导免疫耐受, 通过改变抗原呈递细胞表面分子表达诱导免疫耐受的发生是完全可能的. 已进行的尝试包括将Fas-L的基因片段导入抗原呈递细胞中、应用反义寡核苷酸或CD40L的单抗封闭共刺激信号以及利用体外合成的HLA相关肽改变抗原呈递细胞表面分子结构等方法都达到了诱导T细胞凋亡的目的.
以往的研究表明, 在同种异体移植中, 阻断共刺激通路能够成功地诱导免疫耐受. 在本研究中, 作者构建了含PD-L1基因的腺病毒真核表达载体Ad-PD-L1, 转染供体C57BL/6小鼠骨髓来源的mDC, 增加其表面的PD-L1表达, 再与受体DBA/2小鼠的淋巴细胞混合培养, 通过PD-1/PD-L1共刺激通路来抑制受体淋巴细胞的激活, 防止大量效应性T淋巴细胞的产生, 从而达到防止急性排斥反应发生的目的, 国内外未见报道.
本研究成功构建了含小鼠PD-L1基因的重组腺病毒载体, 并采用重组腺病毒Ad-PD-L1转染供体C57BL/6小鼠树突细胞, 通过共刺激通路PD-1/PD-L1抑制了受体淋巴细胞的激活, 为进一步的体内诱导特异性免疫耐受以及将来的临床应用打下了基础.
活体染料羧基荧光素二醋酸琥珀酰亚胺酯(CFSE): CFSE是一种带负电荷并具有强荧光的可穿过细胞膜的荧光染料, CFSE进入细胞后可以不可逆地与细胞内的氨基结合偶联到细胞蛋白质上. 当细胞分裂时, CFSE标记荧光可平均分配到两个子代细胞中, 因此在一个增殖的细胞群中, 各连续传代细胞以亲代细胞荧光强度的一半而递减为特征, 并可以利用流式细胞术在488 nm激发光下进行分析. 追踪器官移植中免疫细胞的活化、分裂、增殖、凋亡一直是移植免疫研究的重点, 在CFSE标记技术出现之前, 免疫细胞的研究主要是依靠3H-TdR掺入法和MTT法. 这两种方法只能在群体水平上检测细胞增殖, 并且只能局限于体外实验, 而CFSE标记技术能检测免疫反应的动态变化, 体内或体外追踪某个细胞亚群甚至单个细胞的分裂增殖, 为免疫细胞的增殖分析提供了更加全面的资料.
本实验设计合理, 科学性强. 数据可信, 结论可靠. 对移植免疫耐受的理论和临床研究具有很好的价值.
编辑: 潘伯荣 电编:吴鹏朕
| 1. | Nurieva R, Thomas S, Nguyen T, Martin-Orozco N, Wang Y, Kaja MK, Yu XZ, Dong C. T-cell tolerance or function is determined by combinatorial costimulatory signals. EMBO J. 2006;25:2623-2633. [PubMed] [DOI] |
| 2. | Collins M, Ling V, Carreno BM. The B7 family of immune-regulatory ligands. Genome Biol. 2005;6:223. [PubMed] [DOI] |
| 3. | Snanoudj R, de Préneuf H, Créput C, Arzouk N, Deroure B, Beaudreuil S, Durrbach A, Charpentier B. Costimulation blockade and its possible future use in clinical transplantation. Transpl Int. 2006;19:693-704. [PubMed] [DOI] |
| 4. | Koga N, Suzuki J, Kosuge H, Haraguchi G, Onai Y, Futamatsu H, Maejima Y, Gotoh R, Saiki H, Tsushima F. Blockade of the interaction between PD-1 and PD-L1 accelerates graft arterial disease in cardiac allografts. Arterioscler Thromb Vasc Biol. 2004;24:2057-2062. [PubMed] [DOI] |
| 5. | Cai G, Karni A, Oliveira EM, Weiner HL, Hafler DA, Freeman GJ. PD-1 ligands, negative regulators for activation of naive, memory, and recently activated human CD4+ T cells. Cell Immunol. 2004;230:89-98. [PubMed] [DOI] |
| 6. | Konishi J, Yamazaki K, Azuma M, Kinoshita I, Dosaka-Akita H, Nishimura M. B7-H1 expression on non-small cell lung cancer cells and its relationship with tumor-infiltrating lymphocytes and their PD-1 expression. Clin Cancer Res. 2004;10:5094-5100. [PubMed] [DOI] |
| 7. | Iwai Y, Terawaki S, Ikegawa M, Okazaki T, Honjo T. PD-1 inhibits antiviral immunity at the effector phase in the liver. J Exp Med. 2003;198:39-50. [PubMed] [DOI] |
| 8. | Liang SC, Latchman YE, Buhlmann JE, Tomczak MF, Horwitz BH, Freeman GJ, Sharpe AH. Regulation of PD-1, PD-L1, and PD-L2 expression during normal and autoimmune responses. Eur J Immunol. 2003;33:2706-2716. [PubMed] [DOI] |
| 9. | Latchman YE, Liang SC, Wu Y, Chernova T, Sobel RA, Klemm M, Kuchroo VK, Freeman GJ, Sharpe AH. PD-L1-deficient mice show that PD-L1 on T cells, antigen-presenting cells, and host tissues negatively regulates T cells. Proc Natl Acad Sci U S A. 2004;101:10691-10696. [PubMed] [DOI] |
| 10. | Schreiner B, Mitsdoerffer M, Kieseier BC, Chen L, Hartung HP, Weller M, Wiendl H. Interferon-beta enhances monocyte and dendritic cell expression of B7-H1 (PD-L1), a strong inhibitor of autologous T-cell activation: relevance for the immune modulatory effect in multiple sclerosis. J Neuroimmunol. 2004;155:172-182. [PubMed] [DOI] |
| 11. | Coyle AJ, Gutierrez-Ramos JC. The expanding B7 superfamily: increasing complexity in costimulatory signals regulating T cell function. Nat Immunol. 2001;2:203-209. [PubMed] [DOI] |
| 12. | Truong W, Hancock WW, Anderson CC, Merani S, Shapiro AM. Coinhibitory T-cell signaling in islet allograft rejection and tolerance. Cell Transplant. 2006;15:105-119. [PubMed] [DOI] |
| 13. | Dong H, Strome SE, Salomao DR, Tamura H, Hirano F, Flies DB, Roche PC, Lu J, Zhu G, Tamada K. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med. 2002;8:793-800. [PubMed] |
| 14. | Fulcher D, Wong S. Carboxyfluorescein succinimidyl ester-based proliferative assays for assessment of T cell function in the diagnostic laboratory. Immunol Cell Biol. 1999;77:559-564. [PubMed] [DOI] |
| 15. | Selenko-Gebauer N, Majdic O, Szekeres A, Höfler G, Guthann E, Korthäuer U, Zlabinger G, Steinberger P, Pickl WF, Stockinger H. B7-H1 (programmed death-1 ligand) on dendritic cells is involved in the induction and maintenance of T cell anergy. J Immunol. 2003;170:3637-3644. [PubMed] |
| 16. | Liu X, Gao JX, Wen J, Yin L, Li O, Zuo T, Gajewski TF, Fu YX, Zheng P, Liu Y. B7DC/PDL2 promotes tumor immunity by a PD-1-independent mechanism. J Exp Med. 2003;197:1721-1730. [PubMed] [DOI] |
| 17. | Dong H, Zhu G, Tamada K, Flies DB, van Deursen JM, Chen L. B7-H1 determines accumulation and deletion of intrahepatic CD8(+) T lymphocytes. Immunity. 2004;20:327-336. [PubMed] [DOI] |
| 18. | Stuart LM, Lucas M, Simpson C, Lamb J, Savill J, Lacy-Hulbert A. Inhibitory effects of apoptotic cell ingestion upon endotoxin-driven myeloid dendritic cell maturation. J Immunol. 2002;168:1627-1635. [PubMed] |
| 19. | Ozkaynak E, Wang L, Goodearl A, McDonald K, Qin S, O'Keefe T, Duong T, Smith T, Gutierrez-Ramos JC, Rottman JB. Programmed death-1 targeting can promote allograft survival. J Immunol. 2002;169:6546-6553. [PubMed] |
| 20. | Brown JA, Dorfman DM, Ma FR, Sullivan EL, Munoz O, Wood CR, Greenfield EA, Freeman GJ. Blockade of programmed death-1 ligands on dendritic cells enhances T cell activation and cytokine production. J Immunol. 2003;170:1257-1266. [PubMed] |
| 21. | Rouard H, Léon A, Klonjkowski B, Marquet J, Tennezé L, Plonquet A, Agrawal SG, Abastado JP, Eloit M, Farcet JP. Adenoviral transduction of human 'clinical grade' immature dendritic cells enhances costimulatory molecule expression and T-cell stimulatory capacity. J Immunol Methods. 2000;241:69-81. [PubMed] [DOI] |
| 22. | Efrat S, Fejer G, Brownlee M, Horwitz MS. Prolonged survival of pancreatic islet allografts mediated by adenovirus immunoregulatory transgenes. Proc Natl Acad Sci U S A. 1995;92:6947-6951. [PubMed] [DOI] |