修回日期: 2008-04-25
接受日期: 2008-05-12
在线出版日期: 2008-06-08
目的: 探索脂肪酸代谢变化在非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)发病中的作用.
方法: SD大鼠正常喂养1 wk后, 随机分为正常组和高脂饮食组(n = 7). 正常组大鼠以普通饲料喂养, 高脂饮食组以高脂饲料喂养. 实验第16周分别处死大鼠, 观察肝组织的病理改变. ECF衍生GC/MS技术分析NASH大鼠与正常大鼠肝组织脂肪酸代谢的变化, 并运用SPSS11.0软件, 进行主成分分析(PCA), 观察代谢产物信息.
结果: 高脂饮食组大鼠脂肪肝病变程度均为+++, 均达到脂肪肝诊断标准, 且炎症明显. NASH和正常组大鼠肝组织代谢组形态具有明显差异. 高脂饮食大鼠NASH肝脏与正常组相比较, 存在明显的脂肪酸谱变化. 与对照组相比, 除正十二烷酸降低0.56, 其余脂肪酸均显著升高(P<0.05), 硬脂酸、十四烷酸、十六烷酸、二十烷酸、油酸、α-亚麻酸、花生四烯酸和亚油酸分别升高5.42、4.10、11.56、5.86、1.89、1.82、8.00和2.44倍, 且ω-6/ω-3多不饱和脂肪酸的比值升高.
结论: NASH大鼠肝脏存在明显的脂肪酸代谢变化, 肝细胞内各类脂肪酸聚积、ω-6/ω-3多不饱和脂肪酸比率失衡和正十二烷酸降低可能对脂肪肝炎症发生、肝损伤有重要作用.
引文著录: 陆金来, 陈金联, 陈明祥, 洪静, 陈维雄, 朱金水, 陈尼维. 肝脏脂肪酸在高脂饮食大鼠非酒精性脂肪性肝病模型中的代谢. 世界华人消化杂志 2008; 16(16): 1728-1733
Revised: April 25, 2008
Accepted: May 12, 2008
Published online: June 8, 2008
AIM: To analyze fatty acid metabolic profile changes of fatty livers induced by a high fat diet and to determine it's role in non-alcoholic steatohepatitis (NASH).
METHODS: Sprague-Dawley rats were randomly divided into two groups: the control group (treated with normal diet, n = 7) and the model group (treated with high fat diet, n = 7). The rats were all killed at wk 16 to detect pathological changes in liver tissues. The metabolic profile changes of fatty acid in NASH and normal liver tissue samples were detected by ECF derivatization for GC/MS technology. Data were analyzed using SPSS 11.0 software package.
RESULTS: After a high fat diet for 16 wk, severe fatty livers (+++) were present in the high fat diet group with remarkable inflammation. A significant morphological difference was detected between the two groups. Total ion current (TIC) and principal component analysis (PCA) indicated that there were significantly different metabolic patterns in liver tissues between the two groups. Compared with the control group, all fatty acids were raised significantly except a 56% decrease in dodecanoic acid (P < 0.05). Octadecanoic acid, tetradecanoic acid, hexadecanoic acid, eicosanoic acid, 9-octadecenoic acid, 9, 12, 15-octadecatrienoic acid, 5, 8, 11, 14-eicosatetraenoic acid and 9, 12-octadecadienoic acid were raised 5.42, 4.10, 11.56, 5.86, 1.82 and 8.00, 2.44-folds, respectively. Moreover, ω-6/ω-3 polyunsaturated fatty acids (PUFAs) ratio was raised.
CONCLUSION: Our results suggest that there are significant fatty acids metabolic profile changes in NASH. Excessive fatty acids accumulation in hepatic cells, ω-6/ω-3 ratio imbalance and dudecanoic acid decrease may pay a crucial role in steatohepatitis and hepatic injury.
- Citation: Lu JL, Chen JL, Chen MX, Hong J, Chen WX, Zhu JS, Chen NW. Fatty acids metabolic profile in high fat diet-induced non-alcoholic fatty liver disease in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(16): 1728-1733
- URL: https://www.wjgnet.com/1009-3079/full/v16/i16/1728.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i16.1728
近年来, 由于饮食结构的西化和生活方式的改变, 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)的发病率日益增高[1-4]. 单纯性脂肪肝可进展为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH), 并进一步发展为肝硬化、肝癌等终末期肝病[5-7]. 根据脂肪肝的定义, 肝组织脂肪含量超过肝重量的5%以上, 或在组织学上有1/3以上肝细胞脂肪化时, 即称之为脂肪肝[8], 但目前对单纯肝脏脂肪储积发展为NASH的机制尚未弄清楚. 细胞内许多生命活动实际上是发生在代谢物层面的, 关于脂肪肝肝脏代谢的变化报道甚少, 故本研究在建立高脂饮食SD大鼠NASH模型的基础上, 应用代谢组学的方法, 检测肝脏脂肪酸代谢的变化, 并研究其在NASH发病中的意义.
健康♂SD大鼠购于中科院上海实验动物中心, 体质量220±30 g, 胆固醇由上海盛季科技发展有限公司提供, 酸度-乙醇溶解测验合格. GC/MS分析所用试剂和仪器均由上海交通大学药学院提供. 试剂主要包括乙基氯甲酸酯(ECF)、吡啶、无水乙醇、氢氧化钠、氯仿、无水硫酸钠分析纯(中国国家药学集团公司). 仪器主要包括气相色谱-质谱联用仪(Perkin Elmer公司)、WH-90A微型旋涡混合器(上海振荣科学仪器有限公司)等.
1.2.1 分组及造模: 大鼠正常喂养1 wk后, 随机分为2组, 正常组和高脂饮食组(n = 7). 高脂饮食组以高脂饲料(0.88普通饲料+0.10猪油+0.02胆固醇)喂养, 正常组大鼠予以普通饲料喂养. 实验动物均饲养于本院动物房, 自由进食和饮水, 3-4只/笼.
1.2.2 标本收集和病理学检查: 实验第16周分别处死正常组和高脂饮食组大鼠. 在肝固定部位取2块肝组织, 1块以100 g/L中性甲醛固定后, 石蜡包埋切片, HE染色, 光镜下观察肝病理变化, 检测脂肪肝程度, 根据肝小叶内含脂滴细胞数占总细胞的比值为0、1/3、1/3-2/3、>2/3将肝脏脂肪变分为-、+、++、+++, 达到(++)或以上者, 诊断为脂肪肝; 另一块立即置-80℃冷冻保存.
1.2.3 样品制备: (1)首先提取组织, 用蒸馏水和无水乙醇1:1研磨, 得到0.1 kg/L的组织, 以转速 10 000 g离心10 min, 保留上层水相. (2)接着开始ECF衍生化过程, 取上清400 μL加入screw-top玻璃管, 加入无水乙醇200 μL, 蒸馏水400 μL, 吡啶100 μL, ECF 50 μL静止1 min, 振荡10 s, 进行第1次衍生化; 将混合物用40 kHz超声1 min, 加入10 mol/L的NaOH 100 μL调节pH值, 同时加入ECF50 μL, 振荡10 s, 进行第2次衍生化; 超声1 min, 加入氯仿30 μL抽提, 振荡30 s, 静止5 min, 以3000 r/min离心10 min, 静止10-20 min. (3)抽取出水层, 剩下的氯仿层含有衍生物被分离出来, 用无水硫酸钠吸干, 待进样.
1.2.4 GC/MS分析过程: (1)GC/MS分析: 衍生萃取物用Perkin Elmer色谱、TurboMass-Autosystem XL质谱仪进行测定. 色谱条件: 色谱柱DB-5MS毛细管柱(Agilent J&W Scientific, Folsom, CA), 不分流进样, 进样量1 μL, 进样口温度260℃, 离子源温度200℃. 程序升温起始温度80℃, 保持2 min, 以10℃/min升至140℃, 以4℃/min升至240℃, 再以10℃/min升至280℃, 保持3 min. 以流速1 mL/min的氦气作为载气. 质谱条件: 电离方式EI, 电子能量70 eV, 质谱扫描范围: m/z30-550, 全扫描方式. (2)数据分析: 利用仪器附带的TurboMass ver4.1.1软件和NIST质谱仪对色谱图中色谱峰进行定性定量分析. 所有的GC-MS原始文件多变量分析之前使数据标准化, 合成的三维矩阵包括峰指数, 样本名称和标准的峰面积百分比, 引入SPSS11.0, 应用主要成分分析(PCA)直观地观察代谢产物信息.
统计学处理 采用SPSS11.0软件包统计. 计量资料用mean±SD, 采用t检验, P<0.05表示两组代谢产物差异有统计学意义.
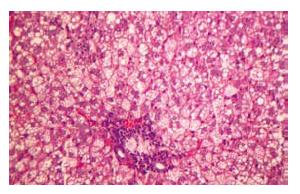
光镜下可见正常大鼠肝组织均无脂肪肝等病理改变. 高脂饮食16 wk大鼠脂肪肝明显, 病变程度均为+++, 100%大鼠达到脂肪肝诊断标准, 门管区见慢性炎症细胞浸润, 肝小叶内肝细胞内可见大囊泡和小囊泡型脂肪滴贮积, 为大泡性和小泡性混合性肝细胞脂肪变性, 可见肝细胞坏死, 炎症细胞浸润明显, 主要以单个核细胞浸润为主, 肝间质无纤维化(图1).
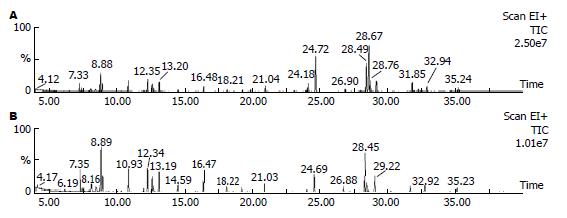
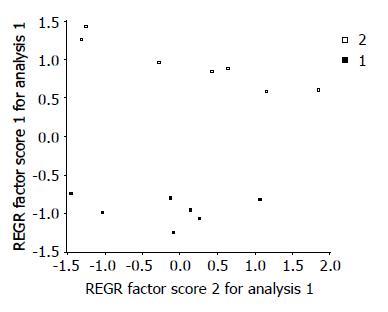
GC/MS分析正常组与高脂饮食组肝脏色谱峰总离子流(total ion current, TIC)表达情况, 结果显示正常组与高脂饮食组两组肝脏色谱峰总离子流显著差异(图2). 运用SPSS11.0软件对数据进行PCA, 直观地显示各组肝组织的代谢组信息(图3), 从图中可以看出两组代谢形态有明显差异.
然后利用仪器附带的TurboMass ver4.1.1软件和NIST Mass Spectral Database数据库对有表达差异的色谱峰进行质谱解析, 结合保留时间进行定性, 识别与NASH相关的生物标志物. 两组物质进行t检验, 共得出9个有表达差异的脂肪酸产物(P<0.05, 表1). 我们可以看出高脂饮食大鼠NASH肝脏与正常组相比较, 存在明显的脂肪酸谱变化. 与对照组相比较, 饱和脂肪酸正十二烷酸降低0.56, 硬脂酸、十四烷酸、十六烷酸、二十烷酸分别升高5.42、4.10、11.56、5.86倍; 单不饱和脂肪酸油酸升高1.89倍; ω-3多不饱和脂肪酸α-亚麻酸(ALA)升高1.82倍; ω-6多不饱和脂肪酸包括花生四烯酸(AA)和亚油酸(LA)分别升高8.00和2.44倍. 另外ω-6升高的程度明显高于ω-3, 对AA/ALA比值进行统计分析, 结果有统计学意义(P<0.05), 而LA/ALA比值没有统计学意义(P>0.05), 提示NASH时有ω-6/ω-3多不饱和脂肪酸比值升高, 存在ω-6/ω-3代谢不平衡.
| 化学名称 | 别名 | 高脂饮食组 | 正常组 | R |
| 饱和脂肪酸类 | ||||
| 十八烷酸 | 硬脂酸 | 276.370±71.399 | 43.024±6.972 | 5.42 |
| 正十二烷酸 | 月桂酸 | 2.613±0.997 | 5.977±1.293 | -0.56 |
| 十四烷酸 | 豆蔻酸 | 70.429±5.172 | 13.796±4.168 | 4.10 |
| 十六烷酸 | 软脂酸 | 7.448±1.193 | 0.593±0.435 | 11.56 |
| 二十烷酸 | 花生酸 | 18.325±1.991 | 2.672±1.020 | 5.86 |
| 单不饱和脂肪酸 | ||||
| 十八碳烯-9-酸 | 油酸 | 55.539±25.156 | 19.205±6.011 | 1.89 |
| ω-3多不饱和脂肪酸 | ||||
| 9, 12, 15十八碳三烯酸 | α-亚麻酸 | 11.482±3.879 | 4.070±3.035 | 1.82 |
| ω-6多不饱和脂肪酸 | ||||
| 二十碳四烯酸 | 花生四烯酸 | 12.544±1.969 | 1.394±0.989 | 8.00 |
| 9, 12-十八碳二烯酸 | 亚油酸 | 941.604±259.804 | 273.242±63.920 | 2.44 |
有学者认为NAFLD可能是代谢综合征在肝脏的表现, 也有学者认为NAFLD是代谢综合征的病因, 因果关系目前尚没有定论. 肥胖、糖尿病、高脂血症被认为是NAFLD患者脂肪肝进展的危险因素[8]. 肝脏是机体能量代谢、脂肪酸代谢和氨基酸代谢的重要部位, 正常状态下这些生物工程处于动态平衡状态, 当输入肝脏的脂质和脂肪酸过多, 而肝脏脂肪酸氧化分解不足, 清除脂质的能力下降时, 脂肪就会在肝脏沉积, 发生脂肪肝. 但是当前对单纯性脂肪肝发展为NASH 的机制仍未弄清.
本实验采用单纯高脂饮食16 wk成功建立SD大鼠NASH动物模型, 组织学观察表明, 肝组织NASH的复制率达100%, 光镜下可见大泡性和小泡性混合性肝细胞脂肪变性, 并伴有肝细胞坏死, 炎症细胞浸润明显. 采用该方法造模与人类NASH自然发病过程相一致, 结果比较可靠[9]. 目前对NASH代谢组变化的研究少见报道. 由于血液中的物质并不能完全代表肝脏内生产物的变化, 故本实验应用ECF衍生GC/MS技术直接检测了NASH肝组织的代谢组变化, 旨在为NASH的发病机制找到一丝端倪. Qiu et al[10]在代谢组学的基础上, 应用联合氯甲酸乙酯(ECF)衍生气相色谱-质谱(GC/MS)技术成功检测了1, 2-二甲肼(DMH)诱导的癌前期病变大鼠尿中代谢组的变化, 证明该技术具有良好的精密度、可重复性和稳定性, 适合用于分析伴随代谢障碍的系统整体代谢组研究. ECF衍生化技术的改善与传统GC/MS技术相比较有两个优点, 首先衍生过程在水中进行, 因此在反应前不需移走水, 有利于样本制备以及提高重复性; 其次, 分两阶段衍生可以更好地衍生化和数据采集, 这样更多的峰可以被探测到. 更重要的是, 用氢氧化钠调节pH值使待检分子更容易融解, 在水中的活性更高[10]. 本实验结果显示正常组与高脂饮食组肝脏色谱峰TIC图有明显的差异, 同一保留时间物质的峰不同, 主成分分析图显示两组肝组织的代谢形态有明显差异.
本实验结果显示, 除了正十二烷酸降低外, 其余发现的脂肪酸与正常组相比较均显著升高, 有统计学意义(P<0.05), 说明NASH大鼠的肝脏存在明显的内生脂肪酸代谢变化. 考虑这一方面可能与高脂饮食摄入增多有关, 另一方面与机体的内分泌代谢机制有关. 已证实胰岛素抵抗可使脂肪分解增加, 循环中FFA增多, 增多的FFA可进一步抑制胰岛素的信号转导并减少胰岛素的清除, 高胰岛素血症能增加糖降解而增加脂肪酸的合成, 这均可使过多的FFA进入肝脏. 肉毒碱脂酰转移酶是肝脏脂肪酸β-氧化的限速酶, 当脂肪酸的供应量超过该酶的运转能力时, 脂酰辅酶A即进入内质网合成脂酰甘油, 四癸基环氧丙酸(tetradecylglycidic acid, TDGA)可通过抑制该酶而抑制脂肪酸的氧化分解[11]. 肝组织固醇调节元件结合蛋白-1C(SREBP-1c)又称脂肪细胞定向和分化因子1(ADD1), 主要在啮齿类动物和人类的肝脏和脂肪细胞表达, 通过转基因小鼠和基因剔除小鼠的研究发现SREBP-1c与脂肪酸代谢有关[12]. 艾正琳 et al[13]研究发现高脂饮食可引起SREBP-1c表达增强, 起初为机体的适应性反应, 若持续增强, 则引起其调控的脂肪酸合成酶(fatty acid synthase, FAS)酶活性增强, 从而导致脂肪酸代谢失衡.
我们的实验结果显示NASH大鼠肝组织硬脂酸、十四烷酸、十六烷酸、二十烷酸、油酸等脂肪酸与正常组比较明显升高. Joshi-Barve et al[14]将肝细胞(HepG2)暴露于十六烷酸, 发现高水平的十六烷酸可以显著提高有生物活性的中性粒细胞化学引诱物, 激活NF-κB和c-Jun N-末端激酶激活蛋白-1, 刺激促炎细胞因子IL-8分泌引起肝脏炎症反应和肝损伤. Yao et al[15]发现铁与十六烷酸(PA)结合后可显著的发挥其毒性作用, 使线粒体功能障碍、细胞凋亡、死亡、和染色体突变. 十六烷酸通过转铁蛋白受体依赖的机制使铁易位到细胞, 还可使已易位的铁进入线粒体内, 细胞内的铁超载导致ROS过度产生和脂质过氧化. 进一步研究发现十六烷酸使铁易位是因为Fe/PA介导的细胞外的氧化应激和随后的膜渗透增高使膜损伤. 缺乏线粒体DNA的rho0细胞内Fe/PA介导的毒性明显降低. Feldstein et al[16]认为是油酸介导的溶酶体的不稳定引起脂毒性. 将肝细胞暴露于油酸, 会导致肝细胞的BAX易位到溶酶体, 使溶酶体失去稳定性, 向胞质溶胶内释放一种溶酶体的半胱氨酸蛋白酶-组织蛋白酶B(ctsb), 且与病情的严重性相关, 而使ctsb钝化则可以阻止脂肪肝、肝损伤、胰岛素抵抗相关的代谢综合征的进展. 另外, 溶酶体失去稳定性还可以激活NF-κB依赖的TNF-α表达. Barreyro et al[17]实验发现饱和脂肪酸(十六烷酸和硬脂酸)在肝细胞内过度聚积, 可促进蛋白质磷酸酶2A的活性, 从而激活依赖该酶的FoxO3a脱磷酸作用, FoxO3a可能同时诱导Bim和FasL的表达从而调节肝细胞的凋亡. Malhi et al[18]发现低浓度的油酸即可使TRAIL致敏, 认为通过JNK依赖的CD5上调介导的TRAIL致敏可能是其致病的机制. 目前花生酸与NASH的关系尚未见报道, 另外, 虽然十四烷酸也未见与NASH的发病有直接联系的报道, 但是Rioux et al[19]发现他可以调节体内饱和、不饱和脂肪酸的生物合成和代谢, 使肝脏ω-3和ω-6不饱和脂肪酸聚积. 研究结果表明, NAFLD大鼠肝脏存在明显的脂肪酸代谢障碍, 肝细胞内各类脂肪酸堆积引起肝脏炎症、肝损伤. 促炎细胞因子、氧化应激和脂质过氧化、肝细胞凋亡增加等可能是脂肪酸导致NASH的机制.
我们的实验结果提示NASH大鼠肝组织内ω-3和ω-6多不饱和脂肪酸均显著高于正常组. 有研究认为饮食中富含多不饱和脂肪酸(PUFAs)包括α-亚麻酸、亚油酸、花生四烯酸等可以抑制脂肪在肝细胞聚积, 可能通过上调脂肪酸β-氧化、脂酰辅酶A氧化酶和中链酰基辅酶A脱氢酶的基因表达, 下调SREBP-1c, 改善胰岛素抵抗等机制[20-21], 且认为α-亚麻酸的降脂作用强于γ-亚麻酸[21]. 但也有实验证实t10, c12-共轭亚油酸可引起高胰岛素血症, 增加脂肪摄入和脂肪形成, 其机制可能与触发PPAR-γ产物异位、诱导SREBP-1c和脂肪酸合酶基因表达等有关[22]. 本实验结果显示ω-6/ω-3多不饱和脂肪酸的比值升高, 提示NASH时可能存在ω-6/ω-3代谢不平衡. ω-3 PUFAs的母体是ALA, 在体内可以生成二十二碳五烯酸(EPA)和二十二碳六烯酸(DHA). ω-6 PUFAs的母体是LA, 在体内生成γ-亚麻酸(GLA)和AA, 由于人体不能合成ALA和LA, 因此二者又被称为必须脂肪酸. 这两族PUFAs在生物体内都发挥了很重要的作用, ω-6:ω-3 PUFAs的平衡对维持机体代谢和功能是必须的[23-24], Conklin et al[25]发现高水平ω-6 PUFAs和低水平ω-3 PUFAs跟抑郁症和神经过敏有关. 两族PUFAs都需依赖环氧合酶和脂氧合酶生成各类具有生物活性的产物, 存在代谢竞争抑制, 且各种酶对ω-3 PUFAs的亲合力更高. 环氧合酶可促进AA和EPA转化为前列腺素、血栓素和前列环素, 脂氧合酶促进AA和EPA转化为白三烯等产物, 当体内ω-3 PUFAs相对不足时, ω-6 PUFAs(AA)就会产生过多的前列腺素发生炎症反应[24,26]. 另外, Schmöcker et al[27]实验证实ω-6:ω-3 PUFAs比值降低可以显著下调肝脏炎症因子TNF-α、IL-1β、IFN-γ和IL-6的表达, 从而减轻肝的炎症损伤. 因此我们有理由认为理想的ω-6:ω-3 PUFAs摄入和他们衍生的二十烷酸类(类花生酸)的作用是机体生物需要的, ω-6:ω-3 PUFAs比率紊乱通过肝内的大量脂质的调整使脂肪肝的组织形态发生变化, 两族PUFAs比率失衡可能是NASH发生的重要原因.
我们的实验结果显示饱和脂肪酸中正十二烷酸降低. 有文献报道2, 2-二氯-12-(4-氯苯基)正十二烷酸(K-111)是PPAR-α显效剂, 可能通过抑制c-Jun氨基末端激酶/应激活化蛋白激酶(JNK/SAPK)途径或NF-κB亚基P65, 可以显著减少RAW2647细胞的IL-6和TNF-α表达[28]. Schäfer et al研究表明K-111还有潜在增强胰岛素敏感性的作用[29-31], 观察了K-111对有肥胖、前驱期糖尿病、高脂血症的猴的疗效, 结果发现其可以增强胰岛素的敏感性, 改善RI, 且比另一胰岛素增敏剂噻唑烷二酮类的作用更强, 还有提高脂肪β-氧化, 降低体重和血脂等作用. 因此机体可能是通过K-111促进PPARa的活性, 抵抗脂肪肝的发展, 而NASH病变大鼠与正常组大鼠比较体内K-111明显降低, 使机体的保护力量下降, 这也可能是NASH发生的另一原因.
总之, NASH大鼠肝脏存在明显的脂肪酸谱变化, 肝细胞内各类脂肪酸聚积、ω-6:ω-3 PUFAs比率失衡和正十二烷酸降低可能对脂肪肝炎症发生、肝损伤有重要作用. 而进行饮食补充ω-3 PUFAs或药物干预脂肪酸代谢将对NAFLD防治具有重要意义.
肝脏是机体新陈代谢、化学反应发生的中心场所, 在代谢过程中具有重要作用. 而各种原因使肝脏脂肪代谢障碍, 脂质代谢的动态平衡失调, 脂肪在肝细胞内储积, 即会发生脂肪肝. 目前对NASH的发病机制还未完全清楚, 临床上也缺乏统一的诊断标准和有效的治疗手段. 因此有必要从代谢水平对NASH的发生机制进行研究, 为临床诊治提供新的思路.
何生松, 教授, 华中科技大学同济医学院附属协和医院感染科; 黄晓东, 副主任医师, 武汉市中心医院消化内科
目前对单纯肝脏脂肪储积发展为NASH的机制尚未明了. 细胞内许多生命活动实际上是发生在代谢物层面, 而关于脂肪肝肝脏代谢的变化报道甚少.
代谢组学已被广泛应用于生理、药物毒性试验、疾病的早期诊断和个性化治疗等领域. 在代谢组学研究的起步阶段, 就已在肝病领域进行了大量研究. 有报道代谢谱变化可作为肝毒性和肝损伤严重程度的预测指标.
本研究在建立高脂饮食SD大鼠NASH模型的基础上, 应用代谢组学的方法, 通过氯甲酸乙酯(ECF)衍生气相色谱-质谱(GC/MS)技术检测肝脏脂肪酸代谢的变化, 并研究其在NASH发病中的意义.
主成分分析: 也称主分量分析, 旨在利用降维的思想, 把多指标转化为少数几个综合指标. 主成分分析法是一种数学变换的方法, 他把给定的一组相关变量通过线性变换转成另一组不相关的变量, 这些新的变量按照方差依次递减的顺序排列. 在数学变换中保持变量的总方差不变, 使第一变量具有最大的方差, 称为第一主成分, 第二变量的方差次大, 并且和第一变量不相关, 称为第二主成分. 依次类推, 一个变量就有一个主成分. 选择越少的主成分, 降维就越好.
本研究方法、技术有一定特色, 结果较明确, 实验证据充足, 讨论条理分明, 有系统的理论分析和有价值的科学结论, 能较好地反映我国肝病学基础研究的先进水平.
编辑: 李军亮 电编:吴鹏朕
| 1. | Chitturi S, Farrell GC, George J. Non-alcoholic steatohepatitis in the Asia-Pacific region: future shock? J Gastroenterol Hepatol. 2004;19:368-374. [PubMed] [DOI] |
| 2. | Maier KP. Non-alcoholic steatohepatitis--a new epidemic. Schweiz Rundsch Med Prax. 2007;96:1857-1860. [PubMed] |
| 3. | Wang CL, Liang L, Fu JF, Zou CC, Hong F, Xue JZ, Lu JR, Wu XM. Effect of lifestyle intervention on non-alcoholic fatty liver disease in Chinese obese children. World J Gastroenterol. 2008;14:1598-1602. [PubMed] [DOI] |
| 4. | Harrison SA, Kadakia S, Lang KA, Schenker S. Nonalcoholic steatohepatitis: what we know in the new millennium. Am J Gastroenterol. 2002;97:2714-2724. [PubMed] |
| 5. | Tarantino G, Saldalamacchia G, Conca P, Arena A. Non-alcoholic fatty liver disease: further expression of the metabolic syndrome. J Gastroenterol Hepatol. 2007;22:293-303. [PubMed] [DOI] |
| 6. | Qureshi K, Abrams GA. Metabolic liver disease of obesity and role of adipose tissue in the pathogenesis of nonalcoholic fatty liver disease. World J Gastroenterol. 2007;13:3540-3553. [PubMed] |
| 8. | McClain CJ, Mokshagundam SP, Barve SS, Song Z, Hill DB, Chen T, Deaciuc I. Mechanisms of non-alcoholic steatohepatitis. Alcohol. 2004;34:67-79. [PubMed] [DOI] |
| 10. | Qiu Y, Su M, Liu Y, Chen M, Gu J, Zhang J, Jia W. Application of ethyl chloroformate derivatization for gas chromatography-mass spectrometry based metabonomic profiling. Anal Chim Acta. 2007;583:277-283. [PubMed] [DOI] |
| 11. | van der Leij FR, Bloks VW, Grefhorst A, Hoekstra J, Gerding A, Kooi K, Gerbens F, te Meerman G, Kuipers F. Gene expression profiling in livers of mice after acute inhibition of beta-oxidation. Genomics. 2007;90:680-689. [PubMed] [DOI] |
| 12. | Wang H, Kouri G, Wollheim CB. ER stress and SREBP-1 activation are implicated in beta-cell glucolipotoxicity. J Cell Sci. 2005;118:3905-3915. [PubMed] [DOI] |
| 14. | Joshi-Barve S, Barve SS, Amancherla K, Gobejishvili L, Hill D, Cave M, Hote P, McClain CJ. Palmitic acid induces production of proinflammatory cytokine interleukin-8 from hepatocytes. Hepatology. 2007;46:823-830. [PubMed] [DOI] |
| 15. | Yao D, Shi W, Gou Y, Zhou X, Yee Aw T, Zhou Y, Liu Z. Fatty acid-mediated intracellular iron translocation: a synergistic mechanism of oxidative injury. Free Radic Biol Med. 2005;39:1385-1398. [PubMed] [DOI] |
| 16. | Feldstein AE, Werneburg NW, Canbay A, Guicciardi ME, Bronk SF, Rydzewski R, Burgart LJ, Gores GJ. Free fatty acids promote hepatic lipotoxicity by stimulating TNF-alpha expression via a lysosomal pathway. Hepatology. 2004;40:185-194. [PubMed] [DOI] |
| 17. | Barreyro FJ, Kobayashi S, Bronk SF, Werneburg NW, Malhi H, Gores GJ. Transcriptional regulation of Bim by FoxO3A mediates hepatocyte lipoapoptosis. J Biol Chem. 2007;282:27141-27154. [PubMed] [DOI] |
| 18. | Malhi H, Barreyro FJ, Isomoto H, Bronk SF, Gores GJ. Free fatty acids sensitise hepatocytes to TRAIL mediated cytotoxicity. Gut. 2007;56:1124-1131. [PubMed] [DOI] |
| 19. | Rioux V, Catheline D, Bouriel M, Legrand P. Dietary myristic acid at physiologically relevant levels increases the tissue content of C20:5 n-3 and C20:3 n-6 in the rat. Reprod Nutr Dev. 2005;45:599-612. [PubMed] [DOI] |
| 20. | Murase T, Aoki M, Tokimitsu I. Supplementation with alpha-linolenic acid-rich diacylglycerol suppresses fatty liver formation accompanied by an up-regulation of beta-oxidation in Zucker fatty rats. Biochim Biophys Acta. 2005;1733:224-231. [PubMed] |
| 21. | Buang Y, Cha JY, Nagao K, Wang YM, Inoue N, Yanagita T. Alleviation of fatty liver by alpha-linolenic acid. J Nutr Sci Vitaminol (Tokyo). 2004;50:272-276. [PubMed] |
| 22. | Clément L, Poirier H, Niot I, Bocher V, Guerre-Millo M, Krief S, Staels B, Besnard P. Dietary trans-10,cis-12 conjugated linoleic acid induces hyperinsulinemia and fatty liver in the mouse. J Lipid Res. 2002;43:1400-1409. [PubMed] [DOI] |
| 23. | El-Badry AM, Graf R, Clavien PA. Omega 3 - Omega 6: What is right for the liver? J Hepatol. 2007;47:718-725. [PubMed] [DOI] |
| 24. | Dobryniewski J, Szajda SD, Waszkiewicz N, Zwierz K. Biology of essential fatty acids (EFA). Przegl Lek. 2007;64:91-99. [PubMed] |
| 25. | Conklin SM, Manuck SB, Yao JK, Flory JD, Hibbeln JR, Muldoon MF. High omega-6 and low omega-3 fatty acids are associated with depressive symptoms and neuroticism. Psychosom Med. 2007;69:932-934. [PubMed] [DOI] |
| 26. | Das UN. Biological significance of essential fatty acids. J Assoc Physicians India. 2006;54:309-319. [PubMed] |
| 27. | Schmöcker C, Weylandt KH, Kahlke L, Wang J, Lobeck H, Tiegs G, Berg T, Kang JX. Omega-3 fatty acids alleviate chemically induced acute hepatitis by suppression of cytokines. Hepatology. 2007;45:864-869. [PubMed] [DOI] |
| 28. | Murakami K, Bujo H, Unoki H, Saito Y. Effect of PPARalpha activation of macrophages on the secretion of inflammatory cytokines in cultured adipocytes. Eur J Pharmacol. 2007;561:206-213. [PubMed] [DOI] |
| 29. | Schäfer SA, Hansen BC, Völkl A, Fahimi HD, Pill J. Biochemical and morphological effects of K-111, a peroxisome proliferator-activated receptor (PPAR)alpha activator, in non-human primates. Biochem Pharmacol. 2004;68:239-251. [PubMed] [DOI] |
| 30. | Bodkin NL, Pill J, Meyer K, Hansen BC. The effects of K-111, a new insulin-sensitizer, on metabolic syndrome in obese prediabetic rhesus monkeys. Horm Metab Res. 2003;35:617-624. [PubMed] [DOI] |
| 31. | Drew BG, Calkin AC. Drug evaluation: K-111, an insulin-sensitizing peroxisome proliferator-activated receptor alpha agonist. Curr Opin Investig Drugs. 2007;8:324-330. [PubMed] |