修回日期: 2008-04-07
接受日期: 2008-05-20
在线出版日期: 2008-05-28
目的: 建立荧光原位明胶酶谱法, 观察纤维化和急性损伤肝组织明胶酶活性表达特点.
方法: 复制二甲基亚硝胺大鼠肝纤维化模型与N-乙酰半乳糖胺/脂多糖急性肝损伤模型, 取其肝组织冰冻切片, 将绿色荧光明胶底物附着于肝组织冰冻切片上, 置于酶反应缓冲液中避光孵育8-24 h; 再以Hoechst液复染细胞核, 在荧光显微镜下分别以蓝光激发拍摄明胶酶绿色荧光和紫光激发拍摄细胞核蓝色荧光, 并将图像重叠.
结果: 成功建立荧光原位明胶酶谱法. 正常大鼠肝组织仅在肝窦周围少量明胶酶表达, 纤维化及急性肝损伤肝组织肝窦处明胶酶活性增强, 纤维化肝组织纤维间隔处明胶酶活性也较强.
结论: 荧光原位明胶酶谱法具有灵敏, 直观, 简便的优点, 可较好分析肝组织明胶酶活性水平与表达位置, 对研究肝脏病理与药理具有重要意义.
引文著录: 陈倩, 沈丽, 何琦麟, 陶艳艳, 刘成海. 荧光原位明胶酶谱法对肝组织明胶酶活性的检测. 世界华人消化杂志 2008; 16(15): 1607-1611
Revised: April 7, 2008
Accepted: May 20, 2008
Published online: May 28, 2008
AIM: To establish fluorescent in situ zymography for gelatinase activity of liver and observe the feature of gelatinase activity in liver tissues with fibrosis and acute injury.
METHODS: Hepatic fibrosis of rats was induced by administration of dimethylnitrosamine (DMN) intraperitoneally and acute liver injury of mice by injection of GalN and lipopolysaccharide (LPS) intraperitoneally. Gelatin substrate of green fluorescence was mounted on cryostat sections of liver tissues from the above two models, incubated for 8-24 h, and then the nuclei were counterstained with Hoechst. The green fluorescence of gelatinase and blue fluorescence of nuclei were observed under fluorescence microscope, and the images were overlapped.
RESULTS: Fluorescent in situ zymography for gelatinase activity was established successfully. With this method, a low level of gelatinase activity was detected in the sinus hepaticus of normal liver sections; however, it was enhanced in the sinus hepaticus of liver sections with fibrosis and acute injury. Gelatinase activity in the fibrous septum of liver fibrosis sections was strong.
CONCLUSION: Flourescent in situ zymography is sensitive, directviewing and convenient in the detection of gelatinase activity level and position and of great significance for the studies on pathology and pharmacology of liver.
- Citation: Chen Q, Shen L, He QL, Tao YY, Liu CH. Detection for gelatinase activity of liver using flourescent in situ zymography. Shijie Huaren Xiaohua Zazhi 2008; 16(15): 1607-1611
- URL: https://www.wjgnet.com/1009-3079/full/v16/i15/1607.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i15.1607
明胶酶, 亦称Ⅳ型胶原酶[1]、基膜性胶原酶[2]等, 属于基质金属蛋白酶(matrix metalloproteinases, MMPs)的一种, 即MMP-2/9, 主要参与Ⅳ型胶原、明胶和Ⅴ型胶原等的降解代谢, 在组织炎症、纤维化与肿瘤转移等诸多病理过程中发挥重要作用[2-7]. 因而分析明胶酶的功能变化即其活性水平, 对于诸多疾病的病理机制、药物作用机制等的研究具有重要意义. 组织明胶酶活性测定有多种方法, 近期我们利用荧光标记的明胶底物, 改良酶底物反应方法, 成功原位检测肝组织明胶酶表达位置与活性水平, 用于急性肝损伤与肝纤维化的病理研究.
EnzChek明胶酶检测试剂盒, 购自Molecular Probes公司. 包括: DQ-明胶(dye-quenched-gelatin)(1 mg×5支), 10×反应液(50 mL, 含0.5 mol/L Tris-HCl, 1.5 mol/L NaCl, 50 mmol/L CaCl2, 2 mmol/L Sodium azide, pH7.6), Ⅳ型胶原酶(500 U). NaCl, 分析纯; KCl, 分析纯; KH2PO4, 分析纯; Na2HPO4•12H2O, 分析纯; 琼脂糖凝胶, 均购自上海国药集团. Hoechst染色液, 购自Beyotime公司. 荧光显微镜为Olympus公司生产.
1.2.1 配制溶液: PBS缓冲液由NaCl 40.9 g, KCl 1.0 g, KH2PO4 1.35 g, Na2HPO4•12H2O 14.35 g, ddH2O定容至5000 mL, pH: 7.3-7.4; 1×反应液: 取10×反应液2 mL, 加18 mL ddH2O配制成20 mL, 充分混匀; 1 mg/mL DQ-明胶: 1 mg DQ明胶溶解于1 mL H2O中, 充分混匀, 配制成1 mg/mL浓度的DQ-明胶.
1.2.2 制模: (1)肝纤维化模型: Wistar♂大鼠16只, SPF级, 体质量160±10 g, 中科院上海实验动物中心提供, 饲养于上海中医药大学实验动物中心. 随机分为正常组(8只), 模型组(8只). 采取ip DMN 10 μg/kg, 隔天1次, 连续4 wk, 共14次. 正常组注射等量生理盐水. (2)急性肝损伤模型: BABL/c♂小鼠20只, SPF级, 体质量22-24 g, 购自中国人民解放军第二医科大学, 饲养于上海中医药大学实验动物中心, 自由饮食. 随机分成正常组(10只), 模型组(10只). 参照文献[8], 以N-乙酰半乳糖胺(N-acetylgalactosamine, GalN)900 mg/kg和脂多糖(lipopolysaccharide, LPS)10 μg/kg小鼠体质量的剂量, ip模型组小鼠, 诱导急性肝损伤. 正常组ip以等量生理盐水. 6 h后处死小鼠, 留取肝组织标本.
1.2.3 明胶酶活性测定: (1)制备肝组织冰冻切片, 厚度大约为6-8 μm. (2)称取1 g琼脂糖加入100 mL PBS中, 微波炉加热至琼脂糖充分溶解, 4℃放置备用. (3)使用前将10 g/L琼脂糖液置于恒温水浴箱中100℃温浴至液体析出, 吸取琼脂糖析出液于Eppendorf管中, 将1 kg/L DQ-明胶按1:10的比例溶解于10 g/L琼脂糖析出液中, 充分混匀. (4)每片肝组织切片滴加50 μL DQ-明胶/琼脂糖混合液, 4℃避光凝胶5 min. (5)将组织切片置于1×反应液中, 37℃避光孵育8-24 h(根据拍摄时荧光强弱调整孵育时间). (6)PBS充分洗涤, 5 min×3次. (7)每片组织切片滴加50 μL Hoechst复染细胞核, 室温避光静置10 min, PBS洗涤, 5 min×3次. (8)荧光显微镜下进行检测, 蓝色光激发拍摄明胶绿色荧光, 紫色光激发拍摄细胞核蓝色荧光, DP Controller软件拍摄. 以10 g/L琼脂糖液代替DQ-明胶/琼脂糖混合液作阴性对照[9].
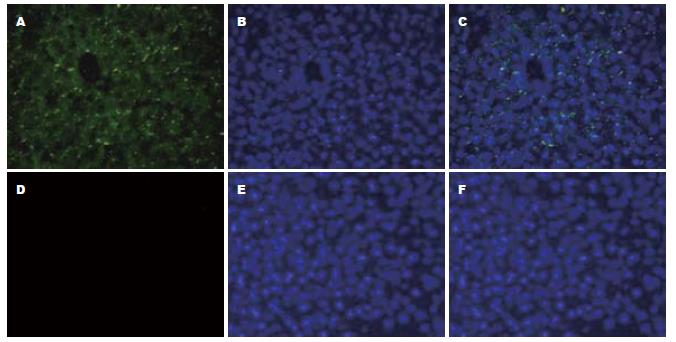
蓝光激发后拍下绿色明胶荧光; 换成紫光激发, 同一视野拍摄蓝色染核荧光, 将两张图片重叠, 即可见肝组织明胶酶活性表达. 图1A依稀可见组织结构, 大部分为本底自发荧光, 较为黯淡, 明胶荧光呈较亮点状, 经重叠后的图1C可见本底自发荧光部分已被图1B中的细胞核覆盖, 只可见在肝窦部位表达的明胶荧光, 活性较微弱. 图1D-F为阴性对照, 未见任何绿色荧光, 可见此方法特异性强.
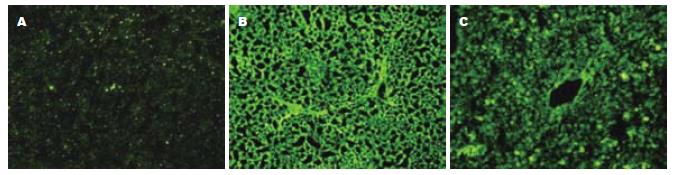
正常大鼠仅少量散在荧光, 即肝窦周围少量活性明胶酶表达(图2A). 肝纤维化大鼠肝组织可见胶原纤维增生并形成纤维间隔, 绿色荧光布满整个纤维间隔, 与正常肝组织比较, 肝窦部位明胶酶活性增强, 荧光连成片状(图2B). 急性肝损伤小鼠肝组织的明胶酶也可见肝窦部位明胶酶活性增强, 但肝组织结构破坏, 荧光部分连接成片(图2C).
MMPs是一族参与细胞外基质降解的主要水解蛋白酶[10-11], 目前已发现25个成员, 根据其功能特点和底物特异性, 分为间质性胶原酶、基底膜性胶原酶、溶基质素、膜型基质金属蛋白酶和金属弹力蛋白酶5大类[12-13]. 自1962年发现MMPs以来, 其生理病理意义得到广泛研究, 目前认为其在生长发育、环境诱导与疾病原因引起的组织生理适应与病理变化中均发挥重要作用[14]. 基底膜性胶原酶包括明胶酶A(MMP-2或称72 kDa Ⅳ型胶原酶)和明胶酶B(MMP-9或称92 kDa Ⅳ型胶原酶)[15], 其作为MMPs的一类, 可降解Ⅳ型胶原等基底膜成分, 在肝脏炎症、纤维化、免疫、肿瘤转移等过程中均发挥着重要作用[5,16-19]. 在炎性损伤时, 基底膜破坏, 肝组织的稳态微环境破坏, 导致肝细胞凋亡[20]、肝星状细胞活化[21]、肿瘤细胞转移等诸多病理变化, 有研究表明, MMP-2/9活性与肿瘤预后明显相关, 我们也发现MMP-2/9活性增加与肝细胞凋亡、肝纤维化发生显著相关.
目前明胶酶活性检测方法包括明胶酶谱法、荧光明胶酶谱法、原位明胶酶谱法, 其中明胶酶谱法最为常用[22-24]. 1994年Kleiner et al[25]建立的明胶酶谱法是一种基于SDS-PAGE电泳和反相凝胶染色的蛋白酶检测方法, 其原理在于: 含明胶酶的样本可分解凝胶中的底物明胶, 电泳后进行显色、脱色后可见蓝色背景下的白色条带; 其具有以下特点: 半定量分析MMPs活性, 可区分酶原和活化型酶两种形式. 而后Molecular Probes公司2001年推出EnzChek荧光明胶酶检测试剂盒, 用荧光胶体耦连物代替普通明胶, 明胶酶分解荧光明胶, 释放荧光肽, 荧光的增加与明胶酶的活性成正比. 该方法比普通明胶酶谱法更为方便和直观, 但缺点在于要经组织匀浆或血清分离等过程, 容易导致蛋白降解及部分酶活性丢失; 无法进行组织定位观察[26].
MMP-2/9活性定位检测具有重要意义. 肝组织结构复杂, 具有多个功能结构区域, 如肝窦、肝小叶等[27], 病变时常有不同部位的病理变化, 如出现纤维间隔与假小叶等[28]. 因此观察特定部位的MMP-2/9活性变化及其组织结构破坏, 对于肝脏病理机制与药效作用研究等均具有重要意义[29-30]. 而原位酶谱法在冰冻组织切片上进行酶谱分析, 可组织定位, 既综合了上述两种方法的优点, 又克服了形态定位缺乏之不足. 实验中我们取荧光明胶酶谱法的直观与原位明胶酶谱法的定位优点, 将这两种方法相结合并进行改良, 利用荧光明胶底物, 成功进行荧光原位明胶酶谱法检测, 组织切片上各部位明胶酶的活性一目了然, 对研究肝脏组织病理等有重要意义. 该方法具有灵敏, 直观, 简便的特点, 但需要注意组织放血或冲洗干净, 冰冻切片应低温保存; 制片厚薄适中、琼脂糖胶的浓度一定要适当, 过稀无法粘住在切片上, 过稠则粘得太牢, 妨碍显微镜下观察. 孵育时注意避光, Hoechst显色后注意避光, 尽快拍摄. 同时实验时需要设立阴性对照, 防止假阳性. 注意复染与图像重叠等, 以便清晰的显示组织结构.
此外, 本实验发现, 正常大鼠仅少量散在荧光, 即肝窦周围少量活性明胶酶表达. 肝纤维化大鼠肝组织可见胶原纤维增生并形成纤维间隔, 绿色荧光布满整个纤维间隔, 与正常肝组织比较, 肝窦部位明胶酶活性增强, 荧光连成片状. 急性肝损伤小鼠肝组织的明胶酶也可见肝窦部位明胶酶活性增强, 但肝组织结构破坏, 荧光部分连接成片. 即不同的肝脏病变其明胶酶活性与组织病变等具有不同的特点.
MMPs是参与细胞外基质降解的主要酶家族, 根据其功能特点和底物特异性, 分为间质性胶原酶、基底膜性胶原酶、溶基质素、膜型基质金属蛋白酶和金属弹力蛋白酶5大类. 明胶酶是其中重要的一类, 他主要有两种形式, 一种被糖化, 分子量为92 kDa, 命名为MMP-9;另一种非糖化, 分子量为72 kDa, 被称为MMP-2. MMP-2/9主要参与Ⅳ型胶原、明胶和Ⅴ型胶原等的降解代谢, 在组织炎症、纤维化与肿瘤转移等诸多病理过程中发挥重要作用, 因此对明胶酶活性进行分析具有重要意义. 组织明胶酶活性检测方法有很多种, 其中明胶酶谱法最为常用.
姚登福, 教授, 南通大学附属医院分子医学中心.
1994年Kleiner et al建立的明胶酶谱法是一种基于SDS-PAGE电泳和反相凝胶染色的蛋白酶检测方法, 其原理在于: 含明胶酶的样本可分解凝胶中的底物明胶, 电泳后进行显色、脱色后可见蓝色背景下的白色条带.
荧光原位明胶酶普法具有灵敏, 直观, 简便的优点, 可较好分析肝组织明胶酶活性水平与表达位置.
明胶酶: 亦称Ⅳ型胶原酶、基膜性胶原酶等, 属于基质金属蛋白酶(MMPs)的一种, 即MMP-2/9, 主要参与Ⅳ型胶原、明胶和Ⅴ型胶原等的降解代谢, 在组织炎症、纤维化与肿瘤转移等诸多病理过程中发挥重要作用.
本文内容新颖, 质量较好, 对研究肝脏病理与药理具有重要意义.
编辑: 李军亮 电编:郭海丽
| 1. | Hrabec E, Naduk J, Strek M, Hrabec Z. Type IV collagenases (MMP-2 and MMP-9) and their substrates--intracellular proteins, hormones, cytokines, chemokines and their receptors. Postepy Biochem. 2007;53:37-45. [PubMed] |
| 2. | Cheng S, Pollock AS, Mahimkar R, Olson JL, Lovett DH. Matrix metalloproteinase 2 and basement membrane integrity: a unifying mechanism for progressive renal injury. FASEB J. 2006;20:1898-1900. [PubMed] [DOI] |
| 3. | Le NT, Xue M, Castelnoble LA, Jackson CJ. The dual personalities of matrix metalloproteinases in inflammation. Front Biosci. 2007;12:1475-1487. [PubMed] [DOI] |
| 4. | Hemmann S, Graf J, Roderfeld M, Roeb E. Expression of MMPs and TIMPs in liver fibrosis - a systematic review with special emphasis on anti-fibrotic strategies. J Hepatol. 2007;46:955-975. [PubMed] [DOI] |
| 5. | Deryugina EI, Quigley JP. Matrix metalloproteinases and tumor metastasis. Cancer Metastasis Rev. 2006;25:9-34. [PubMed] [DOI] |
| 6. | Baraldo S, Bazzan E, Zanin ME, Turato G, Garbisa S, Maestrelli P, Papi A, Miniati M, Fabbri LM, Zuin R. Matrix metalloproteinase-2 protein in lung periphery is related to COPD progression. Chest. 2007;132:1733-1740. [PubMed] [DOI] |
| 9. | Brassart B, Fuchs P, Huet E, Alix AJ, Wallach J, Tamburro AM, Delacoux F, Haye B, Emonard H, Hornebeck W. Conformational dependence of collagenase (matrix metalloproteinase-1) up-regulation by elastin peptides in cultured fibroblasts. J Biol Chem. 2001;276:5222-5227. [PubMed] [DOI] |
| 10. | Vempati P, Karagiannis ED, Popel AS. A biochemical model of matrix metalloproteinase 9 activation and inhibition. J Biol Chem. 2007;282:37585-37596. [PubMed] [DOI] |
| 11. | Ra HJ, Parks WC. Control of matrix metallo-proteinase catalytic activity. Matrix Biol. 2007;26:587-596. [PubMed] [DOI] |
| 12. | Wielockx B, Lannoy K, Shapiro SD, Itoh T, Itohara S, Vandekerckhove J, Libert C. Inhibition of matrix metalloproteinases blocks lethal hepatitis and apoptosis induced by tumor necrosis factor and allows safe antitumor therapy. Nat Med. 2001;7:1202-1208. [PubMed] [DOI] |
| 13. | Das S, Mandal M, Chakraborti T, Mandal A, Chakraborti S. Structure and evolutionary aspects of matrix metalloproteinases: a brief overview. Mol Cell Biochem. 2003;253:31-40. [PubMed] [DOI] |
| 14. | Ethell IM, Ethell DW. Matrix metalloproteinases in brain development and remodeling: synaptic functions and targets. J Neurosci Res. 2007;85:2813-2823. [PubMed] [DOI] |
| 15. | Ye HQ, Azar DT. Expression of gelatinases A and B, and TIMPs 1 and 2 during corneal wound healing. Invest Ophthalmol Vis Sci. 1998;39:913-921. [PubMed] |
| 16. | Reif S, Somech R, Brazovski E, Reich R, Belson A, Konikoff FM, Kessler A. Matrix metalloproteinases 2 and 9 are markers of inflammation but not of the degree of fibrosis in chronic hepatitis C. Digestion. 2005;71:124-130. [PubMed] [DOI] |
| 17. | Li J, Leschka S, Rutschow S, Schwimmbeck PL, Husmann L, Noutsias M, Westermann D, Poller W, Zeichhardt H, Klingel K. Immunomodulation by interleukin-4 suppresses matrix metalloproteinases and improves cardiac function in murine myocarditis. Eur J Pharmacol. 2007;554:60-68. [PubMed] [DOI] |
| 18. | Martin MD, Matrisian LM. The other side of MMPs: protective roles in tumor progression. Cancer Metastasis Rev. 2007;26:717-724. [PubMed] [DOI] |
| 19. | Mook OR, Frederiks WM, Van Noorden CJ. The role of gelatinases in colorectal cancer progression and metastasis. Biochim Biophys Acta. 2004;1705:69-89. [PubMed] |
| 20. | Olle EW, Ren X, McClintock SD, Warner RL, Deogracias MP, Johnson KJ, Colletti LM. Matrix metalloproteinase-9 is an important factor in hepatic regeneration after partial hepatectomy in mice. Hepatology. 2006;44:540-549. [PubMed] [DOI] |
| 21. | Chong LW, Hsu YC, Chiu YT, Yang KC, Huang YT. Anti-fibrotic effects of thalidomide on hepatic stellate cells and dimethylnitrosamine-intoxicated rats. J Biomed Sci. 2006;13:403-418. [PubMed] [DOI] |
| 22. | Frederiks WM, Mook OR. Metabolic mapping of proteinase activity with emphasis on in situ zymography of gelatinases: review and protocols. J Histochem Cytochem. 2004;52:711-722. [PubMed] [DOI] |
| 23. | Cheng XC, Fang H, Xu WF. Advances in assays of matrix metalloproteinases (MMPs) and their inhibitors. J Enzyme Inhib Med Chem. 2008;23:154-167. [PubMed] [DOI] |
| 24. | Snoek-van Beurden PA, Von den Hoff JW. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. Biotechniques. 2005;38:73-83. [PubMed] |
| 25. | Kleiner DE, Stetler-Stevenson WG. Quantitative zymography: detection of picogram quantities of gelatinases. Anal Biochem. 1994;218:325-329. [PubMed] [DOI] |
| 26. | Yoshida T, Adachi E, Nigi H, Fujii S, Yanagi M. Changes of sinusoidal basement membrane collagens in early hepatic fibrosis induced with CCl4 in cynomolgus monkeys. Pathology. 1999;31:29-35. [PubMed] [DOI] |
| 27. | Malarkey DE, Johnson K, Ryan L, Boorman G, Maronpot RR. New insights into functional aspects of liver morphology. Toxicol Pathol. 2005;33:27-34. [PubMed] [DOI] |
| 28. | Goodman ZD. Grading and staging systems for inflammation and fibrosis in chronic liver diseases. J Hepatol. 2007;47:598-607. [PubMed] [DOI] |
| 29. | Han YP. Matrix metalloproteinases, the pros and cons, in liver fibrosis. J Gastroenterol Hepatol. 2006;21 Suppl 3:S88-S91. [PubMed] [DOI] |
| 30. | Knittel T, Mehde M, Grundmann A, Saile B, Scharf JG, Ramadori G. Expression of matrix metalloproteinases and their inhibitors during hepatic tissue repair in the rat. Histochem Cell Biol. 2000;113:443-453. [PubMed] |