修回日期: 2008-03-11
接受日期: 2008-04-21
在线出版日期: 2008-04-28
目的: 观察新型选择性环氧合酶-2抑制剂PC407对2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS)诱导的大鼠溃疡性结肠炎的疗效并探讨其机制.
方法: 应用TNBS/乙醇灌肠复制大鼠溃疡性结肠炎模型. 实验设正常对照组、模型对照组、塞来昔布阳性对照组(18 mg/kg)和PC407治疗组(9, 18 mg/kg), ig 给药, 每天1次, 共6 d, 观察稀便出现情况. 实验第7天, 麻醉大鼠, 分离大鼠结肠、脾脏、胸腺, 观察各组实验动物体质量变化及结肠组织病理学改变, 选用稀便率、结肠指数、溃疡比、胸腺指数和脾脏指数作为衡量治疗效果的指标. 采用免疫组织化学方法检测结肠黏膜环氧合酶-2(COX-2)和肿瘤坏死因子α(tumor necrosis factor-alpha, TNF-α)的变化.
结果: 与模型组相比, 18 mg/kg PC407治疗可明显阻止结肠炎大鼠的体质量下降(258.9 g vs 223.6 g, P<0.05), 降低稀便发生率(30% vs 80 %, P<0.01), 改善大鼠结肠组织损伤及病理学改变, 包括降低结肠指数(5.03±1.26 mg/g vs 7.60±2.07 mg/g, P<0.01)及溃疡比(24.69%±2.83% vs 36.13%±9.64%, P<0.01); 同时, PC407治疗可对抗结肠炎症引起的胸腺萎缩(1.96±0.48 mg/g vs 1.08±0.32 mg/g, P<0.01)和脾脏肿大(2.85±0.33 mg/g vs 3.87±0.96 mg/g, P<0.01), 显著降低结肠炎大鼠结肠黏膜COX-2和TNF-α的阳性表达率(30.6%±7.0% vs 67.4%±1.2%, 19.5%±3.0% vs 52%±4.7%, P<0.01). 9 mg/kg PC407也可以改善以上指数, 只是作用没有18 mg/kg明显.
结论: PC407对TNBS/乙醇诱导的大鼠溃疡性结肠炎治疗作用良好, 其机制可能通过下调COX-2及TNF-α的表达, 从而缓解结肠炎症.
引文著录: 白卉, 张邦乐, 李宇华, 游宇, 郭振军, 孙阳, 梅其炳. 选择性环氧合酶-2抑制剂PC407对TNBS诱导的大鼠溃疡性结肠炎的治疗作用. 世界华人消化杂志 2008; 16(12): 1287-1293
Revised: March 11, 2008
Accepted: April 21, 2008
Published online: April 28, 2008
AIM: To explore the therapeutic effects of a new selective cyclooxygenase-2 (COX-2) inhibitor PC407 on rat ulcerative colitis induced by 2,4,6-trinitrobenzene sulfonic acid (TNBS) and its possible mechanism.
METHODS: A rat colitis model was induced by TNBS and ethonal enema. The rats were randomly divided into 5 groups: normal group, model control group, celecoxib group (18 mg/kg) and PC407 groups (9, 18mg/kg). Celecoxib and PC407 were administered intragastrically once per day for 6 days and the loose stool were recorded. All the rats were anesthetized to separate colon, thymus gland and spleen on the 7th day. The body weights of experimental rats before anesthesia were documented and the macroscopic and histological changes of the colon were observed. The effects in treatment groups were evaluated by loose stool rate, colon index, ulcer ratio, thymus index and spleen index. The protein products of COX-2, tumor necrosis factor-α (TNF-α) in mucosa were analyzed by immunohistochemistry.
RESULTS: In comparison with that in model control group, the body weight was increased significantly in 18 mg/kg-PC407 group (258.9 g vs 223.6 g, P < 0.05), but the loose stool rate was decreased markedly (30% vs 80 %, P < 0.01); moreover, 18 mg/kg PC407 significantly ameliorated the lesions and pathological changes in colon caused by TNBS, improved the indexes such as colon index (5.03 ± 1.26 mg/g vs 7.60 ± 2.07 mg/g, P < 0.01), ulcer ratio (24.69% ± 2.83% vs 36.13% ± 9.64%, P < 0.01), thymus index (1.96 ± 0.48 mg/g vs 1.08 ± 0.32 mg/g, P < 0.01) and spleen index (2.85 ± 0.33 mg/g vs 3.87 ± 0.96 mg/g, P < 0.01), and down-regulated the colonic mucosal expression of COX-2 (30.6% ± 7.0% vs 67.4% ± 1.2%, P < 0.01) and TNF-α (19.5% ± 3.0% vs 52% ± 4.7%, P < 0.01). PC407 at a dose of 9 mg/kg also could improve the above indexes, but the effects were less than PC407 at 18 mg/kg.
CONCLUSION: PC407 has significant therapeutic effects on TNBS-induced colitis in rats, and the mechanism may relate to its regulation on COX-2 and TNF-α expression.
- Citation: Bai H, Zhang BL, Li YH, You Y, Guo ZJ, Sun Y, Mei QB. Therapeutic effects of selective cyclooxygenase-2 inhibitor PC407 on 2,4,6-trinitrobenzene sulfonic acid-induced ulcerative colitis in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(12): 1287-1293
- URL: https://www.wjgnet.com/1009-3079/full/v16/i12/1287.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i12.1287
溃疡性结肠炎(ulcerative colitis, UC)是一种主要累及结肠和直肠的慢性特发性炎症反应, 属于炎症性肠病(inflammatory bowel disease, IBD)的一种[1]. 诸多研究证实UC以自身免疫系统和内环境因素相互作用的严重失调为主要表现[2-3]. 目前, UC的药物治疗首选氨基水杨酸类药物, 对新型非甾体抗炎药(non-steroidal anti-inflammatory drugs, NSAID)的应用正在探索之中. 此类药物通过抑制环氧合酶(cyclooxygenase, COX)来减少前列腺素的合成, 缓解肠道炎症反应[4]. 然而氨基水杨酸类药物对COX-1和COX-2没有选择性, 因抑制COX-1依赖途径产生的前列腺素, 而引发上消化道不良反应(如肠缩窄、穿孔和出血等), 这已成为限制其使用的主要危险因素[5]. 选择性COX-2抑制剂(如塞来昔布、罗非昔布等)通过选择性地抑制炎症期间高表达的COX-2缓解炎症反应, 已引起越来越多的关注. 将选择性COX-2抑制剂引入UC的治疗不仅可以缓解疼痛和炎症反应, 同时亦降低药物引起的消化道不良反应, 但是不同化学类型的COX-2抑制剂对于结肠炎治疗显示的作用不同, 不同抑制强度的选择性COX-2抑制剂的安全性尚待进一步研究[6-7]. 本实验室首次合成以1, 5-二芳基吡唑为母环的选择性COX-2抑制剂, 实验表明4-[5-萘基-3-(三氟甲基)-1-氢-吡唑-1-基]苯磺酰胺, 即PC407, 其IC50.COX-1/IC50.COX-2为14.4, 是塞来昔布的2倍[8-9]. 本实验用PC407 ig治疗TNBS/乙醇诱导的大鼠溃疡性结肠炎, 观察其治疗作用, 初步探讨其药理作用.
二级SD大鼠购自中国人民解放军第四军医大学实验动物中心; PC407由本实验室自行合成, 白色晶体, 分子质量为418, HPLC测定纯度为97.5%[10]; 塞来昔布和TNBS购于Sigma公司; 兔抗大鼠COX-2多克隆抗体购于Abcom公司; 兔抗大鼠TNF-α亲和纯化抗体、即用型SABC免疫组化试剂盒和DAB显色试剂盒购于博士德生物工程有限公司.
1.2.1 模型复制及动物分组: 二级♂SD大鼠50只(230-250 g), 随机分为5组, 每组10只, 即正常对照组、模型对照组、塞来昔布阳性对照组(18 mg/kg)和PC407治疗组(9, 18 mg/kg); PC407的给药剂量由塞来昔布推荐人用量(100-200 mg/d)折算. 各组大鼠造模前禁食24 h, 正常饮水, 造模时(除正常对照组)乙醚麻醉大鼠, 用TNBS和400 mL/L乙醇灌肠, 复制实验性结肠炎模型[11], 造模6 h后, 分别ig给予生理盐水、塞来昔布和PC407, 每天1次, 持续6 d.
1.2.2 大体与组织学观察记录: 实验前后分别称量各组实验大鼠的体质量, 每天观察稀便情况. 给药第7天, 称质量后乙醚麻醉大鼠至死; 打开腹腔从肛门向上截取8 cm结肠, 在冰浴中沿肠系膜缘剪开肠腔, 漂洗内容物, 结肠称质量后, 在冰浴中用透明薄膜画出溃疡面积, 以8 cm结肠质量(mg)比麻醉致死前大鼠体质量(g)为结肠指数, 以8 cm结肠溃疡面积占8 cm结肠总面积的比率为溃疡比(%)进行统计; 肉眼观察结肠外观及肠黏膜的改变, 40 g/L甲醛固定结肠病变部位, 石蜡包埋, 切片, HE染色. 同时取大鼠脾脏、胸腺称量质量, 以大鼠脾脏或胸腺质量(mg)比麻醉致死前大鼠体质量(g)为脾脏或胸腺指数进行统计.
1.2.3 免疫组织化学染色: 运用SABC法进行免疫组化染色. 收集各组石蜡切片常规脱蜡至水, 浸于3 mL/L H2O2液中30 min, 去除内源性过氧化物酶; 再置于组织抗原修复液中, 微波加热至沸腾2次, 静置至室温后滴加5% BSA封闭液20 min, 分别滴加兔抗大鼠COX-2、TNF-α一抗(均按1:200稀释), 4℃过夜; 再滴加生物素化的羊抗兔IgG室温孵育20 min, 加SABC复合物室温孵育20 min, 最后用DAB法微镜下观察显色, 时间控制在30 s-2 min, 以上各步骤之间用0.01 mol/L PBS(pH7.4)充分漂洗. 切片经苏木素复染, 盐酸酒精分化后梯度酒精脱水, 二甲苯透明, 中性树胶封片. 以PBS代替一抗作为阴性对照. COX-2以细胞质染色为主, 细胞膜可有少量染色, 阳性判断标准为该位置出现黄色或棕黄色颗粒. TNF-α阳性表达为细胞质内呈现棕黄色颗粒. 采用计算机图像系统分析摄片, 光镜(×400)下每张切片各取5个视野, 分别计数各视野组织阳性细胞率(阳性细胞/视野内细胞总数×100%), 结果以mean±SD表示.
统计学处理 数据用mean±SD表示, 采用SPSS10.0统计软处理, 两组间比较采用t检验.
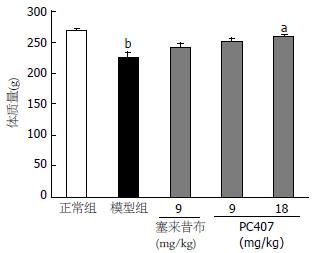
模型对照组大鼠第1天即出现不成形稀便, 大便次数增多, 第2-3天伴有黏液, 症状持续至给药结束; 塞来昔布阳性对照组(18 mg/kg)大鼠第1天即出现不成形稀便, 第5-6天绝大部分大鼠稀便症状消失; PC407治疗组(9, 18 mg/kg)大鼠第1天即出现不成形稀便, 第2-3天稀便症状逐渐消失, 第4-5天完全消失, 此现象显示PC407和塞来昔布能降低结肠炎大鼠稀便发生率(表1). 实验前各组大鼠体质量无显著性差异, TNBS/乙醇诱导大鼠溃疡性结肠炎后, 模型对照组大鼠的体质量较正常对照组明显下降(P<0.01, 图1); 而PC407治疗组(18 mg/kg)可明显阻止结肠炎大鼠的体质量下降(P<0.05, 图1) .
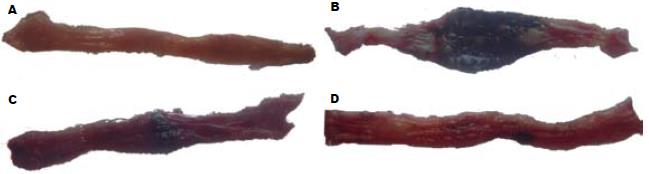
模型对照组大鼠肠壁增厚、皱褶消失并出现大面积坏死, 肠黏膜广泛充血、水肿并多处可见明显的溃疡灶; 塞来昔布阳性对照组(18 mg/kg)肠壁轻度增厚、皱褶部分消失并出现小面积坏死, 多处可见肠黏膜充血、水肿, 溃疡面积较模型组有所缩小(P<0.05); PC407治疗组(18 mg/kg)大鼠结肠病变明显减轻, 肠壁无明显增厚, 皱褶正常, 肠黏膜无明显充血, 仅局部可见水肿和极小面积坏死, 溃疡面积较模型对照组和塞来昔布阳性对照组有显著性缩小(P<0.01); PC407治疗组(9 mg/kg)与塞来昔布阳性对照组(18 mg/kg)对大鼠TNBS/乙醇造成的结肠组织大体损伤恢复程度较为一致, 未在图中显示; 正常对照组肠黏膜未见病变(表1, 图2). 与模型组相比, 塞来昔布阳性对照组(18 mg/kg)和PC407治疗组(9, 18 mg/kg)均可对抗实验性溃疡性结肠炎引起胸腺萎缩(P<0.01, 表1), 但仅PC407治疗组(9, 18 mg/kg)可对抗溃疡性结肠炎引起的脾脏肿大, 且18 mg/kg PC407治疗组效果更为显著(P<0.01, 表1).
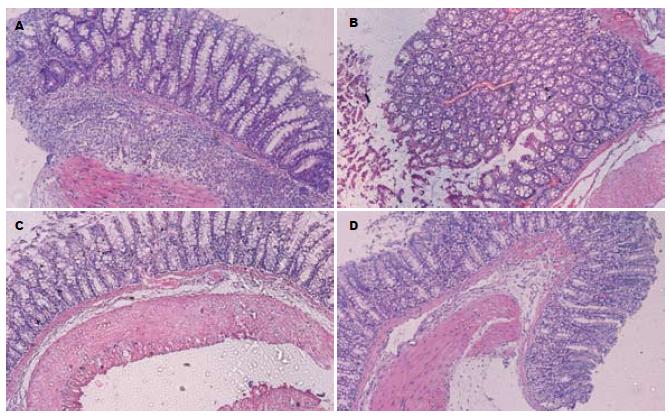
结肠病变组织HE染色结果显示, 模型对照组大鼠黏膜上皮细胞广泛缺失, 腺体大多不完整, 杯状细胞严重变形, 黏膜及黏膜下层炎性细胞广泛浸润, 呈典型炎症改变; 塞来昔布阳性对照组(18 mg/kg)大鼠结肠黏膜部分缺失, 腺体部分不完整, 杯状细胞中度变形, 黏膜及黏膜下层有炎性细胞浸润; PC407治疗组治疗组(18 mg/kg)大鼠结肠黏膜缺失少见, 极小部分腺体不完整, 杯状细胞形态大多恢复正常, 黏膜及黏膜下层炎症细胞浸润程度较轻, 整体炎症程度较模型对照组和塞来昔布阳性对照组(18 mg/kg)明显减轻(图3); PC407治疗组(9 mg/kg)与塞来昔布阳性对照组(18 mg/kg)HE染色结果评价程度较为一致, 故未在图中显示.
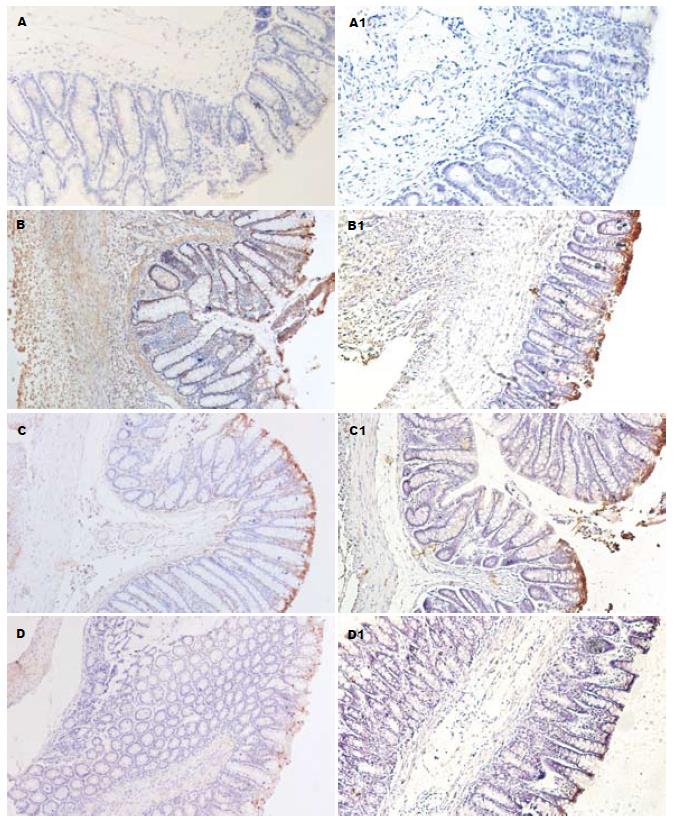
与正常对照组比较, 模型对照组大鼠肠黏膜COX-2、TNF-α的阳性表达率均升高(P<0.01, 表2, 图4), 差异具有统计学意义; 与模型对照组比较, 塞来昔布阳性对照组(18 mg/kg)可降低大鼠肠黏膜COX-2、TNF-α的阳性表达率(P<0.05, 表2, 图4); PC407治疗组(9 mg/kg)降低大鼠肠黏膜COX-2阳性表达率(P<0.05), 但与塞来昔布阳性对照组(18 mg/kg)相当; PC407治疗组(9, 18mg/kg)对大鼠肠黏膜TNF-α的阳性表达率降低效果更为明显(P<0.05; P<0.01, 表2, 图4). PC407治疗组(9 mg/kg)与塞来昔布阳性对照组(18 mg/kg)阳性表达率比较无显著性差异, 故未在图中显示.
UC被世界卫生组织列为现代难治病之一, 其病因探寻和治疗药物发掘一直是研究热点. 遗传、环境、饮食、心理等多种因素都可以引发UC, 这些因素可能触发一个连续的慢性免疫过程, 中性粒细胞、巨噬细胞、T和B淋巴细胞等参与了此过程, 这些效应细胞释放的抗体、细胞因子(如TNF-α, IL-1等)和炎症介质(如前列腺素, 白三烯等)引起组织破坏和炎性病变[12-13]. COX是花生四烯酸转化为前列腺素代谢过程中的关键酶, 越来越多的证据显示, COX-2与UC的发病密切相关. COX-2为诱生型酶, 在静息状态下不表达, 有研究表明, 炎症结肠黏膜上皮细胞及结肠固有层单核炎性细胞大量表达COX-2, 并且在炎症活动期结肠固有层和肌间神经丛中COX-2 mRNA表达水平明显高于非活动期[14-15].
目前, UC的临床治疗药物主要有三类, 即非甾体抗炎类药物(5-氨基水杨酸, 柳氮磺胺吡啶等)、肾上腺皮质激素类药物(泼尼松龙, 地塞米松等)和免疫抑制剂(6-巯基嘌呤, 氨甲喋呤等), 他们各自引发的不良反应都限制其作为长期有效治愈UC的首选药物, 其中, 应用最为广泛的氨基水杨酸类药物就是因其对COX的非选择性抑制而产生了严重的上、下消化道不良反应. 因此, 基于近年来对UC发病机制的进一步研究[16]和现有UC治疗药物的安全性评估[17], 选择性COX-2抑制剂开始应用于UC的治疗. 我们合成了一系列1, 5-二芳基吡唑类选择性COX-2抑制剂并对其抗炎活性进行筛选, 得到对COX-2选择性优于塞来昔布而不良反应极低的PC407[8-9], 并首次用于实验性UC的治疗.
关于已上市的吡唑类选择性COX-2抑制剂治疗实验性UC的报道一致性不高[18], 如Cuzzocrea et al[19]的研究结果显示塞来昔布可以通过降低COX-2下游炎性介质的水平减轻UC大鼠的黏膜损伤和炎症程度; 而Reuter et al[20]用3种不同抑制程度的选择性COX-2抑制剂(包括塞来昔布)进行为期1 wk的大鼠UC的治疗, 结果3种药物均不同程度加重了炎症相关的结肠黏膜损伤. 诸多上述类型的报道[21-22]引起人们对选择性COX-2抑制剂治疗UC安全性的质疑. 造成这种不一致性的原因有二点: 一是后续研究发现过度抑制前列腺素合成会削弱其保护结肠黏膜的作用[23-25], 二是不同研究中选择性COX-2抑制剂的IC50.COX-1/IC50.COX-2和给药剂量大不相同. 因此, 我们参考文献及塞来昔布治疗人用量(100-200 mg/d)进行折算以确定PC407的给药剂量. 实验结果表明, PC407(18 mg/kg)对TNBS/乙醇诱导的UC疗效显著, PC407(9 mg/kg)与塞来昔布(18 mg/kg)治疗效果相当, 提示其对COX-2的选择性抑制是有效治疗UC的基础, 且在治疗剂量范围未引起UC大鼠结肠黏膜损伤加重的不良反应.
细胞因子失衡是UC产生肠道非特异性炎症的关键环节[26], 诸多细胞因子可同时或相继、直接或间接作用于靶细胞, 形成细胞因子网络, 在UC的组织破坏及炎症反应中起着重要作用, 其中与UC关系密切的促炎细胞因子主要有TNF-α[27-28]. 研究表明, 炎症状态时巨噬细胞COX-2表达呈强阳性, 抑制COX-2表达可以调节巨噬细胞吞噬功能, 同时影响巨噬细胞对TNF-α等细胞因子的有害刺激的应答反应[29-30]. 我们的研究显示PC407(9, 18 mg/kg)能显著降低大鼠UC模型促炎细胞因子TNF-α的含量, 表明其能抑制促炎细胞因子的分泌, 调节免疫反应, 从而控制肠道炎症反应, 这可能是其治疗UC的机制之一. 我们将进一步研究PC407治疗UC的作用机制, 解释其对COX-2作用网络调控的可能方式.
溃疡性结肠炎(UC)是一种慢性特发性炎症反应. 作为UC的首选治疗药物, 氨基水杨酸类药物因其对环氧合酶(COX)的非选择性抑制而产生不良反应, 新型非甾体抗炎药(NSAID)的应用正在探索之中.
同行评价者
杜群, 副研究员, 广州中医药大学脾胃研究所药理室; 陈治水, 主任医师, 中国人民解放军第二一一医院中医科.
UC被世界卫生组织列为现代难治病之一, 其病因探寻和治疗药物发掘一直是研究热点.
对COX-2生理、病理作用及选择性COX-2抑制剂更为广泛和深入的研究发现, COX-2在炎症的不同阶段扮演的角色不同, 且不同结构类型的选择性COX-2抑制剂对于溃疡性结肠炎的治疗显示的作用不同.
本实验室首次合成吡唑类选择性COX-2抑制剂PC407, 并观察发现其对TNBS/乙醇诱导的治疗作用.
PC407对TNBS/乙醇诱导的大鼠溃疡性结肠炎治疗作用良好, 其机制可能通过下调COX-2及TNF-α的表达, 从而缓解结肠炎症.
本研究选题新颖, 科研设计合理, 实验手段较先进, 对于开发溃疡性结肠炎治疗新药有重要的临床意义.
编辑: 潘伯荣 电编:吴鹏朕
| 1. | Goyette P, Labbé C, Trinh TT, Xavier RJ, Rioux JD. Molecular pathogenesis of inflammatory bowel disease: genotypes, phenotypes and personalized medicine. Ann Med. 2007;39:177-199. [PubMed] [DOI] |
| 2. | Lukas M, Bortlik M, Maratka Z. What is the origin of ulcerative colitis? Still more questions than answers. Postgrad Med J. 2006;82:620-625. [PubMed] [DOI] |
| 3. | Baumgart DC, Carding SR. Inflammatory bowel disease: cause and immunobiology. Lancet. 2007;369:1627-1640. [PubMed] [DOI] |
| 4. | Murphy SJ, Ullman TA, Abreu MT. Gut microbes in Crohn's disease: getting to know you better? Am J Gastroenterol. 2008;103:397-398. [PubMed] [DOI] |
| 5. | Stadnicki A, Frysz-Naglak D. Non-steroidal anti-inflammatory drugs and intestinal side effects. Wiad Lek. 2007;60:286-290. [PubMed] |
| 6. | Bertolini A, Ottani A, Sandrini M. Selective COX-2 inhibitors and dual acting anti-inflammatory drugs: critical remarks. Curr Med Chem. 2002;9:1033-1043. [PubMed] [DOI] |
| 7. | Lehmann FS, Beglinger C. Impact of COX-2 inhibitors in common clinical practice a gastroenterologist's perspective. Curr Top Med Chem. 2005;5:449-464. [PubMed] [DOI] |
| 9. | Lu ZH, Xiong XY, Zhang BL, Lin GC, Shi YX, Liu ZG, Meng JR, Zhou YM, Mei QB. Evaluation of 2 celecoxib derivatives: analgesic effect and selectivity to cyclooxygenase-2/1. Acta Pharmacol Sin. 2005;26:1505-1511. [PubMed] [DOI] |
| 10. | Hao LL, Mei QB, Zhang BL, Jia M, Li XQ, Zhang F. PC-407 inhibited proliferation and induced apoptosis in human colon cancer SW-1116 cells. Acta Pharmacol Sin. 2004;25:1509-1514. [PubMed] |
| 11. | 刘 莉, 梅 其炳, 周 四元, 韩 凤华, 龙 铟, 刘 家云, 李 晨, 孟 静茹, 王 志鹏. 大黄多糖对TNBS诱导大鼠结肠炎的治疗作用. 中国中药杂志. 2003;28:246-249. |
| 12. | Bamias G, Cominelli F. Immunopathogenesis of inflammatory bowel disease: current concepts. Curr Opin Gastroenterol. 2007;23:365-369. [PubMed] [DOI] |
| 13. | Latinne D, Fiasse R. New insights into the cellular immunology of the intestine in relation to the pathophysiology of inflammatory bowel diseases. Acta Gastroenterol Belg. 2006;69:393-405. [PubMed] |
| 14. | Singer II, Kawka DW, Schloemann S, Tessner T, Riehl T, Stenson WF. Cyclooxygenase 2 is induced in colonic epithelial cells in inflammatory bowel disease. Gastroenterology. 1998;115:297-306. [PubMed] [DOI] |
| 15. | Roberts PJ, Morgan K, Miller R, Hunter JO, Middleton SJ. Neuronal COX-2 expression in human myenteric plexus in active inflammatory bowel disease. Gut. 2001;48:468-472. [PubMed] [DOI] |
| 16. | Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007;448:427-434. [PubMed] [DOI] |
| 17. | Tanaka A, Hase S, Miyazawa T, Ohno R, Takeuchi K. Role of cyclooxygenase (COX)-1 and COX-2 inhibition in nonsteroidal anti-inflammatory drug-induced intestinal damage in rats: relation to various pathogenic events. J Pharmacol Exp Ther. 2002;303:1248-1254. [PubMed] [DOI] |
| 18. | Mahadevan U, Loftus EV Jr, Tremaine WJ, Sandborn WJ. Safety of selective cyclooxygenase-2 inhibitors in inflammatory bowel disease. Am J Gastroenterol. 2002;97:910-914. [PubMed] [DOI] |
| 19. | Cuzzocrea S, Mazzon E, Serraino I, Dugo L, Centorrino T, Ciccolo A, Sautebin L, Caputi AP. Celecoxib, a selective cyclo-oxygenase-2 inhibitor reduces the severity of experimental colitis induced by dinitrobenzene sulfonic acid in rats. Eur J Pharmacol. 2001;431:91-102. [PubMed] [DOI] |
| 20. | Reuter BK, Asfaha S, Buret A, Sharkey KA, Wallace JL. Exacerbation of inflammation-associated colonic injury in rat through inhibition of cyclooxygenase-2. J Clin Invest. 1996;98:2076-2085. [PubMed] [DOI] |
| 21. | Tsubouchi R, Hayashi S, Aoi Y, Nishio H, Terashima S, Kato S, Takeuchi K. Healing impairment effect of cyclooxygenase inhibitors on dextran sulfate sodium-induced colitis in rats. Digestion. 2006;74:91-100. [PubMed] [DOI] |
| 22. | Zamuner SR, Warrier N, Buret AG, MacNaughton WK, Wallace JL. Cyclooxygenase 2 mediates post-inflammatory colonic secretory and barrier dysfunction. Gut. 2003;52:1714-1720. [PubMed] [DOI] |
| 23. | Rutgeerts P, Vermeire S, Van Assche G. Mucosal healing in inflammatory bowel disease: impossible ideal or therapeutic target? Gut. 2007;56:453-455. [PubMed] [DOI] |
| 24. | Sasaki S, Hirata I, Maemura K, Hamamoto N, Murano M, Toshina K, Katsu K. Prostaglandin E2 inhibits lesion formation in dextran sodium sulphate-induced colitis in rats and reduces the levels of mucosal inflammatory cytokines. Scand J Immunol. 2000;51:23-28. [PubMed] [DOI] |
| 25. | Hatazawa R, Ohno R, Tanigami M, Tanaka A, Takeuchi K. Roles of endogenous prostaglandins and cyclooxygenase isozymes in healing of indomethacin-induced small intestinal lesions in rats. J Pharmacol Exp Ther. 2006;318:691-699. [PubMed] [DOI] |
| 26. | Nguyen GC, Harris ML, Dassopoulos T. Insights in immunomodulatory therapies for ulcerative colitis and Crohn's disease. Curr Gastroenterol Rep. 2006;8:499-505. [PubMed] [DOI] |
| 27. | Hassan C, Zullo A, De Francesco V, Campo SM, Morini S, Panella C, Ierardi E. Tumor necrosis factor alpha in ulcerative colitis and diverticular disease associated colitis. Endocr Metab Immune Disord Drug Targets. 2007;7:187-194. [PubMed] [DOI] |
| 28. | Valesini G, Iannuccelli C, Marocchi E, Pascoli L, Scalzi V, Di Franco M. Biological and clinical effects of anti-TNFalpha treatment. Autoimmun Rev. 2007;7:35-41. [PubMed] [DOI] |
| 29. | Huang ZF, Massey JB, Via DP. Differential regulation of cyclooxygenase-2 (COX-2) mRNA stability by interleukin-1 beta (IL-1 beta) and tumor necrosis factor-alpha (TNF-alpha) in human in vitro differentiated macrophages. Biochem Pharmacol. 2000;59:187-194. [PubMed] [DOI] |
| 30. | Ulcar R, Peskar BA, Schuligoi R, Heinemann A, Kessler HH, Santner BI, Amann R. Cyclooxygenase inhibition in human monocytes increases endotoxin-induced TNF alpha without affecting cyclooxygenase-2 expression. Eur J Pharmacol. 2004;501:9-17. [PubMed] [DOI] |