修回日期: 2008-02-28
接受日期: 2008-04-11
在线出版日期: 2008-04-18
目的: 探讨土槿皮乙酸(PAB)对人肝癌细胞株BEL-7402增殖和凋亡的影响及其影响机制.
方法: 体外培养肝癌BEL-7402细胞, 用不同浓度PAB作用不同时间后, MTT比色法检测PAB对细胞增殖的影响; 流式细胞仪分析PAB对细胞周期和凋亡的影响; 吖啶橙染色荧光显微镜下观察PAB引起的肝癌细胞株BEL-7402形态学变化; JC-1检测线粒体膜电位的变化; Western blot方法检测PAB对COX-2表达的影响.
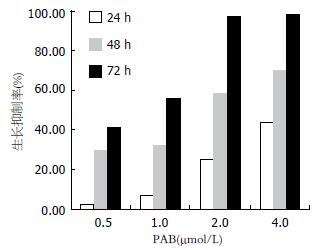
结果: PAB作用细胞24, 48, 72 h, 细胞增殖受到抑制, 且表现为剂量依赖性和时间依赖性; PAB使肝癌细胞细胞周期阻滞于G2/M期; 与对照组相比, 2.0, 4.0 μmol/L PAB作用24 h后, 细胞凋亡率明显增加, 差异显著(19.06%±3.87%, 31.19%±1.46% vs 0.10%±0.08%, P<0.05); 吖啶橙染色发现1.0 μmol/L PAB作用24 h, 细胞内即有凋亡小体出现; 与对照组相比, 0.5 μmol/L PAB作用24 h即可降低BEL-7402线粒体膜电位(P<0.05); 不同浓度PAB作用24 h后, 随PAB浓度增加COX-2蛋白表达递减.
结论: PAB通过降低BEL-7402线粒体膜电位、减少COX-2的表达抑制细胞生长, 诱导细胞凋亡.
引文著录: 鞠晓华, 徐永红, 李岩. 土槿皮乙酸对BEL-7402细胞凋亡、线粒体膜电位及COX-2蛋白表达的影响. 世界华人消化杂志 2008; 16(11): 1151-1156
Revised: February 28, 2008
Accepted: April 11, 2008
Published online: April 18, 2008
AIM: To investigate the effects of pseudolaric acid B (PAB) on the cell cycle arrest and apoptosis of human hepatocellular carcinoma cell line BEL-7402 and the related mechanism.
METHODS: Hepatocellular carcinoma line BEL-7402 cultured in vitro was treated with various concentrations (0.5, 1.0, 2.0, 4.0 μmol/L) of PAB at various intervals. Cell proliferation was examined by MTT assay. Cell cycle and apoptosis were analyzed by flow cytometry, and nuclear condensation in BEL-7402 cells was examined with acridine orange staining. The change of mitochondrial trans-membrane potential was measured by JC-1 staining and cyclooxygenase-2 (COX-2) protein expression was detected by Western blot.
RESULTS: Various concentrations of PAB inhibited the growth of BEL-7402 cells in a dose- and time-dependent manner. PAB induced apoptosis and cell cycle arrest at G2/M phase. BEL-7402 cells treated with 2.0, 4.0 μmol/L PAB for 24 h showed significantly enhanced apoptosis as compared with the control cells (19.06% ± 3.87%, 31.19% ± 1.46% vs 0.10% ± 0.08%, P < 0.05). With acridine orange staining, we observed apoptotic body after the cells were treated with 1.0 μmol/L PAB for 24 h. After the cells were treated with 0.5 μmol/L PAB for 24 h, the mitochondrial membrane potential declined significantly. The expression of COX-2 protein in BEL-7402 cells decreased in a dose-dependent manner.
CONCLUSION: PAB may inhibit the proliferation and induce the apoptosis of BEL-7402 cells by depolarization of the mitochondrial membrane potential and down-regulation of the COX-2 expression.
- Citation: Ju XH, Xu YH, Li Y. Effects of pseudolaric acid B on the apoptosis, mitochondrial membrane potential and cyclooxygenase-2 expression in hepatocellular carcinoma cell line BEL-7402. Shijie Huaren Xiaohua Zazhi 2008; 16(11): 1151-1156
- URL: https://www.wjgnet.com/1009-3079/full/v16/i11/1151.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i11.1151
土槿皮是松科植物金钱松的根皮, 土槿皮乙酸(pseudolaric acid B, PAB)是土槿皮主要的生物活性成分, 与雷公藤总甙同属于二萜类化合物, 分子式为C23H28O8. 近年研究发现PAB具有抗肿瘤作用, 其可以抑制胃癌、肺癌、结肠癌、宫颈癌及黑色素瘤等多种肿瘤细胞的增殖并诱导细胞凋亡[1-4], 但其具体机制尚不完全清楚, 并可能因为细胞类型的不同而存在差异[5-8].
目前, 随着对细胞凋亡机制研究不断深入, 线粒体在细胞凋亡中的作用受到关注. 在凋亡过程中, 线粒体有两个重要作用, 首先他以ATP的形式提供细胞凋亡所需的能量. 其次, 在细胞尚未发生形态改变时, 细胞内线粒体已开始一系列活动, 如线粒体跨膜电位(△ψm)降低、膜发生渗透性转换、线粒体释放凋亡特异性酶激活物细胞色素C及凋亡诱导因子(apoptosis inducing factor, AIF)等, 最终决定细胞凋亡发生与否. 因此, 线粒体被认为是细胞凋亡的调控器[9-10].
本研究观察PAB对肝癌细胞BEL-7402增殖及凋亡的影响, 探讨线粒体膜电位及COX-2在PAB诱导细胞凋亡过程中的变化, 旨在认识PAB抗肿瘤作用机制.
PAB(中国药品生物制品检定所, 分子量432.5 g/mol, 批号110880-200502). RPMI 1640 培养基(Hyclone公司), 胎牛血清(天津灏洋生物制品公司), 胰酶(Amresco公司), 噻唑蓝MTT (南京凯基生物发展有限公司), Hoechst 33258 (Sigma公司), 碘化丙啶(propidium iodide, PI, Sigma公司), 线粒体膜电位检测试剂盒JC-1(南京凯基生物发展有限公司), COX-2, actin羊抗人多克隆一抗和辣根酶标记兔抗山羊IgG(Santa Cruz Biotechnology). 人肝癌细胞株BEL-7402由中国医科大学细胞生物教研室提供.
1.2.1 细胞系及细胞培养: 细胞接种在含100 mL/L胎牛血清、100 U/mL青链霉素的RPMI 1640培养基中, 在37℃、体积分数为50 mL/L CO2、95%湿度培养箱中培养. 细胞单层贴壁生长, 48-72 h传代.
1.2.2 MTT比色法检测细胞增殖: 人肝癌细胞株BEL-7402细胞密度调整为4-5×107/L, 接种于96 孔培养板, 每孔100 μL. 培养12 h, 分别加入浓度为0, 0.5, 1.0, 2.0, 4.0 μmol/L PAB, 培养24, 48, 72 h, 每孔加入MTT 15 μL(5 g/L), 继续培养4 h 后, 弃上清, 每孔加入150 μL二甲基亚砜, 避光振荡15 min后, 酶标仪于590 nm波长下检测各孔吸光度值(A值), 绘制量效曲线. 细胞抑制率(%) = (1-加药组平均A值/对照组平均A值)×100%.
1.2.3 流式细胞仪分析细胞周期和凋亡率: 分别收集被0, 0.5, 1.0, 2.0, 4.0 μmol/L PAB作用24 h的肝癌细胞, 调整细胞数约为1×106, PBS洗涤细胞2次, 加入700 mL/L乙醇, 置4℃固定过夜.检测时用PBS洗涤细胞两次, PI复合染液避光染色20 min后行流式细胞仪检测. Cell Quest软件获取单个细胞104个, 用Mod Fit LT软件分析细胞周期和凋亡率.
1.2.4 细胞形态学观察: 10 mg吖啶橙溶于100 mL pH为6.8的PBS中, 滤过, 4℃避光保存. 收集药物作用后的各组细胞, PBS液洗涤2遍, 制成活细胞悬液, 浓度为1010 cells/L, 取95 μL细胞悬液, 加入5 μL吖啶橙储存液混匀, 吸1滴混合液点于洁净玻片上, 直接用盖玻片封片, 荧光显微镜观察, 摄片.
1.2.5 检测△ψm: PAB作用24 h的肝癌细胞, 用PBS洗涤细胞2次, 收集不多于1×106的细胞; 取500 μL 10×incubation Buffer加4.5 mL灭菌去离子水稀释成1×incubation Buffer, 混匀并预热至37℃; 吸取2.5 mL 1×incubation Buffer, 加入5 μL JC-1, 涡旋混匀配成JC-1工作液; 取500 μL JC-1工作液将细胞均匀悬浮, 37℃, 50 mL/L CO2的培养箱中孵育15-20 min; 室温离心(2000 r/min, 5 min)收集细胞, 用1×incubation Buffer洗两次; 吸取500 μL 1×incubation Buffer重新悬浮细胞; 流式细胞仪(Ex = 488 nm; Em = 530 nm)检测细胞凋亡的情况. 荧光显微镜观察: 滴1滴上述细胞悬液于载玻片, 盖上盖玻片, 于荧光显微镜下观察, 照相.
1.2.6 检测COX-2表达: 收集BEL-7402细胞, 用冰冷的PBS洗涤细胞2次, 4℃, 3000 r/min离心5 min, 去上清, 立即置于冰上; 加入细胞裂解液及蛋白酶抑制剂混合液, 吹打均匀, 冰上放置20 min; 4℃离心, 14 000 r/min, 10 min; 将上清液转移至另一干净的离心管中, 取部分上清液测定蛋白质浓度. 取等蛋白量样品上清液与2×样品缓冲液混匀后于沸水浴中煮沸3 min, 上样, 用SDS-PAGE进行电泳, 转膜, 加入actin山羊多克隆抗体和COX-2山羊多克隆抗体, 室温孵育2 h, 辣根过氧化物酶标记山羊抗兔IgG二抗和兔抗山羊IgG二抗室温孵育1 h; 混合等体积的A液和B液, 与PVDF膜共孵育5 min, 于暗室中进行曝光、显影、定影; 以凝胶成像系统进行成像及数据采集.
统计学处理 所有实验数据均采用mean±SD表示, 用SPSS13.0软件进行t检验.
0.5, 1.0, 2.0, 4.0 μmol/L PAB对细胞作用24, 48, 72 h, 抑制细胞生长, 且表现出明显的剂量依赖性和时间依赖性. 2.0 μmol/L PAB对BEL-7402作用72 h, 抑制率接近100%(图1).
PAB对BEL-7402细胞作用24 h, 随着浓度的增加, G0/G1、S期细胞逐渐减少, G2/M期细胞逐渐增多, 提示细胞周期阻滞于G2/M期; 与对照组相比, 2.0, 4.0 μmol/L PAB作用24 h后, 细胞凋亡率明显增加(表1).
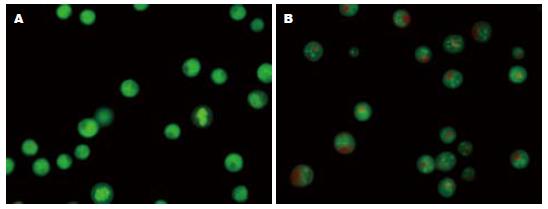
吖啶橙荧光染色可较清楚地显示凋亡细胞的胞体与胞核形态. 正常细胞核结构正常、均呈绿色荧光(图2A). 1.0 μmol/L PAB作用24 h后, 荧光显微镜下观察到典型的细胞凋亡特征性变化: 凋亡细胞胞核呈固缩状的或半月形绿色荧光或橘黄色荧光(图2B).
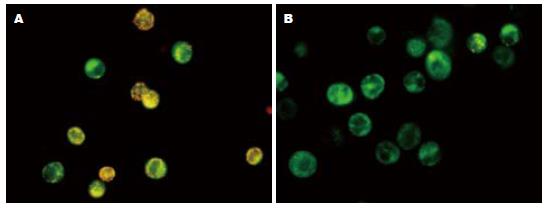
JC-1在正常细胞内聚集在线粒体内, 形成多聚体, 呈鲜红色荧光, 但在凋亡细胞内, 由于△ψm的破坏, 不能聚集到线粒体内, 以单体的形式存在于胞质发绿色荧光. 荧光强度的变化反映△ψm的变化. 流式细胞仪用红色荧光降低的百分比表示△ψm的降低. 该试验发现PAB处理细胞后线粒体由黄绿色变为绿色. BEL-7402细胞经0.5, 1.0, 2.0, 4.0 μmol/L PAB作用24 h后, 线粒体膜电位降低, 分别是33.46%±0.87%、51.97%±1.42%、63.34%±2.67%、70.78%±7.39%和77.62%±8.13%, 提示线粒体膜电位发生去极化(图3).
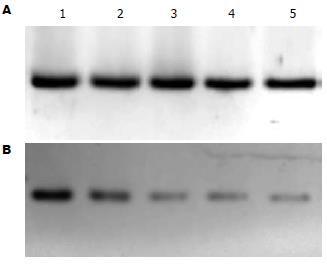
BEL-7402细胞随药物浓度的增加, COX-2蛋白表达减少, 2.0, 4.0 μmol/L PAB处理组尤为明显(图4).
PAB是从金钱松的根皮提取出来的二萜类化合物. 在民间PAB主要用于治疗皮肤真菌感染、终止早期妊娠, 近年来研究发现PAB具有抗肿瘤及抑制肿瘤血管发生的作用, 从而引起人们的广泛关注. PAB主要抑制增殖活跃的肿瘤细胞的生长, 对源于正常组织生长缓慢的细胞影响甚微, 在移植瘤动物模型中, 有效剂量内并未观察到毒性反应, 而且PAB可以抑制P-糖蛋白过表达引起的肿瘤耐药[1]. PAB作为一种新的微管蛋白结合剂, 通过不同于长春新碱和秋水仙素微管蛋白结合位点的直接作用, 可使微管蛋白解聚, 显著抑制人微血管内皮细胞的增殖、迁移和腔管形成, 而且可清除动物体内新形成的内皮腔管和微血管[8].
我们采用不同浓度的PAB对人肝癌细胞株BEL-7402作用不同时间, 发现细胞增殖受到明显抑制, 细胞周期阻滞于G2/M期; 同时吖啶橙染色观察到典型的凋亡细胞, JC-1染色流式细胞仪检测表明PAB作用后线粒体膜电位降低. Ko et al[3]的研究亦发现PAB通过使人结肠癌细胞株HT-29细胞周期阻滞于G2/M期, 调节细胞周期蛋白的表达, 下调c-myc, 从而抑制肿瘤细胞的生长, 诱导细胞凋亡. 这与本实验的结果一致.
我们发现PAB可使肝癌细胞BEL-7402阻滞于G2/M期, 从而抑制细胞的有丝分裂. 这可能是由于PAB裂解细胞微管网状系统, 抑制有丝分裂纺锤体的形成[1]. △ψm是线粒体发挥正常生理功能所必需的, 线粒体膜完整的脂质双层结构保障了△ψm的存在, 一旦膜完整性遭到破坏, 将致使△ψm下降, 从而使线粒体氧化还原状态失常, 引发呼吸链的解耦联等. 这些因素足以使细胞因无法得到正常能量供给而发生凋亡或坏死. 本实验应用JC-1染色, 通过流式细胞仪检测△ψm的变化, 发现△ψm随PAB药物浓度的增加而下降. PAB降低△ψm诱导凋亡的机制尚不明确, 可能是PAB降低线粒体膜电位后直接激活线粒体途径的凋亡通路[11-13]. 由于△ψm下降, 从线粒体外室释放的AIF激活caspase-3, 同时从线粒体释放出来的细胞色素C与凋亡蛋白酶激活因子-1(apoptotic protease activating factor-1, Apaf-1)和caspase-9形成复合体, 活化caspase-3, 从而引起细胞凋亡[14-15].
近年来研究表明, COX-2除在炎症反应中起重要作用外, 尚与肝癌、结肠癌等肿瘤的发生密切相关[16-17]. COX-2通过其催化产物PGE2刺激肿瘤细胞的增殖[18]; 阻断细胞色素C释放, 抑制肿瘤细胞凋亡[19]; 上调bcl-2的表达, 增强AKt激酶介导通路抑制细胞凋亡[20]; 诱导肿瘤细胞产生PGE2、VEGF等, 促进肿瘤血管发生[21-22]; 活化基质金属酶(matrix metalloproteinases, MMP)-9[23],增加肿瘤细胞的侵袭力[24]; COX-2诱导P-糖蛋白表达, 导致肿瘤细胞耐药[19]. 选择性COX-2抑制剂可诱导高表达COX-2的肿瘤细胞凋亡, 抑制肿瘤血管发生、侵袭和转移, 并可与化疗药起协同作用, 说明COX-2是治疗肿瘤的一重要靶点[17,25-26]. BEL-7402强表达COX-2[27-28]. 我们发现2.0 μmol/L PAB作用24 h后, COX-2蛋白表达即明显减少, 同时吖啶橙染色和线粒体膜电位检测发现明显的凋亡征象, 说明PAB通过减少COX-2的表达, 诱导肿瘤细胞凋亡.
可见, PAB通过使细胞周期阻滞于G2/M期抑制BEL-7402细胞生长; 通过降低线粒体膜电位、减少COX-2蛋白表达诱导BEL-7402细胞凋亡. 但目前有关PAB抗肿瘤作用的研究较少, 且多为体外实验, 体内实验也仅限于动物; 有关其诱导凋亡, 抑制肿瘤血管发生的机制尚未完全明确, 不同学者的研究结论也不一致. Gong et al[29]的研究发现PAB通过活化HeLa细胞的c-Jun氨基端激酶(c-Jun N-terminal kinase, JNK)和caspase-3诱导细胞凋亡, JNK部分参与调整PAB引起的P53表达. Liu et al的研究发现PAB可以抑制小鼠体内移植瘤的生长; 通过上调p53, 下调Bcl-2, 活化caspase-3诱导体外培养的肿瘤细胞凋亡, 但Wong et al[1]认为PAB的细胞毒性与p53状态无关. 因此, 我们仍需深入研究PAB的抗肿瘤作用机制, 从而为肿瘤的治疗以及为中药的开发和临床应用提供更多的依据.
土槿皮是松科植物金钱松的根皮, 土槿皮乙酸(PAB)是土槿皮中主要的生物活性成分, 与雷公藤总甙同属于二萜类化合物. 近年来研究发现PAB可抑制胃癌、肺癌、结肠癌、宫颈癌及黑色素瘤等多种肿瘤细胞的增殖、诱导细胞凋亡, 抗肿瘤血管生成和抑制P-糖蛋白过表达引起的肿瘤耐药, 因此, 受到人们的广泛关注.
吴志勇, 教授, 上海交通大学医学院附属仁济医院普外科
PAB可抑制多种肿瘤细胞的增殖并诱导细胞凋亡, 但其具体机制尚不完全清楚, 并可能因为细胞类型的不同而存在差异.
Tong et al研究发现PAB作为一种新的微管蛋白结合剂, 通过不同于长春新碱和秋水仙素微管蛋白结合位点的直接作用, 可使微管蛋白解聚, 显著抑制人微血管内皮细胞的增殖、迁移和腔管形成, 而且可清除动物体内新形成的内皮腔管和微血管. 这说明PAB可以抑制肿瘤血管生成.
本研究收集不同浓度土槿皮乙酸处理24 h的BEL-7402细胞, 应用JC-1染色、流式细胞仪检测线粒体膜电位的变化, 发现随药物浓度的增加, 线粒体膜电位降低.
现代药理实验研究表明, 土槿皮乙酸具有抗肿瘤、抗生育、抗血管生成和抗真菌等作用, 具有广阔的应用前景.
本研究有新意, 方法适用, 论据充分, 结论可靠, 所引参考文献新, 内容广泛, 对PAB抑制肿瘤的研究有较高的价值.
编辑: 李军亮 电编:郭海丽
| 1. | Wong VK, Chiu P, Chung SS, Chow LM, Zhao YZ, Yang BB, Ko BC. Pseudolaric acid B, a novel microtubule-destabilizing agent that circumvents multidrug resistance phenotype and exhibits antitumor activity in vivo. Clin Cancer Res. 2005;11:6002-6011. [PubMed] |
| 2. | Li KS, Gu XF, Li P, Zhang Y, Zhao YS, Yao ZJ, Qu NQ, Wang BY. Effect of pseudolaric acid B on gastric cancer cells: inhibition of proliferation and induction of apoptosis. World J Gastroenterol. 2005;11:7555-7559. [PubMed] |
| 3. | Ko JK, Leung WC, Ho WK, Chiu P. Herbal diterpenoids induce growth arrest and apoptosis in colon cancer cells with increased expression of the nonsteroidal anti-inflammatory drug-activated gene. Eur J Pharmacol. 2007;559:1-13. [PubMed] |
| 4. | Gong X, Wang M, Wu Z, Tashiro S, Onodera S, Ikejima T. Pseudolaric acid B induces apoptosis via activation of c-Jun N-terminal kinase and caspase-3 in HeLa cells. Exp Mol Med. 2004;36:551-556. [PubMed] |
| 5. | Gong XF, Wang MW, Tashiro S, Onodera S, Ikejima T. Pseudolaric acid B induces apoptosis through p53 and Bax/Bcl-2 pathways in human melanoma A375-S2 cells. Arch Pharm Res. 2005;28:68-72. [PubMed] |
| 6. | Gong XF, Wang MW, Tashiro S, Onodera S, Ikejima T. Pseudolaric acid B induces human melanoma A375-S2 cell apoptosis in vitro. Zhongguo Zhongyao Zazhi. 2005;30:55-57. [PubMed] |
| 7. | Liu B, Chen H, Lei ZY, Yu PF, Xiong B. Studies on anti-tumour activities of pseudolaric acid-B (PLAB) and its mechanism of action. J Asian Nat Prod Res. 2006;8:241-252. [PubMed] |
| 8. | Tong YG, Zhang XW, Geng MY, Yue JM, Xin XL, Tian F, Shen X, Tong LJ, Li MH, Zhang C. Pseudolarix acid B, a new tubulin-binding agent, inhibits angiogenesis by interacting with a novel binding site on tubulin. Mol Pharmacol. 2006;69:1226-1233. [PubMed] |
| 9. | Sun MG, Williams J, Munoz-Pinedo C, Perkins GA, Brown JM, Ellisman MH, Green DR, Frey TG. Correlated three-dimensional light and electron microscopy reveals transformation of mitochondria during apoptosis. Nat Cell Biol. 2007;9:1057-1065. [PubMed] |
| 10. | Sareen D, Darjatmoko SR, Albert DM, Polans AS. Mitochondria, calcium, and calpain are key mediators of resveratrol-induced apoptosis in breast cancer. Mol Pharmacol. 2007;72:1466-1475. [PubMed] |
| 11. | van Ginkel PR, Sareen D, Subramanian L, Walker Q, Darjatmoko SR, Lindstrom MJ, Kulkarni A, Albert DM, Polans AS. Resveratrol inhibits tumor growth of human neuroblastoma and mediates apoptosis by directly targeting mitochondria. Clin Cancer Res. 2007;13:5162-5169. [PubMed] |
| 12. | She MR, Li JG, Du X, Lin W, Niu XQ, Guo KY. Involvement of mitochondria apoptotic pathway in the manumycin inducing apoptosis of U937 and HL-60. Zhonghua Xueyexue Zazhi. 2007;28:404-406. [PubMed] |
| 13. | Verma M, Singh SK, Bhushan S, Sharma VK, Datt P, Kapahi BK, Saxena AK. In vitro cytotoxic potential of Polyalthia longifolia on human cancer cell lines and induction of apoptosis through mitochondrial-dependent pathway in HL-60 cells. Chem Biol Interact. 2008;171:45-56. [PubMed] |
| 14. | Chen LH, Fang J, Li H, Demark-Wahnefried W, Lin X. Enterolactone induces apoptosis in human prostate carcinoma LNCaP cells via a mitochondrial-mediated, caspase-dependent pathway. Mol Cancer Ther. 2007;6:2581-2590. [PubMed] |
| 15. | Chen M, Guerrero AD, Huang L, Shabier Z, Pan M, Tan TH, Wang J. Caspase-9-induced mitochondrial disruption through cleavage of anti-apoptotic BCL-2 family members. J Biol Chem. 2007;282:33888-33895. [PubMed] |
| 16. | Wu T. Cyclooxygenase-2 in hepatocellular carcinoma. Cancer Treat Rev. 2006;32:28-44. [PubMed] |
| 17. | Nakamoto RH, Uetake H, Iida S, Kolev YV, Soumaoro LT, Takagi Y, Yasuno M, Sugihara K. Correlations between cyclooxygenase-2 expression and angiogenic factors in primary tumors and liver metastases in colorectal cancer. Jpn J Clin Oncol. 2007;37:679-685. [PubMed] |
| 18. | Park JW, Park JE, Lee JA, Lee CW, Kim CM. Cyclooxygenase-2 (COX-2) is directly involved but not decisive in proliferation of human hepatocellular carcinoma cells. J Cancer Res Clin Oncol. 2006;132:184-192. [PubMed] |
| 19. | Fantappie O, Solazzo M, Lasagna N, Platini F, Tessitore L, Mazzanti R. P-glycoprotein mediates celecoxib-induced apoptosis in multiple drug-resistant cell lines. Cancer Res. 2007;67:4915-4923. [PubMed] |
| 20. | Leng J, Han C, Demetris AJ, Michalopoulos GK, Wu T. Cyclooxygenase-2 promotes hepatocellular carcinoma cell growth through Akt activation: evidence for Akt inhibition in celecoxib-induced apoptosis. Hepatology. 2003;38:756-768. [PubMed] |
| 21. | Zhao QT, Yue SQ, Cui Z, Wang Q, Cui X, Zhai HH, Zhang LH, Dou KF. Potential involvement of the cyclooxygenase-2 pathway in hepatocellular carcinoma-associated angiogenesis. Life Sci. 2007;80:484-492. [PubMed] |
| 22. | Xie YH, Yuan MB. A relationship between cyclooxy-genase-2 expression and tumor angiogenesis in experimental rat liver carcinogenesis. Zhonghua Ganzangbng Zazhi. 2006;14:676-679. [PubMed] |
| 23. | Ishizaki T, Katsumata K, Tsuchida A, Wada T, Mori Y, Hisada M, Kawakita H, Aoki T. Etodolac, a selective cyclooxygenase-2 inhibitor, inhibits liver metastasis of colorectal cancer cells via the suppression of MMP-9 activity. Int J Mol Med. 2006;17:357-362. [PubMed] |
| 24. | Cervello M, Montalto G. Cyclooxygenases in hepatocellular carcinoma. World J Gastroenterol. 2006;12:5113-5121. [PubMed] |
| 25. | Yao M, Lam EC, Kelly CR, Zhou W, Wolfe MM. Cyclooxygenase-2 selective inhibition with NS-398 suppresses proliferation and invasiveness and delays liver metastasis in colorectal cancer. Br J Cancer. 2004;90:712-719. [PubMed] |
| 26. | Pan YY, Xu SP, Jia XY, Xu HQ, Zhang Y, Rui LX, Wei W. Combination of cyclooxygenase-2 inhibitor and doxorubicin increases the growth inhibition and apoptosis in human hepatocellular carcinoma cells. Exp Oncol. 2007;29:23-29. [PubMed] |
| 27. | Liu NB, Peng T, Pan C, Yao YY, Shen B, Leng J. Overexpression of cyclooxygenase-2 in human HepG2, Bel-7402 and SMMC-7721 hepatoma cell lines and mechanism of cyclooxygenase-2 selective inhibitor celecoxib-induced cell growth inhibition and apoptosis. World J Gastroenterol. 2005;11:6281-6287. [PubMed] |
| 28. | Li J, Chen X, Dong X, Xu Z, Jiang H, Sun X. Specific COX-2 inhibitor, meloxicam, suppresses proliferation and induces apoptosis in human HepG2 hepatocellular carcinoma cells. J Gastroenterol Hepatol. 2006;21:1814-1820. [PubMed] |
| 29. | Gong X, Wang M, Tashiro S, Onodera S, Ikejima T. Involvement of JNK-initiated p53 accumulation and phosphorylation of p53 in pseudolaric acid B induced cell death. Exp Mol Med. 2006;38:428-434. [PubMed] |