修回日期: 2008-03-05
接受日期: 2008-03-28
在线出版日期: 2008-04-08
目的: 探讨β-LPA体外抗乙型肝炎病毒(hepatitis B virus, HBV)的作用.
方法: 通过β-LPA干预培养HepG2.2.2.15细胞, ELISA法检测上清HBsAg和HBeAg, 32P标记HBV DNA为探针, Southern blot法检测细胞内的HBV DNA, 再以计算机图像处理进行定量分析, 得出50%抑制的药物浓度(ED50), 以MTT法检测不同浓度药物的细胞毒性, 求出50%细胞抑制的药物浓度(ID50).
结果: β-LPA体外明显抑制HBV DNA的复制, 并呈浓度依赖性. ED50为0.01 μmol/L, β-LPA细胞毒性实验显示ID50为50 μmol/L. 低浓度的β-LPA对上清HBsAg, HBeAg无明显影响, 高浓度时有显著的抑制作用.
结论: β-LPA具有明显的体外抑制病毒DNA复制作用, 且细胞毒性小.
引文著录: 陈婷, 何星星, 彭少华, 林菊生, 常莹, 刘丽凤. 核苷的亲脂性磷酸酰胺酯β-LPA体外抗乙型肝炎病毒的作用. 世界华人消化杂志 2008; 16(10): 1110-1113
Revised: March 5, 2008
Accepted: March 28, 2008
Published online: April 8, 2008
AIM: To explore the in vitro effects of a novel nucleoside analog (β-LPA) against hepatitis B virus (HBV).
METHODS: HepG2.2.2.15 cells were cultured and treated with various concentrations of β-LPA. Serum HBsAg and HBeAg were determined by enzyme-linked immunosorbent assay (ELISA). Intracelluar DNA was extracted and subjected to Southern blotting, hybridized with 32P-labeled HBV probe and autoradiographed. The intensity of the autoradiographic bands was quantified by densitometric scans of computer and ED50 value was calculated. Cytotoxicity with different concentrations of drugs was examined by methyl thiazolyl tetrazolium (MTT) method and ID50 value was calculated.
RESULTS: Autoradiographic bands showed that β-LPA inhibited the replication of HBV DNA in a dose-dependent manner. ED50 value was 0.01 μmol/L. Cytotoxicity experiment showed that the ID50 value of β-LPA was 50 μmol/L. The contents of HBsAg and HBeAg were decreased in a concentration-dependent manner. β-LPA at a low concentration had no marked effect on HBsAg and HBeAg in supernate.
CONCLUSION: β-LPA possesses potent inhibitory effect on the replication of HBV in vitro with little cytotoxicity.
- Citation: Chen T, He XX, Peng SH, Lin JS, Chang Y, Liu LF. In vitro effects of a novel nucleoside analog beta-LPA against hepatitis B virus. Shijie Huaren Xiaohua Zazhi 2008; 16(10): 1110-1113
- URL: https://www.wjgnet.com/1009-3079/full/v16/i10/1110.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i10.1110
乙型肝炎是一种全球性广泛传播的传染性疾病, 乙型肝炎病毒(hepatitis B virus, HBV)是引起慢性乙型肝炎(chronic hepatitis B virus, CHB)的最主要因素[1]. 尽管乙肝疫苗已应用多年[2-4], 据世界卫生组织调查结果, 全球大约有20亿人感染过或者正在感染HBV, 其中CHB患者约有3.5亿人. 每年死于乙肝相关性疾病约100万例[5]. CHB最终可能发展为肝硬化、肝癌[6-7], 所以慢性乙型肝炎是严重危害人类健康的一种疾病. 目前用干扰素或核苷类似物如拉米夫啶、阿德福韦等治疗慢性乙型肝炎, 疗效不理想, 特异性差, 易出现耐药性[8-10]. 因此, 研制和开发新的高效低毒的抗HBV药物已成为当务之急. 我们在体外HepG2.2.2.15细胞培养的基础上, 通过新型核苷类化合物核苷的亲脂性磷酸酰胺酯β-LPA干预, 探索β-LPA体外抗HBV的作用.
1 材料和方法
HepG2.2.2.15细胞引自美国Yale大学医学院, HepG2本室保存; P3.6Ⅱ质粒菌株由本室保存; DMEM干粉及胎牛血清(FBS)购自美国Gibco公司; β-LPA由武汉大学药学院辅助合成的化合物(核苷的亲脂性磷酸酰胺酯), 以磷酸盐缓冲液(PBS, pH7.4)溶解为21 mmol/L的贮存液; 拉米夫啶, ddc由美国Yale大学药学院Cheng教授提供, 以磷酸盐缓冲液(PBS, pH7.4)溶解为10 mmol/L的贮存液; 32P-dCTP购于中国同位素公司, 尼龙膜 (Hgbond-N+)购自Amersham Pharmacia Biotech; HBsAg, HBeAg的ELISA检测试剂盒购自上海科华公司; MTT购自瑞士Fluka公司; XbaⅠ和PstⅠ限制性内切酶均购自Fermenter公司, dNTP购自 Promega, G418(新霉素)、青霉素、链霉素、氨苄青霉素购自凌飞科技公司.
用含400 mg/L G418细胞培养基培养1 mo, 筛选出合乎要求的HepG2.2.2.15.将筛选出来HepG2.2.2.15细胞接种于12孔板, 细胞数为5×104/孔, 加培养液1 mL/孔, 培养液含100 mL/L胎牛血清、青霉素10万 U/L、链霉素100 mg/L. 接种后3 d换用含药培养液, 每个药物浓度点设2个平行孔, 同样条件下培养9 d, 每3 d换含药培养液1次, 以拉米夫啶为阳性对照组, 浓度为1 μmol/L; 设立阴性对照孔组, 即不加药物培养. HepG2细胞作为空白对照. 于12 d回收全部细胞. 机制试验设立β-LPA 1、0.1、0.01、0.001 μmol/L 等含药浓度点. 每孔加入上清液50 μL, 原液不做稀释, 按ELISA试剂盒说明进行HBsAg及HBeAg检测. 酶标仪450 nm波长读数(参考波长630 nm), 结果以P/N值表示, P/N值 = 标本A/阴性对照A值. 抑制率 = (未加药对照孔P/N值-实验孔P/N值)/(未加药对照孔P/N值-2.1)×100%.
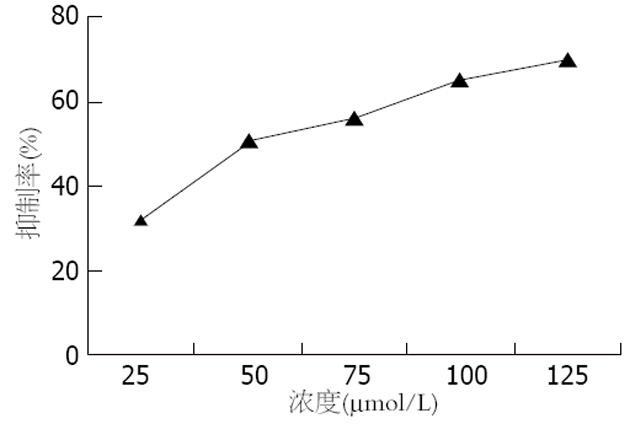
1.2.1 细胞毒性: HepG2.2.15细胞接种于96孔板, 1×104/孔, 每孔加入含100 mL/L胎牛血清的DMEM培养液200 μL, 置37℃、50 mL/L CO2温箱培养使细胞贴壁. 24 h后加入含不同浓度的药物培养基处理, 如拉米夫啶1 μmol/L、β-LPA 25、50、75、100、125 μmol/L, 同时设置调零孔(调零孔只加培养基、MTT、二甲基亚砜, 不加细胞)和对照孔(对照孔和加药孔都要加细胞、培养液、MTT、二甲基亚砜, 不同的是对照加溶解药物的介质, 而加药组加入不同浓度的药物), 每个浓度组设定3复孔, 3 d后回收全部细胞, 用MTT比色法检测细胞吸光度值, 与对照孔的吸光度值(存活细胞100%)比较, 计算存活细胞百分比, 并计算出半数抑制浓度(ID50).
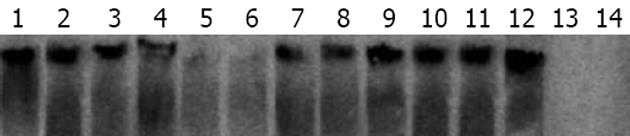
1.2.2 Southern印迹检测细胞内HBV DNA: 去上清液后, 收集12孔板每孔内的细胞, 按DNA抽提试剂盒操作说明, 提取细胞内总的DNA. 细胞内的DNA于8 g/L琼脂糖凝胶电泳, 尼龙膜印迹, 32P标记HBV DNA探针杂交, 2×SSC/0.5% SDS室温1 h, 0.1×SSC, 0.1% SDS, 65℃ 4 h洗膜、放射自显影. 显影条带经计算机图像处理进行定量分析, 求出50%抑制的药物浓度(ED50). 所有的试验重复三次.
统计学处理 所有数据采用mean±SD表示, 用单因数的方差分析, 数据分析在SPSS12.0完成. P<0.05有统计学意义.
2.1 HbsAg和HBeAg检测结果
β-LPA于低浓度时对HBsAg和HBeAg无明显抑制作用, 1 μmol/L时对两者有抑制作用(表1).
治疗剂量范围内细胞毒性小, 超大剂量检测可见细胞毒性, 并呈明显的浓度依赖性. 根据检测的A值, 计算出细胞生长抑制率(图1), 计算出ID50为50 μmo1/L.
细胞内HBV DNA印迹结果显示, 0.1 μmol/L β-LPA同1 μmol/L拉米夫啶的作用相当, 1 μmol/L β-LPA时, 几乎完全抑制HBV DNA的复制; β-LPA对细胞内HBV DNA的抑制呈现明显的量效关系(图2), 计算机图像处理分析, 以不加药空白对照组细胞内的HBV DNA灰度计为1, 测量出各组的灰度值, 再求出HBV DNA抑制百分率, 并绘出浓度与抑制率关系曲线, 最后分析出ED50为0.01 μmol/L.
HBV的感染在全球范围内是一个重要的社会公共卫生问题. 虽然, 正在应用的HBV疫苗对HBV感染的预防起到了一定的作用, 但是HBV感染仍然是医学界的一个棘手问题. 拉米夫啶在抗HBV治疗方面显示了良好的结果, 不仅能快速降低血清HBV滴度, 而且能长期的抑制病毒的复制, 有效改善患者的肝脏病变, 但是停药后的反弹和耐药株的出现, 仍然是有待解决的问题[11-12], 为新的核苷类化合物开发提出了迫切的需要[13].
β-LPA的量效关系研究显示, β-LPA处理后, 细胞内的HBV DNA得到明显的抑制, 并呈现明显的剂量依赖性, 利用图像处理软件ImageTool(IT)3.0进行灰度分析得ED50为0.01 μmol/L. 同拉米夫啶相比较, β-LPA具有相似的高效抑制HBV DNA复制作用. 细胞毒性实验显示, 治疗剂量无明显细胞抑制作用, 超大剂量实验获得50%细胞抑制浓度, 即ID50为50 μmol/L. 治疗指数(therapeuticindex, TI) = ID50/ED50, β-LPA的TI为5000. 以往实验报道拉米夫啶的TI为750. 可见, β-LPA具有强效抑制HBV病毒复制作用, 并具有更高的治疗指数. β-LPA不仅在病毒的复制水平上对HBV DNA有抑制作用, 同时在翻译水平上也有一定的抑制作用. 目前治疗乙型肝炎没有完全有效的方法, 干扰素和核苷类似物都有不同程度的缺陷[14-15]. 我们在国内合成的新的核苷类化合物β-LPA, 显示良好的势头, 作为新一类核苷类化合物, 同拉米夫啶相比较, β-LPA具有相类似的高效抑制HBV DNA复制作用, 细胞毒性小, 可望成为有效的抗HBV类药物, 也有望联合用药提高疗效或缩短用药疗程, 并减少变异株与耐药株的出现.
乙型肝炎病毒(HBV)感染是一个严重的全球性问题. 尽管乙肝疫苗、干扰素及核苷类化合物已应用于抗HBV, 但效果均不理想. 全世界60亿人口中, 仍约有3.5亿人感染HBV, 其中25%-40% HBV慢性感染者最终将发展为肝硬化和肝细胞癌. 每年死于乙型肝炎相关性疾病约100万例.
党双锁, 副教授, 西安交通大学第二医院感染科
近年来, 国际上抗HBV药物研究的趋势之一是对核苷类化合物的研制, 如拉米夫啶、阿德福韦、恩替卡韦、克拉夫啶等, 但在应用中均有产生耐药株与变异株的局限, 基于目前现状, 研制高效低毒、无药物反弹的新核苷类药物已迫在眉睫.
本文以β-LPA干预培养HepG2.2.2. 15细胞, ELISA法检测上清HBsAg, HBeAg; 32P标记HBV DNA为探针, Southern印迹法检测细胞内的HBV DNA, 探索β-LPA体外抗HBV的作用. 这对于研制和开发新型抗HBV药物可能是一个新的研究方向.
β-LPA具有高效低毒的抗HBV作用, 有望成为新的抗HBV药物.
本文实验设计合理, 方法得当, 结果可靠, 有重要的参考价值, 是一篇有较高质量的论文.
编辑: 潘伯荣 电编:何基才
| 1. | O'Connor JA. Acute and chronic viral hepatitis. Adolesc Med. 2000;11:279-292. [PubMed] |
| 2. | Sun Z, Ming L, Zhu X, Lu J. Prevention and control of hepatitis B in China. J Med Virol. 2002;67:447-450. [PubMed] [DOI] |
| 3. | Kao JH, Chen DS. Global control of hepatitis B virus infection. Lancet Infect Dis. 2002;2:395-403. [PubMed] [DOI] |
| 4. | Robertson SE, Mayans MV, El-Husseiny A, Clemens JD, Ivanoff B. The WHO Vaccine Trial Registry. Vaccine. 2001;20:31-41. [PubMed] [DOI] |
| 5. | Shlomai A, Shaul Y. Inhibition of hepatitis B virus expression and replication by RNA interference. Hepatology. 2003;37:764-770. [PubMed] [DOI] |
| 6. | Beasley RP. Hepatitis B virus. The major etiology of hepatocellular carcinoma. Cancer. 1988;61:1942-1956. [PubMed] [DOI] |
| 7. | Liaw YF. Therapy of chronic hepatitis B: current challenges and opportunities. J Viral Hepat. 2002;9:393-399. [PubMed] [DOI] |
| 8. | Dienstag JL, Cianciara J, Karayalcin S, Kowdley KV, Willems B, Plisek S, Woessner M, Gardner S, Schiff E. Durability of serologic response after lamivudine treatment of chronic hepatitis B. Hepatology. 2003;37:748-755. [PubMed] [DOI] |
| 9. | Marcellin P, Chang TT, Lim SG, Tong MJ, Sievert W, Shiffman ML, Jeffers L, Goodman Z, Wulfsohn MS, Xiong S. Adefovir dipivoxil for the treatment of hepatitis B e antigen-positive chronic hepatitis B. N Engl J Med. 2003;348:808-816. [PubMed] [DOI] |
| 10. | Gwak GY, Huh W, Lee DH, Choi MS, Lee JH, Koh KC, Kim SJ, Joh JW, Oh HY. The incidence and clinical outcome of YMDD mutants in hepatitis B surface antigen-positive renal allograft recipients after prolonged lamivudine therapy. Transplant Proc. 2007;39:3121-3126. [PubMed] [DOI] |
| 11. | Lai CL, Ching CK, Tung AK, Li E, Young J, Hill A, Wong BC, Dent J, Wu PC. Lamivudine is effective in suppressing hepatitis B virus DNA in Chinese hepatitis B surface antigen carriers: a placebo-controlled trial. Hepatology. 1997;25:241-244. [PubMed] [DOI] |
| 12. | Tipples GA, Ma MM, Fischer KP, Bain VG, Kneteman NM, Tyrrell DL. Mutation in HBV RNA-dependent DNA polymerase confers resistance to lamivudine in vivo. Hepatology. 1996;24:714-717. [PubMed] [DOI] |
| 13. | Pillay D, Taylor S, Richman DD. Incidence and impact of resistance against approved antiretroviral drugs. Rev Med Virol. 2000;10:231-253. [PubMed] [DOI] |
| 14. | Wong DK, Cheung AM, O'Rourke K, Naylor CD, Detsky AS, Heathcote J. Effect of alpha-interferon treatment in patients with hepatitis B e antigen-positive chronic hepatitis B. A meta-analysis. Ann Intern Med. 1993;119:312-323. [PubMed] [DOI] |
| 15. | Manns MP. Current state of interferon therapy in the treatment of chronic hepatitis B. Semin Liver Dis. 2002;22 Suppl 1:7-13. [PubMed] [DOI] |