修回日期: 2008-03-05
接受日期: 2008-03-28
在线出版日期: 2008-04-08
目的: 探讨非酒精性脂肪性肝病中肝细胞胆固醇(TC)代谢的相关变化.
方法: 正常成人肝细胞株HL-02, 以油酸软脂酸诱导肝细胞产生脂肪变性, 建立肝细胞脂肪变性模型. 分别于实验12、24、48 h收集细胞, 同期设不含脂肪酸培养的细胞作对照. 油红O染色观察细胞内脂滴变化; 试剂盒检测细胞内三酯酰甘油(TG)和TC含量的变化情况, RT-PCR分别检测表达固醇调节元件结合蛋白2(SREBP-2), 其靶基因羟甲基戊二酸单酰辅酶A还原酶(HMGCR)、低密度脂蛋白受体(LDLR)及TC 7a羟化酶(CYP7a1)的基因mRNA变化.
结果: 油酸软脂酸诱导12 h即可产生肝细胞脂肪变性, 24 h及48 h脂肪变性逐渐加重. 随造模时间延长, 模型组细胞内TG、TC含量逐渐增多, 且均显著高于对照组(TG: 16.93±1.57 mg/g, 23.67±2.4 mg/g, 51.1±11.76 mg/g vs 8.43±5.65 mg/g; TC: 14.9±0.6, 23.7±1.1 mg/g, 38.4±4.5 mg/g vs 8.5±1.6 mg/g; 均P<0.01); SREBP-2, HMGCR mRNA表达逐渐升高(SREBP-2 mRNA: 1.2972±0.16, 1.6141±0.21, 2.0368±0.27 vs 1.0±0.11; HMGCR mRNA: 1.0311±0.15, 1.2706±0.28, 1.3954±0.32 vs 1.0±0.12; 均P<0.05), 而LDLR、CYP7α1 mRNA表达逐渐下降(LDLR mRNA: 0.8901±0.22, 0.7846±0.18, 0.6912±0.09 vs 1.0±0.24; CYP7α1 mRNA: 0.9726±0.27, 0.6707±0.18, 0.5659±0.16 vs 1.0±0.19; 均P<0.05).
结论: 肝细胞脂变后细胞内TC含量增加, 其合成基因表达升高及代谢基因表达降低可能是其机制; LDLR mRNA表达降低.
引文著录: 田艳, 范竹萍, 邱德凯, 丁佳, 刘俊平, 高艳敏. 脂肪变性对肝细胞胆固醇代谢的影响. 世界华人消化杂志 2008; 16(10): 1031-1036
Revised: March 5, 2008
Accepted: March 28, 2008
Published online: April 8, 2008
AIM: To investigate the changes of cholesterol metabolism in nonalcoholic fatty liver disease.
METHODS: Steatosis model of hepatocytes was established by adding palmic acid and oleic acid to HL-02 cells. Cells were collected at 12, 24 and 48 h. HL-02 cells without adding palmic acid served as controls. Oil red O staining was used to observe the intracellular changes of lipid drops. The intracellular triglyceride (TG) and total cholesterol were detected using analysis kit. The expression changes of sterol regulatory element-binding protein 2 (SREBP-2), hydroxymethylglutaryl-CoA reductase (HMGCR), low density lipoprotein receptor (LDLR) and cholesterol 7alpha-hydroxylase (CYP7A1) were measured by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Hepatocyte steatosis was observed at 12 h, and became more serious at 24 and 48 h. The contents of intracellular TG and TC increased, significantly higher than those in controls (TG: 16.93 ± 1.57 mg/g, 23.67 ± 2.4 mg/g, 51.1 ± 11.76 mg/g vs 8.43 ± 5.65 mg/g; TC: 14.9 ± 0.6 mg/g, 23.7 ± 1.1 mg/g, 38.4 ± 4.5 mg/g vs 8.5 ± 1.6 mg/g, all P < 0.01). The expression levels of SREBP-2 and HMGCR were up-regulated (SREBP-2 mRNA: 1.2972 ± 0.16, 1.6141 ± 0.21, 2.0368 ± 0.27 vs 1.0 ± 0.11; HMGCR mRNA: 1.0311 ± 0.15, 1.2706 ± 0.28, 1.3954 ± 0.32 vs 1.0 ± 0.12; all P < 0.05) while those of LDLR and CYP7A1 (LDLR mRNA: 0.8901 ± 0.22, 0.7846 ± 0.18, 0.6912 ± 0.09 vs 1.0 ± 0.24; CYP7a1 mRNA: 0.9726 ± 0.27, 0.6707 ± 0.18, 0.5659 ± 0.16 vs 1.0 ± 0.19; all P < 0.05) were down-regulated in a time-dependent manner in model group.
CONCLUSION: Cholesterol contents increase in steatotic hepatocytes, which may be caused by elevated gene expression of SREBP-2 and HMGCR as well as reduced expression of LDLR and CYP7A1.
- Citation: Tian Y, Fan ZP, Qiu DK, Ding J, Liu JP, Gao YM. Cholesterol metabolism in cultured steatotic hepatocytes. Shijie Huaren Xiaohua Zazhi 2008; 16(10): 1031-1036
- URL: https://www.wjgnet.com/1009-3079/full/v16/i10/1031.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i10.1031
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)为代谢综合征(metabolic syndrome, MeS)的肝脏表现[1-2], 近年来发病率逐步增加. 最新的大规模临床调查研究显示, NAFLD是心血管疾病(cardiovascular disease, CVD)的强烈预测指标, 是CVD的独立危险因素, NAFLD患者的CVD发生率显著升高[3]. 因此, NAFLD不仅仅是CVD的一个征兆, 而且是促进其发生的重要环节[4]. 目前对NAFLD患者肝脏胆固醇(TC)代谢变化及其机制的研究鲜有报道, 阐明其变化有助于理解NAFLD高TC血症的发生机制, 并可为临床治疗提供新思路. 本文旨在通过建立非酒精性脂变肝细胞模型, 在细胞水平, 研究NAFLD中肝细胞TC代谢及其相关基因的变化.
正常成人肝细胞株HL-02购自中科院上海细胞生物研究所, RPMI 1640培养基为Gibco公司产品, 胎牛血清为北京鼎国生物技术有限公司产品, 软脂酸(palmitic acid)、油酸(oleic acid)、胰蛋白酶、HEPES、细胞裂解液为Sigma公司产品, 油红O试剂购自上海迈坤化工有限公司, 甘油三酯(TG)及TC检测试剂盒购自南京建成生物工程研究所, 逆转录试剂盒为Fermentas公司产品, Taq DNA聚合酶为TaKaRa公司产品, 其他试剂为国产分析纯. 引物采用Oligo6软件设计, 上海生工生物工程公司合成.
实验共分4组, 包括正常对照组, 油酸软脂酸2∶1混合(以下简称OP液)终浓度为0.5 mmol/L分别干预12、24、48 h. 分组如下: Control组, 含100 mL/L胎牛血清1640培养液培养; OP1组, OP2组和OP3组, OP液0.5 mmol/L分别作用12、24和48 h. 用含100 mL/L胎牛血清的RPMI 1640培养液, 于含50 mL/L二氧化碳、950 mL/L空气的孵箱中, 在37℃、95%湿度条件下培养. 隔天换液, 待细胞生长至80%-90%密度时用2.5 g/L胰蛋白酶消化, 按1∶3比例传代. 肝细胞接种于培养瓶, 常规传代培养, 取对数生长期细胞接种于六孔培养板进行实验. 实验前用无血清的RPMI 1640培养24 h, 使细胞周期同步化. 参照Gómez-Lechón et al[5]方法, 以油酸软脂酸2∶1比例混合, 终浓度为0.5 mmol/L, 孵育细胞分别为12、24、48 h, 诱导肝细胞脂肪变性. 每组设6个复孔.
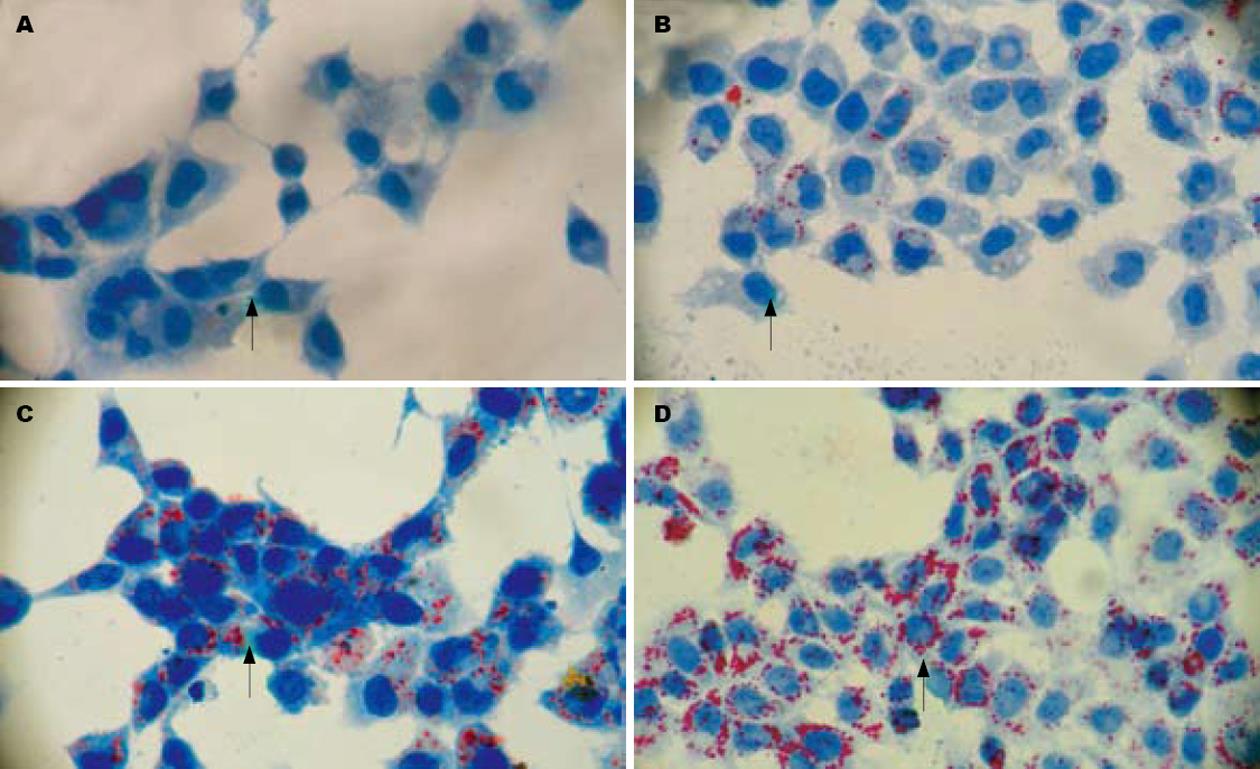
1.2.1 细胞内脂滴的变化: 细胞培养于放有无菌盖玻片的六孔培养板内, 各组予相应处理后, PBS漂洗3次; 40 g/L多聚甲醛固定30 min; 双蒸水漂洗2次; 油红O染液室温染色30 min, 双蒸水漂洗2次; 苏木素染色; 清水漂洗. 取出盖玻片置于载玻片上, 明胶甘油封片、晾干. 于倒置显微镜下观察细胞内橘红色脂滴形成情况.
1.2.2 细胞内TG和TC含量的测定: 胰酶消化收集细胞, 离心并PBS冲洗后. 加入细胞裂解液, 震荡, 冰上放置30 min, 细胞充分裂解后, 4℃离心14 000 r/min, 10 min. 取一部分上清在分光光度计下测量蛋白含量, 其余上清加异丙醇萃取后, 使用相应试剂盒测定TG和TC含量.
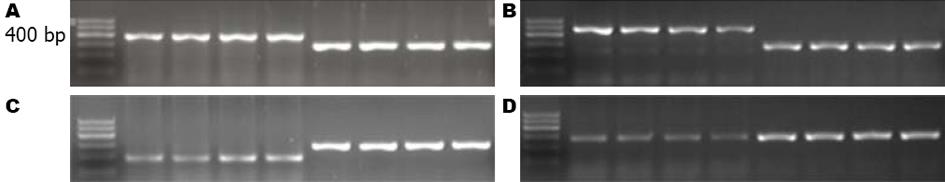
1.2.3 基因mRNA表达的测定: PBS冲洗细胞2遍, 加入TRIzol试剂1 mL/孔提取细胞总RNA, 经电泳分析其完整性, 紫外分光光度计测纯度并定量. 显示28S亚基RNA含量为18S亚基RNA的2倍, 且A260/A280比值范围在1.7-1.9, 说明所提取RNA质量好且纯度高. RNA-70℃保存. 引物设计见表1. RT-PCR反应体系均为25 μL, 反应条件为94℃预变性5 min, 94℃变性30 s, 退火温度30 s, 72℃延伸40 s, 30个循环. 扩增产物琼脂糖凝胶电泳. EPSON Perfection 2480 Photo扫描仪(爱普生公司产品)扫描条带, 以SmartView2000生物电泳图像分析软件(上海复日科技有限公司产品)得到图像储存入电脑. 使用Image J图像分析软件对条带密度进行A定量分析, 与标准化的β-actin条带A定量值作对比, 测定其表达情况.
| 基因 | 引物序列 | 引物长度(bp) | 退火温度(℃) |
| β-actin | 上游: agcgagcatcccccaaagtt | 285 | 54 |
| 下游: gggcacgaaggctcatcatt | |||
| SREBP-2 | 上游: gccacctgcccctctccttcc | 390 | 65 |
| 下游: tgccctgccacctatcctctcacg | |||
| HMGCR | 上游: taggaggctacaacgcccat | 184 | 54 |
| 下游: ccacccaccgttcctatctc | |||
| LDLR | 上游: cttgagttcaggagttggagac | 487 | 59 |
| 下游: ctatctgtacagggacgcattt | |||
| CYP7α1 | 上游: ttctatatccaaaattcagggc | 283 | 54 |
| 下游: ggctatttccatccagttttaa |
统计学处理 各组数据以mean±SD表示, 采用SPSS12.0统计学软件进行统计学分析. 各组数据间比较采用单因素方差分析(One-way ANOVA), P<0.05为有统计学意义.
油红O染色, 对照组细胞内未见明显脂滴, 12、24和48 h OP液处理组细胞均见有大小不等的橘红色脂滴聚集, 明显多于对照组; 脂滴密度随作用时间延长而递增. 表明成功建立了肝细胞脂肪变性模型, 随着OP液作用时间延长, 肝细胞脂肪变性程度加重(图1). 软脂酸处理组细胞内TG和TC含量较对照组增加, 并随OP液作用时间延长而相应增多. OP1组细胞内TG含量显著高于对照组(P<0.05), TC含量略高于对照组(P>0.05), 但差异无统计学意义; OP2组细胞内TG和TC含量均显著高于OP1组(P值均<0.05)和对照组(P值均<0.05)(表2). 细胞内TG含量较对照组显著增多进一步验证了肝细胞脂肪变性模型的建立(对照组TG、TC取12、24和48 h的均值).
流行病学和临床证据表明, NAFLD有潜在的CVD危险性: NAFLD与冠状动脉病的发生与程度存在独立相关. NAFLD是心血管疾病强有力的预测因子, 可能是代谢综合征心血管危险因素的中心环节[6]. 但是否NAFLD能引起CVD, 或者两者是否有共同的致病机制仍需要进一步研究. 高TC血症是心血管疾病的主要危险因素, 与冠心病的发病率及死亡率呈明显的正相关[7]. MS/NAFLD共同的发病病理基础是胰岛素抵抗(insulin resistance, IR), IR可导致血脂变化, 血甘油三酯、极低密度脂蛋白胆固醇、低密度脂蛋白胆固醇升高, 高密度脂蛋白胆固醇降低, 表现为高甘油三酯血症(hypertriglyceridemia)和/或高胆固醇血症(hypercholesterolemia)[8-9]. 后者可引起心脑血管疾病等多种并发症, 危害较大, 逐渐引起临床治疗的重视. 肝脏是三大物质代谢的主要器官, 在人体的物质能量平衡中起到中心作用, 而肝细胞是肝脏的功能细胞, 在脂质代谢中的作用举足轻重. 我们以油酸软脂酸诱导建立肝细胞脂肪变性模型, 在细胞水平初步研究TC代谢通路相关基因的表达变化发现, 脂肪变性肝细胞存在TC代谢紊乱, 肝细胞内TC含量增加; TC代谢相关基因固醇调节元件结合蛋白-2(sterol regulatory element binding protein-2, SREBP-2)及其靶基因羟甲基戊二酸单酰辅酶(hydroxymethylglutaryl CoA reductase, HMGCR)mRNA表达上调, 但低密度脂蛋白受体(low density lipoprotein receptor, LDLR)、TC 7α羟化酶(CYP7a1)mRNA表达下调, 并随脂肪变性程度而更为明显. 提示肝细胞脂变引起TC代谢相关基因变化, 并且可能是造成高胆固醇血症的原因. 该研究结果对探讨NAFLD在心血管病发生发展中的重要性中有一定意义.
肝细胞对FFA的摄入与其存在的浓度差和转运受体有关, 而与非酒精性脂肪肝形成有关的更重要的是血清中游离脂肪酸的浓度[10]. 油酸与软脂酸是正常人肝脏及NAFLD患者肝脏中存在最普遍的两种脂肪酸. 使用油酸和软脂酸(oleate/palmitate, 2∶1)对肝细胞作用, 对肝细胞造成慢性损伤, 与体内非酒精性脂肪肝的慢性肝脂变更相似[5,11]. 我们使用油酸软脂酸2∶1比例造成非酒精性肝细胞脂变模型. 血清TC的量受到合成和吸收两方面的影响, 其生成来源于由肝脏生成的VLDL. VLDL代谢转化为LDL. LDL是人血液中运输胆固醇的主要脂蛋白. 引起动脉粥样硬化及冠心病的原因有很多, 血清LDL浓度升高是其中一个最重要的因素[12-13]. LDL在各组织中的清除主要通过两条途径: 一是依赖细胞表面受体(LDLR)介导的内吞作用, 然后在溶酶体代谢[14-15]; 二是非依赖受体的液相内吞作用[16]. 其中LDLR途径占总LDL清除的70%-80%, 并且这一途径主要存在于肝脏[17-23]. 因此, 血清LDL的变化与肝细胞密切相关.
SREBP-2作为一种特异的核转录因子在TC代谢调控中起重要作用. SREBP-2是存在于内质网的核转录因子, 通过转基因和基因敲除小鼠的研究发现, SREBP-2在TC的合成代谢调控中起重要作用[24]. SREBP-2主要调控TC合成通路相关基因的表达, 其靶基因包括TC相关的一系列酶: HMGCR以及HMGCoA合成酶、法尼酰焦磷酸合成酶和鲨烯合成酶, 此外还介导外源性TC摄取受体LDLR转录. SREBP-2的靶基因HMGCR是TC合成的限速酶, 在TC的合成代谢中起重要作用. HMGCR活性增高可使肝脏合成TC增多, 胆汁中TC饱和指数上升[25]. SREBP-2的另一靶基因LDLR则是在外源性TC的摄入中起关键作用, LDLR的活性还可以受细胞TC和水平的影响. 有文章显示在肝细胞有关脂代谢的基因中, 各基因对不同影响因素的敏感性不同, 包括营养因素、防御因素及应激因素[26]. 本实验中, 模型组SREBP-2和LDLR的表达较对照组变化不一致, 可能与他们对不同影响因素的敏感性有关. CYP7a1基因编码TC7a羟化酶, 胆汁酸是TC排泄的基本通路, 胆固醇7a羟化酶是其中的关键酶. Pullinger et al[27]发现CYP7a1基因突变会造成血液中LDL-C明显升高, 提出CYP7A1单基因突变即可引起高脂血症. Gylling et al[28]对74位诊断为MS的患者进行研究, 发现与正常对照组比较, 胆固醇的合成大于吸收. 有研究发现, 在初发轻度高胆固醇血症中血清胆固醇水平更主要是因为胆固醇较高的吸收率[29]. 然而, 在肥胖、高血糖、胰岛素抵抗这些状态下, 与正常对照组相比, 胆固醇的合成更高而吸收较低[30-32].
总之, 脂肪酸诱导的肝细胞脂变, 同时存在细胞内TC增多, 其机制有基因调节的参与, 即TC合成相关基因表达增加而转化相关基因表达降低. 而且, LDLR mRNA表达下降, 提示NAFLD的肝细胞对血TC清除能力降低. 以上结果提示NAFLD可能存在肝细胞合成TC增加, 但清除血TC减少. 本文在脂代谢方面, 初步探讨NAFLD肝细胞TC代谢变化及其机制, 更深入的机制还需进一步研究.
随着非酒精性脂肪肝(NAFLD)患病率的增加, NAFLD成为国内外关注的疾病. 其发病病理基础是胰岛素抵抗(IR), 导致血脂变化. 尤其高胆固醇血症, 可引起心脑血管疾病等多种并发症, 危害较大, 逐渐引起临床治疗的重视.
党双锁, 副教授, 西安交通大学第二医院感染科
胆固醇代谢的异常可引起心脑血管疾病等多种并发症, 危害较大, 逐渐引起临床治疗的重视.
Helena et al发现代谢综合征状态下, 胆固醇合成比吸收的增加占更主要的地位, 而且血清葡萄糖与甘油三酯水平与胆固醇代谢有相关性.
本文有助于了解MS/NAFLD脂质代谢紊乱机制并为临床治疗提供理论基础.
本文图片清晰, 方法先进, 合理, 是一篇好的论文.
编辑: 潘伯荣 电编:何基才
| 1. | Marchesini G, Brizi M, Bianchi G, Tomassetti S, Bugianesi E, Lenzi M, McCullough AJ, Natale S, Forlani G, Melchionda N. Nonalcoholic fatty liver disease: a feature of the metabolic syndrome. Diabetes. 2001;50:1844-1850. [PubMed] [DOI] |
| 2. | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37:1202-1219. [PubMed] [DOI] |
| 3. | Arslan U, Türkoğlu S, Balcioğlu S, Tavil Y, Karakan T, Cengel A. Association between nonalcoholic fatty liver disease and coronary artery disease. Coron Artery Dis. 2007;18:433-436. [PubMed] [DOI] |
| 4. | Targher G. Non-alcoholic fatty liver disease, the metabolic syndrome and the risk of cardiovascular disease: the plot thickens. Diabet Med. 2007;24:1-6. [PubMed] [DOI] |
| 5. | Gómez-Lechón MJ, Donato MT, Martínez-Romero A, Jiménez N, Castell JV, O'Connor JE. A human hepatocellular in vitro model to investigate steatosis. Chem Biol Interact. 2007;165:106-116. [PubMed] [DOI] |
| 6. | Targher G, Arcaro G. Non-alcoholic fatty liver disease and increased risk of cardiovascular disease. Atherosclerosis. 2007;191:235-240. [PubMed] [DOI] |
| 7. | Kannel WB, Dawber TR, Kagan A, Revotskie N, Stokes J 3rd. Factors of risk in the development of coronary heart disease--six year follow-up experience. The Framingham Study. Ann Intern Med. 1961;55:33-50. [PubMed] [DOI] |
| 8. | Rader DJ. Effect of insulin resistance, dyslipidemia, and intra-abdominal adiposity on the development of cardiovascular disease and diabetes mellitus. Am J Med. 2007;120:S12-S18. [PubMed] [DOI] |
| 9. | Bansilal S, Farkouh ME, Fuster V. Role of insulin resistance and hyperglycemia in the development of atherosclerosis. Am J Cardiol. 2007;99:6B-14B. [PubMed] |
| 10. | Cupp D, Kampf JP, Kleinfeld AM. Fatty acid-albumin complexes and the determination of the transport of long chain free fatty acids across membranes. Biochemistry. 2004;43:4473-4481. [PubMed] [DOI] |
| 11. | Feldstein AE, Werneburg NW, Canbay A, Guicciardi ME, Bronk SF, Rydzewski R, Burgart LJ, Gores GJ. Free fatty acids promote hepatic lipotoxicity by stimulating TNF-alpha expression via a lysosomal pathway. Hepatology. 2004;40:185-194. [PubMed] [DOI] |
| 12. | Havel RJ. The formation of LDL: mechanisms and regulation. J Lipid Res. 1984;25:1570-1576. [PubMed] |
| 13. | NIH Consensus Development Conference. Lowering blood cholesterol to prevent heart disease. Wis Med J. 1985;84:18-19. [PubMed] |
| 14. | Goldstein JL, Anderson RG, Brown MS. Coated pits, coated vesicles, and receptor-mediated endocytosis. Nature. 1979;279:679-685. [PubMed] [DOI] |
| 15. | Brown MS, Goldstein JL. A receptor-mediated pathway for cholesterol homeostasis. Science. 1986;232:34-47. [PubMed] [DOI] |
| 16. | Scharschmidt BF, Lake JR, Renner EL, Licko V, Van Dyke RW. Fluid phase endocytosis by cultured rat hepatocytes and perfused rat liver: implications for plasma membrane turnover and vesicular trafficking of fluid phase markers. Proc Natl Acad Sci U S A. 1986;83:9488-9492. [PubMed] [DOI] |
| 17. | Bilheimer DW, Watanabe Y, Kita T. Impaired receptor-mediated catabolism of low density lipoprotein in the WHHL rabbit, an animal model of familial hypercholesterolemia. Proc Natl Acad Sci U S A. 1982;79:3305-3309. [PubMed] [DOI] |
| 18. | Pittman RC, Carew TE, Attie AD, Witztum JL, Watanabe Y, Steinberg D. Receptor-dependent and receptor-independent degradation of low density lipoprotein in normal rabbits and in receptor-deficient mutant rabbits. J Biol Chem. 1982;257:7994-8000. [PubMed] |
| 19. | Steinbrecher UP, Witztum JL, Kesaniemi YA, Elam RL. Comparison of glucosylated low density lipoprotein with methylated or cyclohexanedione-treated low density lipoprotein in the measurement of receptor-independent low density lipoprotein catabolism. J Clin Invest. 1983;71:960-964. [PubMed] [DOI] |
| 20. | Spady DK, Turley SD, Dietschy JM. Receptor-independent low density lipoprotein transport in the rat in vivo. Quantitation, characterization, and metabolic consequences. J Clin Invest. 1985;76:1113-1122. [PubMed] [DOI] |
| 21. | Spady DK, Bilheimer DW, Dietschy JM. Rates of receptor-dependent and -independent low density lipoprotein uptake in the hamster. Proc Natl Acad Sci U S A. 1983;80:3499-3503. [PubMed] [DOI] |
| 22. | Spady DK, Huettinger M, Bilheimer DW, Dietschy JM. Role of receptor-independent low density lipoprotein transport in the maintenance of tissue cholesterol balance in the normal and WHHL rabbit. J Lipid Res. 1987;28:32-41. [PubMed] |
| 23. | Bilheimer DW, Goldstein JL, Grundy SM, Starzl TE, Brown MS. Liver transplantation to provide low-density-lipoprotein receptors and lower plasma cholesterol in a child with homozygous familial hypercholesterolemia. N Engl J Med. 1984;311:1658-1664. [PubMed] [DOI] |
| 24. | Horton JD, Shah NA, Warrington JA, Anderson NN, Park SW, Brown MS, Goldstein JL. Combined analysis of oligonucleotide microarray data from transgenic and knockout mice identifies direct SREBP target genes. Proc Natl Acad Sci U S A. 2003;100:12027-12032. [PubMed] [DOI] |
| 25. | Roglans N, Vázquez-Carrera M, Alegret M, Novell F, Zambón D, Ros E, Laguna JC, Sánchez RM. Fibrates modify the expression of key factors involved in bile-acid synthesis and biliary-lipid secretion in gallstone patients. Eur J Clin Pharmacol. 2004;59:855-861. [PubMed] [DOI] |
| 26. | Day CP. Genes or environment to determine alcoholic liver disease and non-alcoholic fatty liver disease. Liver Int. 2006;26:1021-1028. [PubMed] [DOI] |
| 27. | Pullinger CR, Eng C, Salen G, Shefer S, Batta AK, Erickson SK, Verhagen A, Rivera CR, Mulvihill SJ, Malloy MJ. Human cholesterol 7alpha-hydroxylase (CYP7A1) deficiency has a hypercholesterolemic phenotype. J Clin Invest. 2002;110:109-117. [PubMed] [DOI] |
| 28. | Gylling H, Hallikainen M, Kolehmainen M, Toppinen L, Pihlajamäki J, Mykkänen H, Agren JJ, Rauramaa R, Laakso M, Miettinen TA. Cholesterol synthesis prevails over absorption in metabolic syndrome. Transl Res. 2007;149:310-316. [PubMed] [DOI] |
| 29. | Miettinen TA, Strandberg TE, Gylling H. Noncholesterol sterols and cholesterol lowering by long-term simvastatin treatment in coronary patients: relation to basal serum cholestanol. Arterioscler Thromb Vasc Biol. 2000;20:1340-1346. [PubMed] [DOI] |
| 30. | Simonen P, Gylling H, Howard AN, Miettinen TA. Introducing a new component of the metabolic syndrome: low cholesterol absorption. Am J Clin Nutr. 2000;72:82-88. [PubMed] |
| 31. | Simonen PP, Gylling HK, Miettinen TA. Diabetes contributes to cholesterol metabolism regardless of obesity. Diabetes Care. 2002;25:1511-1515. [PubMed] [DOI] |
| 32. | Pihlajamäki J, Gylling H, Miettinen TA, Laakso M. Insulin resistance is associated with increased cholesterol synthesis and decreased cholesterol absorption in normoglycemic men. J Lipid Res. 2004;45:507-512. [PubMed] [DOI] |