修回日期: 2007-12-22
接受日期: 2007-12-25
在线出版日期: 2008-01-08
目的: 观察RNA干扰供体Lewis大鼠库普弗细胞(KC)B7分子表达对受体BN大鼠淋巴细胞增殖和生成IL-2的影响.
方法: 分离培养供体Lewis大鼠KC, 设计大鼠B7分子的干扰片段, 构建并鉴定含B7干扰片段的RNA干扰载体Psilencer 3.1H1-Neo-B7, 将RNA干扰载体转染供体大鼠的KC, 转染后采用RT-PCR方法检测KC上B7分子表达的变化. 将转染后的KC分为3组, 对照组(A); 空载体组(B); RNA干扰B7表达组(C). 分离培养受体BN大鼠的淋巴细胞, 将以上各组细胞分别与BN大鼠的淋巴细胞进行共培养, 采用MTT法检测各组淋巴细胞的增殖情况. 采用ELISA方法检测各组培养上清中IL-2的含量.
结果: 分离培养的供体Lewis大鼠KC得率为5×107, 活率大于98%. 构建的RNA干扰载体经酶切和测序鉴定正确. RNA干扰KC后其B7的表达降低了22%(P<0.01). 将干扰B7表达的KC与BN大鼠的淋巴细胞进行共培养, 与对照组相比, 受体BN大鼠的淋巴细胞增殖降低了49%(P<0.01), 细胞培养上清中IL-2的分泌量下降了67%(P<0.01).
结论: RNA干扰供体Lewis大鼠KC B7分子的表达可明显抑制受体BN大鼠淋巴细胞的增殖和IL-2的产生.
引文著录: 李涛, 朱继业, 柳枫, 冷希圣. RNA干扰供体大鼠库普弗细胞B7分子表达对受体大鼠淋巴细胞激活的影响. 世界华人消化杂志 2008; 16(1): 39-44
Revised: December 22, 2007
Accepted: December 25, 2007
Published online: January 8, 2008
AIM: To investigate the effect of RNA interference B7 expression of donor Lewis rat Kupffer cells (KC) on proliferation and interleukin (IL)-2 production of recipient BN rat lymphocytes.
METHODS: Lewis rat KC were isolated and identified. Rat B7 RNA interference vector Psilencer 3.1 H1-Neo-B7 was constructed and identified. KC were transfected by B7 RNA interference vector. RT-PCR was used to measure the expression of B7 in KC. After transfection, KC were divided into three groups: group A served as a control group; group B was KC transfected with vector without B7 interference; group C was RNA interference B7 expression of KC. Recipient BN rat lymphocytes were isolated and co-cultured with the three groups of KC. MTT assay was used to evaluate lymphocyte proliferation. ELISA was used to detect the production of IL-2.
RESULTS: The yield of KC was 5 × 107 and cell viability was > 98%. After B7 RNA interference vector transfection, B7 expression of KC decreased by 22% (P < 0.01). After co-culture with recipient BN rat lymphocytes, the proliferation and IL-2 production of lymphocytes were inhibited. As compared with the controls, lymphocyte proliferation decreased by 49% (P < 0.01). IL-2 production decreased by 67% (P < 0.01).
CONCLUSION: RNA interference B7 expression of donor Lewis rat KC significantly decreases the proliferation and production of recipient BN rat lymphocytes.
- Citation: Li T, Zhu JY, Liu F, Leng XS. Effect of RNA interference B7 expression of donor rat Kupffer cells on activation of recipient rat lymphocytes. Shijie Huaren Xiaohua Zazhi 2008; 16(1): 39-44
- URL: https://www.wjgnet.com/1009-3079/full/v16/i1/39.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i1.39
器官移植术后的急性排斥反应是受体淋巴细胞激活后攻击、破坏新植入的供体器官, 使其丧失功能的细胞免疫应答过程. T淋巴细胞的活化和增殖在同种异体移植的急性排斥反应中起重要作用. T淋巴细胞的活化需要双信号刺激, 一个是抗原肽-MHC分子-CD3/TCR复合物, 另一个是共刺激信号, 由抗原呈递细胞(antigen processing cell, APC)表面的共刺激分子与T细胞膜上的配体结合提供共刺激信号, 是T淋巴细胞活化所必须的, 其中最重要的共刺激信号为CD28/B7[1-6]. 活化的T淋巴细胞分泌大量的IL-2以自分泌或旁分泌的方式作用于自身及其他T细胞, 使得T细胞持续激活并大量分裂增殖[1].
目前已经证明, 阻断共刺激信号能够成功地诱导免疫耐受, 通过改变抗原呈递细胞表面分子表达诱导免疫耐受的发生是完全可能的[7-11]. 肝脏的库普弗细胞(kupffer cells, KC)是肝脏中的一种重要的抗原呈递细胞, 在肝移植的急性排斥反应过程中起重要的作用[12]. 在大鼠的肝移植模型中, Lewis大鼠→BN大鼠是肝移植急性排斥反应模型. 本研究分离供体Lewis大鼠的KC, 采用RNA干扰KC中B7的表达, 然后再将KC与受体BN大鼠的淋巴细胞共培养, 通过KC的介导, 封闭CD28/B7共刺激信号, 抑制T细胞增殖及IL-2的产生, 防止大量效应性T淋巴细胞的产生, 从而达到防止急性排斥反应发生的目的.
供体Lewis♂大鼠, SPF级, 体质量300-400 g; 受体BN♂大鼠, SPF级, 体质量300-400 g, 购自北京维通利华公司. 普通饲料喂养, 自由进食水. Ⅳ型胶原酶(collagenase type Ⅳ, 活性125 kU/g)、链霉蛋白酶E(pronase E, 活性4000 KPU/g)、Histodenz和latex-beads荧光颗粒为美国Sigma公司产品. DnaseⅠ和胰蛋白酶(华美生物工程公司), 活性600-1000 kU/mg. RPMI 1640无钙培养基(Gibco公司). 胎牛血清(hyclone公司). 小鼠抗大鼠CD163 ED2 mAb(mouse anti rat CD163, Serotec公司), 鼠抗兔溶酶体膜相关蛋白2(lysosomal associated Membrane protein 2, LAMP-2为美国生物学公司产品). HindⅢ, BamHⅠ, T4 DNA连接酶, 感受态宿主菌为大肠杆菌DH5α, pSilencer 3.1H1-Neo真核表达载体, pEGFP-N1绿色荧光蛋白载体, IL-2的ELISA检测试剂盒, 均购自北京鼎国生物技术公司. 大鼠B7引物及内参照GAPDH自行设计, 均由上海生工公司合成. 引物序列及扩增片断长度见表1.
| 引物 | 引物序列 | 扩增片段长度 |
| B7 | 5-GGAATCAACCTTCCCAAGCTAAAG-3 | 153 bp |
| 5-AGACTTCATTTCCTTGGAGAAGC-3 | ||
| GAPDH | 5-GCCAAAAGGGTCATCATCTC-3 | 286 bp |
| 5-GTAGAGGCAGGGATGATGTTC-3 |
1.2.1 供体Lewis大鼠KC的分离培养和鉴定: 我们改良的方法[13]: 大鼠麻醉后, 开腹门静脉插管, 灌注链霉蛋白酶E和Ⅳ型胶原酶消化肝脏, 得到肝脏非实质细胞悬液, 用Histodenz密度梯度离心分离KC, 于37℃ 50 mL/L CO2培养箱中培养30 min, 计数, 以1×109 个/L的浓度接种于新瓶中培养, 24 h后洗去未贴壁的细胞, 即可获得纯化的大鼠KC. 使用 ED2(mouse anti rat CD163)、LAMP2(rabbit anti-rat lysosome associated membrane protein 2)免疫细胞化学, 并联合latex-beads吞噬实验和电镜观察来鉴定KC. 0.4%的台盼蓝染色鉴定细胞的产量和存活率.
1.2.2 含大鼠B7干扰片段的Psilencer 3.1H1-Neo真核表达载体的构建和鉴定及转染供体大鼠KC: 参考大鼠的全基因序列, 利用siRNA Target软件, 由北京鼎国生物公司设计并合成B7的RNA干扰片段. 在干扰片段的两端分别加入BamHⅠ和HindⅢ两个酶切位点, 以确保干涉片段可以定向插入真核表达载体Psilencer 3.1-H1 Neo. 并以绿色荧光蛋白作为报告基因, 构建好的载体进行酶切和测序鉴定.
将培养的供体Lewis大鼠KC分为以下三组: A组为对照组; B组为空载体组; C组为RNA干扰B7表达组. 采用电穿孔法转染KC. 转染48-72 h后行以下检测.
1.2.3 RT-PCR方法检测供体大鼠KC B7分子表达的变化: 采用TRIzol试剂提取各组细胞总RNA. 取5 μg RNA进行cDNA的合成, 采用20 μL反应体系合成cDNA. PCR扩增B7, 同一标本扩增GAPDH作为内对照. 引物序列及扩增片段长度见表1. cDNA合成体系为: 取1 μL RNA(1 g/L)样品, 加入0.5 mL离心管中, 按下列参数加入试剂, 聚体随机引物: 0.1 μL(50 ng); AMV 5×buffer: 3 μL; dNTP(10 mmol/L): 0.4 μL; RNasin(20 单位/μL): 1 μL; AMV(10 U/μL): 0.5 μL H2O(DEPC处理): 9.0 μL, 42℃保温30 min, 94℃灭活AMV 5 min. cDNA合成后再进行PCR反应, 体系如下: 取5 μL cDNA模板按下列参数加入试剂: 10×PCR buffer 2.0 μL; dNTP 0.5 μL; GAPDH引物0.5 μL(50 ng); B7引物0.5 μL(50 ng); Taq酶(2 U/μL), 0.5 μL(1 U); H2O, 16 μL, 循环条件为: 94℃预变性2 min, 94℃变性45 s, 55℃复性45 s, 72℃延伸45 s, 扩增30轮, 72℃延伸加时1 min. 取15 μL PCR扩增产物于12 g/L琼脂糖凝胶进行电泳, 数码相机拍照, 记录结果. 用软件分析结果, 得到B7/GAPDH的灰度值比值.
1.2.4 建立各组供体Lewis大鼠KC和受体BN大鼠淋巴细胞的共培养体系, 采用MTT法检测受体淋巴细胞的增殖: BN大鼠淋巴细胞悬液的制备: 无菌条件下切除BN大鼠脾脏, 研磨后, 用80 µm尼龙网过滤, 1200 r/min离心5 min, 用红细胞裂解液FASTLysingTM Solution 20 mL,等渗裂解脾淋巴细胞悬液中的红细胞10 min, 过滤后, 再次离心1200 r/min 5 min, 调整终浓度为实验所需(1010/mL). 建立供体Lewis大鼠KC和受体BN大鼠淋巴细胞的共培养体系, 共培养48-72 h后, 取96孔板, 每孔加入100 µL受体淋巴细胞悬液(1×107/mL), 37℃, 50 mL/L CO2孵育箱中过夜; 细胞同步化: 灭菌PBS洗3遍细胞后加入无血清培养基继续培养16-24 h; 每孔中加入5 g/L的MTT 40 µL, 终浓度0.1 g/L, 在同样条件下继续培养4 h; 弃去培养液, 每孔加入等体积的DMSO, 充分溶解代谢产物, 酶标仪测定540 nm吸光度.
1.2.5 各组细胞共培养上清中IL-2含量的检测: 采用双抗体夹心ELISA法, 测定各组培养上清中IL-2的含量. 按照试剂盒说明进行操作, 在450 nm处测A450值, IL-2浓度与A450值之间呈正比, 通过绘制标准曲线求出各组标本中IL-2浓度.
统计学处理 数据以mean±SD表示, 以组间t检验进行统计学处理. 采用SPSS10.0软件分析, P<0.05认为有统计学差异.
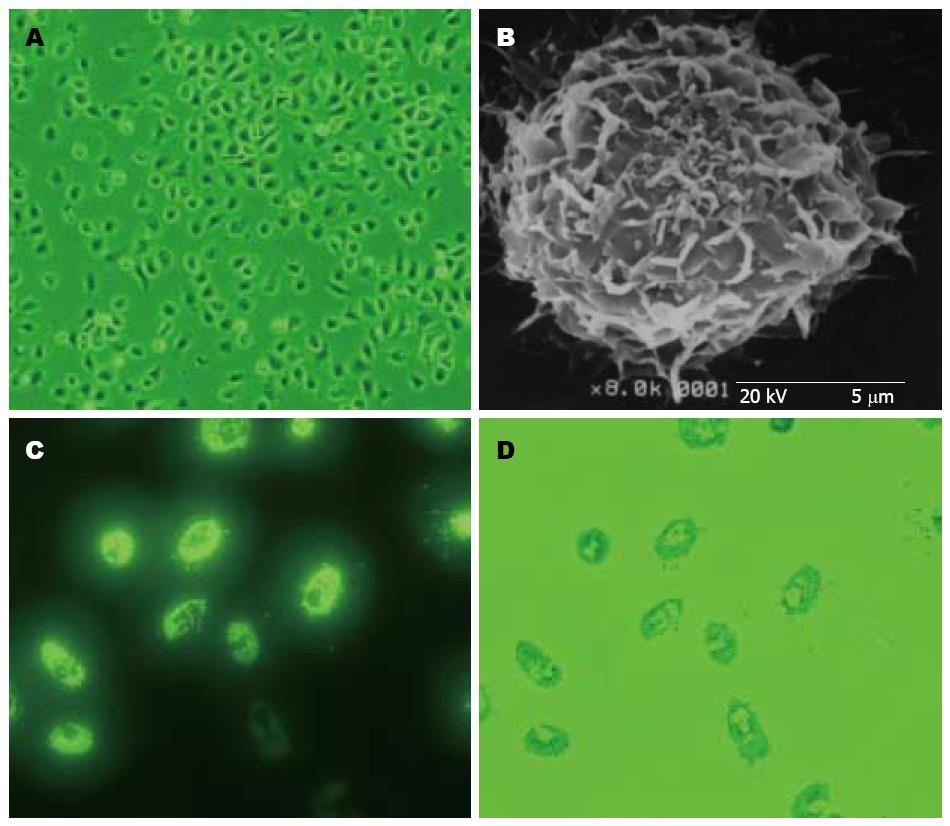
供体Lewis大鼠KC得率为5×107个, 以0.4%的台盼蓝染色, 细胞活率为98%. 培养24 h后, KC贴壁生长, 呈圆形、三角形或多角形(图1A), 电镜观察可见胞质丰富, 细胞表面有大量的突起(图1B), 细胞内含大量核糖体和吞噬体, 有发达的内质网、高尔基体和分泌型囊泡. 免疫细胞化学染色鉴定, CD163 ED2 mAb细胞大于98%, lysosome膜相关蛋白2阳性细胞占99%. 吞噬实验1 h后可见超过98%的细胞都吞噬了latex-beads, 胞质中见大量的吞噬颗粒(图1C-D).
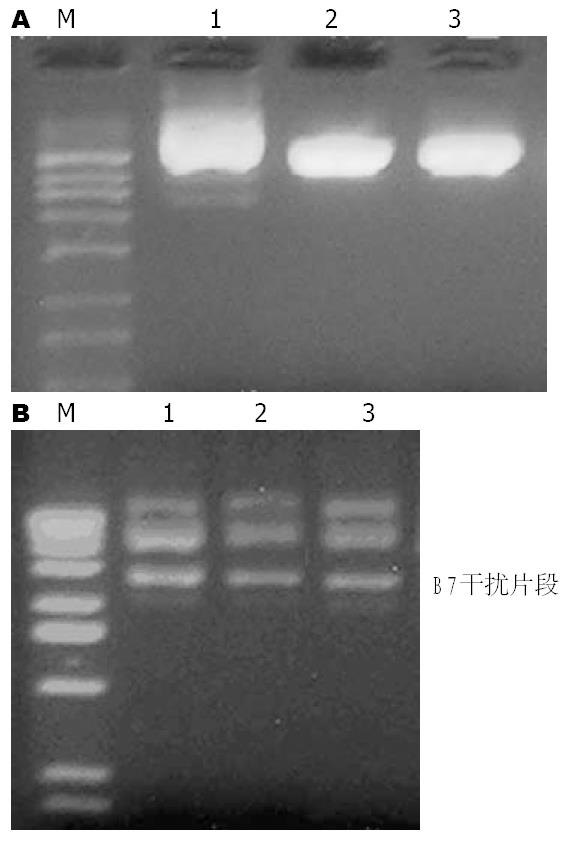
共设计10条干扰片段, 经过测算后从其中选出1条片段进行合成. 在其两端加上BamHⅠ和HindⅢ两个酶切位点后, 定向克隆到Psilencer 3.1H1-Neo真核表达载体, 转化感受态大肠杆菌DH5α, 经筛选后提取重组的Psilencer 3.1H1-Neo, 经过酶切和测序鉴定正确(图2).
构建成功的重组Psilencer 3.1H1-Neo-B7真核表达载体转染供体Lewis大鼠KC, 绿色荧光蛋白为报告基因(图3), 转染效率为30%-40%.
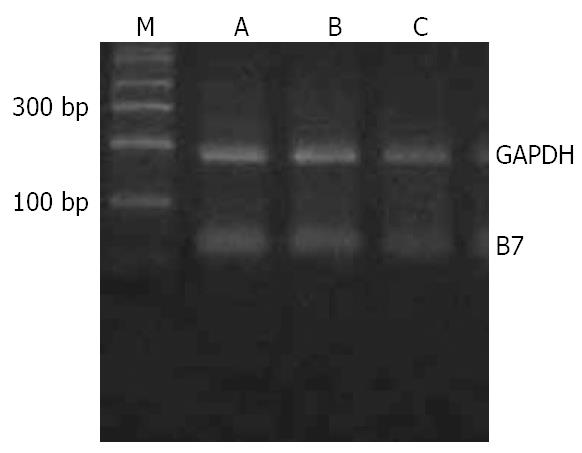
转染72 h后提取供体大鼠KC的总RNA, 采用RT-PCR方法检测B7表达的变化(图4). 与对照组相比, RNA干扰后B7的表达降低了22%(表2, P<0.01).
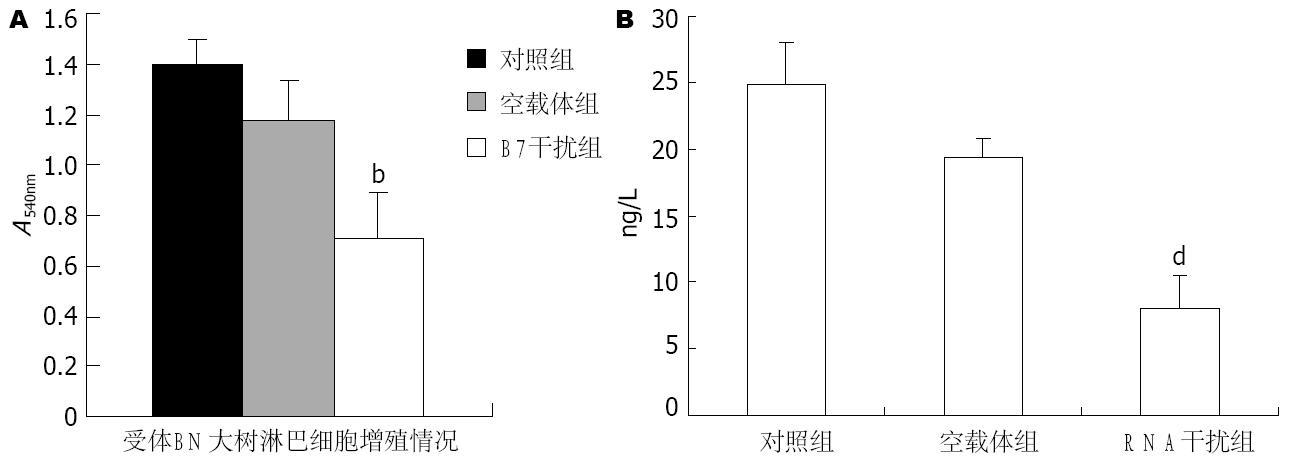
采用MTT法检测表明, RNA干扰供体KC B7分子的表达能显著抑制受体淋巴细胞的增殖, 与对照组相比, 淋巴细胞的增殖降低了49%(图5A, P<0.01).
ELISA法检测各组细胞培养上清中的IL-2含量, 结果表明, RNA干扰供体KC B7分子表达能显著抑制受体淋巴细胞的IL-2分泌(图5B). 与对照组相比, IL-2的分泌量下降了67%(P<0.01).
T淋巴细胞的活化需要两个信号, 第一个信号是T淋巴细胞表面的TCR-CD3复合物同抗原呈递细胞(APC)上的MHC-Ⅱ类抗原肽复合物结合, 赋予免疫应答的特异性, 但不引起T细胞增生和分泌细胞因子; 第二个信号是抗原非特异性的共刺激(costimulatory)信号, 由抗原呈递细胞表面的共刺激分子与T细胞上的配体结合所诱导, 启动维持并调节活化级联反应, 决定了T细胞是活化增殖, 或者转变为无反应状态甚至凋亡[1]. CD28/B7是最经典也是最重要的共刺激通路. CD28广泛表达于T细胞. B7则表达在树突状细胞(DC)、肝库普弗细胞、血管内皮细胞、肺巨嗜细胞等. CD28与抗原呈递细胞上的B7结合后, 为T细胞提供共刺激信号[2]. CD28和B7的结合对初次免疫应答的诱导是必需的, 主要涉及抗原呈递细胞与T细胞相互作用的起始阶段, 该信号修饰和补充TCR信号, 并将多种信号整合后, 起信号传递、增强或放大免疫应答的作用. 初始T细胞上的CD28与抗原呈递细胞上的B7结合后, 可以促进白细胞介素-2(IL-2)的转录, 同时使IL-2受体在T细胞上表达增加, 从而促进T细胞增殖, 还可以通过增加Bcl-xL的表达途径使T细胞免于凋亡[14-15]. 如果只有第一信号而无CD28/B7共刺激信号, 则T细胞无能或凋亡, 如果只有共刺激信号而无第一信号则无任何作用[1,3-5]. CD28/B7共刺激信号对T细胞的活化有重要的加强作用.
因此, 在器官移植免疫中, 如果能够降低抗原呈递细胞上B7分子的表达, 阻断CD28/B7共刺激信号通路, 则能抑制效应T细胞的活化和增生, 受体免疫系统就无法进一步产生针对移植器官的免疫应答. 受体对供体器官的特异性无免疫应答即为免疫耐受现象, 可使移植器官获得长期存活. 以往的研究表明, 在同种异体移植中, 阻断共刺激通路能够成功地诱导免疫耐受[7-11,16]. 研究发现, 在肝脏中的DC主要是不成熟的DC, 由于其表面的B7分子、MHC-Ⅱ类分子的表达明显下降, 因此不能有效地介导免疫反应. 在肝脏中主要起作用的抗原呈递细胞是KC, 其位于肝窦内, 能表达B7, MHC-Ⅱ类分子. 在肝移植动物模型中, 随着排斥反应的启动, KC的MHC-Ⅱ类分子表达明显增加; 而在人体肝移植中, 移植物的排斥反应和胆管消失综合征的程度与来源于供体的KC数量成正比[12,17-19].
我们采用RNA干扰来降低KC上B7分子的表达, RNA干扰(RNAi, RNA interference)即双链RNA介导的、序列特异的、同源基因转录后的基因沉默效应[20-25]. 他可以通过抑制蛋白表达模拟基因敲除技术. 在此过程中, 与双链RNA有同源序列的信使RNA(mRNA)被降解, 从而抑制该基因的表达. RNA干扰是存在于真核细胞内的一种自我保护现象, 既能对抗如病毒基因或人工转入基因所表达的mRNA等外源基因的侵害, 又能降解自身异常基因产生的mRNA. RNA干扰主要发生在基因转录后, 即mRNA的修饰或翻译水平上, 具有特异、高效和持久的特点, 为临床上特异性的基因干预治疗开辟了一条通路. 并为通过阻断共刺激通路来诱导免疫耐受提供了新的方法, 即应用RNA干扰技术敲除供体抗原呈递细胞中共刺激分子的表达以阻断共刺激信号从而使效应性T细胞无能, 达到免疫耐受的作用.
在本研究中, 我们成功地分离培养并鉴定了作为供体的Lewis大鼠KC, 采用RNA干扰的方法降低了供体大鼠肝脏中的抗原呈递细胞KC上B7分子的表达, RNA干扰后B7的表达降低了22%. 同时我们分离培养了受体BN大鼠的淋巴细胞, 将干扰B7表达的KC与受体大鼠的淋巴细胞进行共培养. 本研究发现, 这种方法能有效地阻断CD28/B7共刺激通路, 明显地抑制了淋巴细胞的活化和增殖, 并抑制了淋巴细胞产生细胞因子IL-2. 与对照组相比, 受体BN大鼠的淋巴细胞增殖降低了49%(P<0.01). 细胞培养上清中IL-2的分泌量下降了67%(P<0.01).
总之, 我们以供体Lewis大鼠的KC为介导, 采用RNA干扰的方法降低了KC上共刺激分子B7的表达, 以此来封闭共刺激通路CD28/B7, 达到抑制受体效应T细胞激活、增殖以及分泌IL-2等细胞因子的能力, 证明在体外降低抗原呈递细胞B7分子的表达可以抑制效应T细胞的活化, 从而达到诱导特异性免疫耐受的效果.
器官移植术后的急性排斥反应是受体淋巴细胞激活后攻击、破坏新植入的供体器官, 使其丧失功能的细胞免疫应答过程. 淋巴细胞的活化需要双信号刺激, 一个是抗原肽-MHC分子-CD3/TCR复合物, 另一个是共刺激信号, 由抗原呈递细胞表面的共刺激分子与T细胞膜上的配体结合提供共刺激信号, 是T淋巴细胞活化所必须的, 其中最重要的共刺激信号为CD28/B7. 通过改变抗原呈递细胞表面分子表达来阻断共刺激信号是目前免疫耐受研究的热点.
封闭抗原递呈的共刺激途径诱导免疫耐受是目前移植免疫研究最活跃的领域之一. 针对抗原呈递细胞, 如树突状细胞(DC), 采用反义寡核苷酸、或单克隆抗体等封闭共刺激通路是目前常用的研究方法.
目前已经证明, 阻断共刺激信号能够成功地诱导免疫耐受, 通过改变抗原呈递细胞表面分子表达诱导免疫耐受的发生是完全可能的. 已进行的尝试包括将Fas-L的基因片段导入抗原呈递细胞中、应用反义寡核苷酸或CD40L的单抗封闭共刺激信号以及利用体外合成的HLA相关肽改变抗原呈递细胞表面分子结构等方法都达到了诱导T细胞凋亡的目的.
本文证明在体外降低抗原呈递细胞B7分子的表达可以抑制效应T细胞的活化, 从而达到诱导特异性免疫耐受的效果, 为进一步的体内诱导特异性免疫耐受以及将来的临床应用打下了基础.
RNA干扰: 双链RNA介导的、序列特异的、同源基因转录后的基因沉默效应. 他可以通过抑制蛋白表达模拟基因敲除技术. 在此过程中, 与双链RNA有同源序列的信使RNA(mRNA)被降解, 从而抑制了该基因的表达. RNA干扰是存在于真核细胞内的一种自我保护现象, 既能对抗如病毒基因或人工转入基因所表达的mRNA等外源基因的侵害, 又能降解自身异常基因产生的mRNA.
本文选题新颖, 实验方法合理, 结果可信, 有一定的学术价值.
编辑: 程剑侠 电编:何基才
| 1. | Nurieva R, Thomas S, Nguyen T, Martin-Orozco N, Wang Y, Kaja MK, Yu XZ, Dong C. T-cell tolerance or function is determined by combinatorial costimulatory signals. EMBO J. 2006;25:2623-2633. [PubMed] |
| 2. | Collins M, Ling V, Carreno BM. The B7 family of immune-regulatory ligands. Genome Biol. 2005;6:223. [PubMed] |
| 3. | Wang S, Chen L. T lymphocyte co-signaling pathways of the B7-CD28 family. Cell Mol Immunol. 2004;1:37-42. [PubMed] |
| 5. | 陈 佳佳, 李 兰娟. B7-CD28家族共刺激途径的研究进展及其临床意义. 国外医学•流行病学传染病学分册. 2004;31:334-338. |
| 6. | 纪 志鹏. 共刺激分子CD28/B7家族在抑制肝脏移植排斥反应中的研究现状及展望. 中国现代普通外科进展. 2005;8:260-264. |
| 7. | Snanoudj R, de Préneuf H, Créput C, Arzouk N, Deroure B, Beaudreuil S, Durrbach A, Charpentier B. Costimulation blockade and its possible future use in clinical transplantation. Transpl Int. 2006;19:693-704. [PubMed] |
| 8. | 李 红卫, 孟 自力, 张 卫民, 邱 玉华, 沈 振亚, 滕 小梅. 阻断B7/CD28途径诱导异种免疫耐受的体外研究. 同济大学学报(医学版). 2004;25:108-111. |
| 10. | Fan K, Wang H, Wei H, Zhou Q, Kou G, Hou S, Qian W, Dai J, Li B, Zhang Y. Blockade of LIGHT/HVEM and B7/CD28 signaling facilitates long-term islet graft survival with development of allospecific tolerance. Transplantation. 2007;84:746-754. [PubMed] |
| 11. | Oderup C, Malm H, Ekberg H, Qi Z, Veress B, Ivars F, Corbascio M. Costimulation blockade-induced cardiac allograft tolerance: inhibition of T cell expansion and accumulation of intragraft cD4(+)Foxp3(+) T cells. Transplantation. 2006;82:1493-1500. [PubMed] |
| 12. | Kolios G, Valatas V, Kouroumalis E. Role of Kupffer cells in the pathogenesis of liver disease. World J Gastroenterol. 2006;12:7413-7420. [PubMed] |
| 15. | Carreno BM, Carter LL, Collins M. Therapeutic opportunities in the B7/CD28 family of ligands and receptors. Curr Opin Pharmacol. 2005;5:424-430. [PubMed] |
| 16. | Wang G, Feng Y, Hao J, Li A, Gao X, Xie S. Induction of xenogeneic islet transplantation tolerance by simultaneously blocking CD28-B7 and OX40-OX40L co-stimulatory pathways. Sci China C Life Sci. 2005;48:515-522. [PubMed] |
| 17. | Everett ML, Collins BH, Parker W. Kupffer cells: another player in liver tolerance induction. Liver Transpl. 2003;9:498-499. [PubMed] |
| 18. | Sun Z, Wada T, Maemura K, Uchikura K, Hoshino S, Diehl AM, Klein AS. Hepatic allograft-derived Kupffer cells regulate T cell response in rats. Liver Transpl. 2003;9:489-497. [PubMed] |
| 19. | Fung J, Kelly D, Kadry Z, Patel-Tom K, Eghtesad B. Immunosuppression in liver transplantation: beyond calcineurin inhibitors. Liver Transpl. 2005;11:267-280. [PubMed] |
| 20. | Aphasizhev R, Sbicego S, Peris M, Jang SH, Aphasizheva I, Simpson AM, Rivlin A, Simpson L. Trypanosome mitochondrial 3' terminal uridylyl transferase (TUTase): the key enzyme in U-insertion/deletion RNA editing. Cell. 2002;108:637-648. [PubMed] |
| 22. | Kappel S, Matthess Y, Kaufmann M, Strebhardt K. Silencing of mammalian genes by tetracycline-inducible shRNA expression. Nat Protoc. 2007;2:3257-3269. [PubMed] |
| 23. | Grimm D, Kay MA. Therapeutic application of RNAi: is mRNA targeting finally ready for prime time? J Clin Invest. 2007;117:3633-3641. [PubMed] |
| 24. | Grimm D, Kay MA. RNAi and Gene Therapy: A Mutual Attraction. Hematology Am Soc Hematol Educ Program. 2007;2007:473-481. [PubMed] |
| 25. | Fire AZ. Gene silencing by double-stranded RNA. Cell Death Differ. 2007;14:1998-2012. [PubMed] |