修回日期: 2006-12-25
接受日期: 2007-01-04
在线出版日期: 2007-03-18
目的: 探讨脂质体(liposome)介导核因子-κB (nuclear factor κB, NF-κB)诱捕物(decoy)寡聚脱氧核苷酸(ODN)对重症急性胰腺炎大鼠胰腺NF-κB活性及受其调控炎症因子基因mRNA表达和胰腺损伤的影响.
方法: 除假手术组(n = 10)外, 其余SD大鼠以牛磺胆酸钠(STC)诱导建立重症急性胰腺炎模型后, 分别于建模后1 h静脉注射裸ODN(n = 10)、脂质体/decoy ODN复合物(n = 10)、脂质体/scrambled ODN复合物(n = 10)和生理盐水(n = 10), 注射4 h后应用电泳迁移率变动分析(EMSA) NF-κB的活性, 利用逆转录-聚合酶链反应(RT-PCR)法检测胰腺组织ICAM-1, IL-1α, IL-2, TNF-α, VCAM-1 mRNA表达, 同时检测血淀粉酶、胰腺组织湿/干重比率和胰腺组织髓过氧化物酶(MPO).
结果: EMSA显示, 脂质体/decoy ODN复合物组NF-κB活性明显低于生理盐水组、脂质体/scrambled ODN复合物组和裸ODN组, 均有显著性差异(P<0.05).RT-PCR结果显示, 脂质体/decoy ODN复合物组ICAM-1, IL-1α, IL-2, TNF-α和VCAM-1 mRNA表达低于生理盐水组、脂质体/scrambled ODN复合物组和裸ODN组, 均有显著性差异(ICAM-1: 0.75±0.13 vs 1.39±0.15, 1.37±0.16, 1.32±0.17, P<0.05; IL-1α: 0.64±0.09 vs 1.34±0.20, 1.30±0.14, 1.25±0.20, P<0.05; IL-2: 0.23±0.08 vs 0.74±0.13, 0.71±0.12, 0.69±0.14, P<0.05; TNF-α: 0.41±0.13 vs 1.30±0.17, 1.26±0.17, 1.23±0.20, P<0.05; VCAM-1: 0.21±0.06 vs 0.68±0.13, 0.69±0.15, 0.63±0.13, P<0.05). 与生理盐水组、脂质体/scrambled ODN复合物组和裸ODN组相比, 脂质体/decoy ODN复合物组淀粉酶、胰腺组织湿/干重比率和胰腺组织MPO活性显著性降低(淀粉酶: 50931.85±22432.15 nkat/L vs 188024.26±38659.56, 188412.68±37988.26, 183119.95±33636.23 nkat/L, all P<0.05; 湿/干重比率: 5.76±0.20 vs 6.77±0.18, 6.72±0.18, 6.35±0.12, P<0.05; MPO活性: 46.68±3.00 nkat/g vs 99.02±2.50, 98.19±2.83, 98.52±2.50 nkat/g, P<0.05).
结论: NF-κB decoy ODN可特异性抑制胰腺NF-κB活性及其调控的炎症因子ICAM-1, IL-1α, IL-2, TNF-α和VCAM-1 mRNA的表达, 减轻胰腺损害.
引文著录: 钟荣德, 周杰, 廖柳清, 符方勇, 李湘竑, 林艺雄. 脂质体介导核因子-κB诱捕物寡聚脱氧核苷酸对重症急性胰腺炎大鼠胰腺炎症因子mRNA表达和胰腺损伤的影响. 世界华人消化杂志 2007; 15(8): 813-819
Revised: December 25, 2006
Accepted: January 4, 2007
Published online: March 18, 2007
AIM: To investigate the influences of liposome-mediated nuclear factor κB (NF-κB) decoy oligodeoxynucleotide (ODN) on the NF-κB activation, inflammatory factor mRNA expression and pancreatic injury in rats with severe acute pancreatitis (SAP).
METHODS: Except for those in sham operation group, the rest rats were injected with sodium taurocholate to establish the model of SAP, and then intravenously injected with naked ODN, liposome/decoy ODN complexes, liposome/scrambled ODN complexes, and normal saline, respectively, 1 h later. Four hours after injection, the NF-κB activity was analyzed by electrophoretic mobility shift assay (EMSA), and the mRNA expression of intercellular adhesion molecule-1 (ICAM-1), interleukin-1a (IL-1α), IL-2, tumor necrosis factor-a (TNF-α) and vascular cell adhesion molecule-1 (VCAM-1) were assessed by reverse transcription-polymerase chain reaction (RT-PCR). Meanwhile, the serum amylase level, pancreatic wet/dry weight ratio and myeloperoxidase (MPO) content were detected.
RESULTS: The NF-κB activity and its related inflammatory factors were observably inhibited in liposome/decoy ODN group as compared with those in normal saline group, liposome/scrambled ODN group and naked ODN group (NF-κB activation: P < 0.05; ICAM-1: 0.75 ± 0.13 vs 1.39 ± 0.15, 1.37 ± 0.16, 1.32 ± 0.17, all P < 0.05; IL-1α: 0.64 ± 0.09 vs 1.34 ± 0.20, 1.30 ± 0.14, 1.25 ± 0.20, all P < 0.05; IL-2: 0.23 ± 0.08 vs 0.74 ± 0.13, 0.71 ± 0.12, 0.69 ± 0.14, all P < 0.05; TNF-α: 0.41 ± 0.13 vs 1.30 ± 0.17, 1.26 ± 0.17, 1.23 ± 0.20, all P < 0.05; VCAM-1: 0.21 ± 0.06 vs 0.68 ± 0.13, 0.69 ± 0.15, 0.63 ± 0.13, all P < 0.05). In comparison with normal saline, liposome/scrambled ODN and naked ODN group, the level of serum amylase, the ratio of pancreaic wet/dry weight, and the MPO content of pancreatic tissues in liposome/decoy ODN group were remarkably decreased (amylase: 50931.85 ± 22432.15 nkat/L vs 188024.26 ± 38659.56, 188412.68 ± 37988.26, 183119.95 ± 33636.23 nkat/L, P < 0.05; wet/dry weight ration: 5.76 ± 0.20 vs 6.77 ± 0.18, 6.72 ± 0.18, 6.35 ± 0.12, P < 0.05; MPO: 46.68 ± 3.00 nkat/g vs 99.02 ± 2.50, 98.19 ± 2.83, 98.52 ± 2.50 nkat/g, P < 0.05).
CONCLUSION: NF-κB decoy ODN is effective in alleviating pancreatic injury during SAP through suppressing the activation of NF-κB and mRNA expression of ICAM-1, IL-1α, IL-2, TNF-α and VCAM-1.
- Citation: Zhong RD, Zhou J, Liao LQ, Fu FY, Li XH, Lin YX. Effect of liposome-mediated nuclear factor κB decoy oligodeoxynucleotide on the mRNA expression of inflammatory factors and injury of pancreas in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(8): 813-819
- URL: https://www.wjgnet.com/1009-3079/full/v15/i8/813.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i8.813
重症急性胰腺炎(SAP)导致患者早期死亡的主要原因是严重的炎症反应. SAP及其伴发的急性呼吸窘迫综合征(ARDS)、多器官功能不全综合症(MODS)与多种细胞因子的作用有关[1-2], 然而促炎性细胞因子、趋化因子、黏附因子等基因的活化和表达均受到核转录因子(NF-κB)调控[3-5]. 转染人工合成的NF-κB结合位点寡聚脱氧核苷酸(ODN)可有效的抑制其调控这些因子. 由于脂质体结构与细胞膜类似, 无副作用, 无免疫原性, 可生物降解, 使用方便等优点, 已广泛的用作载体进行各方面的研究和疾病的治疗, 如药物载体、基因介导等治疗感染性疾病、心血管疾病和皮肤疾病等[6-7]. 因此, 脂质体与寡聚脱氧核苷酸相结合阻断NF-κB对下游基因的调控无疑是一条研究治疗SAP器官损伤的新途径.
♂洁级健康SD大鼠50只, 体质量300-400 g, 购自南方医院动物实验中心. 引物和ODN由上海生工生物工程有限公司合成和全硫代修饰, NF-κB decoy ODN: 5'-AGT TGA GGG GAC TTT CCC AGG C-3'; 3'-TCA ACT CCC CTG AAA GGG TCC G-5', Scrambled ODN: 5'-TTG CCG TAC CTG ACT TAG CCG T-3'; 3'-AAC GGC ATG GAC TGA ATC GGC A-5'[8]. 牛磺胆酸钠(Sodium taurocholate, STC), 购自Sigma公司. EMSA试剂盒, 购自Promega公司. In vivo GeneShuttleTM Transfection Reagent[9-11], 购自Qbiogene公司. RT-PCR试剂盒购自Fermentas. Tri Reagent Ls购自美国MRC. 大鼠引物系列见表1.
| 引物 | 有意义链 | 反意义链 | 大小(bp) |
| IL-1α | CTAAGAACTACTTCACATCCGCA | CTGGAATAAAACCCACTGAGGTAGG | 623 |
| IL-2 | TCAACAGCGCACCCACTTCAAG | GTTGAGATGATGCTTTGACAGA | 403 |
| TNF-α | TACTGAACTTCGGGGTGATTGGTCC | CAGCCTTGTCCCTTGAAGAGAACC | 295 |
| ICAM-1 | GGGTTGGAGACTAACTGGA | CCTCTGGCGGTAATAGGTG | 201 |
| VCAM-1 | TTGGCTCCTGATGTTTACCC | GCACCCTCATGTAGCCTTGT | 308 |
| β-actin | TTGTAACCAACTGGGACGATATGG | GATCTTGATCTTCATGGTGCTAGG | 764 |
1.2.1 脂质体/ODN复合物配制: 参考In vivo GeneShuttleTM Transfection Reagent说明书进行配制, 脂质体/ODN复合物A400值为0.8, 含ODN浓度为50 g/L. 裸ODN的浓度同样为50 g/L.
1.2.2 SAP模型制作: 50 g/L戊巴比妥钠溶液0.1 mL/kg ip麻醉, 在无菌操作下行腹正中切口切开SD大鼠腹部, 结扎胆总管末端, 于肝门处肝近端穿绕丝线, 扎紧插入胆总管内的3号输液针头, 继而于胆总管内缓慢注射药物50 g/L STC 1 mL/kg速度0.25 mL/min, 然后撤除输液针头和丝线, 缝合腹部切口.
1.2.3 实验分组: 假手术对照组为开腹·动胰腺, 未作任何处理组; SAP模型分为裸ODN组、生理盐水组、脂质体/scrambled ODN复合物组、脂质体/decoy ODN复合物组. 脂质体/ODN复合物1 mL, 裸ODN 1 mL, 生理盐水1 mL, 分别于SAP模型建立后1 h经尾静脉注射. 各组均在注射4 h后抽取血标本和切取胰腺组织. 在腹主动脉抽取血样本进行淀粉酶检测, 由南方医院检验科检测.
1.2.4 胰腺组织湿/干重比值测定: 取大鼠胰腺固定部位大约100 g, 称取湿重W1, 65 ℃烘箱烘烤24 h, 再称干重W2, W1/W2即为湿/干比值.
1.2.5 胰腺髓过氧化物酶(MPO)活性测定: 取胰腺组织约100 mg, 加5 g/L HTAB 2 mL制备匀浆, 反复冻融3次并超声粉碎(10 s, 3次), 4 ℃ 40000 g离心30 min, 取上清0.1 mL加反应液2.9 mL, 保持温度于25 ℃, 立即在分光光度计460 nm波长下进行2 min的扫描, 记录第30 s和第90 s的光密度差值, 以此1 min内吸光度的变化代表酶活力的改变, 酶的活力可反应中性白细胞的数目.
1.2.6 电泳迁移率变动分析法(EMSA)检测NF-κB活性[12]: 核蛋白抽提, 取冰冻保存的胰腺标本100 mg先用预冷的PBS液洗涤3次, 吸干水分, 以下操作全部在4 ℃冰浴下进行: 加入Buffer A 1 mL[10 mmol/L Hepes-NaOH(pH7.8); 15 mmol/L KCl; 1 mmol/L MgCl2; 0.1 mmol/L EDTA; 1 mmol/L DTT; 1 mmol/L PMSF; 1 mg/L leupeptin; 1 mg/L pepstatin]混匀, 剪碎匀浆, 把匀浆移至1.5 mL EP管中加入100 g/L NP-40 100 mL, 涡动1 min, 10000 g、4 ℃离心1 min, 仔细弃全部上清, 加入Buffer B 1 mL[20 mmol/L Hepes-NaOH(pH7.9); 1.5 mmol/L MgCl2; 0.42 mol/L NaCl; 0.2 mmol/L EDTA; 250 g/L甘油; 0.5 mmol/L DTT; 0.5 mmol/L PMSF; 1 mg/L Leupeptin; 1 mg/L pepstatin; 1 mg/L Aprotinin]混悬, 4 ℃冰浴30 min, 间隔搅拌, 12000 g、4 ℃离心4 min, 吸取上清, 分装, -70 ℃保存. 核蛋白定量, 用Bradford酶标仪蛋白定量法测定核蛋白浓度. 探针标记、纯化、探针与核蛋白的结合及电泳, 按照EMSA试剂盒说明进行. 显影、图像分析用保鲜膜包好, 暗室内压片, -70 ℃过夜后, 显影. 凝胶成像系统分析X胶片上的滞后条带.
1.2.7 凝胶电泳迁移率竞争性试验检验NF-κB与DNA结合的特异性: 即在EMSA探针与核蛋白的结合及电泳过程中加入两组竞争性对照, 一组在反应系中加入100倍特异性标记的探针, 另一组加入100倍非特异性未标记的SP1探针, 其余步骤同EMSA.
1.2.8 RT-PCR方法检测胰腺组织mRNA表达用Tri Reagent: Ls提取总RNA, RT-PCR试剂盒行PCR. PCR反应条件为: 94 ℃预变性2 min, 94 ℃ 30 s, 50-60 ℃ 30-45 s, 72 ℃ 30-45 s, 扩增25-35个循环, 72 ℃延伸7 min. 将PCR产物5 mL在15 g/L琼脂糖凝胶中电泳, 在紫外灯下观查、照相, 然后用凝胶图象扫描仪测算每条带的光密度值与β-actin光密度值之比表示每个样本mRNA的表达水平.
统计学处理 采用SPSS13.0进行方差齐性检验、单因数方差分析和LSD法两两比较(显著性水准a = 0.05). 全部数据以均数±标准差(mean±SD)表示, 以P<0.05为差异有显著性.
脂质体/decoy ODN复合物组淀粉酶、胰腺组织湿/干重比值和MPO活性与假手术对照组、生理盐水组、脂质体/scrambled ODN复合物组和裸ODN组均有显著性差异(P<0.05). 裸ODN组淀粉酶、胰腺组织湿/干重比值和MPO活性与生理盐水组和脂质体/scrambled ODN复合物组相比无显著性差异(P>0.05)(表2).
| 分组 | 淀粉酶(nkat/L) | 胰腺组织湿/干重比值 | MPO活性(nkat/g) |
| 假手术对照组 | 16604.99±4126.66 | 5.36±0.11 | 17.00±2.00 |
| 裸ODN组 | 183119.95±33636.23 | 6.35±0.12 | 98.52±2.50 |
| 脂质体/decoy ODN复合物组 | 50931.85±22432.15 | 5.76±0.20 | 46.68±3.00 |
| 脂质体/scrambled ODN复合物组 | 188412.68±37988.26 | 6.72±0.18 | 98.19±2.83 |
| 生理盐水组 | 188024.26±38659.56 | 6.77±0.18 | 99.02±2.50 |
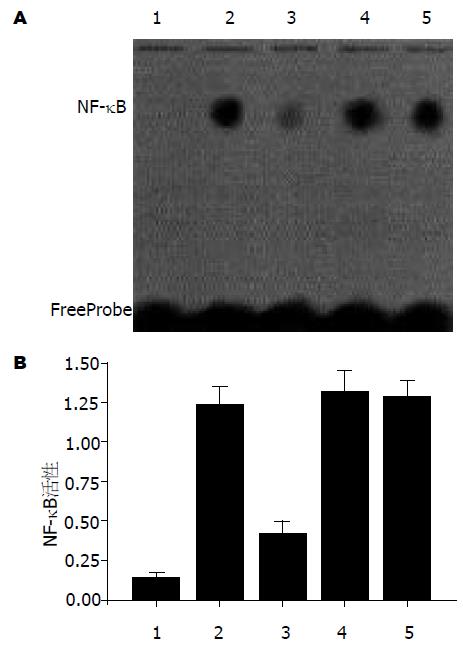
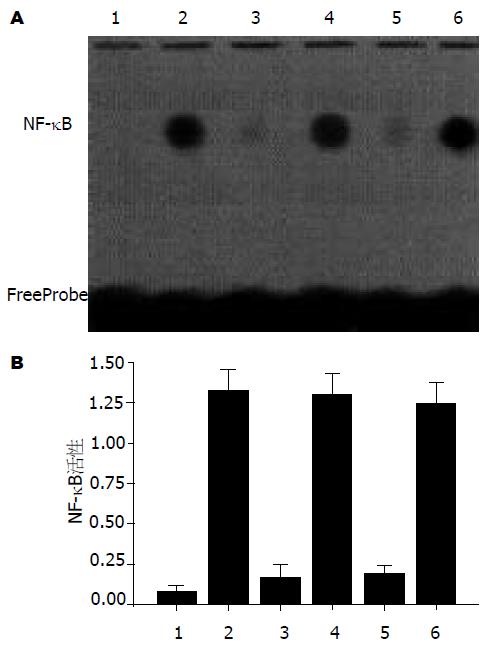
EMSA显示脂质体/decoy ODN复合物组NF-κB活性受到明显抑制, 与假手术对照组比较仍有显著性差异(P<0.05). 生理盐水组、脂质体/scrambled ODN复合物组和裸ODN组NF-κB活性均处于活化状态, 裸ODN组NF-κB活性与生理盐水组和脂质体/scrambled ODN复合物组比较无显著性差异(P>0.05)(图1). 细胞的核蛋白与特异性探针反应后, NF-κB与DNA的结合活性被抑制; 与非特异性SP1探针反应后, NF-κB与DNA的结合活性则不被抑制(图2).
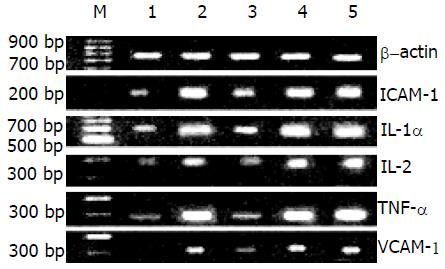
脂质体/decoy ODN复合物组ICAM-1, IL-1α, TNF-α mRNA的表达与假手术对照组、生理盐水组、脂质体/scrambled ODN复合物组和裸ODN组有显著性差异(P<0.05); IL-2, VCAM-1 mRNA的表达与假手术对照组相比无显著性差异(P>0.05), 与生理盐水组、脂质体/scrambled ODN复合物组和裸ODN组相比有显著性差异(P<0.05). 裸ODN组ICAM-1, IL-1α, IL-2, TNF-α, VCAM-1 mRNA的表达与生理盐水组和脂质体/scrambled ODN复合物组相比无显著性差异(P>0.05, 图3, 表3)
| 假手术对照组 | 裸ODN组 | 脂质体/decoy ODN复合物组 | 脂质体/scrambled ODN复合物组 | 生理盐水组 | |
| ICAM-1 | 0.47±0.14 | 1.32±0.17 | 0.75±0.13 | 1.37±0.16 | 1.39±0.15 |
| IL-1α | 0.40±0.13 | 1.25±0.20 | 0.64±0.09 | 1.30±0.14 | 1.34±0.20 |
| IL-2 | 0.11±0.02 | 0.69±0.14 | 0.23±0.08 | 0.71±0.12 | 0.74±0.13 |
| TNF-α | 0.20±0.11 | 1.23±0.20 | 0.41±0.13 | 1.26±0.17 | 1.30±0.17 |
| VCAM-1 | 0.09±0.02 | 0.63±0.13 | 0.21±0.06 | 0.69±0.15 | 0.68±0.13 |
目前普遍认为, SAP时, 异常激活的胰酶在引起胰腺细胞本身损伤的同时, 引起局部及全身炎症反应, 致使炎症介质被大量释放, 导致集体过度的炎症反应(即所谓"瀑布样效应"), 这些炎性介质促成了全身炎症反应综合症(SIRS), 继而引起多器官功能损害, 是导致患者死亡的主要原因. 为何腹部的其他炎症(如急性阑尾炎等)极少并发SIRS, 而胰腺炎往往会合并如此严重的SIRS呢? 核转录因子NF-κB在胰腺炎发展中所起的作用逐渐引人关注[13].
核转录因子NF-κB是由可诱导的3个亚基组成的复合物, 3个亚基分别为转录因子二聚体(p50和p65)和抑制亚基Ⅰ-κB. NF-κB由于IκB的抑制作用主要以非活性形态存在于细胞质. 转录因子NF-κB在许多领域受到研究者的关注基于以下的几点: 罕见和快速的调节性, 控制的基因范围广, 在免疫过程处于中枢的角色, 亚基的复杂性和牵涉若干个疾病. 控制NF-κB的基本水平是通过与抑制蛋白IκB的相互作用. 最近的证据证实了不同机制调节NF-κB的IκB多样形态存在. NF-κB可以被脂肪酶、脂多糖或者炎症细胞因子激活例如TNF、IL-1、病毒感染、某一个病毒基因产物的表达、紫外线照射、B或T细胞活化、其他生理学的和非生理学的刺激物. NF-κB激活转移至细胞核是通过IκB定向磷酸化、降解, 与NF-κB解离进行的. NF-κB一旦转入细胞核即结合同族DNA序列和激活特异靶基因转录, 大多数是编码免疫和炎症的重要蛋白. NF-κB/Rel因子控制大范围的基因表达, 例如编码免疫球蛋白、细胞因子、化学增活素、干扰素、主要组织相容性复合物蛋白质、生长因子、细胞黏附分子. NF-κB可与许多基因的启动子结合, 包括炎症应答例如ICAM-1、E-选择蛋白、VCAM、TNF-α、IL-1、IL-2、IL-6、IL-8、COX 2和iNOS[14-19]. 因此, 核转录因子NF-κB是炎症反应的关键角色. 转染人工合成与NF-κB结合位点具高度亲和力的寡聚脱氧核苷酸也就是诱捕物寡核苷酸(decoy ODN)已被认为是基因治疗策略的有效工具, 并应用于心肌梗塞和肾小球肾炎等许多相关的疾病, 可导致特异性的抑制效果, 无非特异性的细胞毒性[20-21]. 此实验的脂质体/decoy ODN复合物组也提示decoy ODN对重症急性胰腺炎SD大鼠胰腺NF-κB的活性有特异性的抑制效果. NF-κB的活性被有效抑制后, 其控制的下游炎症因子ICAM-1、IL-1α、IL-2、TNF-α、VCAM-1的表达也相应被抑制. 由于相应的炎症因子被抑制后, 胰腺损伤也明显改善, 表现为淀粉酶明显下降、胰腺水肿减轻如胰腺组织湿/干重比率降低和炎症减轻、中性白细胞的数目侵润减少如胰腺组织髓过氧化物酶(MPO)降低等.
脂质体在1960年代被英国Bangham et al[22]发现, 1970年代Gregoriadis et al[23]依据脂质体的特点, 首次提出应用脂质体作为b-半乳糖苷酶载体治疗糖原积累疾病. 经过长期多方面的研究显示脂质体具有减少药物剂量毒性、降低副作用; 改善被包裹药物的化学稳定性, 增加药物在肿瘤的积聚, 延缓药物的暴露时间; 传递基因; 增强寡脱氧核苷酸抵抗核酸酶的能力, 延长半衰期, 提高在靶细胞的摄取等优点[24-27], 人们开始应用脂质体作为载体进行各方面的研究和疾病的治疗, 如药物载体、基因介导、以及治疗感染性疾病、心血管疾病和皮肤疾病等[6-7]. 脂质体诱导反义寡核苷酸在胃癌、胰腺癌、肝癌的研究也正在蓬勃发展[28-31]. 随着脂质体诱导治疗安全性和效率的提高已经在药物治疗领域取得成功[32]. In vivo GeneShuttleTM Transfection Reagent是一种新型的阳离子脂质体转染试剂, 极大的提高了体内的转染效率, 其转染效果与病毒载体相近[9-11]. 在此实验显示, ODN经脂质体介导能较好的在重症急性胰腺炎SD大鼠胰腺转染并达到治疗胰腺炎的目的, 不经脂质体转染的裸ODN只有少量到达胰腺未达到治疗胰腺炎的目的.
总之, 核转录因子NF-κB是炎症反应的关键角色, 脂质体可以有效的转染NF-κB decoy ODN进入体内抑制其活性, 无任何毒性作用. 脂质体转染人工合成寡聚脱氧核苷酸为研究重症急性胰腺炎提供了可以利用的新的基因治疗策略.
重症急性胰腺炎是常见危重疾病之一, 并发症多, 死亡率高, 仍然是临床上的一大难题, 虽然生长抑素和生长激素在治疗急性胰腺炎上取得了明显的疗效, 但是其作用机制仍然不明确, 是否推广应用仍存在争议. 脂质体已广泛的用作载体进行各方面的研究和疾病的治疗, 转染人工合成的NF-κB结合位点寡聚脱氧核苷酸(ODN)可有效的抑制其调控的下游因子.
核转录因子NF-κB是炎症反应的关键角色. 因此, 脂质体转染人工合成的NF-κB结合位点寡聚脱氧核苷酸(ODN)为研究重症急性胰腺炎提供了可以利用的新的基因治疗策略.
本文探讨了脂质体介导NF-κBdecoyODN对重症急性胰腺炎大鼠胰腺炎症因子mRNA表达和胰腺损伤的影响, 文章有深度, 设计合理, 有较高的理论价值.
编辑: 王晓瑜 电编:李琪
| 1. | Denham W, Norman J. The potential role of therapeutic cytokine manipulation in acute pancreatitis. Surg Clin North Am. 1999;79:767-781. [PubMed] [DOI] |
| 2. | Karne S, Gorelick FS. Etiopathogenesis of acute pancreatitis. Surg Clin North Am. 1999;79:699-710. [PubMed] [DOI] |
| 3. | Baeuerle PA, Henkel T. Function and activation of NF-kappa B in the immune system. Annu Rev Immunol. 1994;12:141-179. [PubMed] [DOI] |
| 4. | Collins T, Read MA, Neish AS, Whitley MZ, Thanos D, Maniatis T. Transcriptional regulation of endothelial cell adhesion molecules: NF-kappa B and cytokine-inducible enhancers. FASEB J. 1995;9:899-909. [PubMed] |
| 5. | Brand K, Page S, Walli AK, Neumeier D, Baeuerle PA. Role of nuclear factor-kappa B in atherogenesis. Exp Physiol. 1997;82:297-304. [PubMed] [DOI] |
| 6. | Kita Y, Tanaka T, Yoshida S, Ohara N, Kaneda Y, Kuwayama S, Muraki Y, Kanamaru N, Hashimoto S, Takai H. Novel recombinant BCG and DNA-vaccination against tuberculosis in a cynomolgus monkey model. Vaccine. 2005;23:2132-2135. [PubMed] [DOI] |
| 7. | Aleshin AN, Sawa Y, Kitagawa-Sakakida S, Bando Y, Ono M, Memon IA, Tohyama M, Ogawa S, Matsuda H. 150-kDa oxygen-regulated protein attenuates myocardial ischemia-reperfusion injury in rat heart. J Mol Cell Cardiol. 2005;38:517-525. [PubMed] [DOI] |
| 8. | Vos IH, Govers R, Gröne HJ, Kleij L, Schurink M, De Weger RA, Goldschmeding R, Rabelink TJ. NFkappaB decoy oligodeoxynucleotides reduce monocyte infiltration in renal allografts. FASEB J. 2000;14:815-822. [PubMed] |
| 9. | Templeton NS, Lasic DD, Frederik PM, Strey HH, Roberts DD, Pavlakis GN. Improved DNA: liposome complexes for increased systemic delivery and gene expression. Nat Biotechnol. 1997;15:647-652. [PubMed] [DOI] |
| 10. | Gaensler KM, Tu G, Bruch S, Liggitt D, Lipshutz GS, Metkus A, Harrison M, Heath TD, Debs RJ. Fetal gene transfer by transuterine injection of cationic liposome-DNA complexes. Nat Biotechnol. 1999;17:1188-1192. [PubMed] [DOI] |
| 11. | Templeton NS, Lasic DD. New directions in liposome gene delivery. Mol Biotechnol. 1999;11:175-180. [PubMed] [DOI] |
| 13. | Vaquero E, Gukovsky I, Zaninovic V, Gukovskaya AS, Pandol SJ. Localized pancreatic NF-kappaB activation and inflammatory response in taurocholate-induced pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2001;280:G1197-G1208. [PubMed] |
| 14. | Chen X, Ji B, Han B, Ernst SA, Simeone D, Logsdon CD. NF-kappaB activation in pancreas induces pancreatic and systemic inflammatory response. Gastroenterology. 2002;122:448-457. [PubMed] [DOI] |
| 15. | Rakonczay Z, Jármay K, Kaszaki J, Mándi Y, Duda E, Hegyi P, Boros I, Lonovics J, Takács T. NF-kappaB activation is detrimental in arginine-induced acute pancreatitis. Free Radic Biol Med. 2003;34:696-709. [PubMed] [DOI] |
| 16. | Baldwin AS. The NF-kappa B and I kappa B proteins: new discoveries and insights. Annu Rev Immunol. 1996;14:649-683. [PubMed] [DOI] |
| 17. | Chen Z, Hagler J, Palombella VJ, Melandri F, Scherer D, Ballard D, Maniatis T. Signal-induced site-specific phosphorylation targets I kappa B alpha to the ubiquitin-proteasome pathway. Genes Dev. 1995;9:1586-1597. [PubMed] [DOI] |
| 18. | Verma IM, Stevenson JK, Schwarz EM, Van Antwerp D, Miyamoto S. Rel/NF-kappa B/I kappa B family: intimate tales of association and dissociation. Genes Dev. 1995;9:2723-2735. [PubMed] [DOI] |
| 19. | Li X, Massa PE, Hanidu A, Peet GW, Aro P, Savitt A, Mische S, Li J, Marcu KB. IKKalpha, IKKbeta, and NEMO/IKKgamma are each required for the NF-kappa B-mediated inflammatory response program. J Biol Chem. 2002;277:45129-45140. [PubMed] [DOI] |
| 20. | Tomita N, Morishita R, Lan HY, Yamamoto K, Hashizume M, Notake M, Toyosawa K, Fujitani B, Mu W, Nikolic-Paterson DJ. In vivo administration of a nuclear transcription factor-kappaB decoy suppresses experimental crescentic glomerulonephritis. J Am Soc Nephrol. 2000;11:1244-1252. [PubMed] |
| 21. | Yeh SH, Lin CH, Lee CF, Gean PW. A requirement of nuclear factor-kappaB activation in fear-potentiated startle. J Biol Chem. 2002;277:46720-46729. [PubMed] [DOI] |
| 22. | Bangham AD, Standish MM, Watkins JC. Diffusion of univalent ions across the lamellae of swollen phospholipids. J Mol Biol. 1965;13:238-252. [PubMed] [DOI] |
| 23. | Gregoriadis G, Ryman BE. Liposomes as carriers of enzymes or drugs: a new approach to the treatment of storage diseases. Biochem J. 1971;124:58P. [PubMed] [DOI] |
| 24. | Langner M, Kral TE. Liposome-based drug delivery systems. Pol J Pharmacol. 1999;51:211-222. [PubMed] |
| 25. | Kaneda Y. Virosomes: evolution of the liposome as a targeted drug delivery system. Adv Drug Deliv Rev. 2000;43:197-205. [PubMed] [DOI] |
| 26. | Dass CR. Liposome-mediated delivery of oligodeoxynucleotides in vivo. Drug Deliv. 2002;9:169-180. [PubMed] [DOI] |
| 27. | Park JW, Benz CC, Martin FJ. Future directions of liposome- and immunoliposome-based cancer therapeutics. Semin Oncol. 2004;31:196-205. [PubMed] [DOI] |
| 32. | Lian T, Ho RJ. Trends and developments in liposome drug delivery systems. J Pharm Sci. 2001;90:667-680. [PubMed] [DOI] |