修回日期: 2007-01-01
接受日期: 2007-01-10
在线出版日期: 2007-03-08
目的: 探讨JNK/SAPK信号转导系统在三氧化二砷(As2O3)诱导人肝癌细胞株HepG2凋亡过程中的作用.
方法: 采用MTT法观察不同浓度的As2O3对人类肝癌细胞株HepG2细胞生长的抑制作用; 以流式细胞术观察细胞的凋亡率及生长周期的变化; 以Western blot法检测p-MEK4、JNK、p-JNK、Caspase-3及PARP蛋白在As2O3作用下及SP600125阻断JNK信号转导通路情况下的表达.
结果: 各浓度As2O3均能明显抑制肝癌细胞HepG2增殖, 且具有剂量依赖性和时间依赖性; 流式细胞术(FCM)分析显示, As2O3能够诱导肝癌细胞HepG2凋亡且具有时间依赖性, 细胞滞留于G2/M期(0, 24, 48, 72 h百分率分别为7.22%±1.50%, 11.56%±0.73%, 33.8%±1.62%, 46.02%±0.11%); Western blotting结果显示, As2O3诱导肝癌细胞HepG2凋亡伴随着Caspase-3和PARP的活化; As2O3作用于HepG2细胞10 min后p-MEK4和p-JNK蛋白表达开始增加, 20 min达到高峰, 30 min开始减少, 总JNK蛋白的含量无明显改变, MEK4和JNK的激活早于细胞凋亡; 用SP600125预处理HepG2细胞株后, 可以明显减少Caspase-3和PARP的活化.
结论: As2O3可以体外通过诱导细胞凋亡抑制肝癌细胞株HepG2的增殖, 细胞凋亡通过Caspase-3途径实现. JNK信号转导通路参与了As2O3诱导的HepG2凋亡反应, 并位于Caspase-3的上游.
引文著录: 李航宇, 钟鑫平, 隋春阳, 孔凡民, 董明, 张浩, 刘金钢. JNK/SAPK信号转导系统在三氧化二砷诱导肝癌细胞凋亡中的作用. 世界华人消化杂志 2007; 15(7): 688-693
Revised: January 1, 2007
Accepted: January 10, 2007
Published online: March 8, 2007
AIM: To explore of the role of JNK/SAPK signal transduction system in the apoptosis of human hepatocellular carcinoma cell line HepG2 induced by arsenic trioxide (As2O3).
METHODS: Human hepatocellular carcinoma cell line HepG2 was treated with different concentrations of As2O3. MTT assay was used to observe the proliferation of HepG2 cells, and flow cytometry was used to examine the apoptosis rate and growth cycles of the cells. The expression of p-MEK4, JNK, p-JNK, Caspase-3 and poly (ADP ribose) polymerase (PARP) were detected by Western blot before and after JNK signal was blocked by SP600125, a JNK inhibitor.
RESULTS: As2O3 inhibited the proliferation of HepG2 cells in a concentration- and time-dependent manner. Flow cytometry showed that As2O3 induced the apoptosis of HepG2 cells in a time-dependent way, and the cells were mainly blocked in G2/M phase (7.22% ± 1.50%, 11.56% ± 0.73%, 33.8% ± 1.62%, and 46.02% ± 0.11% for 0, 24, 48, and 72 hours, respectively). Western blotting exhibited that As2O3 induced the activation of Caspase-3 and PARP cleavage. The expression of p-MEK4 and p-JNK were detected 10 minutes after As2O3 treatment, reached the peak at the 20th minute, but decreased gradually from the 30th minute, and preceded apoptosis. The content of total JNK had no significant change. The activation of Caspase-3 and PARP were markedly suppressed after SP600125 treatment.
CONCLUSION: As2O3 can inhibit the proliferation and induce the apoptosis of HepG2 cells in vitro. As2O3-induced apoptosis is achieved by the activation of JNK, and then Caspase-3.
- Citation: Li HY, Zhong XP, Sui CY, Kong FM, Dong M, Zhang H, Liu JG. Role of JNK/SPARK signal transduction system in the apoptosis of hepatocellular carcinoma cell line HepG2 induced by arsenic trioxide. Shijie Huaren Xiaohua Zazhi 2007; 15(7): 688-693
- URL: https://www.wjgnet.com/1009-3079/full/v15/i7/688.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i7.688
肝细胞癌(hepatocellular carcinoma, HCC)是我国常见的恶性肿瘤之一, 早期诊断困难, 根治性切除的机会小, 死亡率高, 对放化疗均不敏感, 总体疗效欠佳. 三氧化二砷(arsentic trioxide, As2O3, 亚砷酸)是中国传统中药砒霜的主要有效成分, 我国学者应用As2O3治疗急性早幼粒性白血病(APL)取得了显著的临床效果[1-4]. 近来的大量实验表明, As2O3对肝癌、食管癌、胃癌以及结肠癌等实体瘤亦有明显的抑制作用[5-6]. 其中对肝癌作用研究最广泛[7-10], 认为As2O3可以通过诱导肝癌细胞凋亡实现抗肿瘤作用. 但对于诱导凋亡的机制, 特别是哪些信号转导通路参与其中尚有待进一步阐明. 作为细胞应激产物的c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)/应激激活蛋白激酶(stress-activated protein kinase, SAPK)信号传导系统, 是丝裂素活化蛋白激酶(mitogen activated protein kinases, MAPK)家族的一员[11]. 在应激状态下, JNK信号传导系统的胞质内组分首先感受这些变化, 并将其传递给胞核内的组分, 最终通过核转录因子来调控细胞的表达[12]. 我们通过体外细胞实验, 研究JNK/SPAK信号转导系统在As2O3诱导肝癌细胞凋亡中的作用.
人肝癌细胞株HepG2, 由中国医科大学附属第一医院肿瘤研究所提供. RPMI1640培养液购自北京华美公司, 小牛血清, MTT购自Gibco公司, 二甲基亚砜(DMSO)购自Sigma公司, 兔抗MEK4 (phospho S257+T261) antibody (Abcam产品)[13]、兔抗SAPK/JNK Antibody (CST产品)[14]、兔抗Phospho-SAPK/JNK(Thr183/Tyr185) Antibody(CST)[15]、兔抗PARP Polyclonal Antibody (Biovision产品)、兔抗Cleaved Caspase-3 (Asp175)Antibody (CST产品)及特异性JNK抑制剂SP600125(Alexis Biochemicals产品)[16]均购自晶美生物工程有限公司. 亚砷酸三氧化二砷(As2O3)注射液为哈尔滨伊达药业有限公司上市药品. 肝癌细胞株HepG2常规培养于含100 mL/L小牛血清, 1×105 U/L青霉素及链霉素的RPMI1640培养液中, 置于37℃, 50 mL/L CO2培养箱内培养.
As2O3对肝癌细胞增殖的抑制作用, 用四甲基偶氮唑盐(MTT)比色法进行检测. 取对数生长期细胞制成1×107/L单细胞悬液, 接种96孔培养板, 每孔200 µL, 37℃, 50 mL/L CO2的培养箱培养, 培养24 h后, 弃去培养液, 每孔分别加入终浓度为0.5, 1, 2, 5, 10 µmol/L的As2O3 200 µL, 对照孔加200 µL培养液, 继续培养0-72 h, 实验终止前4 h加入50 g/L MTT溶液20 µL, 继续孵育4 h, 除去每孔培养液, 加DMSO 100 µL, 振荡15 min, 用酶联仪以波长570 nm测定各孔A值. 并计算细胞生长抑制率(%) = (1-加药孔平均A值/对照孔平均A值)×100%. 另取1×106的对数生长期的细胞悬液接种于培养瓶中, 待细胞贴壁后, 采用血清饥饿法使细胞同化. 加入终浓度为10 µmol/L的As2O3溶液, 置培养箱中培养0-72 h. 贴壁细胞用25 g/L胰酶+0.2 g/L乙二胺四乙酸二钠(EDTA)消化、离心(2000 r/min, 5 min), 缓慢加入700 mL/L预冷的乙醇1 mL固定1 h, 加入含有RNase 10 mg/L和50 mg/L的碘化丙啶(Propidium Iodide)的PBS进行染色, 过滤后, 存放在4℃冰箱内, 20 min后上流式细胞仪检测. 使用CELL Quest软件进行分析. 以上实验重复3次, 取其平均值. As2O3作用下Caspase-3和PARP的激活, 采用Western blot进行检测. 根据作用时间的不同分为12, 24, 48和72 h四组, 每组又根据是否有As2O3作用分为两个亚组. 在As2O3作用下JNK/SAPK信号转导系统各因子的变化情况, 采用Western blot进行检测. 根据作用时间的不同分为10, 20和30 min三组, 每组又根据是否有As2O3作用分为两个亚组. JNK信号转导通路阻断采用SP600125, 20 µmol/L, 预处理HepG2细胞株1 h后, 加入As2O3, 检测各指标变化. 根据是否同时有As2O3和SP600125作用交叉分组, 采用Western blot进行检测. 主要步骤为: 取1×106的对数生长期的细胞悬液接种于培养瓶中, 待细胞贴壁后, 采用血清饥饿法使细胞同化. 分别加入终浓度为10 µmol/L的As2O3溶液, 置培养箱中培养0-30 min. PBS洗涤后, 加入适量细胞裂解液裂解细胞, 用细胞刮刀刮下后, 收集于1.5 mL的微量离心管中, 以12 000 r/min离心20 min (4℃). 取上清, 用Bradford法测定蛋白含量. 每种样品各取蛋白50 µg, 上样, 100 g/L SDS-PAGE (分离胶100 g/L, 浓缩胶60 g/L). 泳毕, 将凝胶上的蛋白电转移至硝酸纤维膜(NC)上, 滴加10 g/L BSA封闭后, 依次滴加一抗(兔抗, 工作浓度均为1:1000)及二抗(1:3000 HRP标记的羊抗兔IgG), 于室温下分别作用2, 1 h, 设b-actin为内参照, 洗膜后, 用ECL化学发光法观察结果.
统计学处理 实验数据采用SPSS12.0统计分析软件进行t检验, 所有数值以mean±SD表示, P<0.05有统计学意义.
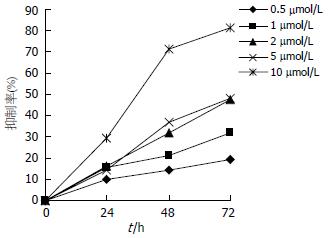
MTT结果显示, 各浓度As2O3均能明显抑制肝癌细胞HepG2增殖(图1), 且具有剂量依赖性和时间依赖性, 抑制率同作用时间呈直线相关(P<0.01). 结果表明, 10 µmol/L组在24, 48和72 h的抑制率分别为29.63%, 71.27%和81.44%, 对HepG2增殖抑制最明显, 因此, 在后续的实验中我们采用10 µmol/L As2O3作为干扰因素, 探讨As2O3对各指标的影响.
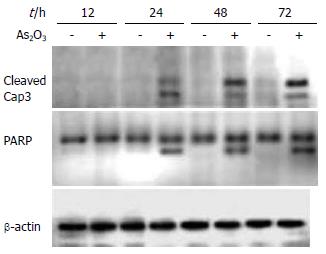
流式细胞术(FCM)分析显示, 将终浓度为10 µmol/L的As2O3溶液作用于肝癌细胞0-72 h后, 经流式细胞仪检测, 结果显示, 作用24, 48和72 h凋亡率分别为15.35%, 24.62%和48.53%, 呈时间依赖性. 对细胞周期的分布表现为, 随着作用时间的增加, S期细胞呈下降趋势, 而G2/M期细胞比例呈上升趋势. 说明细胞滞留于G2/M期(表1). Western blot结果显示, As2O3作用于HepG2细胞24 h后可以看到Caspase-3前体及其底物PARP被剪切激活, 出现活化的Caspase-3条带(cleaved Caspase-3, 17 kDa)和活化的PARP条带(85 kDa), 并随时间延长作用加强(图2).
| 分组(h) | 凋亡 | G0/G1 | S | G2/M |
| 0 | - | 67.35±0.88 | 25.43±1.12 | 7.22±1.50 |
| 24 | 15.35±2.11 | 63.43±1.53 | 25.01±1.27 | 11.56±0.73 |
| 48 | 24.62±3.71 | 41.43±2.24 | 24.77±0.23 | 33.8±1.62 |
| 72 | 48.53±4.22 | 34.41±1.55 | 19.57±2.01 | 46.02±0.11 |
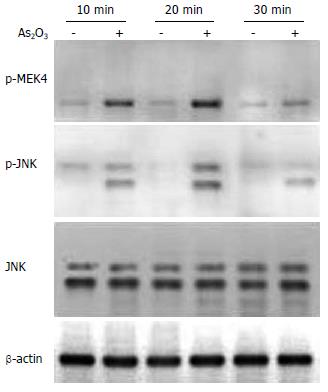
Western blot结果显示, As2O3作用于HepG2细胞10 min后p-MEK4和p-JNK蛋白表达开始增加, 20 min达到高峰, 30 min开始减少. 总JNK蛋白的含量无明显改变(图3). MEK4和JNK的激活早于细胞凋亡.
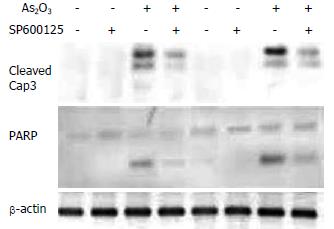
用SP600125, 20 µmol/L, 预处理HepG2细胞株1 h后, 加入As2O3作用48 h, Western blot检测结果显示, SP600125可以明显减少Caspase-3和PARP的活化, 提示JNK信号转导通路参与了As2O3诱导的HepG2细胞凋亡反应(图4).
As2O3的抗肿瘤作用最早在急性早幼粒白血病的治疗中得到体现, 近年来人们开始将As2O3研究的热点转移到各种实体瘤的治疗上, 特别是对肝癌细胞的抑制作用研究的较为深入[17], 发现As2O3可以抑制肝癌细胞的增殖[18]. 我们采用MTT法检测不同浓度As2O3对肝癌细胞株HepG2生长影响的实验, 结果表明As2O3可以使HepG2的生长受到明显的抑制作用, 并且这种抑制作用具有时间依赖性及剂量依赖性, 从而证实As2O3确实具有体外抑瘤作用[19]. 流式细胞分析结果显示, 终浓度为10 µmol/L的As2O3溶液作用于HepG2后, 可以诱导其凋亡, 并具有时间依赖性. Western blot结果进一步揭示, As2O3作用24 h后开始出现活化的Caspase-3和PARP蛋白, 并随时间的延长而表达增加, 持续至少72 h. 由此可见, As2O3抑制肝癌细胞增殖的作用可能是通过诱导细胞凋亡来实现的[20-21]. 细胞凋亡(apoptosis)是正常机体细胞对环境的生理性病理性刺激信号, 环境条件的变化或缓和性损伤产生的应答有序变化的死亡过程, 黏在多细胞生物的组织分化、器官发育、机体稳态的维持中有着重要的意义. 细胞凋亡不是一件被动的过程, 而是主动过程, 黏涉及一系列基因的激活、表达以及调控等的作用. 有研究发现, As2O3作用于肿瘤细胞引起的凋亡在48 h达到较高水平后开始下降, 提示As2O3引起的细胞死亡是非典型死亡, 即凋亡与坏死现象共存, As2O3在诱导肿瘤细胞凋亡的同时也发挥了一定的细胞毒作用[22]. 但本研究结果未发现上述改变, 随着As2O3作用时间的延长, HepG2的凋亡率逐渐增加, 这种作用至少持续72 h. Caspase-3是ICE/CED-3家族的重要成员, 是细胞凋亡调控的重要因子, 以无活性前体存在于细胞质中, 当细胞进入凋亡时被激活, 并可促进ICE家族其他成员一起促进细胞凋亡[23-25]. PARP为Caspase-3的底物, 因Caspase-3的活化将导致细胞发生凋亡性死亡, 所以PARP又被称为"死亡底物"[26]. Caspase-3经激活后能识别PARP中的Asp-Glu-Val-Asp (DVCD)序列, 从而剪切PARP. 目前认为, PARP蛋白的剪切是细胞凋亡的标志. PARP在维持DNA的完整性方面起着重要作用. 当PARP被降解后便失去了对DNA 完整性的监护作用, 结果使受PARP负调控影响的Ca2+/Mg2+依赖性核酸内切酶活性增高, 裂解核小体间的DNA, 引起细胞凋亡[27-29].
有研究表明, As2O3可以通过活化Caspase-3途径诱导人肿瘤细胞凋亡[30-32]. 本研究亦发现, As2O3诱导HepG2细胞凋亡伴有Caspase-3的活化. Caspase-3作为细胞凋亡的执行因子, 受其上游多种信号转导通路的调控. 我们在研究中发现, As2O3作用10 min后开始出现磷酸化MEK4和磷酸化JNK蛋白表达增加, 20 min达到高峰, 30 min开始减少, 且总JNK蛋白表达无变化, 表明p-JNK蛋白的增加是JNK活化所致. 因此, As2O3可以活化MEK4和JNK蛋白[33], 这种作用要早于细胞凋亡的出现(24 h), 即出现活化Caspase-3及PARP. 应用特异性JNK阻断剂SP600125, 预处理HepG2细胞株后, Caspase-3及PARP的活化受到明显抑制. 可见, JNK信号转导通路参与了As2O3诱导的HepG2凋亡反应, 并位于Caspase-3的上游. 由于SP600125并未完全阻断Caspase-3及PARP的活化, 因此As2O3还可以通过其他信号转导通路来活化Caspase-3, 诱导HepG2凋亡. 要阐明所有参与As2O3诱导HepG2凋亡反应的信号转导通路, 尚须进一步的相关研究.
总之, 我们的研究表明, As2O3可以体外通过诱导细胞凋亡抑制肝癌细胞株HepG2的增殖. 细胞凋亡通过Caspase-3途径实现. JNK信号转导通路参与了As2O3诱导的HepG2凋亡反应, 并位于Caspase-3的上游.
As2O3是中国传统中药砒霜的主要有效成分, 我国学者应用As2O3治疗急性早幼粒性白血病(APL ) 取得了显著的临床效果. 近来的大量实验表明As2O3对肝癌、食管癌、胃癌以及结肠癌等实体瘤亦有明显的抑制作用, 但对于As2O3抑制肿瘤的具体机制还有待进一步阐明.
近年来, 关于As2O3体外抑制肝癌细胞株生长和诱导其凋亡的研究成为研究热点,但关于A2O3的具体作用机制尚未研究清楚, 特别是他与调节凋亡的信号转导系统之间的关系有待研究证实.
本研究不但证实了As2O3可以体外通过诱导细胞凋亡抑制肝癌细胞株HepG2的增殖, 并且证实了JNK 信号转导通路参与了As2O3诱导的 HepG2凋亡反应, 并位于Caspase-3 的上游, 首次阐明了As2O3与JNK/ SAPK信号转导系统之间的连系.
针对信号转导通路不同作用点, 特别是JNK/SA PK信号转导系统的抗癌药物已经在国外出现. 阐明A s2O 3与JNK/SAPK信号转导系统之间的连系, 不但有助于揭示其作用机制, 更为其在抗癌领域的临床应用奠定了坚实的基础.
细胞凋亡(apopto-sis): 是正常机体细胞对环境的生理性病理性刺激信号, 环境条件的变化或缓和性损伤产生的应答有序变化的死亡过程, 他在多细胞生物的组织分化、器官发育、机体稳态的维持中有着重要的意义.
本文研究了JNK/SAPK信号转导系统在三氧化二砷诱导肝癌细胞凋亡中的作用, 内容新颖, 总体设计合理, 结果可信, 有较高的参考价值.
电编: 张敏 编辑:王晓瑜
| 1. | 张 鹏, 王 树叶, 胡 龙虎, 施 福东, 邱 凤琴, 洪 珞珈, 韩 雪英, 杨 惠芬, 宋 颖昭, 刘 艳平. 三氧化二砷注射液治疗72例急性早幼粒细胞白血病. 中华血液学杂志. 1996;17:58-60. |
| 2. | Shen ZX, Chen GQ, Ni JH, Li XS, Xiong SM, Qiu QY, Zhu J, Tang W, Sun GL, Yang KQ. Use of arsenic trioxide (As2O3) in the treatment of acute promyelocytic leukemia (APL): II. Clinical efficacy and pharmacokinetics in relapsed patients. Blood. 1997;89:3354-3360. [PubMed] |
| 3. | Jing Y, Dai J, Chalmers-Redman RM, Tatton WG, Waxman S. Arsenic trioxide selectively induces acute promyelocytic leukemia cell apoptosis via a hydrogen peroxide-dependent pathway. Blood. 1999;94:2102-2111. [PubMed] |
| 4. | 高 飞, 易 静, 史 桂英, 李 慧, 金 慧芳, 石 学耕, 汤 雪明. 活性氧水平决定白血病细胞对三氧化二砷诱导凋亡的敏感性. 生物化学与生物物理学报. 2001;33:585-589. |
| 5. | Xiao YF, Liu SX, Wu DD, Chen X, Ren LF. Inhibitory effect of arsenic trioxide on angiogenesis and expression of vascular endothelial growth factor in gastric cancer. World J Gastroenterol. 2006;12:5780-5786. [PubMed] |
| 7. | Oketani M, Kohara K, Tuvdendorj D, Ishitsuka K, Komorizono Y, Ishibashi K, Arima T. Inhibition by arsenic trioxide of human hepatoma cell growth. Cancer Lett. 2002;183:147-153. [PubMed] |
| 9. | 徐 洪雨, 高 媛媛, 武 俏丽, 高 光强, 杨 幼林, 陈 淑香, 刘 铁夫. 三氧化二砷抑制人肝癌细胞株增殖和诱导凋亡作用. 世界华人消化杂志. 2000;8:1233-1237. [DOI] |
| 10. | 邬 红霞, 于 志坚. 三氧化二砷治疗肝胆系统恶性肿瘤机理及临床研究进展. 南通大学学报(医学版). 2006;26:154-156. |
| 12. | Kyriakis JM, Banerjee P, Nikolakaki E, Dai T, Rubie EA, Ahmad MF, Avruch J, Woodgett JR. The stress-activated protein kinase subfamily of c-Jun kinases. Nature. 1994;369:156-160. [PubMed] |
| 13. | Hagemann C, Blank JL. The ups and downs of MEK kinase interactions. Cell Signal. 2001;13:863-875. [PubMed] |
| 14. | Dai Y, Yu C, Singh V, Tang L, Wang Z, McInistry R, Dent P, Grant S. Pharmacological inhibitors of the mitogen-activated protein kinase (MAPK) kinase/MAPK cascade interact synergistically with UCN-01 to induce mitochondrial dysfunction and apoptosis in human leukemia cells. Cancer Res. 2001;61:5106-5115. [PubMed] |
| 15. | Shukla A, Timblin CR, Hubbard AK, Bravman J, Mossman BT. Silica-induced activation of c-Jun-NH2-terminal amino kinases, protracted expression of the activator protein-1 proto-oncogene, fra-1, and S-phase alterations are mediated via oxidative stress. Cancer Res. 2001;61:1791-1795. [PubMed] |
| 16. | Bennett BL, Sasaki DT, Murray BW, O'Leary EC, Sakata ST, Xu W, Leisten JC, Motiwala A, Pierce S, Satoh Y. SP600125, an anthrapyrazolone inhibitor of Jun N-terminal kinase. Proc Natl Acad Sci USA. 2001;98:13681-13686. [PubMed] |
| 17. | Tchounwou PB, Wilson BA, Ishaque AB, Schneider J. Atrazine potentiation of arsenic trioxide-induced cytotoxicity and gene expression in human liver carcinoma cells (HepG2). Mol Cell Biochem. 2001;222:49-59. [PubMed] |
| 18. | 刘 连新, 朱 安龙, 姜 洪池, 周 津, 王 秀琴, 吴 旻. 三氧化二砷对肝癌细胞系BEL-7402的影响. 中国普外基础与临床杂志. 2001;8:209-211, 217. |
| 23. | Nicholson DW, Ali A, Thornberry NA, Vaillancourt JP, Ding CK, Gallant M, Gareau Y, Griffin PR, Labelle M, Lazebnik YA. Identification and inhibition of the ICE/CED-3 protease necessary for mammalian apoptosis. Nature. 1995;376:37-43. [PubMed] |
| 24. | Gottlob K, Fulco M, Levrero M, Graessmann A. The hepatitis B virus HBx protein inhibits caspase 3 activity. J Biol Chem. 1998;273:33347-33353. [PubMed] |
| 26. | Rodriguez-Lafrasse C, Alphonse G, Broquet P, Aloy MT, Louisot P, Rousson R. Temporal relationships between ceramide production, caspase activation and mitochondrial dysfunction in cell lines with varying sensitivity to anti-Fas-induced apoptosis. Biochem J. 2001;357:407-416. [PubMed] |
| 27. | Srinivas G, Anto RJ, Srinivas P, Vidhyalakshmi S, Senan VP, Karunagaran D. Emodin induces apoptosis of human cervical cancer cells through poly(ADP-ribose) polymerase cleavage and activation of caspase-9. Eur J Pharmacol. 2003;473:117-125. [PubMed] |
| 28. | van Wijk SJ, Hageman GJ. Poly(ADP-ribose) polymerase-1 mediated caspase-independent cell death after ischemia/reperfusion. Free Radic Biol Med. 2005;39:81-90. [PubMed] |
| 29. | Koh DW, Dawson TM, Dawson VL. Mediation of cell death by poly(ADP-ribose) polymerase-1. Pharmacol Res. 2005;52:5-14. [PubMed] |
| 31. | 马 银斌, 吴 诚义, 陈 鑫. As2O3对人乳腺癌中NF-κB p65、survivin和caspase-3的作用及相关性研究. 中国普外基础与临床杂志. 2006;13:409-412. |