修回日期: 2006-11-01
接受日期: 2006-11-28
在线出版日期: 2007-02-18
目的: 探讨结肠癌细胞中抑制蛋白激酶B(PKB/Akt)的活化对c-FLIP基因表达的调控作用.
方法: 取对数生长期的HT-29细胞系, 分别采用10、20和40 nmol/L的Akt活化特异性抑制剂wortmannin对其进行干预, 运用MTT法检测不同干预时间点的细胞增殖抑制情况. 采用40 nmol/L的wortmannin干预HT-29细胞0, 3, 6, 12, 24 h后, 采用Western blot检测磷酸化Akt和c-FLIP蛋白表达水平, 逆转录PCR检测c-FLIP基因的转录水平.
结果: 三个浓度的wortmannin都对HT-29细胞的生长具有抑制作用, 随着浓度、时间的递增, 其抑制效应逐渐增强(P<0.01或0.05), 而对照组未见明显变化(P>0.05). 随着wortmannin的干预时间延长, 磷酸化Akt蛋白的表达水平明显降低, 同时c-FLIP蛋白的表达水平也随之下降, 24 h后二者表达水平分别下降了82%和91%. wortmannin干预HT-29细胞3 h后, 与对照组相比其c-FLIP mRNA表达水平已明显下降到40%, 24 h后其表达水平下降到25%.
结论: Akt活化的特异性抑制剂wortmannin可抑制体外培养的结肠癌HT-29细胞的生长, 结肠癌中可能存在Akt/c-FLIP信号通路调节c-FLIP基因的表达.
引文著录: 周晓东, 陈红霞, 吕农华, 朱萱, 徐萍, 陈幼祥, 于红刚, 于皆平. 抑制Akt活化对人结肠癌细胞c-FLIP基因表达的作用. 世界华人消化杂志 2007; 15(5): 513-517
Revised: November 1, 2006
Accepted: November 28, 2006
Published online: February 18, 2007
AIM: To investigate the changes of cellular Fas associated death domain-like IL-1β-converting enzyme-inhibitory protein (c-FLIP) expression after the inhibition of protein kinase B (PKB/Akt) activation.
METHODS: Human colon cancer cell line HT-29 was treated with 10, 20 and 40 nmol/L wortmannin (a specific inhibitor for Akt activation) for 0, 3, 6, 12 and 24 hours. MTT assay was used to detect the proliferation of HT-29 cells. After HT-29 cells were treated with 40 nmol/L wortmannin, the levels of phosphorylated Akt (pAkt) and c-FLIP protein were determined by Western blot, and the transcription of c-FLIP gene was detected by reverse transcriptase-polymerase chain reaction (RT-PCR) at the 0, 3rd, 6th, 12th and 24th hour.
RESULTS: Wortmannin suppressed the proliferation of HT-29 cells in a concentration- and time-dependent manner (P < 0.01 or P < 0.05). With the prolonging of treatment time, the level of pAkt protein expression was obviously decreased, while the expression of c-FLIP protein was also down-regulated, with decreased rates of 82% and 91% at the 24th hour, respectively. After wortmannin for 3 hours, the mRNA expression of c-FLIP was decreased to 40% of the control cells, and for 24 hours, it was decreased to 25% of the control ones.
CONCLUSION: Wortmannin, a specific inhibitor for Akt activation, may inhibit the proliferation of HT-29 cells in vitro by down-regulation of c-FLIP gene.
- Citation: Zhou XD, Chen HX, Lv NH, Zhu X, Xu P, Chen YX, Yu HG, Yu JP. Inhibition of Akt activation down-regulates the expression of cellular Fas associated death domain-like IL-1β-converting enzyme-inhibitory protein in human colon cancer cell line. Shijie Huaren Xiaohua Zazhi 2007; 15(5): 513-517
- URL: https://www.wjgnet.com/1009-3079/full/v15/i5/513.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i5.513
细胞FLICE抑制蛋白(cellular FLICE inhibitory protein, c-FLIP)亦称caspase-8抑制蛋白, 是新近发现的抗凋亡蛋白, 他能抑制死亡受体介导的凋亡[1-2]. 已有研究表明, c-FLIP在多种人类肿瘤如肺癌、恶性黑色素瘤、非霍奇金淋巴瘤及肝癌等组织细胞中过表达, 并发现其与肿瘤的发生、发展密切相关[3-5], 我们近期的研究亦发现, c-FLIP亦过表达于胃癌及结肠癌组织中[6-9], 但有关c-FLIP表达的调控机制尚未阐明. 多种肿瘤中的研究结果表明, 蛋白激酶B(protein kinase B, PKB/Akt)经过磷酸化而活化后可促进c-FLIP的表达而抑制细胞凋亡. 然而, 在结肠癌细胞系中有关c-FLIP表达与Akt信号通路的关系还不明了. 本实验采用Akt活化的特异性抑制剂wortmannin进行干预, 旨在探讨结肠癌细胞中Akt对c-FLIP表达的调控作用.
人大肠癌细胞株HT-29购自湖南湘雅医学院肿瘤研究所, 为中分化大肠腺癌. RPMI1640培养基干粉和胎牛血清为Gibco公司产品, 青霉素、链霉素为华北制药有限公司, 胰蛋白酶为Sigma公司产品, wortmannin为Alexis Biochemical公司产品, 兔抗人c-FLIPL/S多克隆抗体为Santa Cruz公司产品, 鼠抗人Akt Ser473磷酸化mAb、HRP-羊抗兔IgG和HRP-羊抗鼠IgG、预染色的蛋白Marker及增强化学发光显色试剂盒(LumiGLOTM)购自Cell Signaling技术公司, TRIzol试剂为Invitrogen公司产品; MMLV逆转录酶为Promega公司产品; Taq酶、dNTP、RNasin为Takara公司产品; PCR引物及寡聚核苷酸由上海生物工程公司合成.
HT-29细胞株在含100 mL/L的小牛血清, 100 U/mL青霉素, 100 mg/L链霉素的RPMI 1640培养基中, 于37℃、50 mL/L CO2、饱和湿度条件下培养、增殖、传代、扩增以备用.
1.2.1 MTT法检测wortmannin的干预对HT-29细胞增殖活性的影响: 取对数生长期的HT-29细胞, 2.5 g/L胰蛋白酶消化, 通过血球计数板计数, 用培养液制成单细胞悬液, 调整细胞密度为5×107/L. 接种细胞于96孔培养板, 每孔200 µL, 含1×104细胞, 另取1孔加入不含细胞的培养液作为空白调零孔, 置于37℃, 50 mL/L CO2的培养箱中培养24 h后换无血清的RPMI1640培养液培养, 再孵育24 h使细胞同步化后分组进行实验. 细胞培养24 h后, 更换培养液. 实验组: 加不同浓度的wortmannin, 使其终浓度分别为10 nmol/L, 20 nmol/L, 40 nmol/L; 对照组: 培养液不加wortmannin. 每组均为5孔, 于37℃、50 mL/L CO2的培养箱中继续培养. 呈色及比色: 培养第0, 3, 6, 12, 24 h后, 在每孔加入MTT溶液(5 g/L)20 µL, 37℃继续培养4 h后, 小心吸弃上清, 每孔加入DMSO 150 µL振荡10 min, 使结晶物充分溶解, 以空白孔调零, 在酶标仪中检测490 nm波长处每孔吸光度值(absorbance, A值), 吸光度值取平均值, 以均数±标准差(mean±SD)表示, 重复试验3次. 按下式计算细胞存活率: 细胞存活率(%) = (实验孔A值/对照孔A值)×100%.
1.2.2 wortmannin干预后HT-29细胞pAkt(Ser473)及c-FLIP蛋白的检测: 将细胞悬浮液接种到底面积为50 cm2的培养瓶中, 待细胞生长到对数生长期, 用不含血清的RPMI1640培养液处理细胞24 h, 使细胞同步化后, 做如下分组: A组, 用不含小牛血清的RPMI1640培养液作为对照; B组: 无血清的RPMI1640培养液中加入40 nmol/L的wortmannin, 作用时间分别为0, 3, 6, 12, 24 h. 每组收集等量细胞(2×105), 提取细胞总蛋白, 用考马斯亮蓝法测定蛋白浓度; 以β-actin的水平作为等量蛋白质上样对照, 每个样本至少重复3遍, 取50 μg蛋白质样品进行SDS-PAGE电泳, 并转至硝酸纤维膜(PVDF)上, 加入100 g/L脱脂奶粉室温封闭2 h后, 加入一抗工作液(兔抗人c-FLIPL/S多克隆抗体和鼠抗人Akt Ser473磷酸化mAb的稀释度皆为1:1000)后4℃过夜, 加入辣根过氧化物酶标记的羊抗兔或鼠IgG二抗(1:2000), 室温摇床孵育2 h, 增强化学发光显色系统显色, 暗室内X光底片感光成像.
1.2.3 wortmannin干预后HT-29细胞中c-FLIP的转录水平检测: 收集HT-29细胞, 每5×106-10×106个细胞加入1 mL TRIzol提取总RNA, 每例取总RNA 2 μg用MMLV逆转录酶进行逆转录, PCR扩增c-FLIP, 同时扩增β-actin作为内参照, 每个标本至少重复3遍, c-FLIP引物序列(512 bp): 5'-TGT TGC TAT AGA TGT GG-3'(sense), 5'-AAG GAT CCT TGA GAC TCT-3'(antisense); β-actin引物序列(475 bp): 5'-TGA CGG GGT CAC CCA CAC TGT GCC-3'(sense), 5'-CTG CAT CCT GTC GGC AAT GCC AG-3'(antisense). 95℃ 3 min 预变性后开始循环: 95℃ 30 s, 53℃ 30 s, 72℃ 45 min, 共30个循环, 最后于72℃延伸7 min. 扩增产物在15 g/L琼脂糖凝胶上电泳分离, 并在凝胶成像系统中计算每个样本所测得的c-FLIP与β-actin的积分光密度比值.
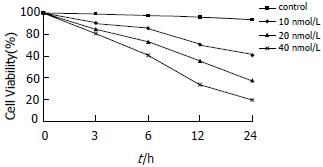
用终浓度10 nmol/L, 20 nmol/L, 40 nmol/L的wortmannin分别处理生长良好的HT-29细胞0, 3, 6, 12、24 h, 采用MTT法检测其对细胞增殖的影响. 3个浓度的wortmannin都对HT-29细胞的生长具有抑制作用, 随着浓度、时间的递增, 其抑制效应逐渐增强(P<0.01或P<0.05), 而对照组未见明显变化(P>0.05)(图1).
wortmannin是PI3'K特异性抑制剂, PI3'K的活性抑制后可导致Akt不能磷酸化而活化. 本实验通过在结肠癌细胞株HT-29中加入wortmannin干预不同的时间, 以观察磷酸化Akt蛋白水平的变化及其对c-FLIP蛋白表达的影响. 经与β-actin的相对积分光密度分析表明, 随着wortmannin的干预时间延长, 磷酸化Akt蛋白的表达水平明显降低, 干预24 h后下降到基础水平的18%; 同时, western blot亦显示c-FLIP蛋白的表达水平也随之下降, 3 h后其表达水平已明显降低, 至24 h则降至基础水平的9%(图2)
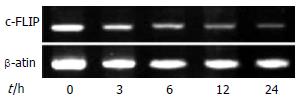
wortmannin干预3 h后, c-FLIP mRNA表达水平已明显下降到40%, 24 h后其表达水平下降到25%(图3).
大肠肿瘤的发生、发展过程中包含了一系列的基因突变(如p53, APC, DCC, ras), 随着基因突变的不断累积最终导致正常肠腺上皮转变为腺瘤乃至恶性转化为腺癌. 其中凋亡失衡在这一过程中起着重要的作用, 结肠腺癌细胞可通过不同的机制逃逸受体介导的凋亡, 使肿瘤细胞继续生长. c-FLIP基因是最近发现的抗凋亡基因, c-FLIP蛋白能抑制caspase-8的活化从而阻断死亡受体Fas, TNF-R1, DR3及TRAIL-R介导的凋亡.
我们在前期的研究中发现, c-FLIP基因过高表达于胃癌、子宫内膜癌中, 并且与细胞凋亡的抑制密切相关, 另外, 我们同样发现在结肠癌组织亦存在c-FLIP基因的上调表达. 然而, 有关c-FLIP在肿瘤中表达的调节机制还不明了, 尤其是促其表达上调的上游分子事件还知之甚少. 已知, 在一系列生长因子的刺激下, 活化的Akt可通过磷酸化作用于不同的下游分子(如Forkhead转录因子家族、核转录因子κB及Erk等)而抑制凋亡, 最近有研究表明, Akt可促进c-FLIP的表达而抑制细胞凋亡, 这在肝癌[10]、卵巢癌细胞系[11]、肾细胞癌细胞系[12]、甲状腺癌细胞系[13]、内皮细胞[14]、乳腺癌及黑色素瘤细胞系中都得到了证实[15]. 然而, 在结肠癌中Akt对c-FLIP的表达有否调控作用还不明了. 我们通过检测结肠癌HT-29细胞系中Akt的活化与c-FLIP基因表达的关系, 以初讨在结肠癌中是否亦存在Akt/FLIP调节通路, 从而进一步了解c-FLIP表达的调节机制.
既往研究表明, 非磷酸化Akt蛋白不具备生物学活性, 然而Akt可经PI3K/Akt信号途径的磷酸化作用生成磷酸化Akt(phosphorylated Akt, pAkt)而活化, 其后pAkt能够通过两种不同的机制促进细胞转化: (1)促进细胞增殖, 使肿瘤细胞通过正常的细胞周期阻滞; (2)抑制细胞凋亡, 使肿瘤细胞免于机体自身所诱导的死亡, 延长其生存时间[16]. wortmannin是PI3'K特异性抑制剂, PI3'K的活性抑制后可导致Akt不能磷酸化而活化. 本实验在体外培养的HT-29细胞中加入wortmannin后其生长明显受到抑制, pAkt表达水平明显降低, 同时伴有c-FLIP蛋白的显著下调表达, 故此我们推测, 在结肠癌中存在Akt/FLIP信号通路调节c-FLIP基因的表达.
为了进一步考察wortmannin对c-FLIP蛋白表达的抑制效应是否伴随有c-FLIP基因转录水平的下调, 我们采用了逆转录PCR检测wortmannin干预不同时间点及对照组中HT-29的c-FLIP mRNA表达水平, 结果显示wortmannin干预3 h后, c-FLIP mRNA表达水平已明显下降达40%, 24 h后其表达水平下降达75%. 由此我们认为, 在HT-29细胞系中, wortmannin通过抑制Akt的活化而下调c-FLIP基因转录水平, 进一步导致c-FLIP蛋白表达的下调.
总之, 本研究表明在结肠癌细胞中, c-FLIP基因的表达水平依赖于Akt蛋白的活化, 存在一条Akt/FLIP信号通路调节FLIP基因的表达, 然而, 其确切的机制还不明了. 既往的研究表明, Akt能够磷酸化多种转录调控因子(如叉头转录因子和核因子-κB等), 而这些转录调控因子大多参与凋亡相关基因的表达. 核因子-κB在结肠癌等消化系疾病中扮演着重要角色[17-18], Micheau等发现HeLa细胞中核因子-κB的活化可诱导FLIP基因的转录[19], 在胰腺癌细胞和卵巢癌中同样存在此现象最新的研究表明, 在结肠癌细胞系Caco-2中, 核因子-κB能够调控FLIP基因的表达[20], 故此, 我们推测, 结肠癌中Akt可能通过活化核因子-κB后而进一步促进FLIP基因的转录, 当然, 这还有待于深入的研究验证.
细胞FLICE抑制蛋白(c-FLIP)亦称 caspase-8抑制蛋白, 是新近发现的抗凋亡蛋白, 他能抑制死亡受体介导的凋亡. 目前已发现在多种人类肿瘤组织细胞中存在c-FLIP的过表达, 并发现其与肿瘤的发生、发展密切相关, 本文课题组近期的研究亦发现, c-FLIP亦过表达于胃癌、结肠癌及子宫内膜癌组织中,但有关c-FLIP表达的调控机制尚未阐明. 多种肿瘤中的研究结果表明, 蛋白激酶B经过磷酸化而活化后可促进c-FLIP的表达而抑制细胞凋亡. 然而, 在结肠癌细胞系中有关c-FLIP表达与Akt信号通路的关系还不明了.
有关凋亡的研究一直是肿瘤研究的热点问题, 诱导肿瘤细胞的凋亡是肿瘤治疗的思路之一. 多种化疗药物都是通过诱导肿瘤细胞的凋亡而发挥作用的. 死亡受体介导的凋亡是参与肿瘤细胞凋亡的重要机制之一, 也是药物的重要作用靶之一. 然而, 死亡受体介导凋亡的机制和上下游信号通路还不明确. c-FLIP因具有强大的抗死亡受体介导凋亡的作用而倍受人们关注,有关c-FLIP抗凋亡的机制也成为研究热点之一.
既往国外的和我们的研究已发现,在结肠癌组织中存在c-FLIP基因的上调表达. 本文首次提出, 在结肠癌细胞中, Akt可促进c-FLIP基因表达, 从而进一步抑制肿瘤细胞凋亡, 这一发现必将丰富肿瘤生物学理论.
本文的研究证实在结肠癌细胞中存在Akt/c-FLIP信号通路调节c-FLIP基因的表达, 这一成果可进一步指导基于死亡受体凋亡通路的抗肿瘤研究, 必将为以后肿瘤的活学和基因治疗提供有益的思路和线索.
磷酸化活化: 某些蛋白的氨基酸序列上的某些位点被上游物质磷酸化后才具有生物学活性, 如Akt蛋白在磷酸化后才具有抗凋亡和促增殖活性.
本研究对结肠癌细胞FLICE抑制蛋白和蛋白激酶B (PKB/Akt) 的关系进行了初步的研究, 表明Akt活化的抑制可抑制c-FLIP基因的表达及癌细胞的生长, 提示结肠癌中可能存在Akt/c-FLIP信号通路调节. 研究设计较为合理, 方法得当, 结果明确,对于进一步揭示Akt/c-FLIP信号通路的机制有指导意义.
电编: 李琪 编辑:张焕兰
| 1. | Thome M, Schneider P, Hofmann K, Fickenscher H, Meinl E, Neipel F, Mattmann C, Burns K, Bodmer JL, Schroter M. Viral FLICE-inhibitory proteins (FLIPs) prevent apoptosis induced by death receptors. Nature. 1997;386:517-521. [PubMed] |
| 2. | Hu S, Vincenz C, Ni J, Gentz R, Dixit VM. I-FLICE, a novel inhibitor of tumor necrosis factor receptor-1- and CD-95-induced apoptosis. J Biol Chem. 1997;272:17255-17257. [PubMed] |
| 3. | Zhang XD, Franco A, Myers K, Gray C, Nguyen T, Hersey P. Relation of TNF-related apoptosis-inducing ligand (TRAIL) receptor and FLICE-inhibitory protein expression to TRAIL-induced apoptosis of melanoma. Cancer Res. 1999;59:2747-2753. [PubMed] |
| 4. | Thomas RK, Kallenborn A, Wickenhauser C, Schultze JL, Draube A, Vockerodt M, Re D, Diehl V, Wolf J. Constitutive expression of c-FLIP in Hodgkin and Reed-Sternberg cells. Am J Pathol. 2002;160:1521-1528. [PubMed] |
| 5. | Thome M, Tschopp J. Regulation of lymphocyte proliferation and death by FLIP. Nat Rev Immunol. 2001;1:50-58. [PubMed] |
| 7. | Zhou XD, Yu JP, Liu J, Luo HS, Chen HX, Yu HG. Overexpression of cellular FLICE-inhibitory protein (FLIP) in gastric adenocarcinoma. Clin Sci (Lond). 2004;106:397-405. [PubMed] |
| 9. | Zhou XD, Yu JP, Chen HX, Yu HG, Luo HS. Expression of cellular FLICE-inhibitory protein and its association with p53 mutation in colon cancer. World J Gastroenterol. 2005;11:2482-2485. [PubMed] |
| 10. | Okano H, Shiraki K, Inoue H, Kawakita T, Yamanaka T, Deguchi M, Sugimoto K, Sakai T, Ohmori S, Fujikawa K. Cellular FLICE/caspase-8-inhibitory protein as a principal regulator of cell death and survival in human hepatocellular carcinoma. Lab Invest. 2003;83:1033-1043. [PubMed] |
| 11. | Kamsteeg M, Rutherford T, Sapi E, Hanczaruk B, Shahabi S, Flick M, Brown D, Mor G. Phenoxodiol-an isoflavone analog-induces apoptosis in chemoresistant ovarian cancer cells. Oncogene. 2003;22:2611-2620. [PubMed] |
| 12. | Asakuma J, Sumitomo M, Asano T, Asano T, Hayakawa M. Selective Akt inactivation and tumor necrosis actor-related apoptosis-inducing ligand sensitization of renal cancer cells by low concentrations of paclitaxel. Cancer Res. 2003;63:1365-1370. [PubMed] |
| 13. | Poulaki V, Mitsiades CS, Kotoula V, Tseleni-Balafouta S, Ashkenazi A, Koutras DA, Mitsiades N. Regulation of Apo2L/tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis in thyroid carcinoma cells. Am J Pathol. 2002;161:643-654. [PubMed] |
| 14. | Suhara T, Mano T, Oliveira BE, Walsh K. Phosphatidylinositol 3-kinase/Akt signaling controls endothelial cell sensitivity to Fas-mediated apoptosis via regulation of FLICE-inhibitory protein (FLIP). Circ Res. 2001;89:13-19. [PubMed] |
| 15. | Panka DJ, Mano T, Suhara T, Walsh K, Mier JW. Phosphatidylinositol 3-kinase/Akt activity regulates c-FLIP expression in tumor cells. J Biol Chem. 2001;276:6893-6896. [PubMed] |
| 16. | Fresno Vara JA, Casado E, de Castro J, Cejas P, Belda-Iniesta C, Gonzalez-Baron M. PI3K/Akt signalling pathway and cancer. Cancer Treat Rev. 2004;30:193-204. |
| 18. | 凌 江红, 李 家邦, 聂 海明, 蒋 荣鑫, 申 定珠, 韦 宗平. 幽门螺杆菌阳性消化性溃疡患者胃黏膜核因子kappaB、beta-防御素-2表达及其与胃窦炎症的关系. 世界华人消化杂志. 2006;14:376-381. [DOI] |
| 19. | Micheau O, Lens S, Gaide O, Alevizopoulos K, Tschopp J. NF-kappaB signals induce the expression of c-FLIP. Mol Cell Biol. 2001;21:5299-5305. [PubMed] |
| 20. | Wang Q, Wang X, Zhou Y, Evers BM. PKCdelta-mediated regulation of FLIP expression in human colon cancer cells. Int J Cancer. 2006;118:326-334. [PubMed] |