修回日期: 2006-12-01
接受日期: 2006-12-18
在线出版日期: 2007-02-18
目的: 研究水通道蛋白-1(AQP-1)在急性胰腺炎大鼠肺组织中的表达及其功能, 探讨其表达与肺损伤的关系.
方法: 将Wistar大鼠分为假手术组(n = 24)、肺损伤组(n = 24)、地塞米松治疗组(n = 24). 采用逆行胰胆管注射15 g/L去氧胆酸诱发大鼠急性胰腺炎肺损伤模型, 地塞米松组于造模后立即于尾静脉注射地塞米松2 mg/kg. 每组分别于造模后4, 8, 12 h剖杀, 取血及肺组织. 通过检测血淀粉酶、血气、肺干/湿比值和肺组织病理切片判断胰腺炎及肺损伤的严重程度, 放免法测血清TNF-α水平, RT-PCR检测肺组织AQP-1 mRNA的表达, 免疫组化法检测肺组织AQP-1的表达.
结果: 与假手术组相比, 胰腺炎肺损伤组血清淀粉酶、肺干/湿比值、TNF-α、肺组织病理损害程度明显升高, 血氧、AQP-1 mRNA(4 h: 0.403±0.018 vs 0.794±0.015, P<0.01; 8 h: 0.382±0.025 vs 0.812±0.032, P<0.01; 12 h: 0.361±0.016 vs 198±5, P<0.01)和AQP-1蛋白(4 h: 104±4 vs 193±8, P<0.01; 8 h: 96±5 vs 201±7, P<0.01; 12 h: 94±3 vs 198±5, P<0.01)表达显著下调. 与肺损伤组相比, 地塞米松组血清淀粉酶、TNF-α、肺干/湿比值、肺组织病理损害程度明显降低, 血氧、AQP-1 mRNA(4 h: 0.681±0.031 vs 0.403±0.018, P<0.05; 8 h: 0.763±0.013 vs 0.382±0.025, P<0.05; 12 h: 0.784±0.032 vs 0.361±0.016, P<0.05)和AQP-1的蛋白(4 h: 145±6 vs 104±4, P<0.05; 8 h: 152±8 vs 96±5, P<0.05; 12 h: 154±4 vs 94±3, P<0.05)表达则明显升高, 且与TNF-α的水平呈负相关性.
结论: 水通道蛋白-1表达与急性胰腺炎的肺损伤密切相关, 其表达可能与TNF-α有关, 地塞米松可上调其表达而减轻肺水肿.
引文著录: 高振明, 陈海龙, 刘小东. 急性胰腺炎大鼠肺组织中水通道蛋白-1的表达及功能. 世界华人消化杂志 2007; 15(5): 453-457
Revised: December 1, 2006
Accepted: December 18, 2006
Published online: February 18, 2007
AIM: To investigate the expression of aquaporin-1 (AQP-1) in acute lung injury induced by severe acute pancreatitis (SAP) in rats, and to explore the relationship between AQP-1 expression and acute lung injury (ALI).
METHODS: Adult Wistar rats were randomly divided into 3 groups: sham operation (SO) group, ALI group and dexamethasone (DEX, 2 mg/kg via caudal vein) group. Sodium deoxycholate was (15 g/L) injected inversely into the biliopancreatic duct of rats to make the model of SAP-induced ALI. Eight rats of each group (n = 8) were killed 4, 8, 12 h respectively after SAP model was established, and blood samples and lung tissues were collected. Serum amylase, partial pressure of oxygen, lung wet-to-dry weight ratio (W/D) and pulmonary homogenate were measured to evaluate the degrees of pancreatic inflammation and ALI. Serum level of tumor necrosis factor-α (TNF-α) was also measured. Reverse transcription-polymerase chain reaction (RT-PCR) was used to quantify AQP-1 mRNA changes and immunohistochemistry was used to detect AQP-1 protein expression in lung tissues.
RESULTS: As compared with those in SO group, the levels of serum amylase, TNF-α, the value of W/D, and the pathological changes of lung tissues were obviously increased in ALI group, while the partial pressure of oxygen, the expression of AQP-1 mRNA (4 h: 0.403 ± 0.018 vs 0.794 ± 0.015, P < 0.01; 8 h: 0.382 ± 0.025 vs 0.812 ± 0.032, P < 0.01; 12 h: 0.361 ± 0.016 vs 198 ± 5, P < 0.01) and AQP-1 protein (4 h: 104 ± 4 vs 193 ± 8, P < 0.01; 8 h: 96 ± 5 vs 201 ± 7, P < 0.01; 12 h: 94 ± 3 vs 198 ± 5, P < 0.01) were significantly decreased. However, DEX treatment elevated the partial pressure of oxygen, the expression of AQP-1 mRNA (4 h: 0.681 ± 0.031 vs 0.403 ± 0.018, P < 0.05; 8 h: 0.763 ± 0.013 vs 0.382 ± 0.025, P < 0.05; 12 h: 0.784 ± 0.032 vs 0.361 ± 0.016, P < 0.05) and AQP-1 protein (4 h: 145 ± 6 vs 104 ± 4, P < 0.05; 8 h: 152 ± 8 vs 96 ± 5, P < 0.05; 12 h: 154 ± 4 vs 94 ± 3, P < 0.05) in lung tissues while lowered the levels of serum amylase, TNF-α, the value of W/D and the pathological changes of lung tissues. The level of serum TNF-α was negatively correlated with the expression of AQP-1.
CONCLUSION: AQP-1 may play an important role during ALI induced by SAP. The expression of AQP-1 is probably adjusted by TNF-α. DEX can decrease the pulmonary edema by increasing the expression of AQP-1.
- Citation: Gao ZM, Chen HL, Liu XD. Expression and function of aquaporin-1 in acute lung injury induced by severe acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(5): 453-457
- URL: https://www.wjgnet.com/1009-3079/full/v15/i5/453.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i5.453
急性重症胰腺炎(severe acute pancreatitis, SAP)发病急剧, 病情凶险, 早期合并以肺水肿为主要表现的急性肺损伤(acute lung injury, ALI)而加重病情[1]. 以往的研究多认为其损伤机制与炎症介质和细胞因子的过度释放有关[2], 而对水通道蛋白在肺损伤中的作用研究甚少, 其对肺水肿形成的影响尚不清楚. 本实验观察急性胰腺炎大鼠肺组织中水通道蛋白-1(aquaporin-1, AQP-1)表达的变化以及地塞米松对其表达的影响, 从新的角度探讨急性胰腺炎时肺损伤的发病机制.
成年Wistar大鼠, 雌雄不限, 体质量200-250 g, 由大连医科大学实验动物中心提供; TNF-α放免试剂盒、AQP-1抗体、免疫组化试剂盒购自武汉博士德生物工程有限公司; RT-PCR试剂盒购自大连宝生物工程公司.
1.2.1 动物模型及分组: 大鼠随机分3组: 假手术组(SHAM组), 胰腺炎肺损伤组(ALI组)和地塞米松治疗组(DEX组), 每组24只. ALI模型制备: 以15 g/L的熊去氧胆酸钠逆行注入胰胆管诱发胰腺炎肺损伤模型; SHAM组只在剖腹后翻动胰腺; DXE组在造模后立即于股静脉注射地塞米松2 mg/kg. 在造模后4, 8, 12 h每组随机选取8只(n = 8), 腹主动脉及下腔静脉采血, 动脉血立即行血气分析, 静脉血离心后血清置-70℃冰箱保存备用.
1.2.2 肺干/湿比值测定: 动物放血致死后取左肺叶称湿质量, 置60℃烤箱连续烘烤24 h, 去除水分后称干质量.
1.2.3 肺组织病理形态观察: 取右肺部分组织甲醛固定、石蜡包埋, 切片5 μm, HE染色观察.
1.2.4 血清淀粉酶测定: 采用酶法, 由HITACHI自动生化分析仪测定.
1.2.5 血清TNF-α水平测定: 采用放免法, 按试剂盒操作程序进行.
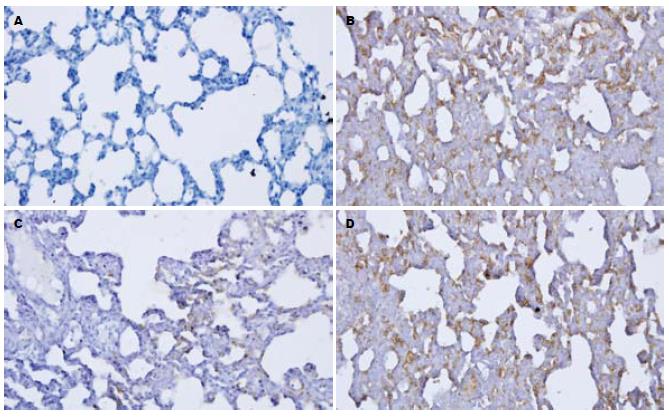
1.2.6 肺组织中AQP-1免疫组化检测: 取右肺组织常规脱水、包埋制成蜡块, 用于免疫组化染色. 采用SP法, PBS代替一抗作为阴性对照, 按免疫组化试剂盒说明书操作. 结果判定: 每只大鼠取3张切片进行图像分析, 求其平均灰度.
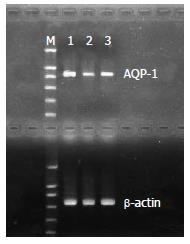
1.2.7 肺组织中AQP-1 mRNA表达检测: 取右肺组织, 提取总RNA. RT-PCR采用一步法. AQP-1引物设计: 上游为5' ATGGCCAGCGAAATCAA GAAG 3'; 下游引物为5'GATATCATCAGCAT CCAGGTC 3'. β-action作为内参照, 其引物设计: 上游为5' GATATCGCTGCGCTCGTCGTC 3'; 下游为5' CATGAGGTAGTCTGTCAGGTC 3'. PCR反应条件: 94℃预变性5 min, 98℃变性10 s, 55℃退火30 s, 72℃延伸10 s, 循环30次, 72℃延伸1 min, 最后降至4℃结束反应. PCR产物在琼脂糖凝胶中电泳后采用凝胶成像系统记录分析.
统计学处理 所有数据用mean±SD标准差表示, 通过SPSS11.0统计软件, 采用单因素方差分析对各组均数进行显著性检验, P<0.05具有显著性差异.
光镜下SHAM组肺组织正常. ALI组4, 8, 12 h可见肺间质高度充血、水肿, 大量炎性细胞浸润, 可见广泛的肺泡出血, 肺间隔增厚, 部分肺泡腔融合形成肺大泡. 随着时间延长, 上述表现呈逐渐加重趋势. 按雷文章肺组织病理评分标准[3], 组织学评分显著高于SHAM组(P<0.01), 而DEX组肺组织炎症反应明显减轻, 组织学评分显著低于ALI组(P<0.01). 肺组织学评分见表1.
SHAM组血清淀粉酶水平处于低水平, ALI组明显升高(P<0.01), 而DEX组较ALI组显著降低(P<0.05)(表2).
| 分组 | 时间(h) | Amy(μkat/L) | Po2(mmHg) | W/D | TNF-α(ng/L) | AQP-1 mRNA | AQP-1免疫组化 |
| SHAM组 | 4 | 15.2±1.5 | 12.6±0.5 | 5.28±0.32 | 71.25±5.25 | 0.794±0.015 | 193±8 |
| 8 | 17.5±0.7 | 11.3±0.7 | 6.31±0.25 | 74.31±6.43 | 0.812±0.032 | 201±7 | |
| 12 | 16.0±1.6 | 11.8±0.4 | 6.12±0.31 | 78.28±5.26 | 0.782±0.021 | 198±5 | |
| ALI组 | 4 | 68.7±6.0b | 8.7±0.8b | 9.52±0.71b | 143.47±29.00b | 0.403±0.018b | 104±4b |
| 8 | 75.7±7.3b | 7.9±1.1b | 10.45±0.47b | 234.20±13.23b | 0.382±0.025b | 96±5b | |
| 12 | 69.2±8.9b | 7.4±0.8b | 11.72±0.68b | 273.86±14.21b | 0.361±0.016b | 94±3b | |
| DEX组 | 4 | 20.5±2.3d | 10.6±0.2c | 6.82±0.28c | 98.32±27.00c | 0.681±0.031c | 145±6c |
| 8 | 21.9±2.8d | 10.1±0.3c | 6.72±0.34c | 110.48±32.12c | 0.763±0.013c | 152±8c | |
| 12 | 18.8±3.6d | 9.8±0.5c | 6.12±0.52c | 108.72±27.42c | 0.784±0.032c | 154±4c |
ALI组显著升高, 并随时间延长逐渐升高; 而SHAM组及DEX组明显低于ALI组(表2).
ALI组肺干/湿比值明显增加, DEX组与其相比显著性降低(P<0.05)(表2).
ALI组AQP-1 mRNA表达较SHAM组显著下调(P<0.01), 而DEX组则较ALI组明显上调(P<0.05)(表2, 图1).
SAP发病急剧, 病死率高. 早期死亡的主要原因是由于合并出现了ALI[1], 因此在SAP早期采取有效的治疗措施, 减少ALI的发生, 会大大提高SAP的生存率. 对于ALI的发病机制, 以往的研究认为炎症介质和细胞因子的过度激活与释放有关[2]. 其中TNF-α作为SAP早期即出现的炎症介质, 被认为是引起ALI的关键性物质, 其出现及水平的高低已经成为判定SAP发病严重程度及预后的早期指标[4-5]. ALI后肺水肿是导致急性呼吸功能衰竭的病理基础, 虽然涉及的因素较多, 但主要是肺内液体渗出与清除失衡的结果. 以往人们一直侧重研究血管内皮细胞的通透性, 而对病理条件下肺组织水通道蛋白的作用认识不足.
AQP是1990年代早期人们发现的、存在哺乳动物细胞膜上的一类疏水性蛋白, 是一种可调节进出细胞膜的水通道同源蛋白质大家族的总称, 他的存在很好解释了水分子的快速转运[6-7]. AQPs不仅参与生理状态下液体的转运, 可能还与病理状态下液体的转运失衡有关. 目前已证实肺组织中存在AQP-1, AQP-3, AQP-4, AQP-5等, 并参与了多种肺水肿性疾病的发生, 尤其是AQP-1被证实参与了高氧肺损伤、内毒素肺损伤等多种病理生理过程[8-10]. 而对于SAP继发ALI的病理过程中AQP-1作用目前研究甚少. 本实验结果证实, 在SAP继发ALI的过程中, 随着肺水肿的出现, AQP-1在肺组织中的蛋白表达及mRNA水平出现下调, 与SHAM组相比有显著差异(P<0.01), 其下调水平与肺水肿的程度成正比. 而在DEX组, 肺水肿程度较ALI组减轻, AQP-1在肺组织中的蛋白表达及mRNA水平相应出现显著上调(P<0.05), 证实了AQP-1确实参与肺水肿的形成. 同时本实验结果提示在ALI组, TNF-α水平显著高于SHAM组(P<0.01), 随着时间的推移、TNF-α水平逐渐升高, 肺损害逐渐加重, 表现为低氧血症逐渐加重, 肺水肿逐渐加重, 与此同时AQP-1蛋白表达及mRNA水平出现下调, 下调程度与TNF-α的升高水平存在负的线性关系, 提示AQP-1在肺组织的表达与TNF-α密切相关. Towne et al[11]证实TNF-α可能通过与TNF-α受体1结合激活了NF-κB途径下调了AQP-5的蛋白表达和mRNA水平, 推测TNF-α也可能通过同样途径下调了AQP-1的蛋白表达和mRNA水平.
由于激素作为非特异性免疫抑制剂, 具有抑制多种炎症介质及细胞因子的合成与释放, 所以地塞米松(DEX)很早即被应用于治疗SAP, 以减轻ALI的严重程度. 本实验中, DEX组肺损伤程度、TNF-α升高水平等指标均好于ALI组(P<0.01). DEX同时上调了AQP-1在肺组织中的蛋白表达及mRNA水平, 具体机制可能与DEX降低了TNF-α水平有关, 另外King et al[12]在AQP-1启动子中发现糖皮质激素反应元件, 提示DEX可调节AQP-1的表达.
本实验初步证实AQP-1确实与SAP合并ALI的形成有关, AQP-1的表达与TNF-α等因素有关, DEX可调节AQP-1的表达. 关于AQP-1参与AP时ALI形成的确切机制、AQPs的表达与AP类型和时间的关系及寻找有效调节AQP-1表达的措施还有待进一步深入研究.
急性胰腺炎可引起以肺水肿为主要病理表现的急性肺损伤, 其发病机制复杂. 以往的研究提示肺损伤的发生与炎症介质和细胞因子的过度释放有关, 如 TNF-α等. 而对于和肺水转运密切相关的AQP-1与肺损伤的关系, 以及肺AQP-1的表达与炎症介质的关系尚未见报道.
目前关于AQP-1与肺水转运以及肺水肿性疾病的关系是众多学者研究的热点, 现已证实其与多种肺损伤性疾病有关,但对于AQP-1在肺组织表达的调控机制还没有完全明确. 对于其是否参与急性胰腺炎肺损伤的形成过程也亟待明确.
我国学者焦广宇、谢艳萍 et al通过实 验 证实AQP-1 在肺组织中有明确表达, 并且参与了内毒素血症引起的肺损伤过程, 为本实验 研究的立题提供了重要依据.
本文通过动物实 验证实AQP-1 参与了急性胰腺炎肺损伤的病理过程, 同时证实AQP-1的表达受 TNF-α的影响, 地塞米松可通过上调AQP-1 的表达而减轻急性胰腺炎肺损伤的程度.
本研究为今后治疗急性胰腺炎肺损伤中寻找能够调整AQP-1 表达的治疗方法提供参考.
AQP-1: 水通道蛋白-1, 是水通道家族的一个亚型, 在肺组织中分布, 是肺水转运的快速通道, 与多种肺水肿性疾病的形成有关.
研究水通道蛋白-1(AQP-1)在急性胰腺炎大鼠肺组织中的表达及其功能, 探讨其表达与肺损伤发生机制的关系, 对于探讨急性胰腺炎重症化和多器官功能障碍的发病机制具有重要意义. 文章选题新颖, 立题有据, 结果准确, 结论可信, 有重要理论价值和临床意义.
电编: 张敏 编辑:王晓瑜
| 1. | Hartwig W, Werner J, Muller CA, Uhl W, Buchler MW. Surgical management of severe pancreatitis including sterile necrosis. J Hepatobiliary Pancreat Surg. 2002;9:429-435. [PubMed] |
| 2. | Pastor CM, Matthay MA, Frossard JL. Pancreatitis-associated acute lung injury: new insights. Chest. 2003;124:2341-2351. [PubMed] |
| 5. | 徐 军, 张 梅, 刘 学民, 潘 承恩, 刘 青光. TNF-α基因表达在大鼠急性重症胰腺炎肺损伤中的作用. 西安交通大学学报(医学版). 2004;25:388-389, 392. |
| 6. | Saboori AM, Smith BL, Agre P. Polymorphism in the Mr 32,000 Rh protein purified from Rh(D)-positive and -negative erythrocytes. Proc Natl Acad Sci USA. 1988;85:4042-4045. [PubMed] |
| 7. | Anderson MR. Update on pediatric acute respira-tory distress syndrome. Respir Care. 2003;48:261-276. [PubMed] |
| 8. | Jiao G, Li E, Yu R. Decreased expression of AQP1 and AQP5 in acute injured lungs in rats. Chin Med J (Engl). 2002;115:963-967. [PubMed] |
| 9. | Su X, Song Y, Jiang J, Bai C. The role of aquaporin-1 (AQP1) expression in a murine model of lipopoly-saccharide-induced acute lung injury. Respir Physiol Neurobiol. 2004;142:1-11. [PubMed] |
| 10. | Towne JE, Harrod KS, Krane CM, Menon AG. Decreased expression of aquaporin (AQP)1 and AQP5 in mouse lung after acute viral infection. Am J Respir Cell Mol Biol. 2000;22:34-44. [PubMed] |
| 11. | Towne JE, Krane CM, Bachurski CJ, Menon AG. Tumor necrosis factor-alpha inhibits aquaporin 5 expression in mouse lung epithelial cells. J Biol Chem. 2001;276:18657-18664. [PubMed] |
| 12. | King LS, Nielsen S, Agre P. Aquaporin-1 water channel protein in lung: ontogeny, steroid-induced expression, and distribution in rat. J Clin Invest. 1996;97:2183-2191. [PubMed] |