修回日期: 2006-11-01
接受日期: 2006-11-08
在线出版日期: 2007-02-08
目的: 观察表皮生长因子(EGF)对胰腺癌细胞KP4增殖、黏附及侵袭力和核转录因子(NF-B)、尿激酶型纤溶酶原激活物(uPA)表达的影响.
方法: 通过细胞侵袭、增殖及黏附实验观察在EGF影响下肿瘤细胞侵袭、增殖及黏附能力变化. Western blot, RT-PCR及EMSA实验检测胰腺癌细胞的NF-B活性和uPA表达并观察在NF-B抑制物PDTC抑制下EGF诱导的NF-B活性和uPA表达及肿瘤细胞侵袭力变化.
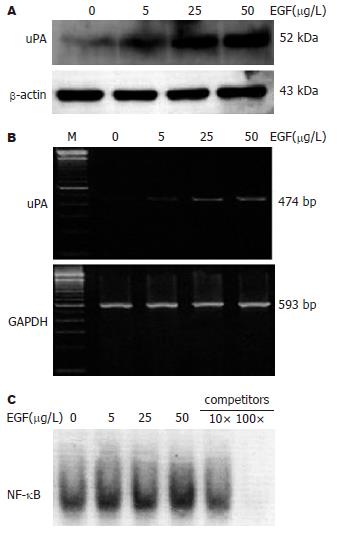
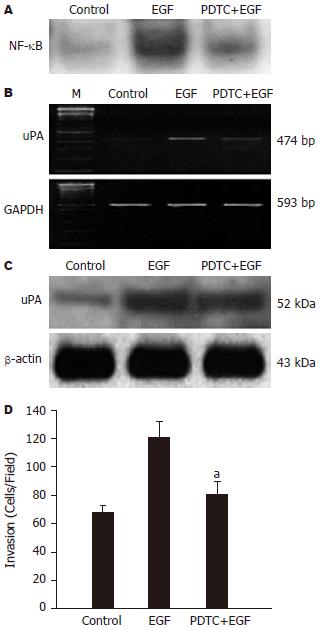
结果: EGF能够明显促进胰腺癌细胞的侵袭能力, 具有明显的剂量依赖性(50, 25, 5 μg/L vs 0 μg/L: 116±13, 97±10, 83±7 vs 72±5; t = 3.552, 3.018, 2.373; P = 0.006, 0.015, 0.042), 然而对增殖及黏附力无明显影响. 随着EGF浓度的增加, NF-B活性明显增强. EGF上调uPA蛋白及mRNA表达, 具有浓度依赖性. PDTC显著抑制EGF诱导的NF-B活性、uPA表达及胰腺癌细胞的侵袭力.
结论: EGF通过激活NF-B而诱导uPA表达, 促进胰腺癌细胞的侵袭和转移.
引文著录: 刘宇, 张浩, 郭仁宣. 表皮生长因子介导的核转录因子-κB活化促进胰腺癌细胞尿激酶型纤溶酶原激活物表达及侵袭和转移. 世界华人消化杂志 2007; 15(4): 365-369
Revised: November 1, 2006
Accepted: November 8, 2006
Published online: February 8, 2007
AIM: To investigate the effect of epidermal growth factor (EGF) on the adhesion, prolifera-tion, and invasion as well as the expression of nuclear factor kappa B (NF-κB) and urokinase plasminogen activator (uPA) of pancreatic cancer cell line KP4.
METHODS: The invasion, adhesion and proliferation of pancreatic cancer cell line KP4 were examined by the corresponding test, respectively. Western blot, reverse transcriptase-polymerase chain reaction (RT-PCR) and electrophoretic mobility shift assay (EMSA) were used to investigate NF-κB activity and uPA expression. The changes of NF-κB activity, uPA expression and invasion of tumor cells were observed as pyrrolidine dithiocarbamate (PDTC), a NF-κB inhibitor, was used.
RESULTS: EGF significantly increased the invasion of KP4 cells in a concentration-dependent way (50, 25, 5 mg/L vs 0 mg/L: 116 ± 13, 97 ± 10, 83 ± 7 vs 72 ± 5; t = 3.552, 3.018, 2.373; P = 0.006, 0.015, 0.042), but did not affect the proliferation or adhesion of the cells. NF-κB activity was obviously enhanced with the increasing of EGF concentration. EGF up-regulated the expression of uPA at both mRNA and protein levels in a dose-dependent manner. In addition, pretreatment with PDTC markedly attenuated EGF-induced NF-κB activity, uPA expression as well as invasion of pancreatic cancer cells.
CONCLUSION: EGF can induce uPA expression by NF-κB activation, which accelerates the invasion and metastasis of pancreatic cancer cells.
- Citation: Liu Y, Zhang H, Guo RX. Epidermal growth factor-mediated nuclear factor kappa B activation induces urokinase plasminogen activator expression and invasion, metastasis of pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2007; 15(4): 365-369
- URL: https://www.wjgnet.com/1009-3079/full/v15/i4/365.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i4.365
胰腺癌是一种较常见的恶性肿瘤. 90%的患者在诊断后1年内死亡, 5 年生存率仅为1%-3%. 早期的侵袭和转移而导致的肿瘤扩散是引起患者死亡的重要原因之一. 表皮生长因子(epidermal growth factor, EGF)及其受体在胰腺癌中表达明显增高, 并与肿瘤的发展和预后密切相关[1-4], 提示EGF可能促进胰腺癌细胞侵袭而加速肿瘤进程. 然而, EGF促进胰腺癌细胞侵袭的机制还有待进一步阐明. 肿瘤侵袭转移是一个多步骤的复杂过程, 包括肿瘤细胞的黏附和脱黏附、细胞外基质的降解和重建等过程. 胞外基质降解是肿瘤浸润转移的首要步骤和分子基础, 大量的研究资料表明, 尿激酶型纤溶酶原激活物(urokinase plasminogen activator, uPA)参与胞外基质降解, 在肿瘤浸润和转移中起到重要作用[5-9]. 核转录因子(nuclear factor kappa B, NF-κB)参与调控侵袭相关基因表达, 是促进肿瘤细胞的侵袭和转移的重要转移因子[10-15]. 本文研究了EGF对胰腺癌细胞侵袭、增殖及黏附力的影响和其对NF-κB活性、uPA表达的影响, 探讨EGF促进胰腺癌侵袭的相关机制.
人胰腺癌细胞系KP4由日本九洲大学医学部外科片野光男教授惠赠. 用含双抗及100 mL/L小牛血清的DMEM培养液, 在37℃含50 mL/L CO2的培养箱中传代培养. 人重组EGF购自Biomedical Technologies公司.
1.2.1 Transwell体外侵袭实验: 应用24孔Transwell侵袭小室进行侵袭实验(美国Milliopore公司). 上室的聚碳酸酯膜-Matrigel (250 μg/cm2)在37℃聚合后待用. 不同浓度的EGF处理细胞24 h后, PBS洗2次后, 在上室孔中准确加入细胞2×105/孔, 下室中加入趋化因子400 μL (MRC-5细胞48 h无血清的条件培养液), 培养8 h. 待培养时间结束后将Transwell上室的附着细胞用湿棉签擦去, 苏木精染色, 封片后显微镜下(300倍)观察穿过膜的细胞数. 每张膜中央部分和周围部分各随机取3个视野, 计数每个视野内的穿过8 μm微孔的细胞数, 每组重复3次.
1.2.2 细胞增殖实验: 于24孔培养皿内接种1×104个对数生长期的细胞, 24 h后分别加入不同浓度的EGF, 48 h后采用WST-1细胞增殖试剂盒(TaKaRa, Kyoto, Japan)对细胞增殖情况进行检测, 具体方法参见厂家说明书.
1.2.3 细胞黏附实验: Matrigel (30 μg/孔)包被24孔培养板后37℃过夜待用. 不同浓度的EGF处理细胞24 h后, 按5×104个细胞(50 μL)/孔将细胞加入包被Matrigel的24孔板, 50 mL/L CO2培养箱内于37℃孵育1 h. PBS漂洗3次移去悬浮细胞, 黏附细胞数经WST-1细胞增殖试剂盒测定吸光度进行评估.
1.2.4 Western印记实验: 不同浓度的EGF处理胰腺癌细胞48 h后, PBS洗后离心弃上清, 适当体积裂解缓冲液[50 mmol/L Tris-HCl (pH 7.5), 150 mmol/L NaCl, 5 mmol/L乙二胺四乙酸(EDTA, pH 8.0), 1 mmol/L苯甲基磺酰氟(PMSF), 1 g/L SDS, 1 mg/L抑肽酶, 10 mg/L抑胃酶肽, 10 mg/L亮抑蛋白酶肽, 10 mg/L抑蛋白酶肽, 10 mg/L大豆胰蛋白酶抑制剂]重悬细胞, 超生裂解细胞45 s, 4℃ 15 000 g离心20 min, 收集上清-70℃保存. BCA定量试剂盒测定蛋白浓度(Bio-Rad, Hercules, CA). 取等量蛋白泳道上样, 经100 g/L十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳, 电转移至聚偏二氟乙烯(PVDF)膜. 封闭缓冲液[0.1 mmol/L三羟甲基氨基甲烷缓冲液盐水(TBS), 50 g/L脱脂奶粉, 1 g/L吐温20]封闭, 加入1:500抗MMP-2 (FUJI Chemical Industries, LTD, Toyama, Japan), MMP-9(Santa Cruz, CA), β-actin(Biomedical Technologies, Stoughton, MA) 4℃孵育过夜. 1:2000稀释的酶标二抗室温孵育1 h, TBS洗净后, 增强化学发光剂(ECL)显色, 暗房中压片, 观察结果.
1.2.5 RT-PCR实验: 细胞总RNA的提取采用ISOGEN总RNA提取试剂盒(Nippon Gene, Tokyo, Japan), 具体方法参见厂家说明. 电泳鉴定RNA质量并在A260nm测其浓度. 所有引物均经GenBank查询为目前已知基因特异性引物序列. uPA sense(5'-AGAATTCACCACCATCGAGA-3'), antisense(5'-ATCAGCTTCACAACAGTCAT-3'), 474 bp. GAPDH sense (5'-CCACCCATGGCAAATTCCATGGCA-3'), antisense (5'-TCTAGACGGCAGGTCAGGTCCACC-3'), 593 bp. 按第一链合成试剂盒说明进行逆转录(TaKaRa, Kyoto, Japan). PCR扩增条件: 变性94℃ 1 min, 退火55℃ 1 min, 延伸72℃ 1 min, 循环30次. PCR产物以20 g/L琼脂糖凝胶电泳检测, 用溴化乙锭染色后长波紫外灯下观测照相, 观察结果.
1.2.6 EMSA实验: 应用EMSA实验检测细胞的NF-κB的活性, 提取不同浓度EGF处理后的胰腺癌细胞的核蛋白各5 μg, 分别于结合液[20 mmol/L HEPES-NaOH (pH 7.9), 2 mmol/L EDTA, 100 mmol/L NaCl, 100 g/L glycerol, 2 g/L NP-40, 聚乙烯, 32P标记的包含NF-κB结合位点的双链寡核苷酸(核酸序列为5'-AGTTGAGGGGACTTTCCCAGGC-3', 购自美国Promega公司)]中室温下作用30 min, 反应后的混合物上样于40 g/L聚丙烯酰胺凝胶电泳后, 行放射自显影.
1.2.7 NF-κB抑制因子PDTC(pyrrolidine dithiocarbamate)抑制实验: NF-κB抑制因子PDTC预先处理胰腺癌细胞2 h, 依照上述方法进行细胞侵袭、增殖及黏附实验、Western印记实验、RT-PCR实验和EMSA实验. 观察PDTC干预下的细胞侵袭、增殖、黏附能力变化及NF-κB活性和uPA的表达情况, 作直方图比较.
统计学处理 所有数据均在SPSS13.0软件包上进行, 实验数据用mean±SD表示. 组间数据的比较采用两样本均值的t检验, P<0.05为显著性差异的检验标准.
EGF能够明显促进胰腺癌细胞的侵袭能力(分别为83±7 vs 72±5, t = 2.373, P = 0.042<0.05; 97±10 vs 72±5, t = 3.018, P = 0.015<0.05; 116±13 vs 72±5, t = 3.552, P = 0.006<0.01), 具有明显的剂量依赖性. 然而, 即使浓度达到100 μg/L, EGF对胰腺癌细胞的增殖及黏附力并无明显影响(表1).
uPA及NF-κB与胰腺癌细胞的侵袭密切相关[16-17], 因此, 我们检测了EGF对胰腺癌细胞表达uPA及NF-κB活性的影响. Western blot实验显示, EGF处理后, 肿瘤细胞的uPA活性明显升高, 有剂量依赖性. RT-PCR与Western blot一致, EGF上调uPA mRNA表达(图1A-B). EMSA结果显示随着EGF浓度的增加, NF-κB活性明显增强, 具有明显的剂量依赖性. 竞争实验表明条带有特异性(图1C).
NF-κB抑制物PDTC明显抑制EGF诱导的NF-κB的活化, 同时也抑制EGF介导的uPA表达及胰腺癌细胞侵袭力, 表明EGF是通过激活NF-κB进一步上调uPA表达, 促进肿瘤侵袭(图2).
大多数的胰腺癌患者死于肿瘤的侵袭及转移, 虽然目前已经发现EGF及其受体的高表达与胰腺癌的增殖和局部侵袭有关, 但其确切的分子机制还不明了. 我们的研究表明, EGF与胰腺癌细胞的侵袭力存在剂量依赖性. 而且, 为了进一步阐明其中的分子机制, 我们还观察了在EGF影响下的细胞黏附、增殖能力变化, 检测了胰腺癌细胞uPA和NF-κB的活性实验结果显示肿瘤细胞的侵袭力与EGF呈剂量依赖性正相关. 尽管肿瘤细胞的增殖和黏附也与其侵袭力密切相关, 但在我们的研究中EGF并没有明显增加细胞的增殖和黏附力. 这表明EGF对胰腺癌细胞的侵袭促进作用与这种细胞株的增殖、黏附无关, 提示还有其他的机制在发挥作用. 肿瘤侵袭是一个复杂的过程, 与肿瘤细胞的增殖、黏附、移动及分泌各种酶类有关. 在这些环节中, 细胞外基质和细胞基底膜的降解是肿瘤侵袭过程中的关键所在. uPA作用系统被认为在细胞外基质和基底膜的降解、促进肿瘤侵袭转移过程中起核心作用[18]. 高水平的uPA已经被证实代表了快速增殖和低分化胰腺癌的高侵袭性的临床特征, 而在几种胰腺细胞株中也有报道称uPA系统的激活与侵袭力有关[19-20]. 我们证实了EGF可以显著诱导uPA的活性及表达[21-23], 提示uPA参与了EGF诱导肿瘤细胞的侵袭. 进一步我们对EGF激活uPA的机制进行了研究. NF-κB对uPA表达的作用已经得到证实[24-27], 最近的研究证明, 在某些特定的肿瘤细胞中EGF可以激活NF-κB[28-29]. 本研究显示EGF显著激发了NF-κB活性, 而且, 其诱导uPA的表达可以被NF-κB抑制因子PDTC抑制, 提示EGF调节uPA活性与激活NF-κB有关. 因此, 我们可以推测在这些胰腺癌细胞中EGF诱导uPA表达是通过或至少是部分通过激活NF-κB来实现的. 为证实EGF是通过上调NF-κB活性来提高肿瘤细胞侵袭力的理论, 我们进行了NF-κB抑制因子PDTC干预下的侵袭实验. 在PDTC干预下, EGF激发细胞侵袭力增加的能力被抑制了, 这表明由EGF引起肿瘤细胞侵袭力的增加与NF-κB的活化有关. 但是, 抑制NF-κB的活性并不能完全阻断EGF对肿瘤细胞侵袭力的影响, 这说明NF-κB并不是EGF诱导肿瘤侵袭唯一的下游事件, 一定存在某个或多个其他通路. 进一步分析其他可能的信号通路, 将对阐明EGF诱导肿瘤细胞侵袭机制有所帮助.
总之, 我们的研究为EGF促进胰腺癌细胞侵袭力增强这一功能提供了进一步的证据. 概括的讲, EGF通过激活了NF-κB的活性, 进而诱导了uPA的表达, 增高其对细胞基底膜及细胞外基质的降解, 导致细胞侵袭力的增加, 促进肿瘤细胞的侵袭和转移, 而这一过程可被NF-κB抑制因子-PDTC抑制. 这一通路发现的意义在于通过抑制肿瘤细胞NF-κB通路, 可以降低胰腺癌细胞的侵袭和转移特征, 为胰腺癌生物靶向治疗开辟了一条新途径.
表皮生长因子及其受体在胰腺癌中表达明显增高, 并与肿瘤的发展和预后密切相关, 提示可能促进胰腺癌细胞侵袭而加速肿瘤的进程. 然而, 其促进胰腺癌细胞侵袭的机制还有待进一步阐明.
本研究为EGF促进胰腺癌细胞侵袭力增强这一功能提供了进一步的证据. 通过抑制肿瘤细胞NF-κB通路, 可以降低胰腺癌细胞的侵袭和转移特征, 为胰腺癌生物靶向治疗开辟了一条新途径.
本文研究了EGF对胰腺癌细胞侵袭、增殖及黏附力的影响和其对NF-κB活性、uPA表达的影响, 探讨 EGF促进胰腺癌侵袭的相关机制, 研究目的明确, 思路清晰, 方法设计合理, 图表清晰, 结论可靠.
电编: 张敏 编辑:张焕兰
| 1. | Zhang Y, Banerjee S, Wang ZW, Marciniak DJ, Majumdar AP, Sarkar FH. Epidermal growth factor receptor-related protein inhibits cell growth and induces apoptosis of BxPC3 pancreatic cancer cells. Cancer Res. 2005;65:3877-3882. [PubMed] |
| 2. | Farrow B, Sugiyama Y, Chen A, Uffort E, Nealon W, Mark Evers B. Inflammatory mechanisms contributing to pancreatic cancer development. Ann Surg. 2004;239:763-769; discussion 769-771. [PubMed] |
| 4. | Chen Z, Fadiel A, Feng Y, Ohtani K, Rutherford T, Naftolin F. Ovarian epithelial carcinoma tyrosine phosphorylation, cell proliferation, and ezrin trans-location are stimulated by interleukin 1alpha and epidermal growth factor. Cancer. 2001;92:3068-3075. [PubMed] |
| 5. | Alfano D, Franco P, Vocca I, Gambi N, Pisa V, Mancini A, Caputi M, Carriero MV, Iaccarino I, Stoppelli MP. The urokinase plasminogen activator and its receptor: role in cell growth and apoptosis. Thromb Haemost. 2005;93:205-211. [PubMed] |
| 12. | Rangaswami H, Bulbule A, Kundu GC. Nuclear factor-inducing kinase plays a crucial role in osteopontin-induced MAPK/IkappaBalpha kinase-dependent nuclear factor kappaB-mediated promatrix metalloproteinase-9 activation. J Biol Chem. 2004;279:38921-38935. [PubMed] |
| 13. | 缪 林, 张 锁林, 季 国忠, 范 志宁, 刘 政, 张 平, 杨 春. 肝癌组织中TGF-b1、TGF-b1 RⅡ和NF-κB的表达. 世界华人消化杂志. 2005;13:1663-1666. |
| 14. | Suh J, Rabson AB. NF-kappaB activation in human prostate cancer: important mediator or epiphenomenon? J Cell Biochem. 2004;91:100-117. [PubMed] |
| 15. | Rahman KM, Li Y, Sarkar FH. Inactivation of akt and NF-kappaB play important roles during indole-3-carbinol-induced apoptosis in breast cancer cells. Nutr Cancer. 2004;48:84-94. [PubMed] |
| 17. | Wang Z, Sengupta R, Banerjee S, Li Y, Zhang Y, Rahman KM, Aboukameel A, Mohammad R, Majumdar AP, Abbruzzese JL. Epidermal growth factor receptor-related protein inhibits cell growth and invasion in pancreatic cancer. Cancer Res. 2006;66:7653-7660. [PubMed] |
| 19. | Tan X, Egami H, Nozawa F, Abe M, Baba H. Analysis of the invasion-metastasis mechanism in pancreatic cancer: involvement of plasmin(ogen) cascade proteins in the invasion of pancreatic cancer cells. Int J Oncol. 2006;28:369-374. [PubMed] |
| 20. | Nielsen A, Scarlett CJ, Samra JS, Gill A, Li Y, Allen BJ, Smith RC. Significant overexpression of urokinase-type plasminogen activator in pancreatic adenocarcinoma using real-time quantitative reverse transcription polymerase chain reaction. J Gastroenterol Hepatol. 2005;20:256-263. [PubMed] |
| 21. | Henic E, Sixt M, Hansson S, Hoyer-Hansen G, Casslen B. EGF-stimulated migration in ovarian cancer cells is associated with decreased internalization, increased surface expression, and increased shedding of the urokinase plasminogen activator receptor. Gynecol Oncol. 2006;101:28-39. [PubMed] |
| 22. | Festuccia C, Angelucci A, Gravina GL, Biordi L, Millimaggi D, Muzi P, Vicentini C, Bologna M. Epidermal growth factor modulates prostate cancer cell invasiveness regulating urokinase-type plasminogen activator activity. EGF-receptor inhibition may prevent tumor cell dissemination. Thromb Haemost. 2005;93:964-975. [PubMed] |
| 23. | Mahabeleshwar GH, Das R, Kundu GC. Tyrosine kinase, p56lck-induced cell motility, and urokinase-type plasminogen activator secretion involve activation of epidermal growth factor receptor/extracellular signal regulated kinase pathways. J Biol Chem. 2004;279:9733-9742. [PubMed] |
| 24. | Li H, Ye X, Mahanivong C, Bian D, Chun J, Huang S. Signaling mechanisms responsible for lysophosphatidic acid-induced urokinase plasminogen activator expression in ovarian cancer cells. J Biol Chem. 2005;280:10564-10571. [PubMed] |
| 25. | Sliva D. Signaling pathways responsible for cancer cell invasion as targets for cancer therapy. Curr Cancer Drug Targets. 2004;4:327-336. [PubMed] |
| 26. | Das R, Philip S, Mahabeleshwar GH, Bulbule A, Kundu GC. Osteopontin: it's role in regulation of cell motility and nuclear factor kappa B-mediated urokinase type plasminogen activator expression. IUBMB Life. 2005;57:441-447. [PubMed] |
| 27. | Cicek M, Fukuyama R, Welch DR, Sizemore N, Casey G. Breast cancer metastasis suppressor 1 inhibits gene expression by targeting nuclear factor-kappaB activity. Cancer Res. 2005;65:3586-3595. [PubMed] |
| 28. | Liptay S, Weber CK, Ludwig L, Wagner M, Adler G, Schmid RM. Mitogenic and antiapoptotic role of constitutive NF-kappaB/Rel activity in pancreatic cancer. Int J Cancer. 2003;105:735-746. [PubMed] |
| 29. | Haussler U, von Wichert G, Schmid RM, Keller F, Schneider G. Epidermal growth factor activates nuclear factor-kappaB in human proximal tubule cells. Am J Physiol Renal Physiol. 2005;289:F808-815. [PubMed] |