修回日期: 2007-11-25
接受日期: 2007-12-22
在线出版日期: 2007-12-28
目的: 研究肝癌组织中DNA依赖蛋白激酶催化亚基DNA-PKcs的表达差异及其生物学意义.
方法: 用组织芯片和免疫组化法检测肝胆癌组织86例, 肝胆管结石切除肝组织17例标本和正常肝组织70例中DNA-PKcs蛋白表达情况, Western blot检测培养细胞中DNA-PKcs表达, Lipofectamine 2000介导DNA-PKcs的siRNA质粒DNA转染, 细胞生长曲线分析细胞增殖, 克隆形成法分析细胞辐射敏感性.
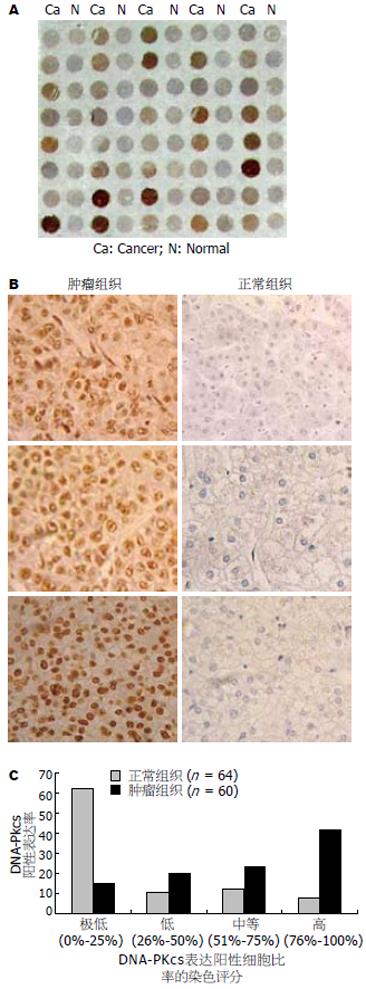
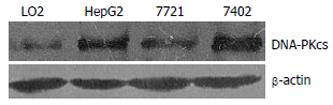
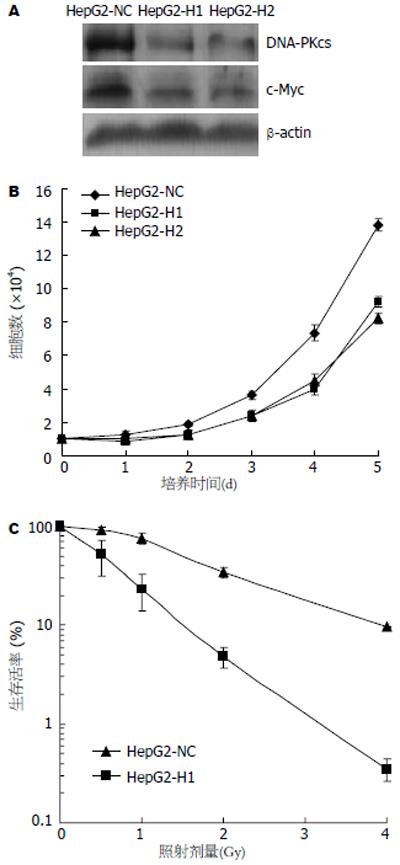
结果: 组织芯片检测显示, 60例肝癌组织细胞中DNA-PKcs阳性表达率<25%(极低表达), 25%-50%(低表达), 51%-75%(中等表达)和>75%(高表达)分别占15%, 20%, 23.3%和41.7%, 而64例正常肝组织中各DNA-PKcs阳性表达率分别为68.7%, 10.9%, 12.6%和7.8%, 表明癌组织DNA-PKcs的表达水平显著高于正常组织(P = 0.0008). 26例肝癌组织病理切片的免疫组化结果也显示, 其DNA-PKcs表达水平显著高于23例非肿瘤性肝组织(P = 0.001). Western blot检测结果显示, 体外培养的肝癌细胞HepG2, 7721和7402中DNA-PKcs表达水平, 同样显著高于正常肝细胞LO2. siRNA分子靶向抑制DNA-PKcs表达, 不但显著提高HepG2细胞对电离辐射的敏感性, 同时还降低肝癌细胞的增殖速度. 随着DNA-PKcs表达的抑制, 癌基因c-Myc蛋白表达水平也显著降低.
结论: 肝癌组织细胞中DNA-PKcs表达水平显著高于正常肝组织和非肿瘤性肝病理组织, siRNA抑制DNA-PKcs表达, 具有抗癌细胞增殖和放射增敏作用, c-Myc蛋白表达抑制可能是其抗增殖作用的相关机制之一.
引文著录: 余子建, 徐勤枝, 周丽君, 隋建丽, 张士猛, 安静, 王豫, 周平坤. 肝癌组织DNA-PKcs过量表达及其靶向siRNA分子的抗增殖作用. 世界华人消化杂志 2007; 15(36): 3815-3821
Revised: November 25, 2007
Accepted: December 22, 2007
Published online: December 28, 2007
AIM: To characterize the difference in DNA-dependent protein kinase catalytic subunit (DNA-PKcs) expression between hepatocarcinoma tissues and non-tumor liver tissues, and to understand the biological significance of the altered expression of DNA-PKcs in cancer cells.
METHODS: DNA-PKcs expression was examined in 86 specimens of hepatocarcinoma and hepatic cholangiocarcinoma by immunohistochemistry analysis on tissue-arrays and ordinary pathological tissue slices. DNA-PKcs protein was detected in culture cells by Western blotting analysis. The siRNA was used to silence DNA-PKcs expression in HepG2 cells. Cell proliferation was evaluated by growth curve analysis, and radiosensitivity was tested using a colony-forming ability assay.
RESULTS: Tissue-array analysis showed that the proportions of cases with a DNA-PKcs expression level of < 25% (very low), 25%-50% (low), 51%-75% (medium) and > 75% (high) were 15%, 20%, 23.3% and 41.7%, respectively, among the 60 hepatocarcinoma tissue specimens. The proportions of the 64 normal liver tissues showing these DNA-PKcs expression levels were 68.7%, 10.9%, 12.6% and 7.8%, respectively. This result indicated that DNA-PKcs expression in cancer tissues was significantly higher than that in normal tissues (P = 0.0008). Immunohistochemistry analysis of ordinary pathological tissue slices also showed that DNA-PKcs levels in the hepatocarcinoma and hepatic cholangiocarcinoma tissues (total 26 specimens) were higher than those in the non-tumor liver tissues (P = 0.001). Moreover, the cultured human liver cancer cell lines HepG2, 7721 and 7402 also exhibited much higher levels of DNA-PKcs than normal liver LO2 cells. Silencing of DNA-PKcs mediated by siRNA resulted in not only an increased sensitivity of HepG2 cells to ionizing radiation, but also decreased proliferation HepG2 cells. We further demonstrated that the expression of c-Myc oncoprotein was also depressed following the down-regulation of DNA-PKcs.
CONCLUSION: DNA-PKcs is overexpressed in hepatocarcinoma tissues as well as cultured liver cancer cells. Targeting DNA-PKcs is an anticancer strategy acting through at least two mechanisms: directly decreasing the proliferation of cancer cells via, at least, depressing c-Myc oncoprotein; and sensitizing cancer cells to radiotherapy or chemotherapy with DNA-damaging agents.
- Citation: Yu ZJ, Xu QZ, Zhou LJ, Sui JL, Zhang SM, An J, Wang Y, Zhou PK. Over-expression of DNA-PKcs in hepatocarcinoma tissues and the antiproliferative effect mediated by down-regulating its expression with siRNA. Shijie Huaren Xiaohua Zazhi 2007; 15(36): 3815-3821
- URL: https://www.wjgnet.com/1009-3079/full/v15/i36/3815.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i36.3815
DNA依赖蛋白激酶催化亚基(DNA dependent protein kinase catalytic subunit, DNA-PKcs)属于磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)家族蛋白, 具有丝氨酸/苏氨酸蛋白激酶活性[1]. DNA-PKcs与另外2个亚基Ku70和Ku80共同构成DNA-PK复合物, 在DNA双链断裂非同源末端连接修复(nonhomologous end-joining, NHEJ)途径中发挥重要作用. DNA-PKcs还具有参与V(D)J重组[1]、维护染色体端粒末端稳定性功能[2-3]. DNA-PKcs缺陷SCID小鼠和缺陷细胞对电离辐射的敏感性显著增加. 由于DNA-PKcs具有丝氨酸/苏氨酸蛋白激酶活性, 能磷酸化多种蛋白底物[4-7], 如P53, 转录因子Sp1, 组蛋白H2AX, DNA修复蛋白XRCC4, 原癌基因c-jun, c-Myc和c-fos等, 显示其是一重要的功能蛋白.
近年来, 不断有研究报道DNA-PKcs在脑部肿瘤、肺癌、乳腺癌、食管癌、前列腺癌、肝癌等多种肿瘤组织细胞中高表达[7-14]. 我们实验室前期研究中, 在非小细胞肺癌[11]和肝胆肿瘤组织[12]中也观察到DNA-PKcs异常高表达现象, 而且DNA-PKcs在肝胆肿瘤组织中表达水平与肿瘤组织细胞的转移或侵袭性、恶性程度有显著的相关性. 因此, DNA-PKcs在肿瘤组织中的过量表达的生物学意义, 非常值得关注. 最近, 我们利用siRNA干扰技术沉默人宫颈癌HeLa细胞中DNA-PKcs表达, 发现癌基因c-Myc蛋白的表达水平也显著下降[15], 同时部分c-Myc蛋白转录调控靶基因如P21, P27和NDRG1以及其他一些细胞增殖调控相关基因的表达水平也发生改变[16].
这些结果提示, DNA-PKcs过量表达可能赋予了其新的生物学功能, 并具有做为潜在肿瘤标志物和抗癌分子靶标意义. 我们采用可靠性更佳的组织芯片技术, 结合siRNA干扰技术和肝癌细胞系的研究, 进一步研究了我国肝癌患者癌组织细胞中DNA-PKcs表达状况, 并探讨DNA-PKcs在肝癌细胞中过表达的生物学意义.
肝癌组织芯片购自陕西超英生物科技有限公司(西安), 南华大学附属第一医院普外科和北京军区总医院病理科肝细胞肝癌和肝内胆管肝癌26例, 肝胆管结石或并发炎症17例, 肝破裂(外伤、囊肿)6例. 病理组织进行石蜡包埋切片. 正常肝细胞LO2、肝癌细胞HepG2, 7721和7402在含100 mL/L新生牛血清的DMEM培养液中培养. DNA-PKcs特异siRNA表达载体及siRNA序列已在前文发表[15], 其中siRNA-H1和siRNA-H2作用的DNA-PKcs靶序列分别位于该基因的编码催化活性区(11637-11655)和功能域间区(12321-12339), siRNA-NC阴性对照序列由Ambion公司提供.
质粒DNA转染前24 h, 接种5×105 HepG2细胞于60 mm的培养皿中, 经Lipofe-ctamine 2000介导DNA-PKcs的siRNA质粒转染HepG2细胞(按试剂盒说明操作). 转染后48 h按1×105个细胞接种于60 mm的培养皿中, 潮霉素B筛选阳性克隆(250 mg/L), 每3天更换培养液, 筛选阳性克隆细胞扩大培养, Western blot免疫印迹杂交实验确证. 同时设一阴性对照, 即将与人类编码基因序列无同源性的片段与载体连接转染细胞. 石蜡切片常规法脱蜡至水后, 在30 mL/L的H2O2溶液中室温温育5-10 min, 消除内源性过氧化物酶活性. 石蜡切片或组织芯片用蒸馏水冲洗并PBS浸泡5 min后, 置于1 mmol/L EDTA(pH8.0)和0.01 mol/L枸橼酸盐缓冲液中, 92℃-98℃持续10-15 min进行抗原修复. 滴加含50 mL/L山羊血清工作液稀释的DNA-PKcs抗体(H-163, SC-9051, Santa Cruz公司)(1:50), 4℃过夜. 切片经PBS清洗3次后, 滴加辣根酶标记链卵白素二抗工作液(PV6001, Zymed Laboratories Inc), 37℃温育30 min. DAB显色剂显色后, 苏木精复染, 封片. 显微镜下观察免疫组化染色后的病理切片, 用Mias2000病理工作站图像分析仪记录结果. DNA-PKcs为核蛋白, 细胞核被染成棕黄色的即为阳性表达细胞. 对组织芯片的每一个组织块点或每一张病理切片随机计数5个视野(×200)中DNA-PKcs表达阳性细胞比率. 根据阳性表达率分为4组: <25%(极低表达组), 25%-50%(低表达组), 51%-75%(中等表达组), >75%(高表达组). 数据经统计学χ2检验.
1.2.1 细胞生长和存活率: 胰酶消化、离心收集细胞, 制成细胞悬液, 细胞计数后, 以每孔1×104接种于24孔板中, 于37℃, 50 mL/L CO2培养箱中常规培养. 每天每组细胞取3个孔, 消化后用胎盼蓝染色, 细胞计数求均值, 绘制生长曲线, 实验重复4次. 采用集落克隆形成率法检测照射细胞的存活率. 胰酶消化、离心收集对数生长期细胞, 制成一定浓度的细胞悬液, 用60Co γ射线室温下照射不同剂量(剂量率为2.0 Gy/min). 照后即刻根据不同的照射剂量, 接种一定数量的细胞于60 mm直径的培养皿, 每个剂量组3个皿, 置于37℃, 50 mL/L CO2孵箱中培养12 d. PBS洗2次, 750 mL/L乙醇固定30-60 min, 自然晾干后Giemsa染色, 计数细胞克隆数(计数≥50个细胞的单克隆). 根据接种细胞数进行校正、计算出细胞存活率. 实验重复3次.
1.2.2 免疫印迹(Western blot)分析: 将筛选出的阳性克隆挑出后继续培养, 潮霉素B浓度减半(125 mg/L), 收集细胞用Lysis buffer(50 mmol/L Tris-HCl pH7.5, 10 mg/L Noridet P40, 5 mg/L 脱氧胆酸钠, 150 mmol/L NaCl, 蛋白酶抑制剂片剂1片/50 mL Lysis buffer) 提取细胞总蛋白, 经考马斯亮兰染色法定量蛋白. 取20 μg总蛋白上样, 经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后将蛋白转移到PVDF膜上; 50 mg/L脱脂奶粉室温封闭1-2 h, 与一抗DNA-PKcs抗体(H-163, SC-9051, Santa Cruz公司)或c-Myc蛋白抗体(9E10, Santa Cruz公司)室温作用1-2 h, 然后与辣根过氧化酶标记的二抗室温作用1 h后显影.
统计学处理 SAS 6.12统计软件包进行分析, 配对资料χ2检验, P<0.05有统计学意义.
在该组织芯片中的每例肝癌组织点旁都有相应的正常肝组织做对照. 用普通相机直接拍照或肉眼直观就可看出, 肿瘤组织的免疫组化染色的着色深度, 明显强于正常肝组织(图1A). 显微镜下可更清晰显示出肝癌组织细胞中DNA-PKcs表达水平显著高于正常肝组织细胞(图1B). 肝癌60例中DNA-PKcs阳性表达率水平为≤25%(极低表达组), 26%-50%(低表达组), 51%-75%(中等表达组), >75%(高表达组)的分别有9例(15%), 12(20%), 14(23.3%), 25(41.7%); 而正常肝组织64例中, 各DNA-PKcs阳性表达率组分别有44例(68.7%), 7(10.9%), 8(12.6%), 5(7.8%). 可见60%以上个体的正常肝组织中DNA-PKcs为极低表达水平, 而肝癌组织中DNA-PKcs的表达阳性率很高, 其中12例患者肝癌组织的DNA-PKcs阳性率细胞超过95%(图1C). 正常肝细胞与肝癌细胞之间DNA-PKcs的表达差异具有显著的统计学意义(χ2检验, P = 0.0008). 肝癌组织除DNA-PKcs阳性表达细胞率明显上升外, 阳性细胞的免疫组化染色深度也显著增强(图1B). 我们还显示癌组织中DNA-PKcs表达水平显著增加(表1).
肝癌细胞HepG2, 7721, 7402中DNA-PKcs表达水平均明显高于正常肝细胞LO2(图2). 细胞转染DNA-PKcs特异的siRNA表达质粒siRNA-H1或siRNA-H2后, 分别筛选和鉴定出稳定转染克隆细胞系HepG2-H1和HepG2-H2. 提取细胞总蛋白, Western blot检测结果显示, 特异siRNA转染细胞HepG2-H1和HepG2-H2中DNA-PKcs表达水平显著低于转染非特异对照质粒的细胞HepG2-NC(图3A). 与此同时, HepG2-H1和HepG2-H2中癌基因c-Myc蛋白表达水平也显著降低(图3A).
DNA-PKcs是一重要的DNA双链断裂损伤修复基因, 可以修复辐射或化疗药物导致的肿瘤细胞DNA双链断裂, 使肿瘤细胞具有抗放射治疗和化疗耐受的能力, 因此肿瘤细胞DNA-PKcs的活性已成为临床肿瘤患者治疗方案选择要考虑的因素之一[17-23]. 我们研究也发现DNA-PKcs缺失的肝癌细胞, 其放射敏感性增强, 提示DNA-PKcs可以作为辐射增敏治疗的靶标. DNA-PKcs与肿瘤的关系如何, 目前的报道存在两个极端: 有研究认为DNA-PKcs除DNA修复和V(D)J重组功能外, DNA-PKcs还具有维持染色体端粒末端稳定性的作用, 因此被认为是抑癌基因, 在维持基因组稳定性中发挥着重要作用[2-3]. Someya et al[24]检测了93例未经治疗的肿瘤患者和41例健康志愿者外周血淋巴细胞中DNA-PKcs的活性, 结果发现子宫颈癌和乳腺癌肿瘤患者的DNA-PKcs的活性显著低于健康志愿者, 且随着DNA-PKcs的活性降低, 染色体异常如双着丝粒、染色体碎片数量增加. 表明DNA-PKcs活性减弱后, 增加了罹患肿瘤的危险度[24]. 另有研究发现由于DNA-PKcs具有丝氨酸/苏氨酸蛋白激酶活性、并可磷酸化多种转录因子和癌基因产物, 特别是其在癌组织细胞中过量表达的发现, DNA-PKcs很可能还有癌基因的功能. 我们通过组织芯片和组织病理的免疫组化分析, 进一步揭示DNA-PKcs在我国肝癌患者的癌组织细胞中过量表达, 而且体外培养细胞的分析结果也显示肝癌细胞中DNA-PKcs表达水平显著高于正常肝细胞. DNA-PKcs蛋白在癌组织中过量表达, 与肿瘤或癌组织的恶性度相关, 提示DNA-PKcs可能具有癌基因的作用[12,25]. Tonotsuka et al[14]也发现在正常食道上皮层, 只有基底细胞表达DNA-PKcs, 且DNA-PKcs定位在细胞核. 而在食道癌组织中, DNA-PKcs的表达丰度明显高于正常食道上皮, 但表达丰度和细胞定位有异质性, 表明不同分化和进展期的细胞其DNA-PKcs的活性不同[14]. Lee et al[26]应用免疫组化的方法检测非肿瘤性的胃黏膜组织122例、胃腺瘤115例和胃癌切除标本564例, 结果发现DNA-PKcs在正常的胃黏膜上皮不表达, 但在H pylori相关的胃炎组织、胃上皮肠化生和胃腺瘤组织中呈阳性表达, 79.8%(450/564)的胃癌组织表达DNA-PKcs. 但相关性分析发现DNA-PKcs表达阴性与肿瘤进展和临床预后差显著相关, 提示DNA-PKcs是一肿瘤抑癌基因. 此结果与我们的结论相反, 推测原因之一是DNA-PKcs作为一把双刃剑, 在不同组织中的作用有选择性, DNA-PKcs缺失导致的DNA损伤修复缺陷, 导致胃癌患者预后差[26].
此外, DNA-PKcs除在肿瘤组织细胞中异常高表达外, 还有研究显示, 成熟发育不同时期的细胞或不同增殖活性细胞中DNA-PKcs的表达水平也存在明显的差异[27-29], 如生殖细胞减数分裂前DNA-PKcs表达明显高于减数分裂后, 而一些没有增殖能力的细胞如Sertoli细胞和Leydig细胞根本不表达DNA-PKcs或非常微弱表达[27]. 增殖活跃的成纤维细胞中DNA-PKcs 表达水平显著高于处于静止期的成纤维细胞[28]. 以上均提示DNA-PKcs与细胞增殖活性存在关系, 但其具体机制还不是很清楚. 有研究利用基因芯片技术发现, 与DNA-PKcs活性有关的基因大都参与细胞周期调控, 如转录因子E2F1与DNA-PKcs活性正相关, 而E2F1的负调控因子Rbp130则与DNA-PKcs活性呈负相关. 当用PHA刺激外周血淋巴细胞时, E2F1活性增加, 具有促进细胞增殖, 同时可检测到DNA-PKcs活性增加[30], 提示DNA-PKcs参与细胞增殖的调控.
我们实验室前期利用siRNA干扰技术和抑制剂wortmannin抑制HeLa细胞中DNA-PKcs表达, 发现癌基因c-Myc蛋白表达水平也显著降低, 但其mRNA表达水平不受影响, 提示DNA-PKcs具有调节癌基因c-Myc蛋白表达的功能[15]. 为了对此做更广泛的研究, 我们又建立了siRNA抑制肝癌细胞HepG2中DNA-PKcs表达的细胞模型, 进一步证实了DNA-PKcs对c-Myc蛋白表达水平的调节作用. 与此同时, siRNA沉默DNA-PKcs表达后, 肝癌细胞的增殖速度明显减慢、辐射敏感性显著增加. c-Myc蛋白与细胞增殖调控和癌症的发生发展有密切的联系, 甚至在动物模型上, 诱导c-Myc单一基因的表达就能诱发肝癌, 反过来, 抑制c-Myc基因表达能促使肝癌细胞的分化[31]. 因此, DNA-PKcs对细胞增殖的影响至少有部分原因是通过调节c-Myc蛋白表达水平实现的. 我们的观察结果为阐述DNA-PKcs在癌细胞中过量表达的生物学意义和作用机制提供了重要的线索. 至于DNA-PKcs是如何调控c-Myc蛋白水平的, 我们利用siRNA沉默HeLa细胞DNA-PKcs表达的细胞模型对此做了初步研究, 显示c-Myc蛋白稳定性随DNA-PKcs表达抑制而降低(待发表结果), 更深入的分子调控机制正在探讨之中.
DNA-PKcs与另外2个亚基Ku70和Ku80共同构成DNA-PK复合物, 在DNA双链断裂非同源末端连接修复途径中发挥重要作用. 有研究报道DNA-PKcs在脑部肿瘤、肺癌、乳腺癌、食管癌、前列腺癌、肝癌等多种肿瘤组织细胞中高表达. 本文也观察到DNA-PKcs异常高表达现象, 而且DNA-PKcs在肝胆肿瘤组织中表达水平与肿瘤组织细胞的转移、侵袭性、恶性程度有显著的相关性.
DNA-PKcs与肿瘤的关系如何, 目前的报道存在两个极端: 有研究认为DNA-PKcs是抑癌基因, 在维持基因组稳定性中发挥着重要作用. 另有研究发现由于DNA-PKcs具有丝氨酸/苏氨酸蛋白激酶活性、并可磷酸化多种转录因子和癌基因产物, 特别是其在癌组织细胞中过量表达的发现, 表明其很可能还有癌基因的功能.
Tonotsuka et al发现在正常食道上皮层, 只有基底细胞表达DNA-PKcs, 且DNA-PKcs定位在细胞核. 而在食道癌组织中, DNA-PKcs的表达丰度明显高于正常食道上皮, 但表达丰度和细胞定位有异质性, 表明不同分化和进展期的细胞其DNA-PKcs的活性不同. Lee et al发现DNA-PKcs在正常的胃黏膜上皮不表达, 但在H pylori相关的胃炎组织、胃上皮肠化生和胃腺瘤组织中呈阳性表达, 79.8%(450/564)的胃癌组织表达DNA-PKcs. 但相关性分析发现DNA-PKcs表达阴性与肿瘤进展和临床预后差显著相关, 提示DNA-PKcs是一肿瘤抑癌基因. 此结果与本文的结论相反, 推测原因之一是DNA-PKcs作为一把双刃剑, 在不同组织中的作用有选择性, DNA-PKcs缺失导致的DNA损伤修复缺陷, 导致胃癌患者预后差.
本文建立了siRNA抑制肝癌细胞HepG2中DNA-PKcs表达的细胞模型, 发现siRNA沉默DNA-PKcs表达后, 肝癌细胞的增殖速度明显减慢、辐射敏感性显著增加. 与此同时, 进一步证实了DNA-PKcs对c-Myc蛋白表达水平的调节作用, 提示DNA-PKcs对细胞增殖的影响至少有部分原因是通过调节c-Myc蛋白表达水平实现的. 本文的观察结果为阐述DNA-PKcs在癌细胞中过量表达的生物学意义和作用机制提供了重要的线索.
DNA-PKcs是一重要的DNA双链断裂损伤修复基因, 可以修复辐射或化疗药物导致的肿瘤细胞DNA双链断裂, 使肿瘤细胞具有抗放射治疗和化疗耐受的能力, 因此肿瘤细胞DNA-PKcs的活性已成为临床肿瘤患者治疗方案选择要考虑的因素之一. 本文研究也发现DNA-PKcs缺失的肝癌细胞, 其放射敏感性增强, 提示DNA-PKcs可具有做为潜在肿瘤标志物和抗癌分子靶标意义的靶标.
DNA双链断裂非同源末端连接修复(NHEJ): DNA双链断裂损伤(DSBs)的修复反应是一个多步骤的复杂过程, 由多个功能蛋白复合物的交替联合, 构成一个完整的修复器(repair machine)来执行功能. 在真核细胞中, DSBs修复主要通过两种途径来完成: 非同源末端连接(NHEJ)和同源重组(HR). 在NHEJ修复途径中, 首先DNA-PK蛋白复合物(Ku70/Ku80/DNA-PKcs)被募集到DNA断裂位点并被激活, 并进一步募集和活化其他修复功能蛋白如MRN, Artemis, Fen1等(包括一些不清楚的成分)形成复合物, 对"dirty"断裂末端做适当的修剪处理后再募集XRCC4/连接酶IV等, 进行连接修复反应. 其中的Fen-1具有核酸内切酶活性; MRN复合物兼有内切酶/外切酶/解旋酶活性; Artemis具有单链特异的外切核酸酶活性, 也参与末端修剪.
本文论文书写规范, 设计合理, 研究方法先进, 结果可靠, 结论合理, 是一篇非常有意义的基础研究论文.
编辑: 程剑侠 电编: 马文华
| 1. | Jackson SP. Sensing and repairing DNA double-strand breaks. Carcinogenesis. 2002;23:687-696. [PubMed] [DOI] |
| 2. | Bailey SM, Brenneman MA, Halbrook J, Nickoloff JA, Ullrich RL, Goodwin EH. The kinase activity of DNA-PK is required to protect mammalian telomeres. DNA Repair (Amst). 2004;3:225-233. [PubMed] [DOI] |
| 3. | Hande MP. DNA repair factors and telomere-chromosome integrity in mammalian cells. Cytogenet Genome Res. 2004;104:116-122. [PubMed] [DOI] |
| 4. | Iijima S, Teraoka H, Date T, Tsukada K. DNA-activated protein kinase in Raji Burkitt's lymphoma cells. Phosphorylation of c-Myc oncoprotein. Eur J Biochem. 1992;206:595-603. [PubMed] [DOI] |
| 5. | Karmakar P, Piotrowski J, Brosh RM, Sommers JA, Miller SP, Cheng WH, Snowden CM, Ramsden DA, Bohr VA. Werner protein is a target of DNA-dependent protein kinase in vivo and in vitro, and its catalytic activities are regulated by phosphorylation. J Biol Chem. 2002;277:18291-18302. [PubMed] [DOI] |
| 6. | Tuteja R, Tuteja N. Ku autoantigen: a multifunctional DNA-binding protein. Crit Rev Biochem Mol Biol. 2000;35:1-33. [PubMed] [DOI] |
| 7. | Sakata K, Matsumoto Y, Satoh M, Oouchi A, Nagakura H, Koito K, Hosoi Y, Hareyama M, Suzuki N. Clinical studies of immunohistochemical staining of DNA-dependent protein kinase in oropharyngeal and hypopharyngeal carcinomas. Radiat Med. 2001;19:93-97. [PubMed] |
| 8. | Stronati L, Gensabella G, Lamberti C, Barattini P, Frasca D, Tanzarella C, Giacobini S, Toscano MG, Santacroce C, Danesi DT. Expression and DNA binding activity of the Ku heterodimer in bladder carcinoma. Cancer. 2001;92:2484-2492. [PubMed] [DOI] |
| 9. | Shintani S, Mihara M, Li C, Nakahara Y, Hino S, Nakashiro K, Hamakawa H. Up-regulation of DNA-dependent protein kinase correlates with radiation resistance in oral squamous cell carcinoma. Cancer Sci. 2003;94:894-900. [PubMed] [DOI] |
| 10. | Nguyen DC, Parsa B, Close A, Magnusson B, Crowe DL, Sinha UK. Overexpression of cell cycle regulatory proteins correlates with advanced tumor stage in head and neck squamous cell carcinomas. Int J Oncol. 2003;22:1285-1290. [PubMed] [DOI] |
| 11. | 隋 建丽, 孙 敬芬, 曹 珍山, 周 平坤, 吴 德昌. DNA依赖蛋白激酶在人支气管上皮细胞癌变株和肺癌组织中的异常表达. 中国体视学与图像分析. 2003;8:141-145. |
| 13. | Hosoi Y, Watanabe T, Nakagawa K, Matsumoto Y, Enomoto A, Morita A, Nagawa H, Suzuki N. Up-regulation of DNA-dependent protein kinase activity and Sp1 in colorectal cancer. Int J Oncol. 2004;25:461-468. [PubMed] [DOI] |
| 14. | Tonotsuka N, Hosoi Y, Miyazaki S, Miyata G, Sugawara K, Mori T, Ouchi N, Satomi S, Matsumoto Y, Nakagawa K. Heterogeneous expression of DNA-dependent protein kinase in esophageal cancer and normal epithelium. Int J Mol Med. 2006;18:441-447. [PubMed] [DOI] |
| 15. | An J, Xu QZ, Sui JL, Bai B, Zhou PK. Downregulation of c-myc protein by siRNA-mediated silencing of DNA-PKcs in HeLa cells. Int J Cancer. 2005;117:531-537. [PubMed] [DOI] |
| 16. | An J, Xu QZ, Sui JL, Bai B, Zhou PK. Silencing of DNA-PKcs alters the transcriptional profile of certain signal transduction genes related to proliferation and differentiation in HeLa cells. Int J Mol Med. 2005;16:455-462. [PubMed] [DOI] |
| 17. | Tian X, Chen G, Xing H, Weng D, Guo Y, Ma D. The relationship between the down-regulation of DNA-PKcs or Ku70 and the chemosensitization in human cervical carcinoma cell line HeLa. Oncol Rep. 2007;18:927-932. [PubMed] [DOI] |
| 18. | Bentle MS, Reinicke KE, Dong Y, Bey EA, Boothman DA. Nonhomologous end joining is essential for cellular resistance to the novel antitumor agent, beta-lapachone. Cancer Res. 2007;67:6936-6945. [PubMed] [DOI] |
| 19. | Ogawa K, Boucher Y, Kashiwagi S, Fukumura D, Chen D, Gerweck LE. Influence of tumor cell and stroma sensitivity on tumor response to radiation. Cancer Res. 2007;67:4016-4021. [PubMed] [DOI] |
| 20. | Gerweck LE, Vijayappa S, Kurimasa A, Ogawa K, Chen DJ. Tumor cell radiosensitivity is a major determinant of tumor response to radiation. Cancer Res. 2006;66:8352-8355. [PubMed] [DOI] |
| 21. | Raju U, Ariga H, Dittmann K, Nakata E, Ang KK, Milas L. Inhibition of DNA repair as a mechanism of enhanced radioresponse of head and neck carcinoma cells by a selective cyclooxygenase-2 inhibitor, celecoxib. Int J Radiat Oncol Biol Phys. 2005;63:520-528. [PubMed] [DOI] |
| 22. | Daido S, Yamamoto A, Fujiwara K, Sawaya R, Kondo S, Kondo Y. Inhibition of the DNA-dependent protein kinase catalytic subunit radiosensitizes malignant glioma cells by inducing autophagy. Cancer Res. 2005;65:4368-4375. [PubMed] [DOI] |
| 23. | Zhang Y, Zhou J, Cao X, Zhang Q, Lim CU, Ullrich RL, Bailey SM, Liber HL. Partial deficiency of DNA-PKcs increases ionizing radiation-induced mutagenesis and telomere instability in human cells. Cancer Lett. 2007;250:63-73. [PubMed] [DOI] |
| 24. | Someya M, Sakata K, Matsumoto Y, Yamamoto H, Monobe M, Ikeda H, Ando K, Hosoi Y, Suzuki N, Hareyama M. The association of DNA-dependent protein kinase activity with chromosomal instability and risk of cancer. Carcinogenesis. 2006;27:117-122. [PubMed] [DOI] |
| 25. | Holgersson A, Erdal H, Nilsson A, Lewensohn R, Kanter L. Expression of DNA-PKcs and Ku86, but not Ku70, differs between lymphoid malignancies. Exp Mol Pathol. 2004;77:1-6. [PubMed] [DOI] |
| 26. | Lee HS, Choe G, Park KU, Park DJ, Yang HK, Lee BL, Kim WH. Altered expression of DNA-dependent protein kinase catalytic subunit (DNA-PKcs) during gastric carcinogenesis and its clinical implications on gastric cancer. Int J Oncol. 2007;31:859-866. [PubMed] |
| 27. | Moll U, Lau R, Sypes MA, Gupta MM, Anderson CW. DNA-PK, the DNA-activated protein kinase, is differentially expressed in normal and malignant human tissues. Oncogene. 1999;18:3114-3126. [PubMed] [DOI] |
| 28. | Salminen A, Helenius M, Lahtinen T, Korhonen P, Tapiola T, Soininen H, Solovyan V. Down-regulation of Ku autoantigen, DNA-dependent protein kinase, and poly(ADP-ribose) polymerase during cellular senescence. Biochem Biophys Res Commun. 1997;238:712-716. [PubMed] [DOI] |
| 29. | Sallmyr A, Miller A, Gabdoulkhakova A, Safronova V, Henriksson G, Bredberg A. Expression of DNA-dependent protein kinase in human granulocytes. Cell Res. 2004;14:331-340. [PubMed] [DOI] |
| 30. | Sakata K, Yamamoto H, Matsumoto Y, Someya M, Hareyama M. cDNA analysis of gene expression associated with DNA-dependent protein kinase activity. Int J Oncol. 2007;30:413-420. [PubMed] |