修回日期: 2007-10-23
接受日期: 2007-11-11
在线出版日期: 2007-12-28
目的: 通过RNA干扰观察其对suivivin及PTEN在大肠腺癌中表达的差异及对大肠腺癌细胞增殖和凋亡的影响.
方法: 将survivin siRNA用脂质体2000转染SW620细胞, 以荧光定量PCR仪检测survivin和PTEN mRNA的变化, Western蛋白印迹法半定量检测两者的蛋白变化, 同时用MTT法检测细胞增殖, 流式细胞仪检测细胞的凋亡和细胞周期分布的变化.
结果: 结肠腺癌SW620中免疫组化染色显示survivin呈阳性表达. siRNA作用于SW620细胞, survivin mRNA及蛋白的表达随着作用时间的延长而下调, PTEN mRNA及蛋白的表达随着作用时间的延长而呈现递增趋势, 在12 h, 24 h, 48 h, survivin mRNA分别下调为对照组的75%, 93.75%, 97.8%, PTEN mRNA较对照组上调41%, 100%, 128%, 均与对照组有显著性差异. MTT法检测siRNA干扰对细胞增殖的影响呈现出时间依赖性, 与对照组相比有显著性差异(P<0.05), 且作用各时间点之间比较亦有显著性差异(P<0.05). 流式细胞仪检测细胞的凋亡率随时间的延长而增加.
结论: survivin siRNA作用于结肠腺癌SW620可使survivin mRNA和蛋白的表达下调, 同时使PTEN的表达上调, 两者呈负相关, 同时抑制细胞的增殖及促进细胞发生凋亡.
引文著录: 张志宏, 韩盛玺, 邱春华, 强欧, 陈和平, 张初民, 李易. RNA干扰survivin基因靶向治疗大肠癌. 世界华人消化杂志 2007; 15(36): 3803-3808
Revised: October 23, 2007
Accepted: November 11, 2007
Published online: December 28, 2007
AIM: To investigate the effects and mecha-nisms of survivin-siRNA inteference on adenocarcinoma cells SW620.
METHODS: SW620 cells were transfected with survivin-siRNA using Lipofectamine 2000. The mRNA expression levels of survivin and PTEN were detected by RT-PCR and protein expression levels were detected by Western blotting. MTT and flow cytometry were used to analyze proliferation and apoptosis.
RESULTS: Compared with control cells, the mRNA and protein levels of survivin were reduced in siRNA-transfected cells, while PTEN was increased. At 12, 24, 48 hours, the expression of survivin mRNA was downregulated 75%, 93.75% and 97.8%, respectivly, compared with that in the controls, and the expression of PTEN mRNA was upregulated 41%, 100%, 128%. The growth of transfected cells was inhibited, while apopotosis was increased.
CONCLUSION: Survivin-siRNA has preferential effects on adenocarcinoma cells.
- Citation: Zhang ZH, Han SX, Qiu CH, Qiang O, Chen HP, Zhang CM, Li Y. Effects and mechanisms of survivin-siRNA interference on colon adenocarcinoma cells SW620. Shijie Huaren Xiaohua Zazhi 2007; 15(36): 3803-3808
- URL: https://www.wjgnet.com/1009-3079/full/v15/i36/3803.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i36.3803
目前普遍认为诱导肿瘤细胞的凋亡是成功治疗肿瘤的基础和关键. 在众多调控细胞凋亡的基因中, survivin是迄今为止发现的最强的凋亡抑制因子, 具有在肿瘤组织中表达的高选择性和独特的抗凋亡作用机制, 作为肿瘤治疗的一个特异攻击靶点日益瞩目. 作为抑癌基因的PTEN与survivin均参与细胞周期的调控和细胞凋亡的发生, 作用环节一致, 而生物学效应相反, 在维持正常细胞的稳定性中发挥重要作用. 当组织恶变时, PTEN基因常发生突变, 其表达出现下调或缺失, 抑制肿瘤细胞增殖分化能力减弱, 而survivin的表达则上调, 促进细胞的增殖和分裂.
本文通过探讨以survivin为靶向, 通过RNA干扰(RNA interference, RNAi)观察其对survivin及PTEN在大肠腺癌中表达的差异及对大肠腺癌细胞增殖和凋亡两者的影响, 进一步探讨大肠癌防治的新途径.
SW620细胞株购于四川大学华西医院移植免疫实验室. 蛋白电泳仪(Bio-Rad公司), ECL半干电转系统(Amersham公司, TE70), 荧光定量PCR仪(上海枫岭生物技术FTC-2000), 流式细胞仪(美国Coulter公司, ELITE ESP型), 酶联免疫检测仪(美国EL-321e型), lipofectamine2000, PCR试剂盒, 兔抗survivin, PTEN(cell signaling, CST Co.), HRP标记的GAPDH survivin的siRNA双链体(Shanghai GenePharma Co.): Sense 5'-GGA CCA CCG CAU CUC UAC AdTdT-3'; Antisense 5'-UGU AGA GAU GCG GUG GUC CdTdT-3'; PCR反应引物: SURF1: 5'-gagcggatggccgaggct -3', SURR1: 5'-tgttcctctatggggtcgtca-3'(124 bp); PTENF: 5'-GATTCGACTTAGACTTGACCT-3', PTENR: 5'-TTTGGCGGTGTCATAATGTCT-3'(182 bp).
1.2.1 细胞复苏及传代: SW620细胞株用1640培养基加胎牛血清, 37℃ CO2孵箱培养.
1.2.2 免疫组化: 将2%明胶预处理过的无菌盖片放入6孔板内, 将细胞接种生长. 40 g/L多聚甲醛固定30 min. 0.1% Triton-X100 5 min打孔. 30 mL/L H2O2室温避光10 min. 羊血清封闭切片, 37℃约20 min. 一抗(1:100), 37℃孵育1 h, 4℃过夜. 二抗羊抗鼠抗体(1:200), 37℃ 40 min. 加过氧化物酶标记的链酶卵白素抗体(1:200), 37℃孵育30 min. DAB显色, 苏木素复染, 脱水透明, 封片.
1.2.3 siRNA双链体转染: siRNA转染前1 d, 将细胞以每孔2×105的密度接种于6孔板中, 用不含抗生素的1640培养基培养. 转染当天用无血清培养基稀释siRNA双链体, 以4 μL100 pmol/孔的siRNA双链体和8 μL/孔lipofectamine2000按1:2体积轻混, 于室温孵育20 min以形成脂质体复合物, 每孔600 μL加入6孔板中. 通过轻轻敲击培养板30 s以使之混匀, 将细胞培养板于37℃ 50 mL/L的CO2培养箱中孵育4-6 h后更换培养液. 观察不同时间点的作用.
1.2.4 Western印迹检测蛋白质: 用含抑制剂的蛋白抽提剂(1×106个细胞加入0.1 mL)抽提蛋白, 收集上清液. 蛋白定量为1.5 μg/μL. 10% SDS-聚丙烯酰胺电泳分离蛋白. 半干电转法将凝胶上蛋白转移到PVDF膜60 min. 封闭液中孵育1 h. 加入1:1000稀释的一抗4℃过夜. TBST洗膜5 min, 共3次. 加入1:5000 HRP标记的二抗及GAPDH, 37℃孵育2 h. 进行ECL检测.
1.2.5 RT-PCR: TRIzol reagent提取细胞总RNA, 参照说明书逆转录后PCR扩增, 参照GenBank序列设计引物. PCR反应条件: 94℃ 2 min 1个循环, 后94℃ 20 s, 54℃ 20 s, 70℃ 30 s, 80℃ 20 s, 共40个循环. 增益率为1.5. PCR产物用琼脂糖凝胶电泳鉴定.
1.2.6 噻唑蓝(MTT)比色试验: 以2×103个细胞/孔的浓度接种细胞于96孔板, 每孔100 μL. 置37℃的CO2孵箱中培养1 d. 转染后继续分别培养24、48、72 h. 实验终止前4 h加MTT 20 μL/孔, 继续37℃孵育, 最后弃上清, 加入DMSO 150 μL/孔, 振荡10 min. 选择570 nm波长, 测定各孔光吸收值.
抑制率 = (1-试验组光吸收值/对照组光吸收值)×100%.
1.2.7 流式细胞仪检测细胞周期及凋亡的影响: 细胞的接种与收集: 将细胞消化计数2×108 /L, 接种于6孔板内, 培养24 h后进行转染. 将待收集细胞悬于4℃预冷的PBS中, 缓缓倒入-20℃预冷乙醇, 4℃过夜. 离心后将与PI染液混合, 4℃放置20-30 min. 过滤检测.
统计学处理 所有统计均采用SPSS10.0软件包进行分析. 细胞增殖抑制结果采用方差分析(F检验), 各组间两两比较用LSD分析. 药物对细胞凋亡的作用采用χ2检验.
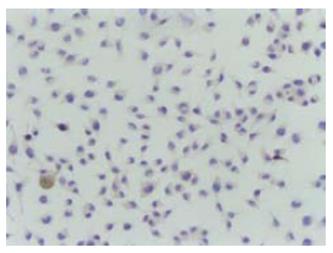
结肠腺癌SW620中免疫组化染色显示survivin呈阳性表达, 弥漫性分布于胞质中呈棕色颗粒样, 胞核呈蓝色复染状(图1).
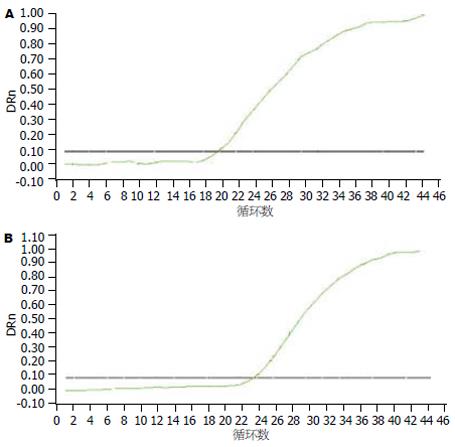
用siRNA干扰分别作用于SW620细胞24 h, 48 h, 72 h后, survivin mRNA的表达下调为对照组的75%, 93.75%, 97.8%, 具有显著性差异(P<0.01)(图2). 而PTEN mRNA的表达则较对照组上调为41%, 100%, 128%, 且差异显著(P<0.01), 且两者呈现出负相关(P<0.01).
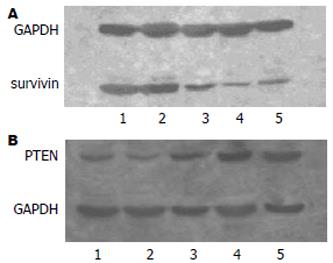
用siRNA干扰作用于SW620细胞24-72 h后, survivin蛋白的表达随着作用时间的延长而下调, 与对照组间的差异显著(P<0.01), 且48 h和72 h与24 h相比较亦有显著差异, 但前两者之间则似乎无明显差异(图3A). PTEN的表达则随时间延长而呈现出递增趋势. 虽然干扰后PTEN的表达较对照仍然升高(P<0.05), 但程度较survivin蛋白表达下降(图3B).
用MTT法检测发现siRNA干扰对细胞增殖的影响呈现出时间依赖性. 干扰组对细胞增殖的抑制率与对照组相比有显著差异(P<0.05). 且各时间点之间比较亦有显著性差异(P<0.05, 表1).
| 分组 | 24 h | 48 h | 72 h |
| 抑制率 | |||
| 空白组 | 5.3±0.8 | 7.6±1.2 | 9.3±0.9 |
| 阴性对照组 | 8.6±1.2 | 11.2±2.1 | 13.5±0.7 |
| siRNA干扰组 | 14.3±1.5 | 36.2±3.3 | 40.6±3.6 |
| 凋亡率 | |||
| 空白组 | 12±2.1 | 15.6±1.6 | 25.3±3.1 |
| 阴性对照组 | 15.2±1.3 | 16±1.5 | 28±2.4 |
| siRNA干扰组 | 25.5±1.9 | 48.9±4.0 | 67±3.7 |
| 细胞周期比例 | |||
| G1期 | 52.9±1.8 | 65.1±4.1 | 70.2±1.9 |
| S期 | 38.4±2.7 | 26.4±2.9 | 18.3±3.1 |
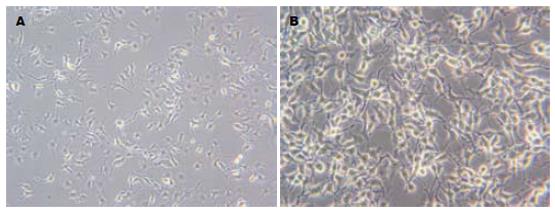
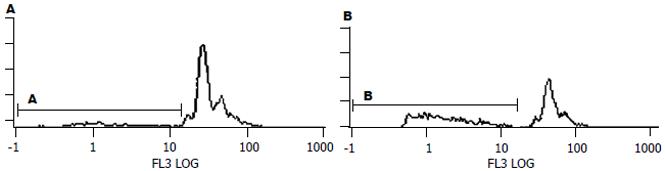
正常生长的细胞表现为不规则的多角形, 融合成集落生长. 经siRNA干扰后, 细胞体积变大, 似乎胞质中颗粒增多, 以后部分细胞从培养瓶壁上脱落下来. 随时间增加, 以上改变明显(图4). 与阴性对照组相比, siRNA干扰作用于细胞48 h后的凋亡率显著增加(图5). 同时用siRNA干扰作用于SW620细胞24-72 h, 细胞的凋亡率随着时间的延长而增加, 72 h达到高峰(表1). 阴性组细胞周期S期43.3%±32%, G1期48%±2.1%, 而干扰组细胞周期S期缩短, 而G1期延长, 也在72 h达到高峰.(表1).
由小片段的双链RNA分子介导RNA干扰可导致生物细胞内同源基因的特异性静默, 具有高特异性[1]及高效性. 有研究将其与寡脱氧核苷酸(oligodeoxyribonucleic acids, ODNs)比较, 发现前者最大抑制浓度(IC50)较后者低100-1000倍[2-3], 并且作用时间延长[4], 同时通过电穿空, 局部注射或静脉注射[5]的方法已经成功将化学合成的siRNA, 表达siRNA的质粒以及病毒等导入哺乳动物, 并不引起全身非特异性反应用[2,6-7]. 2004年美国FDA已经批准将经过修饰的siRNA进行临床新药试验, 用于治疗与年龄相关的黄斑退行性改变的患者[6]. 目前认为RNA干扰作为研究基因功能的一种重要和常用的技术, 已经广泛用于基因组的研究和临床疾病包括病毒感染、显性遗传疾病、尤其是肿瘤[8]的治疗研究, 有广阔的前景和应用潜力.
生存素(survivin)是凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)家族成员之一, 被认为是迄今为止发现的最强的凋亡抑制因子. 不同于其他IAP家族成员主要分布于正常终末分化组织中, survivin在胚胎发育过程中和绝大多数肿瘤组织中表达. 研究发现, survivin在结肠癌组织及癌旁的正常组织中表达阳性率分别为63.5%和29.1%, 有显著差异, 同时发现其阳性表达对疾病的预后有重要影响[9-11]. 本实验通过免疫组化及Western蛋白印迹检测发现结肠腺癌细胞株SW620中survivin的表达呈强阳性. 采用针对survivin设计的siRNA干扰结肠腺癌SW620细胞, 则survivin mRNA及蛋白的表达分别下调75%-97.8%和46%-80%. 与报道用针对survivin dsRNA构建的腺病毒转染人软组织肉瘤, 发现其mRNA表达下降了73%-88%, 蛋白表达减少了52%-81%的结果相接近[12]. 并且有研究报道, siRNA干扰表达于转染后12 h, 高峰出现于36-48 h, 至96 h失效[13]. 本实验结果与其相似, 高峰出现于48 h左右, 作用至72 h mRNA及蛋白的表达较前者无明显增加.
作为抑癌基因的PTEN在维持正常细胞的稳定性中发挥重要的作用[14], 与survivin均参与细胞周期的调控和细胞凋亡的发生, 作用环节一致, 而生物学效应相反, 在肿瘤中的表达常常减少或缺失[15-16]. 因其具有对PI3K-PKB/AKT信号传导通路的负调控作用而备受关注. 当组织恶变时, PTEN基因常发生突变, 出现下调或缺失, 对PI3K/AKT通路的抑制作用减弱, 则抑制肿瘤细胞增殖分化能力减弱, 而survivin的表达上调, 启动细胞周期, 促进分裂, 使肿瘤细胞的恶性增殖能力增强[17]. 有研究应用PTEN基因转染神经胶质瘤和卵巢癌可使肿瘤细胞周期阻滞, 诱导细胞凋亡[18-19]. 本文通过以survivin为靶向的siRNA干扰可以使PTEN mRNA及蛋白分别上调41%-128%及30%-50%, 与survivin的表达呈反方向变化, 两者呈负相关. 其上调的幅度的差异认为可能与不同蛋白所具有的代谢半衰期不同有关.
siRNA干扰还可以对细胞的增殖及凋亡发挥影响作用[20]. 本文发现siRNA干扰可使SW620细胞的增殖明显受抑(14.3%-40.6%), 而对照组为(5.3%-9.3%). 同时促进肿瘤细胞的凋亡, 其凋亡率为25.5%-67%, 并使细胞周期停滞于G1期, 而S期所占比例则明显减少. 该结果与以前报道认为在细胞中survivin的表达增加可以使细胞从G1期进入S期, 启动细胞周期[21], 相反下调survivin的表达可使细胞受阻于G1期的结论相一致[22]. 其主要作用机制可能与以下几点相关: (1)survivin可直接与凋亡路径的下游执行酶caspase-3和caspase-7结合而抑制其活性, 阻止由caspase激活剂或凋亡诱导剂诱导的细胞DEVD-cleaving自杀酶的累积, 从而起到抑制细胞凋亡的作用[23-24]; (2)通过与线粒体释放的凋亡前蛋白, 天冬氨酸特异性半胱氨酸蛋白酶二级活化物(second mitochondria-derived activator of caspase, SMAC)结合, 阻断caspase-9依赖的细胞凋亡信号传导[25-26]; (3)通过竞争性与CDK4/P21结合, 促进S期进程, 同时从CDK中释放出P21, 与procaspase-3形成复合物, 抑制caspase-3的活性[27]. (4)通过其细胞周期调节作用, 使肿瘤细胞逃避细胞周期G2/M期检测点的监测, 从而抵抗DNA损伤或突变自身诱导的细胞凋亡, 从而导致肿瘤细胞异常分裂增殖[28].
总之, 由于survivin在肿瘤组织中所具有的高选择性的表达和独特的抗凋亡的作用机制, 使其作为肿瘤治疗的一个特异的攻击靶点成为可能[29]. 同时PTEN作为与survivin同一路径的相反的靶点, 保持其自身的稳定性及抑制其发生突变也需要进一步的研究明确. 与反义寡核苷酸相比, RNAi的应用不仅效率远高于前者, 而且持续时间延长. 同时有实验证实, 在小鼠体内反义核酸不发挥作用, 而RNAi的活性却很高, 推测反义核酸可能被体内的核酸降解系统破坏[4]. 这一实验结果鼓舞了越来越多的学者们对RNAi的进行更深入的研究. 当然, RNAi真正被用于临床仍然还有许多问题亟待解决: 如何保证RNAi的稳态, 选择合适的无毒载体, 最大限度的延长RNAi的效果等, 但无疑RNAi的应用也为肿瘤治疗提供了新的思路和手段.
诱导肿瘤细胞的凋亡是成功治疗肿瘤的基础和关键. survivin作为凋亡抑制因子, 与抑癌基因PTEN作用环节一致, 而生物学效应相反. 当组织恶变时, PTEN基因的表达出现下调或缺失, 而survivin则上调. siRNA静默survivin的同时发现PTEN的表达增加及大肠腺癌细胞增殖和凋亡均受影响, 以期探讨大肠癌防治的新途径.
本文旨在通过用siRNA干扰survivin的表达, 观察其对大肠癌细胞survivin及PTEN表达的影响, 同时观察其对大肠癌细胞增殖和凋亡的作用, 借以探讨大肠癌防治的新途径.
目前尚无研究直接以siRNA干扰survivin后, 同时观察survivin对相关抑癌基因PTEN表达的影响, 及其对细胞增殖和凋亡的影响.
本文为防治大肠癌提供了理想的方法和途径.
小干扰RNA片段(small interfering RNA, siRNA): 长链的双链RNA进入细胞后, 在细胞胞质内的核酸酶-Dicer的作用下, dsDNA被切切割成21-23 bp大小, 后者包括外源性合成的和内源性表达的siRNA.
本文是一篇较好的基础研究文章, 选题具有先进性, 研究方案设计合理, 有十分重要的理论和实践意义. 但是文字表述应下功夫, 使之更加准确简练.
编辑: 程剑侠 电编: 郭海丽
| 1. | Wohlbold L, van der Kuip H, Miething C, Vornlocher HP, Knabbe C, Duyster J, Aulitzky WE. Inhibition of bcr-abl gene expression by small interfering RNA sensitizes for imatinib mesylate (STI571). Blood. 2003;102:2236-2239. [PubMed] [DOI] |
| 2. | Semizarov D, Frost L, Sarthy A, Kroeger P, Halbert DN, Fesik SW. Specificity of short interfering RNA determined through gene expression signatures. Proc Natl Acad Sci U S A. 2003;100:6347-6352. [PubMed] [DOI] |
| 3. | McCarthy BA, Mansour A, Lin YC, Kotenko S, Raveche E. RNA interference of IL-10 in leukemic B-1 cells. Cancer Immun. 2004;4:6. [PubMed] |
| 4. | Bertrand JR, Pottier M, Vekris A, Opolon P, Maksimenko A, Malvy C. Comparison of antisense oligonucleotides and siRNAs in cell culture and in vivo. Biochem Biophys Res Commun. 2002;296:1000-1004. [PubMed] [DOI] |
| 5. | Soutschek J, Akinc A, Bramlage B, Charisse K, Constien R, Donoghue M, Elbashir S, Geick A, Hadwiger P, Harborth J. Therapeutic silencing of an endogenous gene by systemic administration of modified siRNAs. Nature. 2004;432:173-178. [PubMed] [DOI] |
| 6. | Karagiannis TC, El-Osta A. RNA interference and potential therapeutic applications of short interfering RNAs. Cancer Gene Ther. 2005;12:787-795. [PubMed] [DOI] |
| 7. | Elbashir SM, Martinez J, Patkaniowska A, Lendeckel W, Tuschl T. Functional anatomy of siRNAs for mediating efficient RNAi in Drosophila melanogaster embryo lysate. EMBO J. 2001;20:6877-6888. [PubMed] [DOI] |
| 8. | Karam JA, Lotan Y, Ashfaq R, Sagalowsky AI, Shariat SF. Survivin expression in patients with non-muscle-invasive urothelial cell carcinoma of the bladder. Urology. 2007;70:482-486. [PubMed] [DOI] |
| 9. | Sarela AI, Macadam RC, Farmery SM, Markham AF, Guillou PJ. Expression of the antiapoptosis gene, survivin, predicts death from recurrent colorectal carcinoma. Gut. 2000;46:645-650. [PubMed] [DOI] |
| 10. | Wang TT, Qian XP, Liu BR. Survivin: potential role in diagnosis, prognosis and targeted therapy of gastric cancer. World J Gastroenterol. 2007;13:2784-2790. [PubMed] |
| 11. | Piras F, Murtas D, Minerba L, Ugalde J, Floris C, Maxia C, Colombari R, Perra MT, Sirigu P. Nuclear survivin is associated with disease recurrence and poor survival in patients with cutaneous malignant melanoma. Histopathology. 2007;50:835-842. [PubMed] [DOI] |
| 12. | Kappler M, Bache M, Bartel F, Kotzsch M, Panian M, Würl P, Blümke K, Schmidt H, Meye A, Taubert H. Knockdown of survivin expression by small interfering RNA reduces the clonogenic survival of human sarcoma cell lines independently of p53. Cancer Gene Ther. 2004;11:186-193. [PubMed] [DOI] |
| 13. | McManus MT, Haines BB, Dillon CP, Whitehurst CE, van Parijs L, Chen J, Sharp PA. Small interfering RNA-mediated gene silencing in T lymphocytes. J Immunol. 2002;169:5754-5760. [PubMed] [DOI] |
| 14. | Li J, Yen C, Liaw D, Podsypanina K, Bose S, Wang SI, Puc J, Miliaresis C, Rodgers L, McCombie R. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer. Science. 1997;275:1943-1947. [PubMed] [DOI] |
| 15. | Li YL, Tian Z, Wu DY, Fu BY, Xin Y. Loss of heterozygosity on 10q23.3 and mutation of tumor suppressor gene PTEN in gastric cancer and precancerous lesions. World J Gastroenterol. 2005;11:285-288. [PubMed] [DOI] |
| 16. | Wu SK, Wang BJ, Yang Y, Feng XH, Zhao XP, Yang DL. Expression of PTEN, PPM1A and P-Smad2 in hepatocellular carcinomas and adjacent liver tissues. World J Gastroenterol. 2007;13:4554-4559. [PubMed] [DOI] |
| 17. | Myers MP, Stolarov JP, Eng C, Li J, Wang SI, Wigler MH, Parsons R, Tonks NK. P-TEN, the tumor suppressor from human chromosome 10q23, is a dual-specificity phosphatase. Proc Natl Acad Sci U S A. 1997;94:9052-9057. [PubMed] [DOI] |
| 18. | Davies MA, Lu Y, Sano T, Fang X, Tang P, LaPushin R, Koul D, Bookstein R, Stokoe D, Yung WK. Adenoviral transgene expression of MMAC/PTEN in human glioma cells inhibits Akt activation and induces anoikis. Cancer Res. 1998;58:5285-5290. [PubMed] |
| 19. | Minaguchi T, Mori T, Kanamori Y, Matsushima M, Yoshikawa H, Taketani Y, Nakamura Y. Growth suppression of human ovarian cancer cells by adenovirus-mediated transfer of the PTEN gene. Cancer Res. 1999;59:6063-6067. [PubMed] |
| 20. | Miao GY, Lu QM, Zhang XL. Downregulation of survivin by RNAi inhibits growth of human gastric carcinoma cells. World J Gastroenterol. 2007;13:1170-1174. [PubMed] [DOI] |
| 21. | Suzuki A, Ito T, Kawano H, Hayashida M, Hayasaki Y, Tsutomi Y, Akahane K, Nakano T, Miura M, Shiraki K. Survivin initiates procaspase 3/p21 complex formation as a result of interaction with Cdk4 to resist Fas-mediated cell death. Oncogene. 2000;19:1346-1353. [PubMed] [DOI] |
| 22. | Li LP, Liang NC, Luo CQ. Construction of survivin siRNA expression vector and its regulation on cell cycle and proliferation in MCF-7 cells. Ai Zheng. 2004;23:742-748. [PubMed] |
| 23. | Hay BA. Understanding IAP function and regulation: a view from Drosophila. Cell Death Differ. 2000;7:1045-1056. [PubMed] [DOI] |
| 24. | Sui L, Dong Y, Ohno M, Watanabe Y, Sugimoto K, Tokuda M. Survivin expression and its correlation with cell proliferation and prognosis in epithelial ovarian tumors. Int J Oncol. 2002;21:315-320. [PubMed] [DOI] |
| 25. | Mesri M, Wall NR, Li J, Kim RW, Altieri DC. Cancer gene therapy using a survivin mutant adenovirus. J Clin Invest. 2001;108:981-990. [PubMed] [DOI] |
| 26. | Verhagen AM, Vaux DL. Cell death regulation by the mammalian IAP antagonist Diablo/Smac. Apoptosis. 2002;7:163-166. [PubMed] [DOI] |
| 27. | Suzuki A, Hayashida M, Ito T, Kawano H, Nakano T, Miura M, Akahane K, Shiraki K. Survivin initiates cell cycle entry by the competitive interaction with Cdk4/p16(INK4a) and Cdk2/cyclin E complex activation. Oncogene. 2000;19:3225-3234. [PubMed] [DOI] |