修回日期: 2007-10-31
接受日期: 2007-11-11
在线出版日期: 2007-12-18
目的: 探讨重症急性胰腺炎大鼠血清IL-2、IL-10、sFas及IL-2/IL-10动态变化以及Fas在肠黏膜的表达及意义.
方法: 将SD大鼠64只, 随机分为对照组和胰腺炎组. 经大鼠胰腺被膜下均匀注射50 g/L牛磺胆酸钠制作重症急性胰腺炎模型, 对照组仅胰腺被膜下注射等量生理盐水. 通过肠系膜上静脉取血测定血清IL-2、IL-10和sFas水平, 并计算IL-2/IL-10比值. 分别对胰腺损伤、肠损伤程度进行病理评分. 免疫组化方法检测大鼠肠组织内Fas蛋白的表达水平.
结果: 0.5 h后血清IL-2水平胰腺组较对照组明显升高(3.53±0.62 ng/L vs 2.79±0.51 ng/L, 4.35±1.11 ng/L vs 2.93±0.89 ng/L, 6.94±1.55 ng/L vs 4.81±1.23 ng/L, 4.80±1.10 ng/L vs 3.41±0.72 ng/L, P<0.01), 并于6 h达到最高点. 胰腺炎组6 h后血清IL-10水平较对照组明显升高(494.98±11.23 ng/L vs 89.18±32.52 ng/L, 93.28±25.81 ng/L vs 77.15±22.60 ng/L, P<0.01), 12 h血清IL-10水平较6 h降低. 胰腺炎组的IL-2/IL-10先降低后升高, 0.5 h后即开始下降, 6 h时达到最低点然后开始升高, 显著低于对照组(P<0.01), 12 h接近对照组. 与对照组比较, 胰腺炎组各时相胰腺及肠黏膜病理改变明显加重. 免疫组化结果显示, 在正常的肠黏膜未见明显表达. 造模0.5 h后, 大鼠肠组织内Fas表达增加, 至12 h达最高水平.
结论: Fas参与胰腺炎肠损伤的病理过程, 其机制可能与其介导的Th细胞凋亡有关.
引文著录: 党胜春, 张建新, 毛正发, 瞿建国, 王旭青, 朱蓓. 血清IL-2、IL-10及肠黏膜Fas在重症急性胰腺炎大鼠中的动态变化. 世界华人消化杂志 2007; 15(35): 3697-3702
Revised: October 31, 2007
Accepted: November 11, 2007
Published online: December 18, 2007
AIM: To investigate the dynamic changes in the levels of serum interleukin (IL)-2 and IL-10 sFas and IL-2/IL-10 in rats with severe acute pancreatitis (SAP), and to explore the expression of Fas in the intestinal mucosa of rats with severe acute pancreatitis.
METHODS: A total of 64 Sprague-Dawley (SD) rats were randomly divided into normal control group and SAP group. A SAP model was induced by injection of 50 g/L sodium taurocholate under the pancreatic membrane. The normal control group received isovolumetric injection of 9 g/L physiological saline solution using the same method. Blood samples from the rats in each group were obtained via the superior mesenteric vein to measure the levels of IL-2, IL-10 and sFas, and to calculate the value of IL-2/IL-10. The levels of IL-2, IL-10 and sFas were determined by ELISA. The severity of pancreas and intestinal mucosal injury was evaluated by pathologic score. The expression of Fas in intestinal mucosal tissue was determined by immunohistochemistry.
RESULTS: The levels of serum IL-2 in the SAP group were significantly higher than those in the normal control group at 0.5 h after injury (3.53 ± 0.62 ng/L vs 2.79 ± 0.51 ng/L, 4.35 ± 1.11 ng/L vs 2.93 ± 0.89 ng/L, 6.94 ± 1.55 ng/L vs 4.81 ± 1.23 ng/L, 4.80 ± 1.10 ng/L vs 3.41 ± 0.72 ng/L, P < 0.01) and peaked at 6 h after injury. The levels of serum IL-10 in the SAP group were significantly higher than those in the normal control group at 6 h after injury (494.98 ± 11.23 ng/L vs 89.18 ± 32.52 ng/L, 93.28 ± 25.81 ng/L vs 77.15 ± 22.60 ng/L, P < 0.01). The IL-2/IL-10 ratio in the SAP group was significantly higher than that in the normal control group at 0.5 h and 2 h after injury, and significantly lower than that in the normal control group at 6 h after injury (P < 0.01), after which this ratio returned to the control level (P > 0.05). The pathological changes were significantly aggravated in the SAP group compared with the normal group. Immunohistochemistry staining showed. Fas from normal intestinal tissue. Fas expression in intestinal tissue gradually increased 0.5 h after the induction of pancreatitis, and its a peak at 12 h after induction.
CONCLUSION: Fas is involved in the pathogenesis of pancreatitis-associated intestinal injury. The mechanisms underlying this involvement of Fas may be related to Fas-mediated T helper cell apoptosis.
- Citation: Dang SC, Zhang JX, Mao ZF, Qu JG, Wang XQ, Zhu B. Dynamic changes in the levels of serum interleukin-2 and interleukin-10 and the expression of Fas in the intestinal mucosa of rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(35): 3697-3702
- URL: https://www.wjgnet.com/1009-3079/full/v15/i35/3697.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i35.3697
重症急性胰腺炎(severe acute pancreatitis, SAP)已严重危及人类健康, 后期常出现全身性炎症反应综合征(systemic inflammatory response syndrome, SIRS)、严重感染、感染性休克及多器官功能障碍综合征(MODS), 导致死亡[1]. SAP常伴有肠道细菌、内毒素移位. 造成这一现象的主要原因目前认为是由于肠黏膜屏障功能受损[2]. 研究表明, 急性胰腺炎(acute pancreatitis, AP)患者血中的sCD4和sFas之间存在正相关, 促炎-抗炎细胞因子平衡在决定SAP全身表现和临床转归中起着重要作用[3]. 我们设想Fas介导的胰腺的细胞凋亡与CD4+细胞产生的Th1与Th2有关, 因而与Th1/Th2偏移有一定的相关性. 通过Fas介导的胰腺的细胞凋亡与Th1/Th2偏移相关性的实验与临床研究, 有可能成为SAP的治疗提供新思路. 本研究通过大鼠SAP模型, 探讨Fas在SAP肠损伤中的作用.
SD大鼠64只, 体质量250-300 g, 雌雄不限, 由江苏大学医学院实验动物中心提供. 牛磺胆酸钠(美国Sigma公司), 检测大鼠血清IL-10、 IL-2以及Fas试剂盒均为分装自美国R&D公司, (生产批号分别为0607182、0607183及0607184), 由上海森雄科技实业有限公司提供.
1.2.1 动物分组与处理: 将SD大鼠64只, 随机分为对照组和胰腺炎组. 各组又按模型制备后0.5、2、6、12 h分为4组, 每组8只, 用于抽取血样及组织学观察. 动物实验前12 h禁食不禁饮.
1.2.2 制摸: 20 g/L戊巴比妥钠溶液ip麻醉(剂量1 mL/kg体质量), 采用胰腺被膜下均匀注射法制作胰腺炎模型[4]. 开腹后自胰尾至胰头方向在胰腺被膜下均匀注射5 g/L牛磺胆酸钠4 mL/kg体质量. 对照组进行同样操作, 仅胰腺被膜下注射等量生理盐水.
1.2.3 取材: 实验结束后, 将大鼠剖腹, 肉眼观察胰腺炎症轻重情况. 下腔静脉穿刺取血, 静置2 h后, 以3800 r/min离心3 min, 取血清-20℃冻存, 用于细胞因子及可溶性受体的检测. 取全部胰腺组织及末段回肠, 40 g/L甲醛固定, 制成石蜡切片.
1.2.4 sFas、IL-2及IL-10的测量: 采用双抗体夹心ABC-ELISA法测量sFas、IL-2及IL-10含量(按ELISA试剂盒上的操作说明书进行操作, 由上海森雄科技实业有限公司检测).
1.2.5 胰腺及肠组织病理学观察: 常规制作病理HE切片, 由病理科医生采用盲法在光镜下观察胰腺组织学改变. 按照胰腺组织病理评分标准[5], 每张切片随机选取20个视野, 对每个视野按标准进行单独评分, 20个视野的平均分数为动物的最后病理评分. 肠黏膜损害分级按照Chiu的标准[6], 病理改变由轻至重分为0级-Ⅴ级.
1.2.6 肠组织Fas蛋白表达: 采用DAKO的Envision检测肠组织Fas蛋白表达. 操作步骤: 蜡块置冷冻台冷却5-10 min, 切片3-4 μm, 冷水中摊平, 硅化玻片捞取, 再放入45℃水中摊平, 60℃过夜彻底烘干. 切片二甲苯脱蜡, 梯度酒精脱水, 水洗, 蒸馏水洗. 抗原修复: 放入0.01 mol/L pH6.2柠檬酸缓冲液隔水煮沸10 min, 保温20 min, 室温自然冷却. PBS洗×3, 切片置于湿盒, 滴加一抗50 μL, 4℃冰箱过夜. 次日早晨, 切片PBS洗×3, 滴加二抗50 μL室温40 min, PBS洗×3, DAB显色, 显微镜下控制显色程度. 蒸馏水洗, 苏木素复染, 梯度酒精脱水, 二甲苯透明, 封片.
统计学处理 采用SPSS11.0统计软件包对计量资料进行PostHoc检验, 等级资料用非参数统计法的Man Whitney检验.
0.5 h后血清IL-2水平胰腺组较对照组明显升高(P<0.01), 并于6 h达到最高点, 12 h血清IL-2水平较6 h降低(表1).
6 h后血清IL-10水平胰腺组较对照组明显升高(P<0.01), 12 h血清IL-10水平较6 h降低(表1).
胰腺炎组的IL-2/IL-10先降低后升高, 6 h时达到最低点然后开始升高, 显著低于对照组(P<0.01), 12 h接近对照组(P>0.05)(表2).
胰腺炎组的sFas水平逐渐升高, 6 h到达最高值, 以后逐渐下降. 与对照组各时间点相比未见有显著差异性(表3).
| 分组 | 血清Fas/APO-1 | |||
| 0.5 h | 2 h | 6 h | 12 h | |
| 对照组 | 3.16±0.75 | 4.05±1.08 | 5.93±1.52 | 4.62±1.23 |
| 胰腺炎组 | 3.31±0.80 | 4.32±1.11 | 5.41±1.47 | 4.44±1.16 |
2.5.1 胰腺组织病理学检查: 肉眼观察, 对照组胰腺外观正常. 胰腺炎各组大鼠胰腺肿胀明显, 质地较硬, 有大片黄色坏死灶. 大网膜、肠系膜上可见大量皂化斑, 腹腔有中至大量血性腹水. 显微镜下对照组胰腺腺泡和导管未见异常, 仅见叶间隙稍增宽. 2 h胰腺炎组出现凝固性坏死及脂肪坏死, 12 h胰腺炎组出现胰腺坏死严重, 失去正常结构, 细胞核消失. 各组大鼠病理评分如表4, 各时相胰腺炎组较对照组有显著差异.
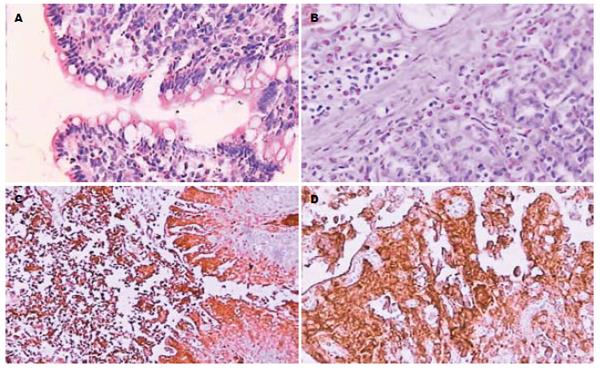
2.5.2 肠组织病理学检查: 肉眼观察, 对照组肠管粉红色, 表面光滑, 蠕动有力. 胰腺炎组肠管颜色随时间延长逐渐变暗, 由深红至暗紫色, 并逐步出现肠管水肿、僵硬、狭窄萎瘪, 12 h后, 肠管暗紫色, 蠕动消失. 各组肠组织损伤分级见表5. 胰腺炎组0.5 h肠黏膜有较轻度炎症伴出血, 绒毛顶层内皮移位. 胰腺炎组6 h肠黏膜光镜所见绒毛脱落明显, 固有层绒毛脱落, 腺体受损明显,光镜观察见图1.
2.5.3 大鼠肠组织Fas的表达: Fas免疫组化染色阳性结果均为细胞质/膜着色, 呈棕黄色, 胞核呈淡蓝色. 正常对照组大鼠肠组织Fas免疫组化染色显示, 肠组织形态结构正常, Fas几乎不表达. 造模后0.5 h组, 免疫组化染色可见大鼠肠组织Fas呈弱阳性表达. 随着时间的延长, 大鼠肠损伤程度加重. 6 h肠组织Fas的表达逐渐增强, 12 h表达最强(图1).
SAP已严重危及人类的生命健康, 是当前临床治疗的难点之一. 目前国内外对现有的治疗, 尽管能够改善临床表现和症状, 但都不能根本逆转其已存在的结构改变, 其病死率仍高达20%-30%[7-9]. 由于胃肠道与胰腺同属消化系统, 而且胃、十二指肠及结肠紧邻胰腺, 因此, 胃肠道往往是SAP时首先受影响的器官之一. 目前认为肠黏膜屏障功能障碍和肠道细菌微生态平衡的破坏及机体免疫功能的损害是导致肠黏膜的主要因素[10-12]. 近年来, MODS防治的研究热点已转移至消化道. 肠道细菌和内毒素移位是胰腺和胰周感染的潜在根源. 维护肠黏膜的屏障功能, 确保肠营养的正常进行, 抑制促发SIRS的肠道机制是成功救治MODS的关键[13-15].
在SAP动物实验中发现, 腺泡细胞死亡存在两种不同的方式: 坏死和凋亡. 凋亡很少甚至完全不引起炎症反应, 而坏死则伴随剧烈的炎症反应. 近年来, 人们已注意到急性水肿型胰腺炎的胰腺中存在着较多的凋亡细胞, 而SAP却很少出现凋亡细胞. 这就提示细胞凋亡在SAP的发生和发展过程中起着一定作用, 细胞凋亡对胰腺具有保护作用, 与AP的严重程度呈负相关[16]. 在AP发生MODS时可见血中sFas和sFasL明显增多, 可见Fas/FasL系统与AP的病程有关[17]. 同时国内程勇 et al[18-19]报道在AP时, Fas蛋白主要表达在胰腺腺泡细胞胞膜, 急性水肿型胰腺炎组和SAP组均明显高于对照组, 且急性水肿性胰腺炎组高SAP组, 说明Fas/FasL系统在大鼠的AP过程中可能参与诱导胰腺腺泡细胞凋亡, 减轻胰腺炎症反应程度. 研究显示, AP早期阶段的肠上皮细胞凋亡比率明显增加, 肠上皮细胞凋亡参与AP肠道黏膜屏障功能障碍的病理过程[20-21]. 肠黏膜屏障稳定的维持依赖于上皮细胞增殖和凋亡之间的平衡. 凋亡虽然对于机体来说是一种保护机制, 但一旦各种刺激因素引起肠上皮细胞凋亡过度, 修复与再生受阻, 肠黏膜屏障功能就会产生障碍[22].
SAP时细胞凋亡基因水平调控的研究很少, 研究多集中在细胞因子上. 近年来的研究显示, SAP的发病机理更多的与免疫异常有关. Th细胞是免疫应答的中心细胞, 根据CD4+ T细胞分泌细胞因子和介导免疫功能的不同, 将其分为Th1和Th2两个亚群. Th1分泌IL-2、IFN-γ、TNF-β等, 主要介导细胞免疫. Th2分泌IL-4、IL-5、IL-6、IL-10、IL-13等, 主要介导体液免疫. 他们对机体的作用及临床表现视两类介质相互作用的最终结果而定. 正常机体Th1/Th2类细胞因子处于动态平衡, Th1和Th2因子之间的平衡决定着促炎细胞因子与抗炎细胞因子之间的平衡[23]. 在众多的细胞因子网络中, 最能代表Th1功能的细胞因子分别是以TNF, IFN-γ和IL-2, 最能代表Th2功能的细胞因子IL-4, IL-6和IL-10. 在SAP的早期, 机体以Th1优势应答为主要病理改变, 表现为多种促炎介质升高, 可导致SIRS. 在SAP的中晚期, Th1细胞功能普遍降低, 而Th2细胞功能明显升高, Th1向Th2型细胞漂移. 由于Th1/Th2细胞因子形成动态的复杂的网络, Th1/Th2失衡会造成"瀑布样级联反应", 导致免疫异常贯穿病程始终[24].
IL-2主要是由Th1细胞释放. AP时IL-2大量释放, 在局部病变发展到全身性病过程中起主要作用, 其水平与疾病的严重程度、病死率和预后呈明显正相关[25]. 本研究发现, 胰腺炎组和对照组血清中0.5 h后IL-2明显升高, 胰腺炎组升高更为明显, 与病理评分显示的胰腺损伤程度一致, 提示IL-2是AP发病中的一个重要炎症介质, 血清的IL-2变化与胰腺炎时胰腺及胰外器官损害程度有关.
IL-10主要是由Th2细胞产生. 有研究显示, IL-10可以减轻AP病程, 并对AP所致的多器官损伤有保护作用[26-30]. IL-10是机体内诸多抗炎细胞因子中最重要的多功能调节因子, 有利于促炎-抗炎细胞因子平衡和炎症的恢复, 是目前所发现的AP时重要的强效抗炎细胞因子, 在阻止胰腺持续坏死, AP的早期诊断、治疗及预防中均起到了关键的作用[31].
本研究结果显示, 胰腺炎组及治疗组血清中IL-10水平也升高. 与IL-2不同的是, 其2 h后才明显升高, 明显滞后于血清中IL-2水平增高时限. 但与IL-2相比, 其幅度增加明显, 提示在SAP病程中存在着由促炎反应向抑炎反应转化趋势. IL-2/IL-10的变化反应了Th1/Th2细胞的功能变化. Th1和Th2的功能变化与机体的细胞免疫及体液免疫有关. 血清sFas的变化与炎症介质的变化一致, 提示Fas与T细胞的免疫调节作用有一定的关系, 这有助于我们寻找更加有效的治疗方法.
重症急性胰腺炎常伴有肠道细菌和内毒素移位. 造成这一现象的主要原因目前认为是由于肠黏膜屏障功能受损. 研究表明, 急性胰腺炎患者血中的sCD4和sFas之间存在正相关, 促炎-抗炎细胞因子平衡在决定重症急性胰腺炎全身表现和临床转归中起着重要作用. 我们设想Fas介导的胰腺的细胞凋亡与CD4+细胞产生的Th1与Th2有关. 通过重症急性胰腺炎Fas介导的细胞凋亡与Th1/Th2偏移相关性的实验与临床研究, 有可能为急性重症胰腺炎的治疗提供新思路.
测定对照组与胰腺炎组的血清sFas、细胞因子, 以及免疫组化法检测肠组织Fas的表达, 重点研究重症急性胰腺炎时细胞凋亡发生情况及初步探讨Fas途径在重症急性胰腺炎细胞凋亡发生中的作用以及与Th1/Th2漂移的关系.
本文研究重症急性胰腺炎细胞凋亡中Fas与Th1/Th2漂移的关系. 从细胞凋亡角度探索与炎症介质的关系,寻求急性重症胰腺炎免疫治疗的新途径.
通过对牛磺胆酸钠诱导重症急性胰腺炎模型的制备, 测定对照组与重症急性胰腺炎组的血清sFas与细胞因子, 以及免疫组化法检测肠组织Fas的表达.
Th1/Th2: Th细胞是免疫应答的中心细胞, 根据 CD4+ T细胞分泌细胞因子和介导免疫功能的不同, 将其分为Th1和Th2两个亚群, Th1分泌IL-2、IFN-γ、TNF-β等, 主要介导细胞免疫, Th2分泌IL-4、IL-5、IL-6、IL-10、IL-13等, 主要介导体液免疫. 他们对机体的作用及临床表现视两类介质相互作用的最终结果而定, 正常机体Th1/Th2类细胞因子处于动态平衡, Th1和Th2因子之间的平衡决定着促炎细胞因子与抗炎细胞因子之间的平衡.
本研究有一定的创新性, 内容比较具体, 完整, 关键问题选择较准确, 具有很强的学术价值.
编辑: 杜群 电编: 郭海丽
| 1. | Austrums E, Pupelis G, Snippe K. Postoperative enteral stimulation by gut feeding improves outcomes in severe acute pancreatitis. Nutrition. 2003;19:487-491. [PubMed] [DOI] |
| 2. | Wang XD, Wang Q, Andersson R, Ihse I. Alterations in intestinal function in acute pancreatitis in an experimental model. Br J Surg. 1996;83:1537-1543. [PubMed] [DOI] |
| 3. | Uehara S, Gothoh K, Handa H, Tomita H, Tomita Y. Immune function in patients with acute pancreatitis. J Gastroenterol Hepatol. 2003;18:363-370. [PubMed] [DOI] |
| 4. | Zhang JX, Dang SC, Qu JG, Wang XQ. Preventive effect of tetramethylpyrazine on intestinal mucosal injury in rats with acute necrotizing pancreatitis. World J Gastroenterol. 2006;12:6386-6390. [PubMed] [DOI] |
| 5. | Kaiser AM, Saluja AK, Sengupta A, Saluja M, Steer ML. Relationship between severity, necrosis, and apoptosis in five models of experimental acute pancreatitis. Am J Physiol. 1995;269:C1295-C1304. [PubMed] |
| 6. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] [DOI] |
| 7. | Takeda K, Mikami Y, Fukuyama S, Egawa S, Sunamura M, Ishibashi T, Sato A, Masamune A, Matsuno S. Pancreatic ischemia associated with vasospasm in the early phase of human acute necrotizing pancreatitis. Pancreas. 2005;30:40-49. [PubMed] |
| 8. | Gerlach H. Risk management in patients with severe acute pancreatitis. Crit Care. 2004;8:430-432. [PubMed] [DOI] |
| 9. | Algül H, Tando Y, Schneider G, Weidenbach H, Adler G, Schmid RM. Acute experimental pancreatitis and NF-kappaB/Rel activation. Pancreatology. 2002;2:503-509. [PubMed] [DOI] |
| 10. | Ammori BJ. Role of the gut in the course of severe acute pancreatitis. Pancreas. 2003;26:122-129. [PubMed] [DOI] |
| 11. | Dervenis C, Smailis D, Hatzitheoklitos E. Bacterial translocation and its prevention in acute pancreatitis. J Hepatobiliary Pancreat Surg. 2003;10:415-418. [PubMed] [DOI] |
| 12. | Furuya T, Soeno T, Komatsu M. [Strategy for bacterial translocation in acute pancreatitis]. Nihon Shokakibyo Gakkai Zasshi. 2004;101:502-509. [PubMed] |
| 13. | Gramlich L, Taft AK. Acute pancreatitis: practical considerations in nutrition support. Curr Gastroenterol Rep. 2007;9:323-328. [PubMed] [DOI] |
| 14. | McClave SA. Nutrition support in acute pancreatitis. Gastroenterol Clin North Am. 2007;36:65-74, vi. [PubMed] [DOI] |
| 15. | Balzan S, de Almeida Quadros C, de Cleva R, Zilberstein B, Cecconello I. Bacterial translocation: overview of mechanisms and clinical impact. J Gastroenterol Hepatol. 2007;22:464-471. [PubMed] [DOI] |
| 16. | Bhatia M. Apoptosis versus necrosis in acute pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2004;286:G189-G196. [PubMed] [DOI] |
| 17. | Endo S, Inoue Y, Fujino Y, Yamada Y, Sato N, Wakabayashi G, Sakamoto T, Ishikura H, Tanaka T, Inada K. Soluble Fas and soluble Fas L levels in patients with acute pancreatitis. Res Commun Mol Pathol Pharmacol. 2000;108:179-186. [PubMed] |
| 18. | 程 勇, 王 卫星, 侯 靖. 大鼠急性胰腺炎凋亡相关蛋白Fas、FasL、Bcl-2的表达及意义. 武汉大学学报(医学版). 2004;25:286-288, 298. |
| 20. | Wang X, Wang B, Wu K, Xu M, Gong Z. Growth hormone downregulated the excessive apoptosis of ileal intestinal epithelial cells in rats during the early course of acute necrotizing pancreatitis. Pancreas. 2002;25:205-209. [PubMed] [DOI] |
| 21. | Takeyama Y. Significance of apoptotic cell death in systemic complications with severe acute pancreatitis. J Gastroenterol. 2005;40:1-10. [PubMed] [DOI] |
| 23. | Coffman RL, Seymour BW, Lebman DA, Hiraki DD, Christiansen JA, Shrader B, Cherwinski HM, Savelkoul HF, Finkelman FD, Bond MW. The role of helper T cell products in mouse B cell differentiation and isotype regulation. Immunol Rev. 1988;102:5-28. [PubMed] [DOI] |
| 26. | Warzecha Z, Dembiński A, Ceranowicz P, Konturek S, Tomaszewska R, Stachura J, Nakamura T, Konturek PC. Inhibition of cyclooxygenase-2 reduces the protective effect of hepatocyte growth factor in experimental pancreatitis. Eur J Pharmacol. 2004;486:107-119. [PubMed] [DOI] |
| 27. | Mentula P, Kylänpää ML, Kemppainen E, Jansson SE, Sarna S, Puolakkainen P, Haapiainen R, Repo H. Plasma anti-inflammatory cytokines and monocyte human leucocyte antigen-DR expression in patients with acute pancreatitis. Scand J Gastroenterol. 2004;39:178-187. [PubMed] [DOI] |
| 28. | Chen ZQ, Tang YQ, Zhang Y, Jiang ZH, Mao EQ, Zou WG, Lei RQ, Han TQ, Zhang SD. Adenoviral transfer of human interleukin-10 gene in lethal pancreatitis. World J Gastroenterol. 2004;10:3021-3025. [PubMed] [DOI] |
| 29. | Demols A, Deviere J. New frontiers in the pharmacological prevention of post-ERCP pancreatitis: the cytokines. JOP. 2003;4:49-57. [PubMed] |
| 30. | Han XC, Zhang YC, Wang Y, Jia MK. Clinical evaluation of serum interleukin 10 in patients with acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2003;2:135-138. [PubMed] |