修回日期: 2007-11-02
接受日期: 2007-11-28
在线出版日期: 2007-12-08
目的: 构建人肠三叶因子(hITF/hTFF3)酵母双杂交诱饵载体并鉴定其自激活作用.
方法: 从人结肠黏膜提取总RNA. RT-PCR制备总cDNA, PCR扩增hTFF3基因, TA克隆至pGEMT载体并测序鉴定. 经NcoⅠ/XhoⅠ双酶切, 连接到pENTR11质粒构建入门克隆. LR反应获得酵母双杂交诱饵载体pDEST32-hTFF3, 测序正确后与酵母双杂交空猎物载体pDEST22共同转化Mav203酵母细胞, SD/-Leu/-Trp固体培养基上生长. 挑取单克隆划线接种到分别含有不同浓度氨基三唑(3AT)的SD/-Leu/-Trp/-His培养基上, 观察重组诱饵载体的自激活情况.
结果: 从人正常结肠黏膜成功克隆了hTFF3基因, 构建了pDEST32- hTFF3酵母表达质粒. 转化pDEST32- hTFF3和pDEST22的Mav203酵母细胞可在3AT浓度为30 mmol/L以下的SD/-Leu/-Trp/-His培养基上生长, 在3AT浓度为30 mmol/L以上的培养基上则未见酵母细胞生长.
结论: 所构建的pDEST32-hTFF3可作为酵母双杂交的诱饵质粒.
引文著录: 卢雅丕, 董菁, 周飞, 王琳, 陈美娅, 廉亚美, 张波, 任建林. 人肠三叶因子酵母双杂交载体的构建及其自激活作用鉴定. 世界华人消化杂志 2007; 15(34): 3625-3628
Revised: November 2, 2007
Accepted: November 28, 2007
Published online: December 8, 2007
AIM: To construct a yeast two-hybrid bait vector of intestinal trefoil factor (ITF/TFF3) and identify its self-activation.
METHODS: The open reading frame of ITF gene containing NcoⅠand XhoⅠ endoenzyme sites was obtained by RT-PCR from normal human intestinal mucosa and ligated into pGEMT vector from a TA clone. The hTFF3 gene was then transferred into the vector pENTR11 by enzyme digestion and ligation to obtain the entry clone pENTR11-hTFF3. Subsequently, pDEST32-hTFF3, the yeast two-hybrid bait vector of hTFF3, was constructed by the LR reaction. Finally, pDEST32-hTFF3 and pDEST22 were transfected into MaV203 yeast and amplified by yeast in 3AT plates with SC/-leu/-trp/-his.
RESULTS: The fragment of the hTFF3 gene was found in the reconstituted plasmid pDEST32-hTFF3 by sequencing. Yeast two-hybrid tests showed that MaV203 transfected with pDEST32-hTFF3 and pDEST22 didnot grow in SC/-leu/-trp/-his plates with 3AT concentrations higher than 30 mmol/L.
CONCLUSION: The constructed plasmid pDEST32-hTFF3 is competent for yeast two-hybrid experiments.
- Citation: Lu YP, Dong J, Zhou F, Wang L, Chen MY, Lian YM, Zhang B, Ren JL. Construction of a human intestinal trefoil factor yeast two-hybrid vector and identification of its self-activation in yeast cells. Shijie Huaren Xiaohua Zazhi 2007; 15(34): 3625-3628
- URL: https://www.wjgnet.com/1009-3079/full/v15/i34/3625.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i34.3625
肠三叶因子(intestinal trefoil factor, ITF/TFF3)是三叶因子家族(trefoil factor family, TFF)成员之一, 分子质量约6.7 kDa, 1991年由Suemori et al[1]在大鼠空肠黏膜中发现. 生理条件下, TFF3在胃肠道呈细胞特异性表达, 主要由小肠和结肠的杯状细胞分泌. 但在病理条件下, 这种特异性消失, TFF3可出现于胃肠道的任一病变部位[2]. TFF3可通过促进细胞增殖、移行和抗细胞凋亡而促进胃肠损伤黏膜的重建修复, 是一种胃肠黏膜保护因子. 体外实验显示, 重组TFF3能刺激肠道上皮细胞的迁移, 促进伤口愈合, 改变上皮细胞钙粘蛋白(E-cadherin)的表达和细胞定位[3], 但这一特性同时促进肿瘤的侵袭扩散[4]. 有学者甚至提出, TFF3可作为胃癌预后不良的标志物[5]. 因此, TFF3是胃肠黏膜保护和胃肠道肿瘤研究领域中的一种重要的蛋白质, 但其具体作用机制迄今尚不清楚. 为进一步研究人肠三叶因子3(hTFF3)的功能、作用机制和相互作用蛋白, 我们构建了hTFF3酵母双杂交诱饵载体以用于筛选hTFF3相互作用蛋白.
Proquest2酵母双杂交系统(含Mav203酵母感受态细胞、pDEST32质粒、pDEST22质粒、pEXP32/Krev1质粒和pEXP22/RalGDS-wt质粒等)、pENTR11质粒、LR反应试剂盒和TRIzol Reagent为Invitrogen公司产品, pMD 19T载体和RT-PCR试剂盒为TakaRa公司产品, 限制性内切酶、T4 DNA连接酶、Taq酶、dNTP和DNA marker为TakaRa公司产品, DNA凝胶回收试剂盒为厦门鹭隆生物技术有限公司产品, 小量质粒DNA提取试剂盒为博大泰克公司产品, PCR引物由上海英骏公司合成. 本研究所取标本已告知被采取人, 并知情同意签字.
1.2.1 人结肠黏膜总RNA提取: 经结肠镜检查钳取人正常肠黏膜组织一块(约10 mg), 立即置于液氮中保存. 将肠黏膜组织置于研钵中研成粉末, 随后严格按TRIzolTM试剂说明书提取组织总RNA, 溶于DEPC水中, -80℃保存.
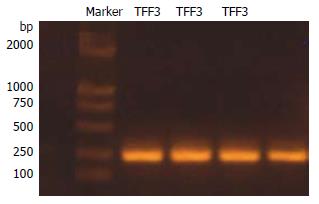
1.2.2 RT-PCR获得hTFF3基因: 取1 mg总RNA进行逆转录, 取4 uL总逆转录产物(总cDNA)进行PCR扩增. 根据已知的hTFF3基因序列(GenBank: NM_003226)来设计合成hTFF3 ORF引物, 上、下游引物分别添加了NcoⅠ和XhoⅠ酶切位点. 上游引物: 5'-ACCATGGTCA TGCTGGGGCTGGTCCTG-3', 下游引物: 5'-TCTCGAGTGGAAGGTGCATTCTGCTTCCTG-3', 扩增片段长度预计为237 bp. 反应体系25 uL, 94℃预变性2 min, 94℃, 58℃, 72℃各30 s, 共35个循环, 延伸10 min. 扩增产物10 g/L琼脂糖凝胶电泳后切胶, 按DNA凝胶回收试剂盒说明书纯化回收目的基因.
1.2.3 TA克隆及重组质粒鉴定: 按照pMD19T载体及T4 DNA连接酶说明书进行TA克隆, 获得重组质粒pMD19T-hTFF3. CaCl2法小量制备大肠杆菌DH5a感受态细胞, 将重组质粒转化DH5a, 采用蓝白筛选法及氨苄青霉素抗性筛选阳性克隆, 按照博大泰克小量质粒DNA提取试剂盒说明书提取质粒, 采用原引物PCR法和DNA序列测定法鉴定阳性克隆. DNA测序送上海英骏生物技术有限公司完成.
1.2.4 酵母双杂交载体的构建和鉴定: 分别将pMD19T-hTFF3重组质粒及pENTR11质粒用NcoⅠ和XhoⅠ双酶切. 酶切产物经10 g/L琼脂糖凝胶电泳后, 切胶回收, 用T4 DNA连接酶16℃连接过夜, 连接产物称为pENTR11-hTFF3. 经测序验证后将其转化DH5a感受态细胞, 提取质粒, 分别经NcoⅠ/XhoⅠ酶切鉴定和PCR鉴定. 按照LR反应试剂盒说明书, 将pENTR11-hTFF3和酵母双杂交空诱饵质粒pDEST32进行LR反应, 将hTFF3克隆至含有DNA结合域(DBD)的pDEST32中. 重组质粒送上海英骏生物技术有限公司进行DNA测序.
1.2.5 pDEST32-hTFF3自激活作用的鉴定: 按照Invitrogen公司酵母双杂交说明, 将pDEST32- hTFF3及酵母双杂交猎物质粒pDEST22共同转化到Mav203酵母感受态细胞中, 转化菌液于SD/-Leu/-Trp固体培养基上生长3 d. 挑取生长出的单克隆, 接种到含有0, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100 mmol/L氨基三唑(3-Aminotriazole, 3AT)的SD/-Leu/-Trp/-His培养基上, 观察Mav203细胞的生长情况. 分别以pEXP32/Krev1+pDEST32和pEXP22/RalGDS-wt+pDEST22转化Mav203细胞作为阴性对照及阳性对照.
TA克隆后, 以重组质粒p MD19T-hTFF3为模板进行原引物PCR. 产物经10 g/L琼脂糖凝胶电泳, 在近250 bp处出现特异性条带. 重组质粒经测序, 得到的序列为: ATGCTGGGGCTGGTCCTGGCCTTGCTGTCCTCCAGCTCTGCTGAGGAGTACGTGGGCCTGTCTGCAAACCAGTGTGCCG TGCCAGCCAAGGACAGGGTGGACTGCGGCTACCCCCATGTCACCCCCAAGGAGTGCAACAACC GGGGCTGCTGCTTTGACTCCAGGATCCCTGGGGTGCCTTGGTGTTTCAAGCCCCTGCAGGAAGCAGAATGCACCTTCTGA. 该序列与已知的hTFF3基因ORF序列(GenBank: NM_003226)完全一致, 证实hTFF3基因成功克隆到pMD19T质粒中.
经NcoⅠ/XhoⅠ双酶切, 电泳回收, T4连接酶连接, 将靶片段定向克隆入pENTR11质粒中. 经DNA测序鉴定验证, 将重组质粒命名为pENTR11-hTFF3. 按照Invitrogen公司指南, 通过LR反应将pENTR11-hTFF3中的靶片段转移到pDEST32中. 提取重组质粒用原引物进行PCR鉴定, 阳性重组质粒送上海英骏生物技术有限公司行DNA测序鉴定. 测序结果与TA克隆阳性重组子测序结果一致, 提示pDEST32-hTFF3酵母表达载体构建成功.
按照Invitrogen公司操作指南, 将共同转化了pDEST32-hTFF3与空猎物载体pDEST22的酵母细胞MaV203, 经过梯度浓度3AT培养基培养, 发现共转化的酵母细胞MaV203可在3AT浓度为30 mmol/L以下的SD/-Leu/-Trp/-His培养基上生长, 在3AT浓度为30 mmol/L以上的培养基上则未见生长. 阴性对照在所有3AT浓度培养基上均不能生长, 阳性对照在所有3AT浓度培养基上均能正常生长.
三叶因子家族是一群主要由胃肠道细胞分泌的小分子多肽. 目前在哺乳动物体内发现的三叶因子有3种, 即乳癌相关肽(pS2/TFF1)、解痉多肽(SP/TFF2)和肠三叶因子(ITF/TFF3), 均含一特殊的P结构域, 由38-39个氨基酸通过6个高度保守的半胱氨酸残基经由3个分子内的二硫键相互联接, 使整个肽链扭曲、折叠形成三叶状结构[6]. 这一家族在胃肠道黏膜完整性和持续性的维护方面具有重要的作用[7]. hTFF3是胃肠黏膜保护和胃肠道肿瘤研究领域中的一种重要蛋白质, 但其作用机制迄今尚不清楚. 其结合蛋白或受体及在细胞中的信号转导途径尚未明确, 仍需进一步深入研究.
为了避免病理条件下基因变异的可能性, 我们采用RT-PCR技术从人正常结肠黏膜中获得了生理条件下的hTFF3基因. 我们采用TA克隆技术对PCR产物进行TA克隆, 先构建pMD19T -hTFF3重组质粒, 经测序鉴定后进行NcoⅠ/XhoⅠ双酶切, 定向克隆予质粒pENTR11中, 再经由LR反应将靶基因克隆到质粒pDEST32中. 为保证实验结果的可靠性, 分别对pMD19T-hTFF3, pENTR11-hTFF3和pDEST32- hTFF3的插入部分进行了测序. 结果提示三者的插入序列与GenBank中的hTFF3序列(NM_003226)完全一致.
本实验采用的Proquest2酵母双杂交系统中的诱饵载体pDEST32和入门克隆载体pENTR11中均含有ccdB基因, 其表达产物为一种可干扰大肠杆菌促旋酶从而对大肠杆菌具有致死性效应的蛋白[8-9]. 转化了该载体的大肠杆菌将无法存活. 当pENTR11与携带目的基因的目的载体进行LR反应后, 携带有ccdB基因的片段可被目的基因片段取代. 因此, 只有正确插入目的基因的pENTR11-hTFF3及和DEST32-hTFF3才可导致大肠杆菌存活. 携带有ccdB基因的未反应载体或保留有ccdB基因副产品的细胞将不会生长, 这个特点有利于阳性克隆的筛选. 构建诱饵质粒过程中经过pENTR11和pDEST32两次筛选, 且该系统含有组氨酸(His)、尿嘧啶(Ura)和LacZ三种报道基因, 进一步有利于阳性相互作用克隆的筛选, 使这一系统可以最大限度的减少酵母双杂交实验的假阳性结果. Gateway克隆技术[10-12]是为了快速有效地在载体之间进行高流通量DNA转移而采用的一种基因重组技术, 能够克隆一个或多个基因进入到任何蛋白表达系统, 包括LR反应和BP反应两种反应. 这项强大的体外技术大大地简化了基因克隆和亚克隆的步骤, 典型的克隆效率高达95%或更高. 当基因在目的表达载体之间快速简便的穿梭时, 还可以保证正确的方向和阅读框, 因而反应后不必再进行新的表达克隆的测序. LR反应操作简便快速、效率高、对位准确, 是Gateway克隆技术中的一种重要反应. 本实验采用了这种方法, 获得了满意的结果.
诱饵蛋白常对报道基因具有一定的自激活作用, 这将影响阳性相互作用克隆的筛选, 导致假阳性结果. 诱饵载体pDEST32含有亮氨酸基因, 猎物载体pDEST22含有色氨酸基因, 同时转化了这两种载体的酵母细胞可在缺乏亮氨酸与色氨酸的SD/-Leu/-Trp培养基上生长. 若两者存在相互作用, 可启动报道基因转录及表达. 因此, 阳性相互作用克隆可在SD/-Leu/-Trp/-His培养基上正常生长. 本实验构建的pDEST32-hTFF3与空猎物载体pDEST22共同转化Mav203酵母细胞, 发现阳性转化子可在SD/-Leu/-Trp/-His培养基上生长, 提示hTFF3具有自激活报道基因His的作用. 为了消除这种自激活作用, 我们将转化子接种到含不同浓度3AT的SD/-Leu/-Trp/-His培养基上, 发现其可在3AT浓度30 mmol/L以下的培养基上生长, 在含30 mmol/L及以上浓度 3AT的培养基上则未见生长, 提示hTFF3的自激活报道基因作用可被30 mmol/L浓度的3AT所抑制. 因此, 所构建的pDEST32- hTFF3可作为酵母双杂交的诱饵载体可用于进一步的研究, 筛选hTFF3相互作用蛋白.
本研究初步构建了pDEST32-hTFF3酵母表达载体, 拟进一步行酵母双杂交筛选其相互作用蛋白, 为阐明hTFF3的作用机制奠定基础.
TFF3是胃肠黏膜保护和胃肠道肿瘤研究领域中的一种重要的蛋白质, 但其具体作用机制迄今尚不清楚. 为进一步研究人肠三叶因子3(hTFF3)的功能、作用机制和相互作用蛋白, 本文构建了hTFF3酵母双杂交诱饵载体以用于筛选hTFF3相互作用蛋白.
近年来, 国外很多学者在寻找三叶因子结合蛋白方面做了大量的工作, 也获得了一些TFF3结合蛋白, 但一致性差. 若能筛选到真正的TFF3结合蛋白, 将有利于进一步揭示TFF3的作用机制. 这也是目前TFF3研究中亟待解决的问题.
Chinery et al用重组rTFF3分别与人乳腺癌细胞系MCF-7及结肠直肠腺癌细胞系Colony-29的细胞膜蛋白及大鼠小肠组织细胞膜蛋白进行交联, 经免疫共沉淀及免疫印迹技术获得一种分子质量约为45 kDa的复合物, 考虑这是TFF3及其结合蛋白的复合物. 假设TFF3与其结合蛋白以1:1的比例结合, 那么, rTFF3的结合蛋白分子质量应为38 kDa. Tan et al使用配体印迹技术, 从小肠细胞膜成分中鉴定出了一种结合于TFF3的分子质量为50 kDa的糖基化蛋白质, 考虑其可能是TFF3在胃肠道中的受体. 这些研究都证实了TFF3结合蛋白或受体的存在, 但未进一步明确TFF3结合蛋白的结构及氨基酸序列.
本文所构建的酵母双杂交诱饵载体可进一步用于进行酵母双杂交实验, 筛选人肠三叶因子结合蛋白.
本文研究内容新颖, 设计合理, 具有一定的可读性.
编辑: 李军亮 电编:马文华
| 1. | Suemori S, Lynch-Devaney K, Podolsky DK. Identification and characterization of rat intestinal trefoil factor: tissue- and cell-specific member of the trefoil protein family. Proc Natl Acad Sci USA. 1991;88:11017-11021. [PubMed] |
| 3. | Dignass A, Lynch-Devaney K, Kindon H, Thim L, Podolsky DK. Trefoil peptides promote epithelial migration through a transforming growth factor beta-independent pathway. J Clin Invest. 1994;94:376-383. [PubMed] |
| 4. | Emami S, Rodrigues S, Rodrigue CM, Le Floch N, Rivat C, Attoub S, Bruyneel E, Gespach C. Trefoil factor family (TFF) peptides and cancer progression. Peptides. 2004;25:885-898. [PubMed] |
| 5. | Yamachika T, Werther JL, Bodian C, Babyatsky M, Tatematsu M, Yamamura Y, Chen A, Itzkowitz S. Intestinal trefoil factor: a marker of poor prognosis in gastric carcinoma. Clin Cancer Res. 2002;8:1092-1099. [PubMed] |
| 7. | Taupin D, Podolsky DK. Trefoil factors: initiators of mucosal healing. Nat Rev Mol Cell Biol. 2003;4:721-732. [PubMed] |
| 8. | Smith AB, Maxwell A. A strand-passage conformation of DNA gyrase is required to allow the bacterial toxin, CcdB, to access its binding site. Nucleic Acids Res. 2006;34:4667-4676. [PubMed] |
| 9. | Bernard P, Kezdy KE, Van Melderen L, Steyaert J, Wyns L, Pato ML, Higgins PN, Couturier M. The F plasmid CcdB protein induces efficient ATP-dependent DNA cleavage by gyrase. J Mol Biol. 1993;234:534-541. [PubMed] |
| 10. | Hartley JL, Temple GF, Brasch MA. DNA cloning using in vitro site-specific recombination. Genome Res. 2000;10:1788-1795. [PubMed] |
| 11. | Sasaki Y, Sone T, Yoshida S, Yahata K, Hotta J, Chesnut JD, Honda T, Imamoto F. Evidence for high specificity and efficiency of multiple recombination signals in mixed DNA cloning by the Multisite Gateway system. J Biotechnol. 2004;107:233-243. [PubMed] |