修回日期: 2007-10-03
接受日期: 2007-10-28
在线出版日期: 2007-12-08
目的: 探讨ghrelin对糖尿病小鼠胃排空的影响及其作用机制.
方法: 采用四氧嘧啶建立糖尿病小鼠模型, 用灌食phenol red的方法研究糖尿病小鼠胃排空的改变, 并观察注射不同剂量ghrelin(50, 100和200 μg/kg)对糖尿病小鼠胃动力的影响. 糖尿病小鼠胃底环形平滑肌条安置在恒温灌流肌槽中并用SMUP-E生物信号处理系统记录肌条的自发收缩活动, 观察不同浓度ghrelin(0.1, 1和10 μmol/L)对肌条自发收缩活动的影响, 并研究其作用机制.
结果: 糖尿病小鼠的胃排空率显著低于正常小鼠的胃排空率(22.90%±1.42% vs 28.10%±1.28%, P<0.05). ghrelin能显著提高糖尿病小鼠的胃排空, 具有明显的量效关系. Ghrelin在0.1, 1和10 μmol/L均能显著增加糖尿病小鼠离体胃底环形平滑肌肌条的自发收缩幅度(1.11±0.03, 1.22±0.02, 1.36±0.04 vs 1.00, 均P<0.05), 而atropine和L-NAME均能抑制ghrelin增加糖尿病小鼠肌条自发收缩幅度的效应.
结论: Ghrelin能提高糖尿病小鼠的胃排空能力, 作用机制可能是通过肌间丛神经系统的硝基能神经和胆碱能神经上的受体而起作用.
引文著录: 邱文才, 王维刚, 王志刚, 郑起. Ghrelin对糖尿病小鼠胃排空的影响及机制. 世界华人消化杂志 2007; 15(34): 3617-3620
Revised: October 3, 2007
Accepted: October 28, 2007
Published online: December 8, 2007
AIM: To investigate the gastroprokinetic effect of ghrelin in diabetic mice and its mechanism.
METHODS: The effects of ghrelin (50, 100 and 200 μg/kg) on gastric emptying in diabetic mice were after intragastric application of phenol red in vivo. The effects of ghrelin on the spontaneous contraction of fundic stomach muscle strips in the presence of ghrelin on the spontaneous contraction of fundic muscle strips from the stomachs of diabetic mice were studied in vitro. The effects of atropine and NG-nitro-L-arginine methyl ester hydrochloride (L-NAME) were also investigated.
RESULTS: Ghrelin accelerated gastric emptying in diabetic mice with a significant dose-response relationship. Administration of ghrelin to tissue increased the spontaneous contraction of fundic stomach muscle strips from diabetic mice (1.11 ± 0.03, 1.22 ± 0.02, 1.36 ± 0.04 vs 1.00, all P < 0.05). In the presence of atropine or L-NAME, ghrelin failed to increase the spontaneous contraction of these strips.
CONCLUSION: Ghrelin can accelerate gastric emptying in diabetic mice, perhaps by activating the GHS-R cholinergic excitatory pathways and nitrergic nervous pathways in the enteric nervous system.
- Citation: Qiu WC, Wang WG, Wang ZG, Zheng Q. Effect of ghrelin on gastric emptying in diabetic mice and its mechasnism. Shijie Huaren Xiaohua Zazhi 2007; 15(34): 3617-3620
- URL: https://www.wjgnet.com/1009-3079/full/v15/i34/3617.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i34.3617
Ghrelin作为生长激素促分泌素受体(growth hormone secretagogue receptor, GHS-R)的第一个被发现的内源性配体, 除在摄食与能量代谢、心血管功能等方面具有调节作用外, 还具有控制胃酸分泌、调节胃肠动力和胃黏膜保护作用. 糖尿病胃轻瘫概念提出已近半世纪, 其研究工作取得了很大的进展, 但对于糖尿病胃轻瘫的治疗, 仍无较好办法. 本实验旨在研究不同浓度ghrelin对糖尿病小鼠胃排空的影响及作用机制. 现将结果报道如下.
C57小鼠, ♀♂不拘, 体质量25±5 g, 购自上海中国科学院实验动物中心. 大鼠ghrelin、一氧化氮合酶抑制剂Nω-硝基-L-精氨酸甲酯(L-NAME)购自Tocris公司, 阿托品、四氧嘧啶购自Sigma公司. 小鼠胃排空生理试验及离体肌条试验均在上海交通大学医学院生理学教研室完成.
1.2.1 糖尿病小鼠模型的建立: 小鼠禁食12 h后, 腹腔注射(ip)四氧嘧啶200 mg/kg, 72 h后取血测血糖. 选取血糖值在11.1 mmol/L以上的小鼠, 不予胰岛素控制血糖, 饲养4 wk, 作为糖尿病小鼠模型进行后续研究.
1.2.2 各组小鼠胃排空率的检测: 糖尿病小鼠20只禁食不禁自由饮水12 h后随机平均分为4组, 每组5只, 分别ip生理盐水1 mL, ghrelin(50 μg/kg), ghrelin(100 μg/kg)和ghrelin(200 μg/kg). 5只正常小鼠禁食不禁自由饮水12 h后, ip生理盐水1 mL. 每只小鼠注射全部完成后立即以15 mg/kg酚红溶液(0.5 g/L, 双蒸水溶解)ig. ig 20 min后将小鼠脱臼法处死, 立即结扎贲门和幽门, 抽取胃液置离心管中, 再用0.1 mol/L NaOH溶液2.5 mL分5次冲洗胃内容物. 将冲洗液一并转移至离心管中, 量取体积后800 g离心10 min. 取上清液在分光光度计λ = 546 nm处读取光密度, 由酚红标准曲线求出酚红含量, 按下式计算胃排空率: 酚红胃排空率(%) = (注入量-胃内剩余量)/注入量×100%.
1.2.3 各组小鼠离体胃底环形平滑肌肌条自发收缩活动的检测: 将小鼠断颈处死, 平铺于实验台上, 沿腹中线开腹取出胃. 放入台氏缓冲液中清洗后, 移入氧饱和的台氏缓冲液中, 在解剖显微镜下仔细去除胃底黏膜层, 显露出肌层, 沿环行肌走向剪取宽2.0 mm, 长8.0 mm的肌条, 置于含有950 mL/L氧和50 mL/L二氧化碳饱和台氏液的垂直灌流槽内. 灌流槽内的液体通过恒温装置(WC/09-05)使温度保持在(37.0±0.5)℃. 肌条一端固定于玻璃小钩上, 另一端同SMUP-E生物信号处理系统连接的张力换能器相连, 记录肌条自发收缩幅度. 肌条自发收缩活动平稳后, 灌流槽内分别通入不同浓度的ghrelin(0.1, 1和10 μmol/L), 药理机制实验是分别加入阻断剂阿托品(5 μmol/L), L-NAME(300 μmol/L 后2 min, 再通入不同浓度ghrelin(0.1, 1和10 μmol/L), 记录自发收缩幅度的变化. 更换药物浓度或药物种类时, 用台式液充分冲洗. 待肌条自发收缩活动平稳后, 再加入另外1组浓度或另外1种药物. 胃底肌条加药后收缩幅度变化以不加药物情况下, 肌条自发收缩活动稳定后的收缩幅度为对照表示.
统计学处理 所有数据采用mean±SE表示, 实验结果采用同体对照的t检验, P<0.05为显著性差异.
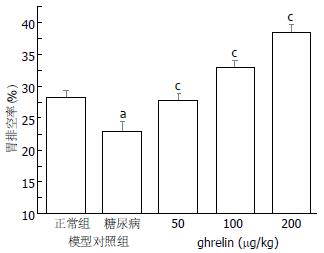
与正常小鼠胃排空率(28.10±1.28)%相比较, 糖尿病小鼠胃排空显著降低为(22.90±1.42)%(图1, P<0.05). ghrelin注射剂量为50, 100和200 μg/kg时, 糖尿病小鼠胃排空率与未给药糖尿病小鼠相比显著提高, 分别为(27.80±0.97)%, (32.90±1.20)%和(38.50±1.10)%, 有明显量效关系(P<0.05).
胃轻瘫作为糖尿病的一种慢性并发症, 多见于长期血糖控制欠佳的糖尿病患者[1]. 目前认为与植物神经病变和代谢[2]、激素异常[3-4](高血糖, 胆囊收缩素)有关. ghrelin是1999年Kojima et al[5]发现的第一个生长激素促分泌素受体的内源性配体, 由28个氨基酸组成的小分子多肽. 研究表明, ghrelin除在摄食与能量代谢、心血管功能等方面具有调节作用外, 还具有控制胃酸分泌、调节胃肠动力和胃黏膜保护作用. GHS-R主要分布在中枢神经系统中, 胃、小肠、胰腺、甲状腺、性腺、肾上腺、肾、心脏、脉管系统、内分泌器官、内分泌肿瘤[6]和免疫细胞[7]中也有分布. ghrelin功能的广泛性可能与其受体分布的组织广泛性有关[8]. 我们通过建立糖尿病小鼠模型, 研究ghrelin对糖尿病小鼠胃轻瘫的治疗意义, 结果表明ghrelin能显著增加糖尿病小鼠的胃排空能力, 有明显的量效关系. 通过对糖尿病小鼠胃离体肌条的进一步研究表明, ghrelin可能是通过作用于胃肌间神经丛的硝基能神经和胆碱能神经上的受体而起作用.
Dass et al[9]发现, GHS-R免疫反应阳性在大鼠胃和结肠的神经细胞上表达, 在平滑肌细胞和上皮细胞无表达, 提示在大鼠ghrelin可能通过肠神经系统发挥作用. Xu et al[10]将豚鼠的肠神经元分离出来, 发现并证实有motilin、ghrelin及其受体的存在. Fukuda et al[11]发现辣椒辣素能阻断ghrelin的促大鼠胃肠运动作用, 提示ghrelin通过肠神经通路将辣椒辣素敏感的感觉传入神经元, 调节胃肠运动. Murray et al[12]观察了外源性ghrelin对糖尿病胃轻瘫患者胃排空的影响. 在ghrelin注入90 min时, 血浆ghrelin水平达到峰值, 且与生长激素血浆峰值相对应. 在10例患者中, ghrelin使7例患者胃排空增快(P<0.05), 受损的迷走神经张力与餐后胰多糖峰值呈负相关, 但与胃排空率无明显关联. 因而认为ghrelin促进糖尿病胃轻瘫患者的胃排空, 不依赖于迷走神经张力. 但也有相反的研究结果. De Smet et al[13]应用ghrelin基因敲除小鼠ghrelin(-/-)模型, 观察到ghrelin存在对胃排空无影响, 外源性ghrelin引起胃排空加速的效应曲线在ghrelin(+/+)和ghrelin(-/-)小鼠并无变化. 因而认为ghrelin并不是一种必须的胃排空调节因素. Masuda et al[14]发现小鼠静脉注射ghrelin可增加胃酸分泌和增强胃动力. 此效应被阿托品或双侧迷走神经切除所阻断, 因此认为ghrelin也通过迷走神经影响胃动力.
Ghrelin可以通过中枢和外周神经促进胃肠动力, 所以ghrelin将是极具潜力的治疗胃动力的药物. 发现GHS-R及其内源性配体ghrelin后, 其对胃肠运动影响及机制的研究给胃肠道动力相关性疾病的治疗开拓了新的研究方向, 提供了极具潜力的应用前景.
Ghrelin作为生长激素促分泌素受体(GHS-R)的第一个被发现的内源性配体, 研究发现其除在摄食与能量代谢、心血管功能等方面具有调节作用外, 还具有控制胃酸分泌、调节胃肠动力和胃黏膜保护作用. 糖尿病胃轻瘫概念提出已近半世纪, 其研究工作取得了很大的进展, 但对于糖尿病胃轻瘫的治疗, 仍无较好办法, 本研究探讨了ghrelin对糖尿病小鼠胃轻瘫的治疗作用及机制.
进一步从组织水平上研究ghrelin对胃肠动力的影响及其机制, 仍是目前研究的热点.
本研究为治疗糖尿病胃轻瘫的药物选择提供依据.
文章选题新颖、设计合理、手段先进, 结论有一定先进性.
编辑: 何燕 电编:李海寅
| 3. | Tougas G, Hunt RH, Fitzpatrick D, Upton AR. Evidence of impaired afferent vagal function in patients with diabetes gastroparesis. Pacing Clin Electrophysiol. 1992;15:1597-1602. [PubMed] |
| 4. | Mitsukawa T, Takemura J, Ohgo S, Mizuta M, Ii T, Kuribayashi T, Matsukura S. Gallbladder function and plasma cholecystokinin levels in diabetes mellitus. Am J Gastroenterol. 1990;85:981-985. [PubMed] |
| 5. | Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 1999;402:656-660. [PubMed] |
| 6. | Ghigo E, Broglio F, Arvat E, Maccario M, Papotti M, Muccioli G. Ghrelin: more than a natural GH secretagogue and/or an orexigenic factor. Clin Endocrinol (Oxf). 2005;62:1-17. [PubMed] |
| 7. | Dixit VD, Taub DD. Ghrelin and immunity: a young player in an old field. Exp Gerontol. 2005;40:900-910. [PubMed] |
| 8. | Locatelli V, Bresciani E, Bulgarelli I, Rapetti D, Torsello A, Rindi G, Sibilia V, Netti C. Ghrelin in gastroenteric pathophysiology. J Endocrinol Invest. 2005;28:843-848. [PubMed] |
| 9. | Dass NB, Munonyara M, Bassil AK, Hervieu GJ, Osbourne S, Corcoran S, Morgan M, Sanger GJ. Growth hormone secretagogue receptors in rat and human gastrointestinal tract and the effects of ghrelin. Neuroscience. 2003;120:443-453. [PubMed] |
| 10. | Xu L, Depoortere I, Tomasetto C, Zandecki M, Tang M, Timmermans JP, Peeters TL. Evidence for the presence of motilin, ghrelin, and the motilin and ghrelin receptor in neurons of the myenteric plexus. Regul Pept. 2005;124:119-125. [PubMed] |
| 11. | Fukuda H, Mizuta Y, Isomoto H, Takeshima F, Ohnita K, Ohba K, Omagari K, Taniyama K, Kohno S. Ghrelin enhances gastric motility through direct stimulation of intrinsic neural pathways and capsaicin-sensitive afferent neurones in rats. Scand J Gastroenterol. 2004;39:1209-1214. [PubMed] |
| 12. | Murray CD, Martin NM, Patterson M, Taylor SA, Ghatei MA, Kamm MA, Johnston C, Bloom SR, Emmanuel AV. Ghrelin enhances gastric emptying in diabetic gastroparesis: a double blind, placebo controlled, crossover study. Gut. 2005;54:1693-1698. [PubMed] |
| 13. | De Smet B, Depoortere I, Moechars D, Swennen Q, Moreaux B, Cryns K, Tack J, Buyse J, Coulie B, Peeters TL. Energy homeostasis and gastric emptying in ghrelin knockout mice. J Pharmacol Exp Ther. 2006;316:431-439. [PubMed] |
| 14. | Masuda Y, Tanaka T, Inomata N, Ohnuma N, Tanaka S, Itoh Z, Hosoda H, Kojima M, Kangawa K. Ghrelin stimulates gastric acid secretion and motility in rats. Biochem Biophys Res Commun. 2000;276:905-908. [PubMed] |