修回日期: 2007-09-24
接受日期: 2007-09-28
在线出版日期: 2007-11-28
目的: 评价超分子药物西茜铂实验性治疗消化系肿瘤的效果.
方法: 用细胞培养方法测定西茜铂和卡铂对肝癌(BEL7402), 胰腺癌(BXCP-3, JF305), 胃癌(MG803, SG7901)和结肠癌(CX-1)6株消化系癌细胞株和一株人胚胎肺成纤维细胞的半数抑制浓度(IC50). 建立肝癌H22昆明鼠模型和人胰腺癌JF305裸鼠模型, 腹腔注射高(20 mg/kg)、中(15 mg/kg)、低(10 mg/kg)剂量西茜铂, 测定其在动物体内的抑瘤作用, 注射葡萄糖注射液作为阴性对照, 注射20 mg/kg卡铂作为阳性对照. HE染色判断肿瘤组织的坏死, CD34抗体免疫组化染色观察肿瘤组织中微血管的生长状况.
结果: 西茜铂对6株肿瘤细胞的IC50值明显低于卡铂, 约为后者1/3至1/2. 但2种药物对人胚胎肺成纤维细胞的半数抑制浓度(IC50)均大于240 mg/L. 在肝癌H22荷瘤昆明小鼠, 腹腔注射高、中、低剂量西茜铂的抑瘤率分别为 56.1%-67.0%, 46.9%-54.8%和42.4%-44.3%, 卡铂的抑瘤率是50.3%-51.3%. 西茜铂和卡铂治疗组的瘤质量与葡萄糖组相比, 明显降低(t>2.91, P<0.01). 20 mg/kg西茜铂的抑瘤率高于相同剂量卡铂的抑瘤率, 瘤质量均值也明显轻于卡铂组(t = 2.39, P<0.05). 在接种人胰腺癌JF305裸鼠, 高、中、低剂量西茜铂组的抑瘤率分别为61.4%-73.4%, 51.4%-54.0%和17.6%-22.6%, 卡铂的抑瘤率是37.1%-42.0%. 中、高剂量的抑瘤率明显高于卡铂组, 瘤质量明显低于葡萄糖组和卡铂组(t>2.28, P<0.05). 经HE染色后, 在接种人胰腺癌JF305裸鼠, 西茜铂治疗组的瘤组织见大片出血性坏死. CD34抗体免疫组化染色在葡萄糖组可见有大量的微血管形成, 而西茜铂治疗组仅有少数微血管生成, 微血管生成受到抑制.
结论: 超分子药物西茜铂对消化系统肿瘤有明显的抑制作用, 其作用明显高于卡铂.
引文著录: 王士勇, 杨振君, 于环, 杨云锋, 张晖, 王敬尊. 超分子铂类药物西茜铂体内外对消化系肿瘤的抑制作用. 世界华人消化杂志 2007; 15(33): 3489-3494
Revised: September 24, 2007
Accepted: September 28, 2007
Published online: November 28, 2007
AIM: To investigate in vivo and in vitro inhibitory effects of a supramolecular drug-platinum compound CCP on digestive tumors.
METHODS: Six digestive tumor cell lines, hepatocellular carcinoma (BEL7402), gastric carcinoma (MG803 and SG7901), pancreatic carcinoma (BXCP-3 and JF305), and colon carcinoma (CX-1), were used to test the IC50 of CCP and carboplatin. H22-bearing Kunming mice and JE305-bearing nude mice were treated intraperitoneally with CCP at 10, 15 or 20 mg/kg. Mice were treated with glucose as a negative control and carboplatin as a positive control. HE staining was used to detect tumor necrosis, and CD34 antibody was used to demonstrate differences in microvasculature in tumors.
RESULTS: The IC50 of CCP was only 33% - 50% of that of carboplatin. The IC50 of both CCP and carboplatin was > 240 mg/L in lung embryo fibroblasts. In H22-bearing Kunming mice, the inhibitory rate for 20, 15 and 10 mg/kg CCP was 56.1% - 67.0%, 46.9% - 54.8% and 42.4% - 44.3%, respectively, and the inhibitory rate for CBP was 50.3% - 51.3%. Tumor weight in the CCP group was lower than that in the control group (t > 2.91, P < 0.01). In the CCP 20 mg/kg group, the inhibitory rate for CCP was higher and the tumor weight was lower than those in the carboplatin group (t = 2.39, P < 0.05). In JF305-bearing nude mice, the inhibitory rate for 20 and 15 mg/kg CCP was 61.4% - 73.4% and 51.4% - 54.0%, respectively, and the inhibitory rate for carboplatin was 37.1%-42.0%. Tumor weight was significantly lower than that in the control groups (t > 2.28, P < 0.05). However, the inhibitory rate of 10 mg/kg CCP was 17.6% - 22.6%, which was not different from that in the glucose group (t = 1.70). The microvascular growth in JE305-bearing nude mice showed more necrosis in the CCP group with HE staining. Immunohistochemical staining with anti-CD34 antibody suggested more microvascular formation in the glucose group, but it was more clearly inhibited in the CCP group.
CONCLUSION: CCP has a greater ability to inhibit digestive tumor growth than carboplatin.
- Citation: Wang SY, Yang ZJ, Yu H, Yang YF, Zhang H, Wang JZ. Inhibitory effects of supramolecular platinum compound CCP on digestive tumors. Shijie Huaren Xiaohua Zazhi 2007; 15(33): 3489-3494
- URL: https://www.wjgnet.com/1009-3079/full/v15/i33/3489.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i33.3489
自70年代顺铂上市以来, 人们合成了数以千计的铂类配合物, 并进行了抗肿瘤活性的研究, 大约有30多个铂类配合物进入了临床实验治疗阶段. 最近, 基于对肿瘤细胞耐铂类配合物机制的深入了解, 人们不再局限于顺铂和卡铂的经典分子结构, 设计出多种非经典结构的药物, 具有代表性的种类如下: 能口服的四价铂类配合物、具有空间阻位且与顺铂无交叉耐药的ZD0473、抗癌机制不同的反式铂类配合物JM335、多核配合物BBR3464和含有铂硫键的thioplaitin等[1-8]. 国内学者也合成了多种新型的铂类配合物, 并进行了结构和药效学等方面的研究[9-11]. 本文研究所用的西茜铂(CCP)是我国学者自主合成的新型铂类配合物(专利号CN01823848.3), 具有超分子结构. 本文研究了CCP对消化系统肿瘤的药效学, 也是该药临床前研究的部分内容.
CCP由北京三思维尔高科技开发有限公司王敬尊教授提供, 原浓度为15.2 mg/mL. 卡铂(Carboplatin, CBP)为山东齐鲁制药厂产品, 批号为0202007, 粉末状, 使用时用5%的葡萄糖溶液溶解. 四氮唑兰(MTT)为Sigma产品, 兔抗人CD34 mAb和免疫组化染色试剂盒购自福州迈新公司. 6株人传代消化系癌细胞株为肝癌(BEL7402)、胃癌(MG803和SGC7901)、胰腺癌(JF305和BXCP-3)、结肠癌(CX-1), 为中国医科大学各实验室保存的细胞株. 人胚胎肺成纤维细胞(WI83)购自上海中科院细胞库. 用RPMI1640完全培养液(含100 g/L小牛血清、100 kU/L青霉素和100 mg/L链霉素), 在37℃、50 mL/L CO2条件下培养, 2.5 g/L胰酶消化、传代. 18-22 g 昆明鼠和5-6 wk的BABL/c(nu/nu)裸鼠, 购自中国医科大学动物中心, 饲养于中国医科大学动物中心动物层流系统中.
1.2.1 体外实验: 取对数生长期细胞, 用0.25%胰酶消化成单细胞, 调整细胞密度为1×108-8×108 /L, 于96孔培养板, 每孔加入100 μL, 培养4 h, 再加入480, 240, 120, 60, 30, 15和7.5 mg/L的卡铂或CCP, 每浓度至少设3个复孔. 每块培养板设12孔溶剂和3孔空白对照组, 继续培养64 h, 离心去上清, 加入5 g/L MTT溶液200 μL, 继续培养4 h. 再离心去上清, PBS洗2次, 加入200 μL二甲基亚砜, 振荡10 min, 充分溶解. 用酶标仪测定吸光度值, 检测波长为570 nm, 参比波长为450 nm. 每株癌细胞的药敏实验重复3-4次.
1.2.2 荷瘤鼠模型的建立及实验: (1)每次实验取昆明鼠60只, 于右腋皮下接种4倍稀释的小鼠肝癌(H22)腹水瘤细胞悬液, 0.2 mL/只. 于接种后次日随机分组、称质量、给药. 用50 g/L的葡萄糖溶液稀释CCP注射液, 按高、中、低三个剂量组分别给予20, 15, 10 mg/kg ip, 每日1次, 连续7-10 d. 阳性对照组卡铂浓度为20 mg/kg, 使用方法和天数同CCP. 阴性对照组给5%葡萄糖注射液. 于停药后次日处死动物, 分别称鼠质量和瘤质量, 按照下列公式计算抑瘤率, 抑瘤率[12] = (1-实验组平均瘤质量/对照组平均瘤质量)×100%. 实验重复3次, 均为独立实验. (2)每次实验取裸鼠40-50只, 于右腋皮下接种培养的人胰腺癌JF305细胞株, 接种细胞数为5×105-2×106/只. 待腋下出现可明显判定的瘤体时(约2 wk), 将动物随机分为5组, 每组8只, 称质量, 次日给药. 给药浓度、方法、抑瘤率计算等同昆明鼠实验.
1.2.3 肿瘤组织HE染色、免疫组织化学染色和结果判定: 常规中性甲醛溶液固定, 梯度酒精脱水, 石蜡包埋、切片、脱蜡等. 采用迈新公司二步法试剂盒检测CD34, 具体方法按照说明书和文献[13]进行. DAB显色, 苏木素衬染. 结果判定: 棕色着色为阳性, 先在100倍视野下选取5个微血管密集区, 400倍显微镜下3个以上的成堆细胞判定为微血管, 计数微血管数.
统计学处理 数据用mean±SD表示. 将药物浓度及其抑制率用MicroCal Origin软件作图, 并用该软件中的四参数Logistic程序拟合CCP对肿瘤细胞生长的抑制曲线, 求出半数抑制浓度(IC50). 各组抑瘤率以百分数直接比较, 各组间肿瘤平均瘤质量行t检验, P<0.05为有统计学意义.
CCP对6株肿瘤细胞的IC50值明显低于卡铂, 约为后者1/3至1/2(表1). 当换算成微摩尔浓度表示时(具体值未给出), 差异更为明显; 但CCP和卡铂对人胚肺成纤维细胞的IC50值均在240 mg/L以上.
| 药物 | 肝癌 | 胰腺癌 | 胰腺癌 | 胃癌 | 结肠癌 | 胃癌 | 人胚肺 |
| BEL7402 | BXCP-3 | JF305 | MG803 | CX-1 | SG7901 | WI38 | |
| CCP | 32.0±5.2 | 11.8±1.5 | 26.6±8.7 | 50.5±24.5 | 31.3±1.0 | 25.8±6.6 | >240 |
| CBP | 52.0±16.1 | 27.8±14.6 | 47.2±20.4 | 83.2±21.5 | 44.5±4.3 | 72.3±41.1 | >240 |
| CBP/CCP | 1.6 | 2.4 | 1.4 | 1.6 | 1.4 | 2.7 | 1.0 |
表2是三次独立实验中的一次结果. 综合3次结果, ip CCP给肝癌H22荷瘤昆明小鼠具有明确的抗肿瘤作用, 高、中、低剂量的抑瘤率分别为56.1%-67.0%、46.9%-54.8%和42.4%-44.3%. 抑瘤率随着药物浓度的增加而增加, 卡铂的抑瘤率是50.3%-51.3%. CCP和卡铂治疗后的瘤质量与葡萄组相比, 明显降低(t>2.91, P<0.01). 而且20 mg/kg CCP的抑瘤率高于相同剂量卡铂的抑瘤率, 瘤质量均值也明显轻于卡铂组(t = 2.39, P<0.05). 实验组与葡萄糖对照组相比, 体质量有所减轻, 以高剂量组较为明显, 但仍符合体内抗肿瘤实验规程要求, 实验过程中无动物死亡.
| 药物(mg/kg) | n | 体质量 | 瘤质量(g) | 抑瘤率(%) | |
| 治疗前 | 治疗后 | ||||
| H22对照 | 20 | 19.83±0.35 | 22.58±0.64 | 1.15±0.34 | |
| CCP(10) | 10 | 19.35±0.41 | 21.20±0.75 | 0.66±0.32a | 42.6 |
| CCP(15) | 10 | 20.29±0.19 | 21.37±1.03 | 0.52±0.32b | 54.8 |
| CCP(20) | 10 | 20.3±0.10 | 19.62±1.31 | 0.38±0.24b | 67.0 |
| CBP(20) | 10 | 19.54±0.32 | 19.09±1.01 | 0.56±0.30b | 51.3 |
| JF305对照 | 8 | 18.04±0.02 | 20.43±0.3 | 1.24±0.24 | |
| CCP(10) | 8 | 18.61±0.01 | 18.22±0.1 | 0.96±0.19 | 22.6 |
| CCP(15) | 8 | 18.79±0.04 | 17.71±0.03 | 0.57±0.14b | 54.0 |
| CCP(20) | 8 | 18.43±0.02 | 17.12±0.3 | 0.33±0.10b | 73.4 |
| CBP(20) | 8 | 19.02±0.02 | 18.17±0.05 | 0.78±0.13b | 37.1 |
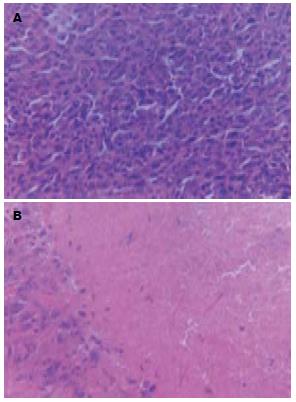
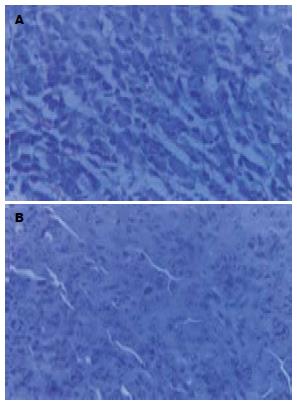
表2给出了2次独立实验的一次结果. 高、中、低剂量组的抑瘤率分别为61.4%-73.4%, 51.4%-54.0%和17.6%-22.6%. 抑瘤率随着药物浓度的增加而增加, 卡铂的抑瘤率是37.1%-42.0%. 中、高剂量的抑瘤率明显高于卡铂组, 瘤质量明显低于葡萄糖组和卡铂组, 经统计学处理均有显著性差异(t>2.28, P<0.05). 低剂量治疗组的瘤质量与葡萄组相比, 没有统计学差异(t = 1.70, P>0.05). 经HE染色后, 治疗组的瘤组织见大片出血性坏死, 抗CD34免疫组化染色在葡萄糖组可见有大量的微血管形成, 而治疗组仅有少数微血管 (图1-2).
在我国, 消化系肿瘤是常见的肿瘤, 铂类药物是治疗消化系肿瘤的常用药. 在结肠癌, 以奥沙利铂或伊力替康联合5氟尿嘧啶和醛氢四氢叶酸的化疗方案, 再加上抗表皮生长因子受体mAb抗体治疗, 疗效有明显的提高[14-15]. 在胃癌, 奥沙利铂联合5氟尿嘧啶和醛氢四氢叶酸的化疗方案成为最常用临床治疗方案[16]. 胰腺癌的治疗仍然是以健择联合铂类药物为主[17-18], 食道癌、肝癌缺乏有效的化疗药物[19-21]. 总体上来说, 消化系肿瘤的疗效有待于进一步提高[22-23], 研制更为适合消化系肿瘤的药物和方案是当务之急.
铂类抗癌药物的研制最为活跃. CCP是一种超分子药物, 他的设计是基于超分子化学的理念. 所谓超分子化学是指多个分子间以非共价键范德华力(氢键力、偶极力等)紧密结合形成的分子聚合体, 具有新的选择、识别、信息传递、能量转移等一系列的功能和性质. 双螺旋DNA分子中的嘌呤和嘧啶是以氢键结合的超分子, 各种营养成分在体内传递时, 其与细胞膜结合等过程都是非共价键结合的超分子化学过程. 超分子化学药物是由主体化学药物分子与特别的客体分子在一定的条件下, 通过分子间的非共价键组装成稳定的特定结构的超分子化合物. 他可能改变药物的稳定性和在人体的传送机制, 即改进药物在体内的膜运输, 使药物达到特定的作用靶点, 提高和特异靶点结合的能力, 提高药物的有效利用度, 降低药物的毒副作用. 因此可能开发出具有新的结构、药理、药效和剂型的药物. 目前已经有超分子药物的报道, 但主要作为药物的载体, 关于超分子铂类药物迄今未见文献报道[25]. CCP以卡铂分子作为主体分子, 以柠檬酸作客体分子. 柠檬酸分子中3个-COOH, 其中2个结合成分子内键, 生成超分子CCP, 第三个-COOH, 增加分子的极性, 增加了CCP 的溶解度, 同时增加了与膜蛋白的结合、传递的能力和打开膜离子通道的跨膜能力. CCP分子呈笼状结构, 能有效地保护和阻止卡铂的原子与水结合, 减缓卡铂水解成活泼水合铂的速度, 增加CCP在体液中的稳定性, 降低药物的毒性. 而且, 酸性羧基构成的笼子, 易被碱性基团打开, 使主体分子卡铂易与DNA的碱基结合, 起到抗肿瘤的作用.
本文研究结果显示, CCP均能明显抑制肝癌、胃癌、胰腺癌、结肠癌的生长, 而且IC50值仅为卡铂的1/2或1/3, 但对人胚肺成纤维细胞的IC50大于240 mg/L, 说明CCP对消化系肿瘤有较高的杀伤作用, 而对正常组织细胞的毒副作用较小. 腹腔注射CCP给人胰腺癌细胞JF305荷瘤裸鼠, 也有明确的抗肿瘤作用. 按高、中、低剂量的抑瘤率分别是61.4%-73.4%, 51.4%-54.0%和17.6%-22.6%, 抑瘤率呈现出剂量依赖性. 此外, HE染色显示的大片肿瘤组织坏死, 进一步证明上述结果. 实验组与葡萄糖对照组相比, 体质量有所减轻, 以高剂量组较为明显, 但仍符合体内抗肿瘤实验规范的要求. H22昆明鼠实验也得出同样结果. 总之, 在体外和体内, CCP的药效明显高于卡铂, 而且副作用大大地降低. 但是, 关于CCP的作用机制, 还需要进一步研究.
抗血管生成治疗是目前肿瘤研究的热点和重点. 自上世纪70年代初, 美国学者提出肿瘤发生和血管生成有关, 并可通过抑制血管形成来治疗肿瘤的假说以来, 历经30余年的研究, 肿瘤血管成为抗肿瘤治疗的新靶点[25-26]. 目前抗血管治疗主要集中在下面几个方面: 第一, 抗血管内皮生长因子及其受体[27-28], 包括用长效脂质体包裹的抑制血管内皮生长因子的小分子多肽[29-30]. 而且有数种药物进入临床, 如贝伐mAb抗体, 联合化疗能明显地提高大肠癌治疗效果[31]. 第二, 作用于血管内皮细胞的抑制因子[32], 如我国在世界上推出的血管生成抑制剂YH-16[33], 已经广泛地应用于非小细胞肺癌的治疗. 第三, 抑制血管外基质分解酶的药物[34]. 此外还有如抗Bcl-2基因等其他类型药物. CD34是血管内皮细胞的标志物, 被证明在各种肿瘤包括消化系肿瘤均高表达, 而且可能与肿瘤的转移及预后密切相关[35-36].
在本研究中, CD34在肿瘤组织中均呈高表达, 即微血管密度明显增高. 当用CCP进行实验性治疗后, 微血管密度显著降低. 我们推测可能与CCP抑制肿瘤细胞的生长进而抑制促肿瘤血管生成因子的释放有关, 但确切的机制有待于进一步研究证实.
铂类配合物是临床上广泛应用的抗肿瘤药物, 其中最常用的有顺铂、卡铂、奥沙利铂. 这些药物均有一定的毒副作用, 抗肿瘤谱窄, 易产生耐药性; 而且, 分子量小, 仅能识别2-3个碱基, 特异性不高, 易损伤正常细胞的DNA. 另外, 他们与靶分子的结合作用弱, 与DNA单加合后, 会引起DNA结构的改变, 从而导致药效的降低. 因此, 研究与经典铂类配合物结构不同的非经典的配合物, 克服现有的铂类配合物的缺点, 增加疗效, 是目前研究的重点和热点.
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
CCP是我国学者自行合成的超分子铂类配合物, 已经申请专利. CCP是一种笼状结构, 以卡铂作为主体分子, 以柠檬酸作为客体分子, 即以柠檬酸的3个-COOH中的2个结合成分子内氢键, 生成超分子的CCP, 以第三个COOH增加分子的极性, 进而增加可溶性. 同时, 这种结构起到保护中心铂原子的作用. 整个分子将增加稳定性、溶解性、极性、特异性和增加对肿瘤的毒性. 本文是关于CCP的体外和动物体内的药效学研究.
CCP的研究已经得到国家科技部"863"创新药物重大专项资助. 本文是有关药效学研究的部分内容. 经研究已明确, CCP在动物体外和体内均有杀伤肿瘤细胞的作用, 疗效高于卡铂, 副作用小, 有望进入正式的临床实验.
1 超分子化学: 多个分子间以非共价键紧密结合形成的分子聚合体, 具有新的选择、识别、信息传递、能量转移等一系列特定功能和性质; 他包括诸如"主-客体化学"、"超分子器件"、"超分子开关"等一系列全新的科学概念.
2 超分子药物: 是由主体药物分子和特别的客体分子在一定的条件下, 通过分子间的非共价键力, 组装成结构稳定的超分子, 他们改进了药物的稳定性和在人体内的运输机制.
本文研究具有科学性, 实验手段先进, 结果结论可信.
编辑: 程剑侠 电编:马文华
| 1. | Abu-Surrah AS. Development and current status of unconventional platinum anticancer complexes. Mini Rev Med Chem. 2007;7:203-211. [PubMed] |
| 2. | Ho YP, Au-Yeung SC, To KK. Platinum-based anticancer agents: innovative design strategies and biological perspectives. Med Res Rev. 2003;23:633-655. [PubMed] |
| 3. | Wosikowski K, Lamphere L, Unteregger G, Jung V, Kaplan F, Xu JP, Rattel B, Caligiuri M. Preclinical antitumor activity of the oral platinum analog satraplatin. Cancer Chemother Pharmacol. 2007;60:589-600. [PubMed] |
| 4. | Ang WH, Pilet S, Scopelliti R, Bussy F, Juillerat-Jeanneret L, Dyson PJ. Synthesis and characterization of platinum(IV) anticancer drugs with functionalized aromatic carboxylate ligands: influence of the ligands on drug efficacies and uptake. J Med Chem. 2005;48:8060-8069. [PubMed] |
| 5. | Ye QS, Lou LG, Liu WP, Yu Y, Chen XZ, Hou SQ, Gao WQ, Liu Y. Synthesis and in vitro cytotoxicity of novel lipophilic (diamine)platinum(II) complexes of salicylate derivatives. Bioorg Med Chem Lett. 2007;17:2146-2149. [PubMed] |
| 6. | Hall MD, Alderden RA, Zhang M, Beale PJ, Cai Z, Lai B, Stampfl AP, Hambley TW. The fate of platinum(II) and platinum(IV) anti-cancer agents in cancer cells and tumours. J Struct Biol. 2006;155:38-44. [PubMed] |
| 7. | Wheate NJ, Day AI, Blanch RJ, Arnold AP, Cullinane C, Collins JG. Multi-nuclear platinum complexes encapsulated in cucurbit[n]uril as an approach to reduce toxicity in cancer treatment. Chem Commun (Camb). 2004;21:1424-1425. [PubMed] |
| 8. | Wheate NJ, Collins JG. Multi-nuclear platinum drugs: a new paradigm in chemotherapy. Curr Med Chem Anticancer Agents. 2005;5:267-279. [PubMed] |
| 11. | 张 金超, 龚 钰秋, 郑 小明, 崔 景荣, 杨 梦苏. 对称胺和不对称胺的二碘合铂(II)混配合物的合成及其抗肿瘤活性. 浙江大学学报(理学版). 2005;32:292-299. |
| 13. | Karavasilis V, Malamou-Mitsi V, Briasoulis E, Tsanou E, Kitsou E, Pavlidis N. Clinicopathologic study of vascular endothelial growth factor, thrombospondin-1, and microvessel density assessed by CD34 in patients with stage III ovarian carcinoma. Int J Gynecol Cancer. 2006;16 Suppl 1:241-246. [PubMed] |
| 14. | Labianca R, La Verde N, Garassino MC. Develo-pment and clinical indications of cetuximab. Int J Biol Markers. 2007;22:S40-S46. [PubMed] |
| 15. | Giuliani F, Colucci G. Cetuximab in colon cancer. Int J Biol Markers. 2007;22:S62-S70. [PubMed] |
| 16. | Oh SY, Kwon HC, Seo BG, Kim SH, Kim JS, Kim HJ. A phase II study of oxaliplatin with low dose leucovorin and bolus and continuous infusion 5-fluorouracil (modified FOLFOX-4) as first line therapy for patients with advanced gastric cancer. Acta Oncol. 2007;46:336-341. [PubMed] |
| 17. | Boeck S, Hinke A, Wilkowski R, Heinemann V. Importance of performance status for treatment outcome in advanced pancreatic cancer. World J Gastroenterol. 2007;13:224-227. [PubMed] |
| 18. | Ducreux M, Boige V, Malka D. Treatment of advanced pancreatic cancer. Semin Oncol. 2007;34:S25-S30. [PubMed] |
| 19. | Siersema PD. Pathogenesis, diagnosis and therapeutic possibilities of esophageal cancer. Curr Opin Gastroenterol. 2007;23:456-461. [PubMed] |
| 20. | Layke JC, Lopez PP. Esophageal cancer: a review and update. Am Fam Physician. 2006;73:2187-2194. [PubMed] |
| 21. | Del Pozo AC, Lopez P. Management of hepato-cellular carcinoma. Clin Liver Dis. 2007;11:305-321. [PubMed] |
| 22. | Gill S, Blackstock AW, Goldberg RM. Colorectal cancer. Mayo Clin Proc. 2007;82:114-129. [PubMed] |
| 23. | Blackstein ME, Blay JY, Corless C, Driman DK, Riddell R, Soulieres D, Swallow CJ, Verma S. Gastrointestinal stromal tumours: consensus state-ment on diagnosis and treatment. Can J Gastroenterol. 2006;20:157-163. [PubMed] |
| 24. | Goshe AJ, Steele IM, Bosnich B. Supramolecular recognition. Terpyridyl palladium and platinum molecular clefts and their association with planar platinum complexes. J Am Chem Soc. 2003;125:444-451. [PubMed] |
| 25. | Pandya NM, Dhalla NS, Santani DD. Angiogenesis--a new target for future therapy. Vascul Pharmacol. 2006;44:265-274. [PubMed] |
| 26. | Shimizu K, Oku N. Cancer anti-angiogenic therapy. Biol Pharm Bull. 2004;27:599-605. [PubMed] |
| 27. | Jo N, Mailhos C, Ju M, Cheung E, Bradley J, Nishijima K, Robinson GS, Adamis AP, Shima DT. Inhibition of platelet-derived growth factor B signaling enhances the efficacy of anti-vascular endothelial growth factor therapy in multiple models of ocular neovascularization. Am J Pathol. 2006;168:2036-2053. [PubMed] |
| 28. | Wedge SR, Kendrew J, Hennequin LF, Valentine PJ, Barry ST, Brave SR, Smith NR, James NH, Dukes M, Curwen JO. AZD2171: a highly potent, orally bioavailable, vascular endothelial growth factor receptor-2 tyrosine kinase inhibitor for the treatment of cancer. Cancer Res. 2005;65:4389-4400. [PubMed] |
| 29. | Yonezawa S, Asai T, Oku N. Effective tumor regression by anti-neovascular therapy in hypova-scular orthotopic pancreatic tumor model. J Control Release. 2007;118:303-309. [PubMed] |
| 30. | Maeda N, Takeuchi Y, Takada M, Sadzuka Y, Namba Y, Oku N. Anti-neovascular therapy by use of tumor neovasculature- targeted long-circulating liposome. J Control Release. 2004;100:41-52. [PubMed] |
| 31. | Shih T, Lindley C. Bevacizumab: an angiogenesis inhibitor for the treatment of solid malignancies. Clin Ther. 2006;28:1779-1802. [PubMed] |
| 32. | Ou-Yang F, Lan KL, Chen CT, Liu JC, Weng CL, Chou CK, Xie X, Hung JY, Wei Y, Hortobagyi GN. Endostatin- cytosine deaminase fusion protein suppresses tumor growth by targeting neovascular endothelial cells. Cancer Res. 2006;66:378-384. [PubMed] |
| 33. | 周 志伟, 万 德森, 王 国强, 任 镜清, 卢 震海, 唐 绍贤, 叶 燕丽, 陈 功, 林 素暇. 血管生成抑制剂YH-16联合氟尿嘧啶抑制结直肠癌肝转移的研究. 中华胃肠外科杂志. 2006;9:161-164. |
| 34. | Kondo M, Asai T, Katanasaka Y, Sadzuka Y, Tsukada H, Ogino K, Taki T, Baba K, Oku N. Anti-neovascular therapy by liposomal drug targeted to membrane type-1 matrix metalloproteinase. Int J Cancer. 2004;108:301-306. [PubMed] |
| 35. | Des Guetz G, Uzzan B, Nicolas P, Cucherat M, Morere JF, Benamouzig R, Breau JL, Perret GY. Microvessel density and VEGF expression are prognostic factors in colorectal cancer. Meta-analysis of the literature. Br J Cancer. 2006;94:1823-1832. [PubMed] |
| 36. | Matsumoto M, Natsugoe S, Okumura H, Arima H, Yanagita S, Uchikado Y, Yokomakura N, Setoyama T, Ishigami S, Takao S. Overexpression of vascular endothelial growth factor-C correlates with lymph node micrometastasis in submucosal esophageal cancer. J Gastrointest Surg. 2006;10:1016-1022. [PubMed] |