修回日期: 2007-11-02
接受日期: 2007-11-28
在线出版日期: 2007-11-28
目的: 探讨polo-like kinase-1(PLK1)基因在胰腺癌细胞中的作用.
方法: 采用PLK1小干扰核糖核酸分子(small interfering RNA, siRNA)转染人胰腺癌Mi-aPaCa-2细胞后, 分别采用实时定量PCR和Western blot检测PLK1基因mRNA和蛋白表达水平, 观察PLK1 siRNA转染对胰腺癌细胞体内外增殖的影响. 于转染不同时间后收集细胞, 分别采用琼脂糖凝胶电泳和TUNEL方法检测胰腺癌细胞凋亡情况.
结果: 胰腺癌MiaPaCa-2细胞经siRNA转染处理后, PLK1 mRNA和蛋白表达水平明显下降(P<0.05). PLK1基因siRNA可明显抑制癌细胞体外生长(P<0.05)和体内裸鼠模型增殖(P<0.05). 细胞凋亡检测发现, DNA电泳出现明显的梯度图谱, 且与浓度相关(r = 0.836, P<0.05). TUNEL结果显示, 转染组癌细胞凋亡指数明显增加, 且呈时间和浓度依赖性(r = 0.875, P<0.05).
结论: PLK1 siRNA转染可明显抑制胰腺癌细胞增殖, 其机制可能与诱导细胞凋亡有关.
引文著录: 张尤历, 范钰, 吴莺, 张宇川, 张炜. RNAi沉默Polo-like kinase-1基因表达对胰腺癌细胞增殖的影响. 世界华人消化杂志 2007; 15(33): 3484-3488
Revised: November 2, 2007
Accepted: November 28, 2007
Published online: November 28, 2007
AIM: To investigate the role of polo-like kinase-1 (PLK1) in human pancreatic cancer cells.
METHODS: After MiaPaCa-2 pancreatic cancer cells were transfected with small interfering RNA (siRNA) against PLK1, real-time RT-PCR and Western blotting were used to examine PLK1 gene expression in all cancer cells. The proliferation and growth of cancer cells in vivo and in vitro were studied. Apoptosis of cancer cells was evaluated by terminal uridine deoxynucleotidyl nick end labeling (TUNEL) and agarose gel electrophoresis, respectively.
RESULTS: Expression of PLK1 in MiaPaCa-2 cancer cells transfected with siRNA was down-regulated significantly. Transfection of PLK1 siRNA resulted in significant inhibition of pancreatic cancer cells in vivo and in vitro. The results from TUNEL and DNA ladder analysis showed cancer cells exhibited marked apoptosis, in a time- and dose-dependent manner (r = 0.875, P < 0.05).
CONCLUSION: RNA interference PLK1 can inhibit proliferation through inducing apoptosis of human pancreatic cancer cells.
- Citation: Zhang YL, Fan Y, Wu Y, Zhang YC, Zhang W. Effects of polo-like kinase-1 gene silence by RNA interference on proliferation of human pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2007; 15(33): 3484-3488
- URL: https://www.wjgnet.com/1009-3079/full/v15/i33/3484.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i33.3484
Polo激酶家族包括人polo-like kinase(PLK)1, Snk, Fnk, Xenopus laevis Plx1, 果蝇Drosophila polo, 酵母PLO1和出芽酵母Cdc5[1-4]. 在低级动物中, 该家族成员能控制中心小体功能, 染色体分离和胞质移动[5-8]. PLK1是哺乳类该基因家族的重要成员之一. 研究发现, PLK1在有丝分裂指数增高的细胞和组织中如恶性肿瘤中表达增高[9-13]. 已经发现, 非小细胞肺癌, 鳞状上皮细胞癌, 食管癌, 黑素瘤, 口咽癌, 乳腺癌, 结直肠癌, 子宫内膜癌[14-21]等实体瘤中PLK1呈高表达. 前期研究发现, 采用针对PLK1基因的反义寡核苷酸可明显抑制大肠癌细胞增殖[22], 提示PLK1在许多实体瘤的发生发展中具有重要的作用. 但PLK1在胰腺癌中研究得较少. 我们借助于RNA干扰(RNA interference, RNAi)技术, 采用针对PLK1设计合成的小干扰核糖核酸分子(small interfering RNA, siRNA)转染处理胰腺癌细胞, 观察了其对细胞增殖和凋亡的影响, 借此了解PLK1在胰腺癌形成中的可能作用.
人胰腺癌细胞系MiaPaCa-2购自中国科学院上海生物化学和细胞生物学研究所. PLK1 siRNA反义链序列: CAGGAUCC UCAGCCUCCUCTT, 目标位点1253-1273, 与已知人类基因组序列无重复. 无关siRNA(scr siRNA)序列: 5'-UUCUCCGAACGUGUCACGUTT-3'. PLK1抗体, 购自Santa Cruz公司. TRIzol, RNase inhibitor, 逆转录酶SSRTⅡ, Taq酶和转染试剂Oligofectamine购自Invitrogen公司. DNA抽提试剂盒, 购自上海申能博彩公司. Balb/c裸鼠, ♀15只, 4 wk, 质量14-18 g, 购自中国科学院上海生物化学研究所, 于无特殊病原体条件(SPF)下饲养.
胰腺癌细胞系在含100 mL/L胎牛血清的RBMI 1640培养液, 37℃ 50 mL/L CO2, 饱和湿度环境的条件下连续培养. 转染前1 d, 将1.0×108/L对数期生长的细胞接种于24孔培养板, 1 mL/well, 培养过夜, 次日进行转染. 基本操作按照说明书进行. 细胞分为空白对照组(Con-A): 未经任何处理的癌细胞; 空载对照组(Con-B): 即脂质体对照组; scr siRNA组: 培养液中含50 nmol/L的已用脂质体包埋的scr siRNA; siRNA组: 培养液中含不同浓度的已用脂质体包埋的PLK1 siRNA. 转染后于不同时间采用胰酶消化收取细胞, 进行以下试验.
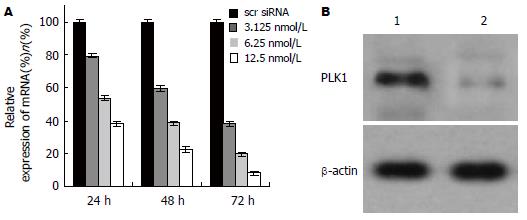
1.2.1 PLK1基因检测: 采用荧光实时定量PCR检测. 应用TRIzol抽提细胞总RNA, 取总RNA 1 μg, 以Oligo dT为引物逆转录合成cDNA第一链. 以此cDNA链2 μL为模板进行PCR扩增, 荧光实时定量PCR检测步骤文献进行[23]. PLK1引物序列为: 上游: 5'- CAAGCTCATCTTGTGCCCACT-3'; 下游: 5'-GAGAAAGGGCTGCCAGGC-3'. FAM探针: 5'-CCGCTTCTCGTCGATGTAGGTCACG-3'-TAMRA. 以GAPDH为内参. PCR反应条件为: 95℃, 预变性3 min, 95℃, 30 s; 52℃, 45 s; 72℃, 45 s; 35个循环后72℃再延伸7 min. 另外, 提取各实验组细胞总蛋白, 蛋白定量后, 以β-actin为内参照, 进行常规Western blot检测.
1.2.2 细胞增殖检测: 转染48 h后, 收集经转染的癌细胞, 常规进行MTT试验, 观测PLK1 siRNA对胰腺癌细胞增殖的影响. 另外, 转染48 h后, 收集转染的癌细胞, 以1×PBS洗涤, 重悬. 将4-6周龄的裸鼠动物随机分为2组, 每组5只. 在裸鼠背部皮下注射细胞, 106/只. 将裸鼠置于SPF级培养环境下饲养, 每天检查1次. 观察动物情况, 注意可触及到的肿瘤, 计数肿瘤质量.
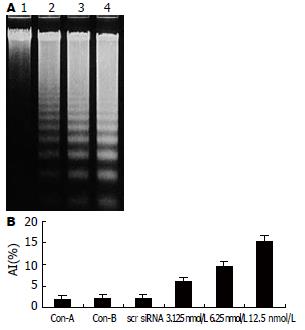
1.2.3 细胞凋亡检测: 转染48 h后, 收集细胞, 采用DNA抽提试剂盒抽提DNA, 无水乙醇沉淀. 行25℃琼脂糖凝胶电泳, 电压60 V, 2 h. 另外, 根据文献[22]方法, 进行TUNEL检测. 凋亡指数(apoptosis index, AI)计算按以下公式进行: 凋亡细胞/细胞总数×100%.
统计学处理 采用SPSS10.0软件分析. P<0.05为有统计学意义, P<0.01为差异显著.
PLK1 siRNA转染胰腺癌MiaPaCa-2细胞后, PLK1基因mRNA和蛋白水平明显下调(P<0.05, 图1A-B).
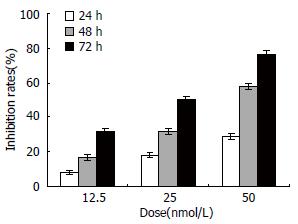
MTT结果显示, siRNA转染组癌细胞生长明显受到抑制, 且呈浓度依赖性(P<0.05, 图2).
大肠癌裸鼠模型对照组在12 d后, 5只均出现可见的肿瘤. 于5 wk后处死裸鼠, 分离裸鼠肿瘤组织, 计算肿瘤质量, 发现对照组肿瘤质量在45-210 mg, 而转染组在5 wk时无肿瘤出现, 说明PLK1 siRNA转染明显抑制了裸鼠肿瘤生长, 提示PLK1 siRNA对癌细胞发挥了强烈的体内抑瘤效应.
越来越多的证据表明, PLK1基因高表达在许多实体瘤发生发展中具有重要的作用[14-21,24-28]. 目前, 已经有许多学者[23,29-31]针对PLK1基因采用反义寡核苷酸或者RNAi技术对恶性肿瘤进行研究, 并已取得了很多重要的成果. 但目前在胰腺癌中PLK1基因研究较少, 尚不清楚该基因在胰腺癌细胞中的可能作用和机制. 在基因治疗领域中, RNAi相关技术早已引起了广泛的注意. RNAi是近年来发现的一种调节mRNA的生物学现象, 能够使基因表达的mRNA被相应的双链RNA分子敲除, 其效果要远强于正义和反义RNA[32]. 人工化学合成的siRNA也可以在哺乳动物细胞中直接触发RNAi而抑制特定基因的表达[33]. 作为一种简单、有效的代替基因敲除的工具, RNAi和siRNA相关技术的应用不但加快了功能基因组学领域的研究步伐, 也推动了疾病基因治疗的研究, 在抵御病毒感染、抑制突变基因表达以及筛选药物作用靶点等方面有广阔的应用前景. 我们针对PLK1 mRNA特点, 设计并采用化学方法合成PLK1 siRNA, 以其转染胰腺癌MiaPaCa-2细胞后, 分别采用定量PCR和 Western blot检测PLK1 mRNA和蛋白水平. 结果发现浓度为3.125 nmol/L的PLK1 siRNA转染即可明显下调胰腺癌MiaPaCa-2细胞PLK1基因表达水平, 提示了siRNA的高效性, 也说明我们所设计的siRNA可作为研究PLK1基因功能的有力工具.
下调PLK1基因表达后, 我们分别在体内外检测了PLK1 siRNA的抑制胰腺癌细胞增殖的效应. 结果发现, PLK1 siRNA可明显抑制胰腺癌细胞在体外增殖和裸鼠肿瘤生长. 说明该siRNA发挥了有效地体内外抑瘤效应. 我们尝试从细胞凋亡角度探讨了PLK1 siRNA发挥抑瘤效应的可能机制. 细胞转染不同时间后, 收集细胞, 分别采用琼脂糖凝胶电泳和TUNEL方法检测各组细胞凋亡情况. 结果发现, 转染组DNA电泳出现明显的梯度图谱. TUNEL检测发现, 转染组凋亡指数明显高于对照组. 以上结果提示, 采用siRNA下调胰腺癌细胞PLK1表达后, 可诱导细胞凋亡.
总之, 本研究提示, PLK1基因异常表达可能在胰腺癌细胞增殖中起重要的作用, 而以RNAi技术下调PLK1表达, 可有效地抑制胰腺癌细胞恶性增殖, 其机制与诱导凋亡有关.
研究发现, PLK1基因高表达在许多恶性肿瘤发生发展中具有重要的作用, 但该基因在胰腺癌中研究报道较少.
RNAi技术已广泛用于基因治疗的研究, 具有广阔的应用前景. 但以PLK1基因为靶点, 采用siRNA治疗胰腺癌的报道较少.
本文针对PLK1 基因特点, 设计并用化学方法合成siRNA, 转染胰腺癌细胞株, 观察其对癌细胞增殖和凋亡的影响.
研究证明, 本研究所设计的siRNA具有高效性, 可用于PLK1高表达的恶性肿瘤的治疗, 具有重要的潜在的实用价值.
本文思路清晰, 表述简洁, 明了, 有一定的科学意义和潜在的应用价值.
编辑: 程剑侠 电编:何基才
| 1. | Golsteyn RM, Lane HA, Mundt KE, Arnaud L, Nigg EA. The family of polo-like kinases. Prog Cell Cycle Res. 1996;2:107-114. [PubMed] |
| 2. | Mayor T, Meraldi P, Stierhof YD, Nigg EA, Fry AM. Protein kinases in control of the centrosome cycle. FEBS Lett. 1999;452:92-95. [PubMed] |
| 3. | Nigg EA. Polo-like kinases: positive regulators of cell division from start to finish. Curr Opin Cell Biol. 1998;10:776-783. [PubMed] |
| 4. | Dai W, Huang X, Ruan Q. Polo-like kinases in cell cycle checkpoint control. Front Biosci. 2003;8:d1128-d1133. [PubMed] |
| 5. | Martin BT, Strebhardt K. Polo-like kinase 1: target and regulator of transcriptional control. Cell Cycle. 2006;5:2881-2885. [PubMed] |
| 6. | Toyoshima-Morimoto F, Taniguchi E, Shinya N, Iwamatsu A, Nishida E. Polo-like kinase 1 phosphorylates cyclin B1 and targets it to the nucleus during prophase. Nature. 2001;410:215-220. [PubMed] |
| 7. | Yuan J, Eckerdt F, Bereiter-Hahn J, Kurunci-Csacsko E, Kaufmann M, Strebhardt K. Cooperative phosphorylation including the activity of polo-like kinase 1 regulates the subcellular localization of cyclin B1. Oncogene. 2002;21:8282-8292. [PubMed] |
| 8. | Qian YW, Erikson E, Taieb FE, Maller JL. The polo-like kinase Plx1 is required for activation of the phosphatase Cdc25C and cyclin B-Cdc2 in Xenopus oocytes. Mol Biol Cell. 2001;12:1791-1799. [PubMed] |
| 9. | van de Weerdt BC, Medema RH. Polo-like kinases: a team in control of the division. Cell Cycle. 2006;5:853-864. [PubMed] |
| 10. | Takai N, Hamanaka R, Yoshimatsu J, Miyakawa I. Polo-like kinases (Plks) and cancer. Oncogene. 2005;24:287-291. [PubMed] |
| 11. | Eckerdt F, Yuan J, Strebhardt K. Polo-like kinases and oncogenesis. Oncogene. 2005;24:267-276. [PubMed] |
| 12. | Liu J, Maller JL. Xenopus Polo-like kinase Plx1: a multifunctional mitotic kinase. Oncogene. 2005;24:238-247. [PubMed] |
| 13. | Holtrich U, Wolf G, Bräuninger A, Karn T, Böhme B, Rübsamen-Waigmann H, Strebhardt K. Induction and down-regulation of PLK, a human serine/threonine kinase expressed in proliferating cells and tumors. Proc Natl Acad Sci U S A. 1994;91:1736-1740. [PubMed] |
| 14. | Wolf G, Elez R, Doermer A, Holtrich U, Ackermann H, Stutte HJ, Altmannsberger HM, Rübsamen-Waigmann H, Strebhardt K. Prognostic significance of polo-like kinase (PLK) expression in non-small cell lung cancer. Oncogene. 1997;14:543-549. [PubMed] |
| 15. | Knecht R, Elez R, Oechler M, Solbach C, von Ilberg C, Strebhardt K. Prognostic significance of polo-like kinase (PLK) expression in squamous cell carcinomas of the head and neck. Cancer Res. 1999;59:2794-2797. [PubMed] |
| 16. | Tokumitsu Y, Mori M, Tanaka S, Akazawa K, Nakano S, Niho Y. Prognostic significance of polo-like kinase expression in esophageal carcinoma. Int J Oncol. 1999;15:687-692. [PubMed] |
| 17. | Kneisel L, Strebhardt K, Bernd A, Wolter M, Binder A, Kaufmann R. Expression of polo-like kinase (PLK1) in thin melanomas: a novel marker of metastatic disease. J Cutan Pathol. 2002;29:354-358. [PubMed] |
| 18. | Takahashi T, Sano B, Nagata T, Kato H, Sugiyama Y, Kunieda K, Kimura M, Okano Y, Saji S. Polo-like kinase 1 (PLK1) is overexpressed in primary colorectal cancers. Cancer Sci. 2003;94:148-152. [PubMed] |
| 19. | Wolf G, Hildenbrand R, Schwar C, Grobholz R, Kaufmann M, Stutte HJ, Strebhardt K, Bleyl U. Polo-like kinase: a novel marker of proliferation: correlation with estrogen-receptor expression in human breast cancer. Pathol Res Pract. 2000;196:753-759. [PubMed] |
| 20. | Macmillan JC, Hudson JW, Bull S, Dennis JW, Swallow CJ. Comparative expression of the mitotic regulators SAK and PLK in colorectal cancer. Ann Surg Oncol. 2001;8:729-740. [PubMed] |
| 21. | Takai N, Miyazaki T, Fujisawa K, Nasu K, Hamanaka R, Miyakawa I. Polo-like kinase (PLK) expression in endometrial carcinoma. Cancer Lett. 2001;169:41-49. [PubMed] |
| 22. | Fan Y, Zheng S, Xu ZF, Ding JY. Apoptosis induction with polo-like kinase-1 antisense phosphorothioate oligodeoxynucleotide of colon cancer cell line SW480. World J Gastroenterol. 2005;11:4596-4599. [PubMed] |
| 24. | Weichert W, Denkert C, Schmidt M, Gekeler V, Wolf G, Köbel M, Dietel M, Hauptmann S. Polo-like kinase isoform expression is a prognostic factor in ovarian carcinoma. Br J Cancer. 2004;90:815-821. [PubMed] |
| 25. | Yamada S, Ohira M, Horie H, Ando K, Takayasu H, Suzuki Y, Sugano S, Hirata T, Goto T, Matsunaga T. Expression profiling and differential screening between hepatoblastomas and the corresponding normal livers: identification of high expression of the PLK1 oncogene as a poor-prognostic indicator of hepatoblastomas. Oncogene. 2004;23:5901-5911. [PubMed] |
| 26. | Mito K, Kashima K, Kikuchi H, Daa T, Nakayama I, Yokoyama S. Expression of Polo-Like Kinase (PLK1) in non-Hodgkin's lymphomas. Leuk Lymphoma. 2005;46:225-231. [PubMed] |
| 27. | Weichert W, Kristiansen G, Winzer KJ, Schmidt M, Gekeler V, Noske A, Müller BM, Niesporek S, Dietel M, Denkert C. Polo- like kinase isoforms in breast cancer: expression patterns and prognostic implications. Virchows Arch. 2005;446:442-450. [PubMed] |
| 28. | Kanaji S, Saito H, Tsujitani S, Matsumoto S, Tatebe S, Kondo A, Ozaki M, Ito H, Ikeguchi M. Expression of polo-like kinase 1 (PLK1) protein predicts the survival of patients with gastric carcinoma. Oncology. 2006;70:126-133. [PubMed] |
| 29. | Liu X, Erikson RL. Polo-like kinase (Plk)1 depletion induces apoptosis in cancer cells. Proc Natl Acad Sci U S A. 2003;100:5789-5794. [PubMed] |
| 30. | Reagan-Shaw S, Ahmad N. Silencing of polo-like kinase (Plk) 1 via siRNA causes induction of apoptosis and impairment of mitosis machinery in human prostate cancer cells: implications for the treatment of prostate cancer. FASEB J. 2005;19:611-613. [PubMed] |
| 31. | Strebhardt K, Ullrich A. Targeting polo-like kinase 1 for cancer therapy. Nat Rev Cancer. 2006;6:321-330. [PubMed] |