修回日期: 2007-11-02
接受日期: 2007-11-28
在线出版日期: 2007-11-28
目的: 构建新型AFP顺式作用元件调控的基因表达载体, 检测该调控元件的特异性和活性表达.
方法: 设计含有特定酶切位点的引物, 采用PCR法从HepG2细胞中克隆AFP启动子及增强子基因亚区片段. 启动子与增强子长、短片段分别与含有报告基因荧光素酶基因的载体pGL-3的多克隆位点连接, 构建不同长度hAFP增强子调控的肝癌特异性Luciferase表达载体APSE-Luc/APLE-Luc. 经测序, PCR及酶切鉴定各重组体. 用脂质体法将表达载体转染表达或不表达AFP的肿瘤细胞系进行荧光强度及特异性表达测定.
结果: 成功地将AFP基因启动子、增强子克隆到报告基因载体pGL-3的多克隆位点, 构建成为不同长度hAFP增强子调控的肝癌特异性Luciferase表达载体APSE-Luc/APLE-Luc, 酶切鉴定和DNA序列分析无误. 转染APLE-Luc质粒的细胞中Luciferase表达量明显高于转染APSE-Luc质粒的细胞, 其在HepG2细胞中的表达明显高于SMMC7721细胞及Hela细胞.
结论: 成功构建AFP启动子与增强子联合调控载体APSE-Luc/APLE-Luc. AFP增强子能够特异性地增强目的基因在AFP阳性细胞中表达, 并且不同的亚区活性不同, 长片段的活性明显高于短片段.
引文著录: 马晓娟, 匡安仁, 黄蕤. hAFP增强子调控的肝癌特异性基因治疗载体的构建及活性测定. 世界华人消化杂志 2007; 15(33): 3474-3478
Revised: November 2, 2007
Accepted: November 28, 2007
Published online: November 28, 2007
AIM: To construct a gene-modified hepatocellular carcinoma (HCC)-specific luciferase expression vector regulated by alpha fetoprotein (AFP) promoter and enhancer, and to evaluate the effects.
METHODS: The minimal essential DNA fragment of the AFP gene promoter and enhancer was amplified through PCR from the genome of HepG2 cells. It was then cloned into the plasmid pGL-3 after the AFP promoter was combined with a 0.4- or 1.0-kb enhancer region, to construct the recombinant plasmids APSE-Luc and APLE-Luc. These two plasmids were transfected into HepG2, SMMC7721 and Hela cells. Fluorescence was detected in order to evaluate the luciferase expression and specificity.
RESULTS: By restriction digestion and sequence analysis, we confirmed that the length, position, and orientation of inserted genes of the AFP promoter and enhancer were all correct. The recombinant vector APSE-Luc/APLE-Luc was successfully constructed. The expression of luciferase in HepG2 cells transfected with APLE-Luc was significantly higher than that in SMMC7721 and Hela cells, and also higher than that in cells transfected with the APSE-Luc plasmid.
CONCLUSION: AFP enhancer, especially the 1.0-kb enhancer, can specifically accelerate the expression of target genes within cells that are positive for AFP.
- Citation: Ma XJ, Kuang AR, Huang R. Construction of the alpha-fetoprotein enhancer controlled gene therapy vector specific for hepatocellular carcinoma and identification of its activity. Shijie Huaren Xiaohua Zazhi 2007; 15(33): 3474-3478
- URL: https://www.wjgnet.com/1009-3079/full/v15/i33/3474.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i33.3474
肝细胞癌(hepatocellular carcinoma, HCC)是全球最常见的恶性肿瘤之一, 是在我国癌症患者病死率最高的疾病之一[1]. 手术、放化疗及介入等常规治疗疗效均不理想, 不能从根本上改善患者的预后[2]. 利用基因工程的手段, 对肝癌进行基因治疗, 是肝癌治疗的热点[3-6]. 目前利用AFP转录调控序列驱动目的基因表达是肝癌靶向治疗的主要手段[4-10]. 已有文献报道, 应用甲胎蛋白基因转录顺式作用元件调控抗肿瘤基因, 能特异性杀伤肝癌细胞[11-16]. 我们克隆了缩短的AFP基因启动子和增强子, 将其连接到含有荧光素酶(Luciferase)报告基因的载体(pGL-3), 构建了重组真核表达载体APSE-Luc及APLE-Luc, 并对其活性及特异性进行了检测.
内切酶BglⅡ、KpnⅠ、HindⅢ购自TaKaRa公司, 1640、TRIzol购自Invitrogen公司, 小牛血清购自杭州四季青公司, T4连接酶、质粒提取试剂盒Plasmid mini kit、凝胶回收试剂盒Gel Extraction Kit、PCR试剂盒购自Promega公司, Tris、琼脂糖、胰蛋白胨、酵母提取物、耗材等购自华美生物工程公司或三博远志生物技术公司. 人NIS基因由四川大学华西医院核医学科黄蕤博士合成[17], 大肠杆菌JM109、人肝癌细胞系HepG2、SMMC27721细胞、人宫颈癌细胞系Hela细胞由四川大学华西医院传染科惠赠.
1.2.1 细胞培养: 在研究中分实验组(AFP阳性肝癌细胞系HepG2)及对照组(AFP阴性肝癌细胞系SMMC27721). 3株人宫颈癌细胞(Hela)在含100 mL/L小牛血清的1640培养基中, 于37℃, 50 mL/L CO2, 饱和湿度下培养.
1.2.2 AFP启动子及增强子长、短片段的克隆: 根据人AFP基因图谱设计引物, 启动子正向引物5'-GAAGATCTTCTGAGGAGAATATTTGTTA-3', 反向引物5'-CCAAGCTTGGTGTTATTGGCAGTGGTGG-3'; 增强子长片段正向引物5'-GGTACCCTGTCTGCAAGCTTATGATTCCC-3', 短片段正向引物5'-GGTACCCCCACACGTATAGCTCAACTGC-3', 长、短片段共用反向引物5'-AGATCTTGGCCTGGATAAAGCTGAGTGG-3', 并在上、下游引物5'端分别加入限制性内切酶BglⅡ和KpnI(启动子)、BglⅡ和HindⅢ(增强子)位点. 按照Omega公司Tissue DNA Kits试剂盒操作说明抽提HepG2细胞基因组DNA, 以此为模板进行PCR 扩增, 并将产物纯化后进行测序.
1.2.3 APSE-Luc及APLE-Luc表达载体构建: 使用Gel Extraction Kit凝胶回收试剂盒回收PCR产物AFP启动子、增强子基因片段cDNA, 按照启动子-增强子(长/短)顺序连接后, 在T4连接酶作用下分别连接至pGL-3载体上, 16℃过夜. 连接产物转化感受态大肠杆菌JM109, 挑取克隆, 以180 r/min、37℃摇菌过夜, Plasmid kit质粒提取试剂盒提取质粒. 新构建重组真核表达载体APSE-Luci及APLE-Luci, 进行酶切、电泳测定.
1.2.4 脂质体转染: 转染前1 d, 在6孔培养板内以2×106接种细胞, 每种细胞做3个复孔, 共3个6孔培养板. 待细胞生长到70%-80%密度时, 以含3-4 μg APSE-Luc/APLE-Luc、1 μL LP2000和500 μL无血清的1640培养基进行混合转染, 3-6 h后用1 mL含100 mL/L小牛血清的1640培养基取代.
1.2.5 荧光强度检测(虫荧光素酶及海肾荧光素酶活性分析): 转染48 h后使用1×PBS清洗培养细胞, 加入适量1×lysis buffer, 将细胞转入微量离心管置冰上, 离心后将细胞裂解液置于检测管中并将管放入检测仪中检测荧光强度, 用于评价重组质粒APSE-Luc/APLE-Luc在肿瘤细胞中的表达.
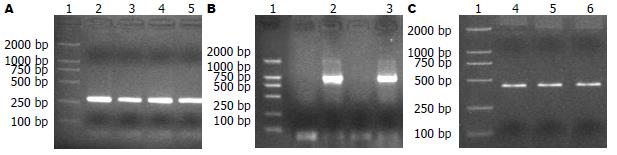
PCR克隆的AFP启动子cDNA共268 bp, 增强子长片段cDNA含986 bp, 短片段420 bp. PCR产物进行20 g/L琼脂糖凝胶电泳分别可见到一条清晰的300 bp、400 bp及1000 bp左右条带, 符合预期结果(图1).
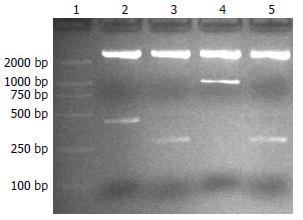
连接产物转化感受态大肠杆菌JM109, 培养挑取克隆, 提取质粒APSE-Luc和APLE-Luc, 分别进行BglⅡ+KpnⅠ(启动子)、BglⅡ+HindⅢ(增强子)双酶切, 20 g/L琼脂糖凝胶电泳鉴定可见到0.3 kb(Promoter)、420 bp(Senh)及1.0 kb (Lenh)片段(图2).
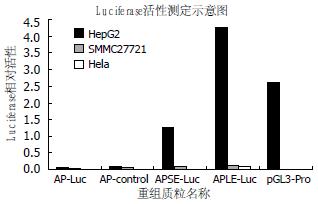
分别将APSE-Luc和APLE-Luc质粒转染HepG2细胞、SMMC27721和Hela细胞, 对细胞荧光表达量进行虫荧光素酶及海肾荧光素酶活性分析. 结果(图3)显示, 转染APLE-Luc质粒的HepG2细胞中的荧光强度明显高于转染APSE-Luc质粒的HepG2、SMMC27721和Hela细胞, 表明AFP启动子与增强子联合调控, 可特异性地启动并增强其下游的Luc基因在AFP阳性的肝癌细胞中高效表达, 长片段的增强子作用尤为显著.
目的基因的靶向性表达对肝癌的治疗极重要. 基因治疗中利用细胞或组织特异性启动子能够使目的基因在特定的靶细胞中表达[18-19], 最大程度地减少对正常组织的毒副作用. AFP作为特异性的肿瘤标志物, 其启动子能够被用来驱动治疗基因的表达[20-21]. 利用AFP在肝癌组织中特异性高表达的特性, 可将目的基因置于AFP基因调控序列下方, 使目的基因仅在肝癌细胞表达, 提高基因治疗的特异性和靶向性. Kunitomi et al[22]将白喉毒素片段A的基因(DTA)连接在AFP启动子下游, 然后直接注射到肝癌组织中, 结果肝癌细胞中DTA基因大量表达, 肿瘤细胞死亡, 而AFP阴性癌细胞和正常肝脏细胞不受影响.
对AFP的许多调控元件已有较多研究, 这些调控序列较长, 包含了几乎所有的顺式和反式作用元件, 目的是发挥最大的转录启动活性[14,23]. 大多数基因治疗载体容量有限, 无法容纳AFP基因全部5'-端序列(约7.6 kb), DNA片段太长也不易操作. 另外, 若采用AFP基因全部5'-端序列作为调控序列, 除启动子外还有许多正、负调控元件, 专一性不好, 用其调控抗肿瘤基因的转录有可能杀伤肝脏再生时出现的有分化功能的干细胞, 因为后者也产生AFP, 从而影响肝脏的再生功能. Ido et al[25]证实, 300 bp的人AFP启动子序列已足以在人、大鼠细胞中启动目的基因的表达. 利用含这种启动子的逆转录病毒载体在AFP阳性的肝癌细胞株中取得了特异表达自杀基因的效果, 但是组织特异性启动子的活性通常都较低, 若仅采用0.3 kb的启动子则启动活性太低达不到基因治疗的要求. 为了解决这一问题, Ido et al[24]将人类VEGF基因5'-端具有增强子活性的缺氧反应性元件(hypoxia-responsive element, HRE)克隆到AFP启动子的上游, 联合调控自杀基因(HSV-tk)的表达, 可明显增强AFP启动子的活性, 在体内和体外实验中杀伤AFP低表达的肝脏肿瘤.
由于AFP的表达很大程度上依赖于增强子的活性[24], 一些研究者试图利用增强子的功能来增强转染基因的表达[26-29]. Kanai et al[12]将AFP基因的启动子和增强子同时与自杀基因胞嘧啶脱氨酶(CD)基因融合, 转染肝癌细胞, 使CD基因在肝癌组织特异性高效表达, 将无毒的5-氟胞嘧啶(5-FC)代谢为5-氟脲嘧啶, 杀伤肝癌细胞. Cao et al[30-31]的系列研究结果显示, 在表达或不表达AFP的HCC细胞内AFP增强子都可明显提高启动子的活性, 使转染基因的表达增强4-8倍, 同时明显抑制转染基因在非HCC细胞的表达. AFP增强子的增强作用与抑制作用相结合, 使转染基因在HCC细胞的表达为非HCC细胞的32-152倍.
AFP完整的增强子序列含2.0 kb碱基(-5.1/-3.1), 含有两个亚区: 0.3 kb的增强子A(-4.0/-3.7)和0.4 kb的增强子B(-3.7/-3.3). 基于Akio et al[23]的研究思路, 我们克隆了最小的AFP启动子(0.3 kb)和不同长度的增强子(0.4 kb/1.0 kb)序列, 再分别将增强子与启动子连接, 作为肝癌特异性顺式调控元件, 试图寻找能够保持正常活性、便于分子克隆操作的小片段顺式调控元件. 实验证明, 重组的肝癌基因治疗表达载体, 能够特异性的在AFP阳性肝癌细胞HepG2中发挥转录活性, 调控目的基因的表达, 在低表达AFP的SMMC-7721细胞和不表达AFP的HeLa细胞中则启动活性极低. 同时还证实, 1.0 kb增强子的调控活性要明显高于0.4 kb增强子, 其转录活性、特异性都很好的保存下来, 在其下游克隆抗肿瘤基因, 可对AFP阳性肝癌进行基因治疗.
总之, 本研究构建的hAFP增强子调控的肝癌特异性基因治疗载体APSE-Luc和APLE-Luc, 为肝癌的基因靶向治疗提供了新的思路和有力工具, 增加了转染基因靶向治疗肝癌应用于临床的可行性.
肝细胞癌是人类最常见、死亡率最高的恶性肿瘤之一, 全世界每年大约有100万人死于肝癌, 亚洲和非洲是高发区. 由于HCC的发生发展过程与慢性肝病, 特别是乙型或丙型肝炎造成的肝硬化密切相关, 因此大多数HCC患者在发现病变的初期即丧失了手术的机会, 即便是接受了手术或介入治疗的患者, 也因为肝功能的问题不能很好的恢复. 近年来尽管在预防、早期诊断和综合治疗方面出现了很多新的方案, 但是肝癌发病率仍逐年增长, 患者生存率并无明显改善, 也没能从根本上解决肝癌的转移和复发. 随着肿瘤生物治疗技术的不断发展, 肝癌的基因治疗成为研究热点.
如何实现治疗基因的靶向性表达是肿瘤基因治疗领域中的一个热点领域. 甲胎蛋白在多数原发性肝细胞癌(HCC)患者血清中明显升高, 因此AFP可作为一种特异性肿瘤标志物应用于肝癌的基因靶向治疗. 甲胎蛋白启动子目前已广泛应用于肝癌的靶向性基因治疗中, 但组织特异性启动子的活性通常都较低, 因此单独的启动子启动活性太低达不到基因治疗的要求. 对AFP的许多调控元件已有较多研究, 这些调控序列较长, 包含了几乎所有的顺式和反式作用元件. 大多数基因治疗载体容量有限, 无法容纳AFP基因全部5'-端序列(约7.6 kb), DNA片段太长也不易操作, 同时其专一性不好.
已有文献报道, 300 bp的人AFP启动子序列已足以在人、大鼠细胞中启动目的基因的表达, 利用含这种启动子的逆转录病毒载体在AFP阳性的肝癌细胞株中取得了特异表达自杀基因的效果. Cao et al的系列研究结果显示, 在表达或不表达AFP的HCC细胞内AFP增强子都可明显提高启动子的活性, 使转染基因的表达增强4-8倍, 同时明显抑制转染基因在非HCC细胞的表达, AFP增强子的增强作用与抑制作用相结合, 使转染基因在HCC细胞的表达为非HCC细胞的32-152倍.
本文提示, AFP增强子能够明显提高启动子的启动活性, 1.0 kb增强子的调控活性要明显高于0.4 kb增强子, 其转录活性、特异性都很好的保存下来. AFP增强子与启动子联合调控抗肿瘤基因的表达, 对AFP阳性肝癌的基因治疗具有重要意义.
本文目的明确, 思路清晰, 结论合乎逻辑, 对于进一步开展该领域的研究提供了可行的思路.
编辑: 程剑侠 电编:何基才
| 1. | Levin B, Amos C. Therapy of unresectable hepatocellular carcinoma. N Engl J Med. 1995;332:1294-1296. [PubMed] |
| 2. | Li Y, Yu DC, Chen Y, Amin P, Zhang H, Nguyen N, Henderson DR. A hepatocellular carcinoma-specific adenovirus variant, CV890, eliminates distant human liver tumors in combination with doxorubicin. Cancer Res. 2001;61:6428-6436. [PubMed] |
| 3. | Kaneko S, Hallenbeck P, Kotani T, Nakabayashi H, McGarrity G, Tamaoki T, Anderson WF, Chiang YL. Adenovirus-mediated gene therapy of hepatocellular carcinoma using cancer-specific gene expression. Cancer Res. 1995;55:5283-5287. [PubMed] |
| 4. | Schmitz V, Qian C, Ruiz J, Sangro B, Melero I, Mazzolini G, Narvaiza I, Prieto J. Gene therapy for liver diseases: recent strategies for treatment of viral hepatitis and liver malignancies. Gut. 2002;50:130-135. [PubMed] |
| 5. | Lu SY, Sui YF, Li ZS, Pan CE, Ye J, Wang WY. Construction of a regulable gene therapy vector targeting for hepatocellular carcinoma. World J Gastroenterol. 2003;9:688-691. [PubMed] |
| 6. | Shibata T, Giaccia AJ, Brown JM. Development of a hypoxia-responsive vector for tumor-specific gene therapy. Gene Ther. 2000;7:493-498. [PubMed] |
| 7. | Ling CQ, Li B, Zhang C, Zhu DZ, Huang XQ, Gu W, Li SX. Inhibitory effect of recombinant adenovirus carrying melittin gene on hepatocellular carcinoma. Ann Oncol. 2005;16:109-115. [PubMed] |
| 8. | Sa Cunha A, Bonte E, Dubois S, Chretien Y, Eraiser T, Degott C, Brechot C, Tran PL. Inhibition of rat hepatocellular carcinoma tumor growth after multiple infusions of recombinant Ad.AFPtk followed by ganciclovir treatment. J Hepatol. 2002;37:222-230. [PubMed] |
| 9. | Takahashi M, Sato T, Sagawa T, Lu Y, Sato Y, Iyama S, Yamada Y, Fukaura J, Takahashi S, Miyanishi K. E1B-55K-deleted adenovirus expressing E1A-13S by AFP- enhancer/promoter is capable of highly specific replication in AFP-producing hepatocellular carcinoma and eradication of established tumor. Mol Ther. 2002;5:627-634. [PubMed] |
| 10. | Kim J, Lee B, Kim JS, Yun CO, Kim JH, Lee YJ, Joo CH, Lee H. Antitumoral effects of recombinant adenovirus YKL-1001, conditionally replicating in alpha-fetoprotein-producing human liver cancer cells. Cancer Lett. 2002;180:23-32. [PubMed] |
| 11. | Dachs GU, Dougherty GJ, Stratford IJ, Chaplin DJ. Targeting gene therapy to cancer: a review. Oncol Res. 1997;9:313-325. [PubMed] |
| 12. | Kanai F. Transcriptional targeted gene therapy for hepatocellular carcinoma by adenovirus vector. Mol Biotechnol. 2001;18:243-250. [PubMed] |
| 13. | Su H, Chang JC, Xu SM, Kan YW. Selective killing of AFP-positive hepatocellular carcinoma cells by adeno-associated virus transfer of the herpes simplex virus thymidine kinase gene. Hum Gene Ther. 1996;7:463-470. [PubMed] |
| 14. | Sakai M, Morinaga T, Urano Y, Watanabe K, Wegmann TG, Tamaoki T. The human alpha-fetoprotein gene. Sequence organization and the 5' flanking region. J Biol Chem. 1985;260:5055-5060. [PubMed] |
| 15. | Li MS, Li PF, Chen Q, Du GG, Li G. Alpha-fetoprotein stimulated the expression of some oncogenes in human hepatocellular carcinoma Bel 7402 cells. World J Gastroenterol. 2004;10:819-824. [PubMed] |
| 16. | Ren XW, Liang M, Meng X, Ye X, Ma H, Zhao Y, Guo J, Cai N, Chen HZ, Ye SL. A tumor-specific conditionally replicative adenovirus vector expressing TRAIL for gene therapy of hepatocellular carcinoma. Cancer Gene Ther. 2006;13:159-168. [PubMed] |
| 18. | Tomizawa M, Yu L, Wada A, Tamaoki T, Kadomatsu K, Muramatsu T, Matsubara S, Watanabe K, Ebara M, Saisho H. A promoter region of the midkine gene that is frequently expressed in human hepatocellular carcinoma can activate a suicide gene as effectively as the alpha-fetoprotein promoter. Br J Cancer. 2003;89:1086-1090. [PubMed] |
| 19. | Guan M, Rodriguez-Madoz JR, Alzuguren P, Gomar C, Kramer MG, Kochanek S, Prieto J, Smerdou C, Qian C. Increased efficacy and safety in the treatment of experimental liver cancer with a novel adenovirus-alphavirus hybrid vector. Cancer Res. 2006;66:1620-1629. [PubMed] |
| 20. | Meng WS, Butterfield LH, Ribas A, Dissette VB, Heller JB, Miranda GA, Glaspy JA, McBride WH, Economou JS. alpha- Fetoprotein-specific tumor immunity induced by plasmid prime-adenovirus boost genetic vaccination. Cancer Res. 2001;61:8782-8786. [PubMed] |
| 21. | Gorog D, Regoly-Merei J, Paku S, Kopper L, Nagy P. Alpha-fetoprotein expression is a potential prognostic marker in hepatocellular carcinoma. World J Gastroenterol. 2005;11:5015-5018. [PubMed] |
| 22. | Kunitomi M, Takayama E, Suzuki S, Yasuda T, Tsutsui K, Nagaike K, Hiroi S, Tadakuma T. Selective inhibition of hepatoma cells using diphtheria toxin A under the control of the promoter/enhancer region of the human alpha-fetoprotein gene. Jpn J Cancer Res. 2000;91:343-350. [PubMed] |
| 23. | Watanabe K, Saito A, Tamaoki T. Cell-specific enhancer activity in a far upstream region of the human alpha-fetoprotein gene. J Biol Chem. 1987;262:4812-4818. [PubMed] |
| 24. | Ido A, Nakata K, Kato Y, Nakao K, Murata K, Fujita M, Ishii N, Tamaoki T, Shiku H, Nagataki S. Gene therapy for hepatoma cells using a retrovirus vector carrying herpes simplex virus thymidine kinase gene under the control of human alpha- fetoprotein gene promoter. Cancer Res. 1995;55:3105-3109. [PubMed] |
| 25. | Ido A, Uto H, Moriuchi A, Nagata K, Onaga Y, Onaga M, Hori T, Hirono S, Hayashi K, Tamaoki T. Gene therapy targeting for hepatocellular carcinoma: selective and enhanced suicide gene expression regulated by a hypoxia- inducible enhancer linked to a human alpha-fetoprotein promoter. Cancer Res. 2001;61:3016-3021. [PubMed] |
| 26. | Tan EH, Hooi SC, Laban M, Wong E, Ponniah S, Wee A, Wang ND. CCAAT/enhancer binding protein alpha knock-in mice exhibit early liver glycogen storage and reduced susceptibility to hepatocellular carcinoma. Cancer Res. 2005;65:10330-10337. [PubMed] |
| 27. | Huang X, Zhang W, Wakimoto H, Hamada H, Cao X. Adenovirus-mediated tissue-specific cytosine deaminase gene therapy for human hepatocellular carcinoma with different AFP expression levels. J Exp Ther Oncol. 2002;2:100-106. [PubMed] |
| 28. | Pin RH, Reinblatt M, Fong Y. Utilizing alpha-fetoprotein expression to enhance oncolytic viral therapy in hepatocellular carcinoma. Ann Surg. 2004;240:659-665; discussion 665-666. [PubMed] |
| 29. | Takikawa H, Mafune K, Hamada H, Nettelbeck DM, Muller R, Makuuchi M, Kaminishi M. An advanced strategy of enhanced specific gene expression for hepatocellular carcinoma. Int J Oncol. 2003;22:1051-1056. [PubMed] |
| 30. | Cao G, Kuriyama S, Tsujinoue H, Chen Q, Mitoro A, Qi Z. A novel approach for inducing enhanced and selective transgene expression in hepatocellular-carcinoma cells. Int J Cancer. 2000;87:247-252. [PubMed] |
| 31. | Cao G, Kuriyama S, Gao J, Nakatani T, Chen Q, Yoshiji H, Zhao L, Kojima H, Dong Y, Fukui H. Gene therapy for hepatocellular carcinoma based on tumour-selective suicide gene expression using the alpha-fetoprotein (AFP) enhancer and a housekeeping gene promoter. Eur J Cancer. 2001;37:140-147. [PubMed] |