修回日期: 2007-09-13
接受日期: 2007-09-28
在线出版日期: 2007-11-08
目的: 利用RNA干扰(RNAi)技术, 以HER-2为靶基因, 设计构建重组表达载体, 并进行测序鉴定.
方法: 设计具有短发夹结构的两条DNA序列, 经退火成互补双链, 再克隆至载体pGPU6/GFP/Neo中构建重组表达载体, 转化DH5α菌株, 提取质粒行酶切鉴定后, 并进行序列测定. 再转染人大肠癌HT29细胞, 进行荧光摄像和G418抗性筛选.
结果: 将合成的DNA序列退火后克隆到载体上, 经酶切和测序鉴定确实为所需序列.
结论: HER-2靶向RNA干扰重组表达载体的构建成功, 并可以进行稳定筛选.
引文著录: 韩明阳, 吴爱国, 郭爱林, 李鹏, 纪术峰, 刘铮. HER-2基因靶向RNA干扰重组表达载体的构建及序列分析. 世界华人消化杂志 2007; 15(31): 3284-3288
Revised: September 13, 2007
Accepted: September 28, 2007
Published online: November 8, 2007
AIM: To clone the recombinant plasmid affecting HER-2 gene translation by RNA interference, and to analyze the nucleic acid sequence of the recombinant plasmid for tumor gene therapy.
METHODS: Two DNA sequences containing a small hairpin structure were designed and synthesized. The complement form was obtained by annealing and cloning into vector pGPU6/GFP/Neo, and the recombinant plasmid was transformed into strain DH5α. The plasmid identified by restriction enzyme analysis was used for sequencing. Human colon cancer HT29 cells were transfected with plasmid vector, and then fluorescence photographs were taken and selected according to G418.
RESULTS: The recombinant plasmid was cloned, and the sequence was obtained.
CONCLUSION: Successful cloning of the recombinant plasmid may help to discover new gene therapies for tumors.
- Citation: Han MY, Wu AG, Guo AL, Li P, Ji SF, Liu Z. Cloning of recombinant plasmid affecting HER-2 in gene translation by RNA interference. Shijie Huaren Xiaohua Zazhi 2007; 15(31): 3284-3288
- URL: https://www.wjgnet.com/1009-3079/full/v15/i31/3284.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i31.3284
HER-2(human epidermal-growth-factor recptor 2)分子是表皮生长因子受体家族(human epidermal-growth-factor recptor)的第2位成员, 对细胞的生长、分化及存活起重要的调节作用. HER-2在结直肠癌中阳性表达与肿瘤浸润转移密切相关, 在大肠癌中其过表达与否是患者预后的重要指标[1-2]. 研究表明他与表皮生长因子受体家族其他3位成员形成异二聚体, 通过多种信号转导途径促进肿瘤的增殖、转移、耐药性的产生, 是肿瘤基因治疗的重要靶位点[3].
自从RNA干扰技术被《Science》杂志评选为2002年度世界十大科学成就之首以来, RNA干扰在结直肠癌的应用方面有了长足的进步. 针对细胞信号转导、细胞凋亡、细胞周期调控分子、端粒酶、细胞因子及其受体基因等不同位点而设计的小干扰RNA对结肠癌细胞均有明显的阻抑作用[4-5]. RNAi技术具有特异性和高效性, 已经成为研究基因功能的重要工具[6]. RNAi技术是通过导入细胞19 nt-23 nt的小分子干扰RNA(small interference RNA, siRNA), 降解同源mRNA, 高效、特异性阻断目的基因表达[7]. 但是, 裸siRNA导入机体和细胞, 转染效率低, 抑制时间短. 有研究表明, 短发卡状RNA(short hairpin RNA, shRNA)对靶基因的抑制效果优于siRNA[8]. 我们构建了针对HER-2基因的短发夹结构RNA(short hairpin RNA, shRNA)重组表达载体[9], 期望通过重组表达载体有效感染和表达HER-2-shRNA发挥RNAi作用.
含有人U6启动子的pGPU6/GFP/Neo质粒购买于上海吉玛公司, 克隆用大肠杆菌DH5α购买于大连宝生物公司, 限制性内切酶(BamHⅠ, PstⅠ, BbsⅠ)及T4 DNA连接酶购买于美国NEB公司, 核酸分子质量标准Lambda DNA/Eco130Ⅰ购买于Fermentas公司, 质粒小量抽提试剂盒为天为时代公司产品, 胶回收试剂盒购买于广州美津生物公司, HT29细胞由广东省人民医院中心实验室赠送, DH5α大肠杆菌感受态细胞冻存于-70℃备用. 根据GenBank中报道的HER-2基因核苷酸序列(No. M11730), 参考shRNA设计原则进行设计, 使用BLAST将选定的序列和相应的人基因组数据库进行比较, 排除和其他编码序列/EST同源的序列. 最后选择出两条片段作为HER-2基因干扰片段, 一条是位于395-415 bp的GCTACGTGCTCATCGCTCACA, 另一条是位于2184-2204 bp的序列GCAGC AGAAGATCCGGAAGTA. loop结构选用了TTCAAGAGA以避免形成终止信号. 反义片段以后接TTTTTT, 以终止转录. 正义链模板的5'端添加了CACC, 与BbsⅠ酶切后形成的黏端互补; 反义链模板的5'端添加了GATC, 与BamHⅠ酶切后形成的黏端互补; 并将其送上海生工公司合成. shRNA1正义链: 5'CACCGCTACGTGCTCATCGCTCACATTCAAGAGATGTGAGCGATGAGCACGTAGCTTTTTTG3'. shRNA1反义链: 5'CGATGCACGAGTAGCGAGTGTAAGTTCTCTACACTCGCTACTCGTGCATCGAAAAAACCTAG3'. shRNA2正义链: 5'CACC GCAGCAGAAGATCCGGAAGTATTCAAGAGATACTTCCGGATCTTCTGCTGC TTTTTTG3'. shRNA2反义链: 5'CGTCGTCTTCTAGGCCTTCATAAGTTCTCTATGAAGGCCTAGAAGAGGACGAAAAAACCTAG3'.
pGPU6/GFP/Neo-shRNA表达载体的构建. 将DNA Oligo分别用TE(pH8.0)溶解, 浓度为100 μmol/L. 取相应的正义链和反义链Oligo溶液, 退火体系: 50 μL = 5 μL(正义链)+5 μL(反义链)+5 μL退火Buffer+35 μL无菌水, 在PCR仪上按照如下程序进行退火处理: 95℃ 5 min, 85℃ 5 min, 75℃ 5 min, 70℃ 5 min, 4℃保存. 退火处理后得到浓度为10 μmol的shRNA模板. 将所得模板溶液稀释500倍, 终浓度为20 nmol/L, 用于连接反应. 载体pGPU6/GFP/Neo经BamHⅠ和BbsⅠ双酶切, 琼脂糖电泳, 使用胶回收试剂盒回收. 将退火片段与经酶切后的载体按摩尔比3:1的比例进行连接反应, 置16℃过夜. 将连接产物分别接种于100 μL的DH5α感受态细胞中进行转化, 涂布于含Kanamycin抗性(终浓度为20 mg/L)的LB平板上, 37℃恒温箱培养过夜. 从每个培养皿上各挑取3个单克隆菌落接种于3 mL含Kanar抗性(终浓度为20 mg/L)的LB培养液中, 37℃恒温摇床培养过夜. 用质粒小量抽提试剂盒小量提取质粒后, 分别用限制性内切酶PstⅠ和BamHⅠ做单酶切鉴定, 得到的重组质粒分别命名pGPU6/GFP/Neo-shRNA1, pGPU6/GFP/Neo-shRNA2. 将鉴定证实后的两个重组质粒各取1管菌液送上海英骏公司测序. 所用引物为5'-TAATACGACTCACTATAGGG-3'. 以含100 mL/L小牛血清的RPMI1640培养基培养人大肠癌HT29细胞株, 胰酶消化传代. 细胞铺6孔板, 用Opti-MEM®Ⅰ无血清培养基(购自Invitrogen公司), 分别以250 μL稀释4 μg质粒载体和10 μL脂质体Lipofectamine®2000进行转染, 6-7 h后更换完全培养基. 转染后的细胞加入600 mg/L G418筛选, 经14 d后形成阳性克隆, 扩增培养备用.
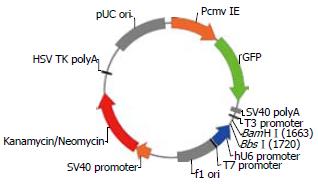
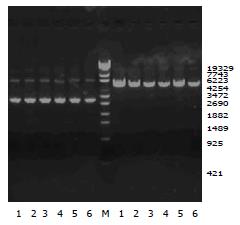
将合成的shDNA序列片段连入质粒pGPU6/GFP/Neo(图1)后, 用BamHⅠ和PstⅠ内切酶分别单酶切, 质粒pGPU6/GFP/Neo的BamHⅠ和BbsⅠ酶切位点之间是PstⅠ的酶切位点. 而插入目的基因片段之后, PstⅠ酶切位点被取代, 故不能被PstⅠ所酶切. PstⅠ酶切结果显示有2条带, 第1条为超螺旋的SC构型, 第2条为质粒的松弛开环的OC构型, 可显示重组体不能被PstⅠ所酶切. 重组体被BamHⅠ单酶切而线性化, 条带在5100 bp左右(图2).
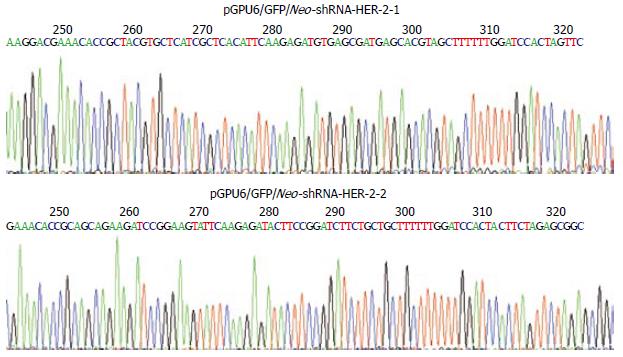
2个重组质粒shRNA编码序列与设计的片段完全一致, 表明载体构建正确(图3).
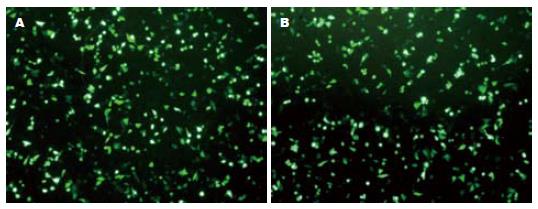
编码shRNA的带绿色荧光蛋白的重组载体转染入HT29细胞后在绿色荧光激发波长下细胞应显示为绿色(图4), 转染后24 h荧光显微镜摄片证实转染成功, G418稳定筛选出阳性克隆.
目前在研究哺乳动物细胞的基因功能方面, 产生RNAi效应主要应用的方法有两类: 一类为体外转录或化学合成siRNA经脂质体或逆转录病毒载体等转染细胞后介导RNAi, 另一类为发夹式siRNA表达载体转染细胞后表达的发夹式siRNAs诱导RNAi. 化学合成的siRNAs抑制作用时间短, 合成成本昂贵, 并且易于污染RNA酶而降解, 因此限制其应用. 而发夹式siRNAs表达载体转染细胞后表达发夹式siRNAs成本较低, 可以在细胞内RNA酶的作用下被切割成与体外合成的siRNA相同的序列与结构, 诱导RNAi. 同时, 他可以稳定持续地表达发夹式siRNA, 使RNAi作用时间更长、更稳定[10-11]. Brummelkamp et al[8]研究发现将表达载体导入细胞内在U6启动子的作用下转录产生shRNA, 其发卡环结构被切除后产生siRNA, 具有表达量多、持续时间久的优点, 并且还证实以9个核苷酸序列环为发卡的shRNA产生的抑制效应最强[12]. Willmore et al[13]应用免疫组化法检测结直肠良恶性病变erbB-2表达水平. 结果显示, HER-2基因表达与Duke分期、生存期有关, HER-2表达强阳性者术后较早发生肝转移, HER-2表达水平是影响预后的独立因素. 目前HER-2/neu蛋白产物P185neu所引起的肿瘤细胞内在的对化疗药物耐药的机制仍不清楚. Pietras et al[14-15]研究提示P185neu过表达的肿瘤细胞对损伤的修复能力增强, 是HER-2/neu诱导化疗药物耐药性的关键. 如能设法阻断癌细胞内HER-2基因的表达, 定会大大减弱癌细胞增殖能力同时减弱凋亡抑制. 阐明HER-2基因在肿瘤细胞凋亡抑制和增殖中的作用, 可为肿瘤治疗提供新的靶点, 具有重要的理论意义和实际应用前景[16].
RNAi作为一种高效的序列特异性基因敲除技术在恶性肿瘤基因治疗领域发展必定更加迅速. 如今RNA干扰已经成为药物开发的一种关键技术. 2004年, RNAi首次作为评估药物靶标的一种技术进入应用, RNAi开发药物也将会进入临床试验. siRNA技术对于药物发展的一个主要优点是可以在最短的时间, 以相对较小的经济发展代价来为任何一个目的基因设计一个特异siRNA复合物, 同其他传统的小分子为基础的治疗相比有明显的灵活性[17]. 质粒pGPU6/GFP/Neo包括一种人U6 RNA聚合酶Ⅲ启动子, 利用相对单一的启动子和终止序列产生大量的小RNA. 同时, 位于启动子下游的shRNA是为了在RNAi质粒进入宿主表达后, 单链的RNA配对形成短的dsRNA, 引发RNA干扰. 而且, 该载体中含有可供筛选的卡那耐药基因, 利于阳性重组子的克隆筛选. 在本实验所构建的载体含有GFP基因, 在细胞内, GFP基因的表达产物-绿色荧光蛋白, 可以方便地通过荧光显微镜或流式细胞仪检测, 确定载体转染效率. 因此, 我们根据GenBank中报道的HER-2基因核苷酸序列, 参考shRNA设计原则设计出了两条阻断HER-2基因表达的RNAi序列, 并成功克隆至载体pGPU6/GFP/Neo, 通过抗性辅助筛选, 重组体被整合到宿主细胞基因组后, RNA干扰(RNAi)效应可以实现传代[18]. 为下一步检测其对HER-2mRNA的抑制效率和抑制HER-2蛋白表达情况[19], 进一步研究HER-2基因在大肠癌中的作用以及探索大肠癌的基因治疗奠定基础.
HER-2分子是表皮生长因子受体家族的第2位成员, 对细胞的生长、分化及存活起重要的调节作用. HER-2在结直肠癌中阳性表达与肿瘤浸润转移密切相关, 在大肠癌中其过表达与否是患者预后的重要指标. 研究表明他与表皮生长因子受体家族其他3位成员形成异二聚体, 通过多种信号转导途径促进肿瘤的增殖、转移、耐药性的产生, 是肿瘤基因治疗的重要靶位点.
2004年Yang et al应用逆转录病毒载体介导siRNA引起乳腺癌和卵巢癌HER2/neu沉默,导致G0/G1期细胞增加, 认为其与细胞周期蛋白D1降低、p27增加有关,与下游信号分子PI3K、pAKt表达降低有关.
本文中构建了HER-2siRNA载体, 并建立了稳定转染细胞株, 为进一步研究HER-2基因在大肠癌中的作用以及探索大肠癌的基因治疗奠定基础.
本文利用带有绿色荧光蛋白的质粒构建靶向HER-2基因的shRNA表达载体, 不仅可以检测转染效率, 也可以为进一步体外和体内实验, 探索抑制HER-2表达在大肠癌治疗中的作用奠定基础.
本文是一篇方法学的研究, 有一定的参考价值.
编辑: 程剑侠 电编:郭海丽
| 1. | Zhao J, Zhang LH, Jia LT, Zhang L, Xu YM, Wang Z, Yu CJ, Peng WD, Wen WH, Wang CJ. Secreted antibody/granzyme B fusion protein stimulates selective killing of HER2-overexpressing tumor cells. J Biol Chem. 2004;279:21343-21348. [PubMed] |
| 3. | Faltus T, Yuan J, Zimmer B, Kramer A, Loibl S, Kaufmann M, Strebhardt K. Silencing of the HER2/neu gene by siRNA inhibits proliferation and induces apoptosis in HER2/neu-overexpressing breast cancer cells. Neoplasia. 2004;6:786-795. [PubMed] |
| 5. | Perrimon N, Mathey-Prevot B. Applications of high-throughput RNA interference screens to problems in cell and developmental biology. Genetics. 2007;175:7-16. [PubMed] |
| 6. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] |
| 8. | Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science. 2002;296:550-553. [PubMed] |
| 10. | Paul CP, Good PD, Winer I, Engelke DR. Effective expression of small interfering RNA in human cells. Nat Biotechnol. 2002;20:505-508. [PubMed] |
| 11. | Wadhwa R, Kaul SC, Miyagishi M, Taira K. Know-how of RNA interference and its applications in research and therapy. Mutat Res. 2004;567:71-84. [PubMed] |
| 12. | Paddison PJ, Caudy AA, Bernstein E, Hannon GJ, Conklin DS. Short hairpin RNAs (shRNAs) induce sequence-specific silencing in mammalian cells. Genes Dev. 2002;16:948-958. [PubMed] |
| 13. | Willmore C, Holden JA, Layfield LJ. Correlation of HER2 gene amplification with immunohistochemistry in breast cancer as determined by a novel monoplex polymerase chain reaction assay. Appl Immunohistochem Mol Morphol. 2005;13:333-341. [PubMed] |
| 14. | Pietras RJ, Fendly BM, Chazin VR, Pegram MD, Howell SB, Slamon DJ. Antibody to HER-2/neu receptor blocks DNA repair after cisplatin in human breast and ovarian cancer cells. Oncogene. 1994;9:1829-1838. [PubMed] |
| 15. | Arteaga CL, Winnier AR, Poirier MC, Lopez-Larraza DM, Shawver LK, Hurd SD, Stewart SJ. p185c-erbB-2 signal enhances cisplatin-induced cytotoxicity in human breast carcinoma cells: association between an oncogenic receptor tyrosine kinase and drug-induced DNA repair. Cancer Res. 1994;54:3758-3765. [PubMed] |
| 16. | Levkowitz G, Waterman H, Ettenberg SA, Katz M, Tsygankov AY, Alroy I, Lavi S, Iwai K, Reiss Y, Ciechanover A. Ubiquitin ligase activity and tyrosine phosphorylation underlie suppression of growth factor signaling by c-Cbl/Sli-1. Mol Cell. 1999;4:1029-1040. [PubMed] |
| 17. | Cejka D, Losert D, Wacheck V. Short interfering RNA (siRNA): tool or therapeutic? Clin Sci (Lond). 2006;110:47-58. [PubMed] |