修回日期: 2007-10-10
接受日期: 2007-10-28
在线出版日期: 2007-11-08
目的: 建立一种简单稳定、死亡率低的二步法大鼠原位小肠移植模型.
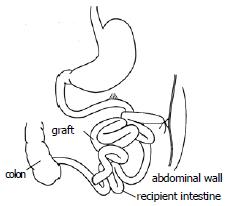
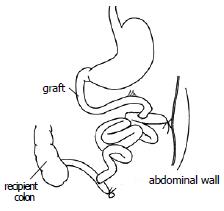
方法: 整块获取带肠系膜上动脉的腹主动脉和门静脉的全小肠, 血管重建采用供体腹主动脉和受体腹主动脉端侧吻合、供体门静脉和受体左肾静脉端套管吻合. 受体第一步手术时, 供肠远端端侧吻合于受体的末端回肠, 已结扎的供肠近端固定于右侧腹壁(不做腹壁造口). 7 d后行第2步手术, 自Tritze韧带下1 cm到回肠吻合口上1 cm切除受体小肠, 受体空肠残端端侧吻合于供肠近端.
结果: 共进行二步法大鼠原位小肠移植手术174次, 正式实验44次, 手术成功率90.9%. 受体第1次手术时间约50±15 min, 其中动脉吻合时间约为20±5 min, 静脉吻合时间2±1 min, 受体第2次手术时间约35±15 min. 4只大鼠死于第一次手术后5 d内, 2只死于肠瘘, 1只死于麻醉意外, 1只死于肠梗阻. 第2次术后没有大鼠死亡, 40只大鼠均长期存活(超过3 mo).
结论: 二步法大鼠原位小肠移植方法安全可靠, 并发症少, 生存率高.
引文著录: 朱亮, 李幼生, 黎介寿. 二步法大鼠原位全小肠移植模型的建立与改进. 世界华人消化杂志 2007; 15(31): 3272-3277
Revised: October 10, 2007
Accepted: October 28, 2007
Published online: November 8, 2007
AIM: To establish a simple and stable model of orthotopic small intestinal transplantation in rats that minimizes mortality.
METHODS: The graft removed en bloc consisted of the entire small intestine, portal vein and donor aortic segment, along with the superior mesenteric artery. The graft was perfused in situ and the gut lumen was irrigated during the operation. Revascularization was accomplished by end-to-side anastomosis of the graft aortic segment to the prepared recipient aorta, and by the formation of a cuff anastomosis between the donor portal vein and the recipient left renal vein. In the first part of the two-stage procedure, the distal end of the graft was anastomosed to the side of the distal ileum, and the proximal end was fixed to the abdominal wall. Seven days after heterotopic transplantation, the second procedure was performed. The native small intestine above the jejunojejunostomy was resected and the distal end was closed. The proximal end was end-to-side anastomosed to the proximal end of the graft.
RESULTS: A total of 174 intestinal transplantations were performed in rats, 44 of which were in the formal experimental group, with a survival rate of 90.9%. The time for recipient surgery was 50 ± 15 min. The average time for the arterial and venous anastomoses was 20 ± 5 min and 2 ± 1 min, respectively. The average time for the two-stage surgical procedure was approximately 35 ± 15 min. Four rats died within 5 d of the first operation. These technical failures were due to anesthesia complications, intestinal fistula and intestinal obstruction. No rats died after the second operation. Forty animals survived for > 3 mo.
CONCLUSION: The two-stage orthotopic intestinal transplantation technique used in this study allows graft recovery from ischemic damage, the avoidance of life-threatening intestinal anastomotic complications, and increases survival rate.
- Citation: Zhu L, Li YS, Li JS. Establishment of two-step orthotopic small intestinal transplantation in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(31): 3272-3277
- URL: https://www.wjgnet.com/1009-3079/full/v15/i31/3272.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i31.3272
小肠移植是治疗终末期小肠功能衰竭(不能维持中心静脉营养的小肠功能不全)的理想方法[1-3]. 由于小肠为体内最大的淋巴库和细菌库, 移植免疫反应较其他脏器移植更为剧烈和复杂, 在排斥移植物的同时肠源性感染时有发生, 从而严重制约小肠移植应用[4-5]. 动物模型在促进小肠移植的临床应用中起重要作用[6-7]. 大鼠是最常用的动物模型, 大鼠异位小肠移植模型(heterotopic intestinal transplantation HIT)首先由Monchik et al[8]于1971年建立, 用于移植小肠的免疫学研究. 手术操作简单, 死亡率低是这种模型的主要优点, 不足之处是不符合生理解剖, 存在废用性的移植肠黏膜萎缩和吸收功能低下. 一步法大鼠原位小肠移植模型(orthotopic intestinal transplantation OIT)由Kort et al[9]于1973年建立, 是移植小肠生理学研究的最佳模型. 这种模型的高死亡率使他的应用远不及HIT. 我们建立了一种简单、安全的二步法大鼠原位全小肠移植模型, 同传统的一步法OIT相比, 二步法OIT可减少手术并发症和死亡率, 有利于移植小肠从缺血再灌注损伤中恢复, 使OIT的手术成功显著提高.
供、受体均选用健康成年♂近交系清洁级Wister大鼠, 体质量220-260 g, 由中国科学院上海实验动物中心提供, 术前经过至少5 d时间适应环境并单独喂养水和食物. 手术时按照供体体质量略小于受体的原则配对. 术前供受体均置于代谢笼内禁食过夜, 自由饮水. 术前采用戊巴比妥40 mg/kg和阿托品0.1 mg/kg ip麻醉, 术中动物如苏醒, 可追加戊巴比妥初始剂量的1/2.
1.2.1 动物模型的制作及标本采集: 供体手术: 供体麻醉后于背部皮下注射葡萄糖生理盐水10 mL, 术中不予静脉补液, 取腹部大"十"字形切口入腹, 在髂血管分叉以上血管夹夹闭腹主动脉和下腔静脉, 游离带肠系膜上动脉的腹主动脉段, 至回肠末端1 cm以下切除全部结肠, 结扎并切断脾静脉、幽门静脉, 在门静脉和肠系膜上动脉夹角间, 分离并结扎肠引流淋巴管, 门静脉的右缘缝标记线, 游离门静脉至肝门. Treitz韧带以下1 cm切断空肠, 将肠管理顺, 肠腔用含5 g/L的新霉素乳酸林格液5 mL灌洗, 两端结扎. 自左肾下腹主动脉向近心端插入22GA静脉套管针直达肠系膜上动脉开口处, 结扎预置在腹主动脉上的5-0丝线, 用含103 U/L肝素的冰乳酸林格氏液5 mL灌洗血管床, 速度用微量泵(B.Braun, Melsungen AG, Germany)控制在40 mL/h, 将碎冰屑倒在小肠上快速降温, 紧贴肝脏下缘剪断门静脉以便灌洗液流出, 至小肠系膜苍白, 门静脉断端流出液清亮, 迅速取下供肠及带肠系膜上动脉段、门静脉置于4℃乳酸林格氏液中. 结扎腹主动脉远端, 修整好腹主动脉近端, 将预先做好的cuff管套于门静脉上并将门静脉末段翻转覆盖在cuff管上, 调整好两者的位置, 使静脉套管的柄部恰好位于门静脉的背侧, 用7-0丝线妥善结扎固定.
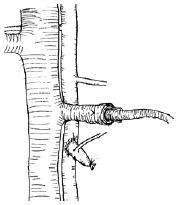
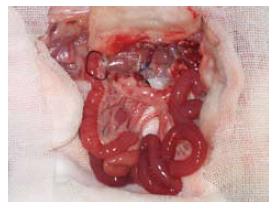
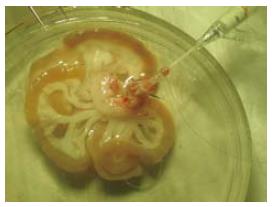
1.2.2 受体手术: 在供体手术结扎幽门静脉后, 助手进行受体手术, 取腹部正中直切口, 进腹后将小肠推向右上方, 钝性分离并游离出肾下腹主动脉约1 cm以备吻合, 将左侧输尿管结扎切断,分离、结扎左肾动脉, 用显微血管夹夹闭左肾静脉起始部, 靠近肾门用7-0缝线将肾静脉间隔120度缝3针作牵引, 于3针以远剪断左肾静脉移去肾脏. 此时, 术者已将供肠修整完毕, 术者用改良李氏钳[27]纵形夹闭肾下腹主动脉, 剪出一椭圆形缺口, 大小与供肠腹主动脉动脉口径相似. 将供肠调整好血管方向后置于自制的保存袋中移入术野, 行带肠系膜上动脉的腹主动脉与受体腹主动脉的端侧吻合, 先将供肠用置于术者的右侧, 9-0医用无损伤缝线缝合动脉吻合口上、下两端, 然后连续缝合吻合动脉吻合口的左侧, 再将供肠用置于术者的左侧, 吻合动脉吻合口的右侧, 共约16-18针, 吻合口周围用生物蛋白胶封闭. 动脉吻合完毕后, 将供肠门静脉插入受体左肾静脉, 检查确认血管无扭曲后用7-0丝线结扎妥善固定(图1). 依次打开肾静脉止血夹、李氏钳, 检查动静脉吻合口无渗血后, 剪去保存袋, 依次开放左肾静脉、供肠腹主动脉恢复供肠血液灌注, 即见肠系膜上动脉搏动明显, 移植肠迅速恢复红润(图2), 立即用温盐水行移植肠复温. 理顺供肠肠管顺序, 将其置于受体右侧腹腔, 用7-0丝线将供肠末端回肠端侧吻合于受体回肠末段, 将末端已经结扎的供肠近端固定在左侧腹壁上, 不做腹壁造口(图3). 异位移植1 wk后行二步法大鼠原位小肠移植第2步, 再次入腹后, 自Tritze韧带下1 cm远端至距回肠吻合口上1 cm将受体大部分空回肠切除近端, 受体回肠残端结扎, 空肠残端和已结扎的供肠近端行端侧吻合(图4).
1.2.3 术后管理: 第1步手术后, 大鼠苏醒后自由进水、进食; 第2步手术后, 术后24 h内大鼠进食糖盐水, 次日流质饮食, 3 d后恢复正常饮食, 术后不用免疫抑制剂, 存活超过7 d者视为手术成功. 术后观察一般状况及体质量. 两次手术后大鼠均单笼饲养, 室温控制在25℃左右.
共进行大鼠异位全小肠移植手术174次. 其中预实验阶段行130次, 正式实验阶段44次, 手术成功率分别为48.6%和90.9%. 在预实验阶段动物的死亡原因主要是麻醉意外, 动脉吻合口血栓, 大出血, 肠瘘, 肠梗阻等. 正式实验中4例动物分别死于麻醉意外1例, 吻合口瘘2例, 肠梗阻1例. 大鼠小肠移植手术由两人配合完成, 耗时约175±15 min. 其中供体手术时间约60±10 min; 供肠修整8±3 min; 受体第1次手术时间约50±15 min, 其中移植肠冷缺血时间(动脉冷灌注开始至恢复血液供应的时间)约为30±5 min, 动脉吻合时间约为20±5 min, 静脉吻合时间2±1 min, 受体第2次手术时间约35±15 min.
自Monchik于1971年首次建立大鼠小肠移植模型以来, 先后建立了各种各样模型, 但均分成异位小肠移植(HIT)和原位小肠移植(OIT). HIT模型由于死亡率低(19.7%)被广泛用于移植小肠的免疫学研究[10-11]. 但一些研究显示HIT的移植肠, 通透性高、运动功能减低, 加重排斥反应[12-14]. Schroeder et al[15-16]发现移植小肠长时间异位将导致黏膜萎缩和吸收功能下降. Schweizer et al[17]发现HIT后移植小肠黏膜明显萎缩, 隐窝深度及绒毛高度减少. 将异位小肠移植于原位后, 结果所有关于黏膜的指标都恢复到正常. HIT导致移植小肠萎缩和吸收功能低下的原因是由于缺乏胃肠道内营养素的刺激. 异位小肠移植由于没有消化液的刺激, 存在明显的废用性萎缩, 而且异位小肠移植至少需要一个腹壁造口, 通常两个腹壁造口, 易发生粪便污染. 在肠黏膜萎缩的基础上存在细菌污染, 使HIT细菌易位明显多于OIT[18]. 细菌易位会导致肠源性感染, 进而刺激细胞因子的产生, 从而诱发或加重排斥反应, 而排斥反应发生又会加重感染, 形成恶性循环. 因此即使用于免疫学方面的研究, HIT也有明显缺陷[19]. 近来国外有关小肠移植免疫学方面的研究也趋向都采用OIT模型[20-21], 而有关移植小肠生理学方面的研究大多采用OIT模型[22-24].
OIT恢复肠道的连续性, 有利于肠黏膜修复, 减少细菌移位, 从生理角度看OIT是最好的模型. 1973年Kort et al建立的经典一步法OIT由于受体的手术创伤大, 致死性肠道并发症多(20%), 死亡率高达32.5%, 大大限制了这种模型的应用. 随着显微外科的进步和围手术期循环维持技术的提高, 很多学者对一步法OIT进行了改进[25-27], 死亡率得以下降. 但在实验研究中, 一步法OIT仍被高吻合口并发症和早期死亡率所困扰. 因此, 一些学者采用二步法大鼠原位小肠移植模型, 同传统的一步法OIT相比, 二步法OIT能减少致死性的肠道并发症和手术创伤, 并有利于移植小肠从缺血再灌注损伤中恢复, 使OIT的手术成功显著提高[28-30]. Yoo et al[31]异位移植术后3 d行原位移植, 一步法OIT和二步法OIT的长期存活率分别为40%和70%. Kitagawa et al[32]认为二步法OIT和一步法OIT肠功能恢复没有显著差异, 但二步法OIT死亡率显著低于一步法OIT. 我们为进一步提高生存率(90.9%), 保证移植物术后功能, 减少并发症, 对二步法原位小肠移植技术做了如下改进: (1)手术行2人操作. 冷缺血时间控制在40 min以内, 这部分受体术后均能顺利存活下来. 冷缺血时间超过60 min则受体术后难以苏醒. 说明冷缺血时间过长是影响手术成功率的主要因素. 冷缺血时间过长影响供肠质量和移植物术后功能的恢复, 同时影响受体下肢血液循环. 在恢复血流后热缺血期间组织内积聚的大量代谢产物和再灌注时产生的大量炎性介质、溶酶体酶进入血液循环, 对心脏泵血机能和血管调节机能均产生不利影响. 我们在手术时采用2人操作, 加快了分离结扎操作时的速度, 减少了手术时间, 更重要的是在术者进行供体手术后半程时, 助手可进行受体开始阶段的手术; 而单人操作时则必须先取下供肠放入冷保存液中再进行受体手术. 2人操作能显著的减少供肠的冷缺血保存时间(减少20 min), 缩短至30±5 min. (2)肠吻合行端侧吻合. 移植小肠由于去神经和缺血再灌注损伤, 术后运动功能变化明显, 移植小肠和受体残余小肠运动不协调, 这是OIT肠吻合口并发症高于HIT的原因. Kort报道吻合口瘘和梗阻达20%. 我们在肠吻合时供肠上下均采用端侧吻合技术(图3-4), 使肠运动不协调时吻合口产生的张力减小. 另外在每次关腹前均将肠吻合口置于腹腔最上面, 保证出现吻合口并发症时大网膜可包裹吻合口. 上述这些措施减少了OIT后至死性的肠吻合口并发症(正式实验时致死性肠道并发症5%). (3)动脉吻合口应用生物蛋白胶. 大鼠的血容量约为70 mL/kg体质量, 一次性失血达15 mL/kg即可发生低血容量性休克. 受体大鼠在血管吻合前不会有太多出血, 但是在血管吻合完成、开放移植肠血供之后, 由于吻合口出血和移植肠血管床开放将造成血容量相对不足. 动脉吻合口出血虽可通过温盐水棉球压迫止血, 但由于实际操作中动脉开放前静脉已吻合, 操作较困难, 效果不确实, 压迫过程中(1-2 min)受体亦有失血. 吻合口出血可能和吻合前血管用肝素冲洗有关, 而压迫止血的原理是在缝针处形成小的血栓. 基于上述原因, 本研究在动脉吻合后应用生物蛋白胶(可对抗肝素, 促进止血)封闭动脉吻合口1 wk, 结果发现开放血流后动脉吻合口周围无渗血和漏血, 不必压迫止血. (4)血管吻合时应用自制的保存袋放置移植肠. 在进行血管吻合时, 通常用冰盐水纱布保护移植肠置入腹腔. 为防止腹腔升高冰盐水纱布的温度, 需更换冰盐水纱布或间歇给于冰盐水. 这一方面增加手术时间, 同时也难以保证整个吻合过程中移植肠各处始终处于4℃以下, 加之冰盐水会降低受体体温增加手术创伤, 而且较大的冰盐水纱布也会妨碍手术操作. 我们在血管吻合时, 供肠放置在自制的保存袋当中(图5), 保存袋中有未溶解的冰块使供肠始终处于低温保存状态, 几乎没有(2±1 min)温缺血时间(移植肠离开冷保存液之后到血供恢复之间的时间), 而温缺血时间同移植肠术后功能的恢复是相关的, 同时保存袋同腹腔之间隔以纱布也防止了受体体温的下降. 另外, 由于供肠在保存袋中, 吻合中移动供肠方便并可保证移动中无触摸技术. (5)其他改进. 供体手术时, 进入腹腔后首先同时夹闭髂血管以上的主动脉和下腔静脉, 可改善内脏器官的血液灌注. 供体手术时, 在门静脉、肠系膜上动脉夹角内寻找和结扎肠引流淋巴管, 有利于减少术后肠淋巴瘘. 供体主动脉穿刺置管时, 使用静脉套管针代替头皮针或硅胶管, 可减少血管内皮损伤, 开始灌注时在拔出管芯可防止置管时的血液反流. 血管冲洗时应用套管针代替平针头可减少内皮损伤, 并可避免平针头刺破很薄的门静脉和肾静脉(图6). 在两步法大鼠原位小肠移植第1步(暂时性异位小肠移植期间)采用无腹壁造口技术(供肠近端结扎固定于腹壁, 远端和受体回肠端侧吻合), 可减少造口相关的并发症和粪便对移植肠的污染(图3). (6)血管重建采用供体门静脉和受体左肾静脉端端套管吻合. 这种静脉回流方式可避免阻断下腔静脉导致的对受体血流动力学的影响, 但这种方法须切除左肾, 体循环回流不符合生理解剖[33-35], 也是这种模型的不足之处.
总之, 本试验建立的二步法大鼠原位小肠移植, 可缩短移植肠冷保存时间, 减少血管吻合口和肠吻合口并发症, 能提高手术成功率, 是进行小肠移植研究的简单、安全、可靠的动物模型.
小肠移植是治疗终末期小肠功能衰竭的理想方法, 但由于解剖、生理等方面的独特性, 使小肠移植的发展落后于肾脏、肝脏和心脏等其他器官移植. 动物模型在促进小肠移植的临床应用中起重要作用. 狗、猪、鼠等动物模型的建立, 已用于进行小肠移植的研究, 由于大鼠遗传背景明确、饲养环境和条件容易控制, 其实验结果也具有较强的科学性和可比性等因素, 因此大鼠是小肠移植研究的最常用的动物模型.
自Mo-nchik于1971年首先建立大鼠小肠移植模型以来, 出现了各种各样模型, 这些模型能简化手术操作, 缩短了移植肠冷保存时间, 减少血管吻合口和肠吻合口并发症, 提高手术成功率, 减少早期死亡率, 保证移植物术后功能, 是小肠移植模型研究的热点、重点.
1973年Kort建立的经典一步法OIT由于受体的手术创伤大, 致死性肠道并发症多(20%), 死亡率高达32.5%, 大大限制了这种模型的应用. Yoo et al研究异位移植术后3 d行原位移植, 一步法OIT和二步法OIT的长期存活率分别为40%和70%.
大鼠异位小肠移植的模型技术简单、死亡率低, 但不符合生理, 长时间异位将导致黏膜萎缩、细菌移位和吸收功能下降. 经典的一步法原位小肠移植受体的手术创伤大, 致死性肠道并发症多, 死亡率高. 本研究创新的建立了一种改进的, 更加安全的二步法大鼠原位小肠移植模型, 即可保证原位移植, 又使受体手术创伤减少, 而且在暂时性异位移植期间, 移植小肠有时间从缺血再灌注等损伤中恢复, 因此术后严重的肠吻合并发症减少, 提高了原位小肠移植的成功率(90.9%).
本文建立的二步法大鼠原位小肠移植, 符合生理, 可缩短移植肠冷保存时间, 减少血管吻合口和肠吻合口并发症, 提高了手术成功率, 是进行小肠移植研究的简单、安全、可靠的动物模型.
冷缺血时间: 动脉冷灌注开始至恢复血液供应的时间. 温缺血时间, 移植物离开冷保存液之后到血供恢复之间的时间.
本文选题新颖, 设计合理, 动物试验工作量大, 结果提出了一些改进动物模型的体会, 对小肠移植动物实验研究具有参考价值.
编辑: 何燕 电编:郭海丽
| 1. | Ruiz P, Kato T, Tzakis A. Current status of tran-splantation of the small intestine. Transplantation. 2007;83:1-6. [PubMed] |
| 2. | Beath SV. Closure and summary of Ninth International Small Bowel Transplantation Symposium. Transplant Proc. 2006;38:1657-1658. [PubMed] |
| 4. | Braun F, Broering D, Faendrich F. Small intestine transplantation today. Langenbecks Arch Surg. 2007;392:227-238. |
| 5. | 朱 亮, 李 宁, 李 幼生, 李 元新, 李 维勤, 朱 维铭, 刘 放南, 倪 小东, 曹 斌, 李 为苏. 肝肠移植术后的代谢调控治疗. 肠外与肠内营养. 2004;11:143-146. |
| 6. | Li Y, Zhu L, Li J. Absorption of orthotopically transplanted intestine in rats: evaluation of amino acid absorption. Transplant Proc. 2006;38:1827-1829. [PubMed] |
| 7. | Yin ZY, Ni XD, Jiang F, Li N, Li YS, Li JS. Modified technique for combined liver-small bowel transplantation in pigs. World J Gastroenterol. 2003;9:1625-1628. [PubMed] |
| 8. | Monchik GJ, Russell PS. Transplantation of small bowel in the rat: technical and immunological considerations. Surgery. 1971;70:693-702. [PubMed] |
| 9. | Kort WJ, Westbroek DL, MacDicken I, Lameijer LD. Orthotopic total small bowel transplantation in the rat. Eur Surg Res. 1973;5:81-89. [PubMed] |
| 10. | Fandrich F, Schroder J, Jahnke T, Waaga AM, Pawaresch MR, Wacker HH. Migration and activation pattern of specialized dendritic cells after heterotopic small bowel transplantation in a graft-versus-host model of the rat. Front Biosci. 1997;2:b1-11. [PubMed] |
| 11. | Gasser M, Prange K, Schroeder P, Stoffregen C, Eckstein V, Deltz E. Host vs graft and graft vs host reactions after allogeneic heterotopic small bowel transplantation in the rat. Transplant Proc. 1992;24:1128-1129. [PubMed] |
| 12. | Li Y, Li J, Jiang J, Li N, Wang X, Wang Z, Wu B, Liu F. Glycyl-glutamine-supplemented long-term total parenteral nutrition selectively improves structure and function in heterotopic small-bowel autotransplantation in the pig. Transpl Int. 2003;16:866-871. [PubMed] |
| 13. | Nakao A, Tahara K, Inoue S, Tanaka N, Kobayashi E. Experimental models of small intestinal trans-plantation in rats: orthotopic versus heterotopic model. Acta Med Okayama. 2002;56:69-74. [PubMed] |
| 14. | Grant D, Zhong R, Hurlbut D, Garcia B, Chen HF, Lamont D, Wang PZ, Stiller C, Duff J. A comparison of heterotopic and orthotopic intestinal transplantation in rats. Transplantation. 1991;51:948-954. [PubMed] |
| 15. | Schroeder P, Deltz E, Seifert J, Sandforth F, Thiede A. Absorptive capacity of the transplanted small bowel. Gut. 1987;28 Suppl:275-279. [PubMed] |
| 16. | Schroeder P, Sandforth F, Gundlach M, Deltz E, Thiede A. Functional adaptation of small intestinal mucosa after syngeneic and allogeneic orthotopic small bowel transplantation. Transplant Proc. 1989;21:2887-2889. [PubMed] |
| 17. | Schweizer E, Gundlach M, Gassel HJ, Deltz E, Schroeder P. Effects of two-step small bowel transplantation on intestinal morphology and function. Transplant Proc. 1991;23:688. [PubMed] |
| 18. | Guo WH, Tian L, Dallmann MJ, Tam PK. Comparative study of allograft survival of heterotopic and orthotopic small bowel trans-plantation in rat. Transplantation. 2003;75:1895-1897. [PubMed] |
| 19. | Heeckt PF, Halfter WM, Schurer B, Schraut WH, Beger HG, Bauer AJ. Heterotopic intestinal transplantation aggravates the insult of chronic rejection. Transplantation. 1998;65:354-362. [PubMed] |
| 20. | Chen Y, Li X, Tian L, Lui VC, Dallman MJ, Lamb JR, Tam PK. Inhibition of sonic hedgehog signaling reduces chronic rejection and prolongs allograft survival in a rat orthotopic small bowel transplantation model. Transplantation. 2007;83:1351-1357. [PubMed] |
| 21. | Koshiba T, Van Damme B, Kitade H, Rutgeerts O, Tanaka K, Waer M, Pirenne J. Induction of tolerance by donor-specific blood transfusion in a model of intestinal transplantation: technical and immunological aspects. Transplant Proc. 2002;34:1033-1039. [PubMed] |
| 22. | Salehi P, Zhu LF, Sigurdson GT, Jewell LD, Churchill TA. Nutrient-related issues affecting successful experimental orthotopic small bowel transplantation. Transplantation. 2005;80:1261-1268. [PubMed] |
| 23. | Kastl S, Muller V, Kotschenreuther U, Radespiel-Troeger M, Hohenberger W, Erben RG. Effect of orthotopic small bowel transplantation on mineral metabolism in an experimental model. Br J Surg. 2005;92:764-771. [PubMed] |
| 24. | Syzmula von Richter TP, Baumeister RG. Clinical observation of intestinal transplantation with microsurgical lymphatic vessel and nerve reconstruction in the allogeneic orthotopic rat model. Transplant Proc. 1998;30:2607-2608. [PubMed] |
| 25. | Nakao A, Ogino Y, Tahara K, Uchida H, Kobayashi E. Orthotopic intestinal transplantation using the cuff method in rats: a histopathological evaluation of the anastomosis. Microsurgery. 2001;21:12-15. [PubMed] |
| 26. | Soin AS, Friend PJ. A modification to improve technical success rate of small bowel transplantation in rats. Transplant Proc. 1996;28:2722. [PubMed] |
| 27. | Zhong R, Grant D, Sutherland F, Wang PZ, Chen HF, Lo S, Stiller C, Duff J. Refined technique for intestinal transplantation in the rat. Microsurgery. 1991;12:268-274. [PubMed] |
| 28. | Nakai K, Hamada Y, Kato Y, Kitagawa K, Hioki K, Ito S, Okumura T. Further evidence that epidermal growth factor enhances the intestinal adaptation following small bowel transplantation. Life Sci. 2004;75:2091-102. [PubMed] |
| 29. | Anveden-Hertzberg L, Sonnino RE. Impaired survival and growth in immunosuppressed young rats with lethal short gut syndrome and a small bowel transplant: an effect of cyclosporine. J Pediatr Surg. 1995;30:1004-1008; discussion 1008-1009. [PubMed] |
| 30. | Galvao FH, Bacchella T, Cerqueira Machado M. Teaching intestinal transplantation in the rat for medical student. Microsurgery. 2007;27:277-281. [PubMed] |
| 31. | Yoo CH, Suh KW, Kim JH. Experimental orthotopic intestinal transplantation with temporary heterotopic implantation in the rat. Transplant Proc. 1998;30:3443-3445. [PubMed] |
| 32. | Kitagawa K, Hamada Y, Nakai K, Kato Y, Okumura T. Comparison of one- and two-step procedures in a rat model of small bowel transplantation. Transplant Proc. 2002;34:1030-1032. [PubMed] |
| 33. | Galvao FH, Santos RM, Neto AB, Machado MA, Bacchella T, Machado MC. Small bowel and colon transplantation in rats using porto-portal cuff anastomosis. Transplant Proc. 2006;38:1842-1843. [PubMed] |
| 34. | Hernandez F, Zou Y, Lopez G, Romero M, Martinez L, Gonzalez-Reyes S, Garcia A, Pena P, Lopez Santamaria M, Tovar JA. Is portal venous outflow better than systemic venous outflow in small bowel transplantation? Experimental study in syngeneic rats. J Pediatr Surg. 2005;40:336-340. [PubMed] |
| 35. | Berney T, Kato T, Nishida S, Tector AJ, Mittal NK, Madariaga J, Nery JR, Cantwell GP, Ruiz P, Tzakis AG. Portal versus systemic drainage of small bowel allografts: comparative assessment of survival, function, rejection, and bacterial translocation. J Am Coll Surg. 2002;195:804-813. [PubMed] |