修回日期: 2007-08-18
接受日期: 2007-08-28
在线出版日期: 2007-10-28
目的: 建立定量检测及监测乙肝病毒DNA的rtM204I/V(YMDD)及rtL180M变异的方法.
方法: 以克隆、测序鉴定及构建乙肝病毒DNA YMDD及变异(YIDD和YVDD)质粒作为标准, 4例接受拉米夫定治疗(100 mg/d, 疗程48 wk以上)的慢性乙型肝炎患者血清标本为对象, 用焦磷酸测序的方法检测变异位点核苷酸的频率, 并计算变异株的含量比例, 通过检测不同变异株类型的标准质粒, 确定测序峰图的背景信号.
结果: 通过检测标准质粒后, 确定背景信号为5%, 变异位点调整后的核苷酸频率转化为变异病毒株的比例后, 4例患者治疗前均检测出变异的病毒株(4.5%-33%), 并且随治疗时间延长呈增多的趋势. 病毒载量及ALT分析提示基因型耐药发生后, 将发生病毒学反跳及临床耐药.
结论: 焦磷酸测序可以定量检测及动态监测变异病毒株的含量. 拉米夫定耐药突变株在拉米夫定治疗前已存在, 并随治疗时间的增加而增长, 出现病毒学反弹及临床耐药.
引文著录: 田国保, 席宏丽, 田地, 崔建军, 于敏, 陆海英, 曾争. 拉米夫定治疗慢性乙型肝炎中变异病毒株的动态变化. 世界华人消化杂志 2007; 15(30): 3245-3250
Revised: August 18, 2007
Accepted: August 28, 2007
Published online: October 28, 2007
AIM: To use pyrosequencing to establish a method for monitoring hepatitis B virus mutants resistant to lamivudine.
METHODS: Plasmids cloned, sequenced and constructed from the lamivudine-resistant HBV mutants at rtM204I/V (YMDD motif) and rtL180M were used as a standard. The frequencies of mutation-site nucleotides were detected by pyrosequencing in sera from 4 patients who underwent lamivudine therapy. HBV DNA with rtM204I, rtM204V and wildtype plasmids were constructed for subtracting the background signal frequencies.
RESULTS: The frequency of background signals in all plasmids were between 0.1% and 3.9%, The frequency of background signals was determined as 5%. In all 4 patients, HBV variations were detected from 4.5% to 33% before lamivudine therapy. Virological breakthrough was monitored for 4 to 8 months along with the gradually increasing HBV variations at positions of rtM204I/V and rtL180M.
CONCLUSION: Pyrosequencing is an effective method to quantify and monitor HBV variations during lamivudine therapy. HBV lamivudine-resistant mutants exist before lamivudine treatment and gradually increase during treatment, and then virological breakthrough and clinical resistance occur.
- Citation: Tian GB, Xi HL, Tian D, Cui JJ, Yu M, Lu HY, Zeng Z. Dynamics of hepatitis B virus variations during lamivudine treatment. Shijie Huaren Xiaohua Zazhi 2007; 15(30): 3245-3250
- URL: https://www.wjgnet.com/1009-3079/full/v15/i30/3245.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i30.3245
拉米夫定作为第一个获批准国际公认的po抗乙肝病毒(HBV)药物, 其问世推动了慢性乙型肝炎治疗的进程. 然而随着治疗时间的延长(6 mo以后), 其DNA聚合酶的基序酪氨酸-蛋氨酸-天冬氨酸-天冬氨酸(YMDD)(rtM204I/V)变异的发生率逐渐增高达到14%-32%(1年)、38%(2年)、49%(3年)及66%(4年)[1], 并且常伴随其上游位点rtL180M的变异[2]. 有研究表明未经拉米夫定治疗的HBV感染者血清中可检测HBV的YMDD变异的病毒株[3], 而且治疗后常常表现为变异株与野生株的共生. 目前尚无满意的定量检测变异株的方法. 我们通过采用焦磷酸测序(pyrosequencing)分析变异位点的核苷酸频率, 以乙型肝炎病毒(HBV)聚合酶区(rtM204I/V及rtL180M)为研究位点, 动态观察4例拉米夫定治疗的慢性乙型肝炎患者体内变异病毒株的动态变化情况.
4例慢性乙型肝炎患者均为北京大学第一医院的就诊者, 均为男性, 诊断标准符合2005年慢性乙型肝炎防治指南标准, 并排除其他原因如甲型、丙型及戊型肝炎病毒所致肝脏损害. 4例患者都服用拉米夫定(用法: 100 mg, 1次/d)至少48 wk, 治疗中定期进行肝脏功能检查、血清学检查(HBeAg和anti-HBe, 美国Abbott AxSYM)及HBV DNA定量检测(罗氏Cobas Amplicor HBV monitor), 并作详细记录. 留取血清标本, 保存于-20℃冰箱.
1.2.1 血清HBVDNA的提取: 采用QIAgen全血基因组提取试剂盒(德国Qiagen公司), 操作按试剂盒说明书进行.
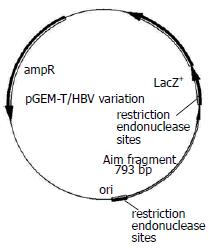
1.2.2 标准质粒的构建: 以3例被DNA测序法证明分别为YMDD、YIDD及YVDD的HBV DNA为模板, PCR产物(793 bp)经琼脂糖凝胶电泳鉴定后, 采用DNA胶回收试剂盒(TIANGEN DNA gel extraction kit(中国北京天根生化科技有限公司)纯化, 而后与pGEM-T载体(pGEM-T vector ligation assay(Promega, USA))连接并转化感受态的大肠杆菌, 接种于含有氨苄青霉素的培养皿中, 37℃, 16 h. 每个培养皿随机挑选8个克隆接种于5 mL LA细菌培养基中进行增菌培养, 提取质粒(E.Z.N.A plasmid miniprep kit(Omega))后, 用引物P1和P2进行PCR扩增后, 测序鉴定. 引物P1(5'CTCWSCCATATCGTCAATC3' W = A/T, S = C/G, 106-124 bp)和P2(5'AACTYCCAATTACATATCCC3' Y = C/T, 879-898 bp).
1.2.3 焦磷酸测序: (1)测序前PCR扩增: 以上述试剂盒提取的HBV DNA为模板, 以引物P3(5'ACAAAACCTWCGGACGGA 3'W = A or T, 572-589 bp)和P4(5'Biotin- SAAAGGGACTCAAGATGT 3'S = C or G, 774-791 bp, 5'端生物素标记)扩增片段包括rtM204I/V及rtL180M位点的片段(220 bp). 扩增体系: 2.5 µL dNTP, 5 µL 10×Buffer(含有1.5 mmol/L MgCl2), 1 µL Primer, 0.5 µL Hotstart Taq DNA聚合酶(5 U/µL TaKaRa大连宝生物工程有限公司), 4 µL模板和36 µL ddH2O, 总体系50 µL. 扩增条件: 94℃ 5 min预变性, 而后94℃ 30 s、55℃ 20 s和72℃ 20 s, 50个循环, 最后72℃ 10 min充分延伸. 最后扩增片段用20 g/L琼脂糖凝胶电泳鉴定. (2)单链DNA模板的准备: 将PCR产物转移至96孔PCR板, 加45 µL 1×结合缓冲液(10 mmol/L Tris-HCl、2 mol/LNaCl、1 mmol/L EDTA和1 mL/L Tween20)和4 µL链霉素磁珠(10 g/L, Dynabeads M280-链霉素磁珠), 1400 r/min离心30 min, 充分摇动混匀. 被固定在磁珠上PCR产物先后在750 mL/L乙醇、0.5 mol/L NaOH(变性使之变成单链)、复性缓冲液(20 mmol/LTris-Acetate、5 mmol/L MgAc)及ddH2O中分别洗涤1 min. (3)测序引物杂交: 测序引物P5(5'-AGTGGGCCTCAGTCCGTTTC-3'645-664 bp, 针对rtL180M位点)或P6(5'CTGTYTGGCTTTCAGT3' Y = C or T, 720-735 bp, 针对rtM204I/V位点)和单链DNA模板随磁珠转入45µL复性缓冲液(含测序引物10 µmol/L), 在80℃杂交3 min, 冷却至室温. (4)利用PSQ96MA测序仪(中科奥华基因组研究所有限公司提供)和SNP通用试剂盒(Pyrosequencing AB公司, 瑞典), 按仪器和试剂盒说明书进行PCR产物SNP的焦磷酸测序, 分别检测rtL180M位点(CTG)及rtM204I/V位点(TATATGGATGAT)中变异位点的核苷酸频率.
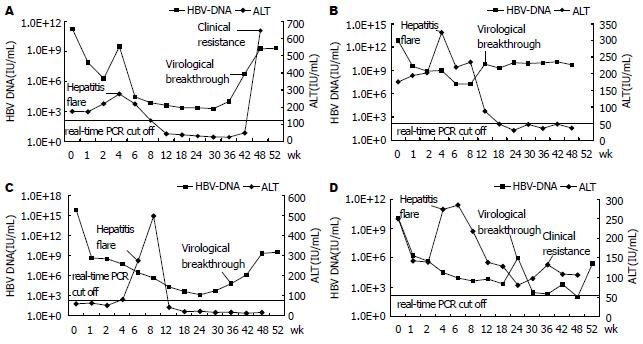
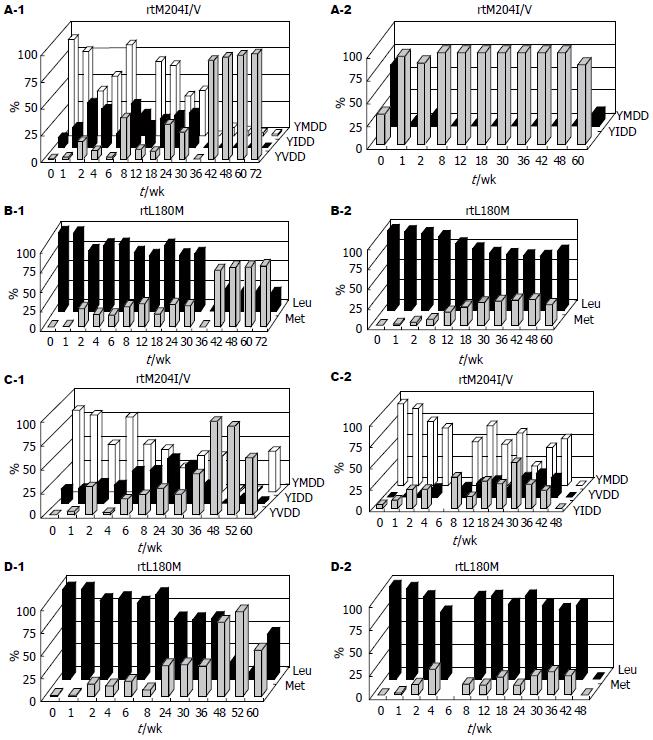
4例慢性乙型肝炎患者在接受拉米夫定治疗后, HBV DNA在1-2 wk后病毒核酸部分应答, 4-8 wk后出现一过性的ALT升高, 而后伴随着HBV DNA的进一步下降和ALT的复常或下降(部分应答). 然而治疗18-36 wk后不同程度上均发生了HBV DNA的反跳(virological breakthrough, 病毒学反弹), 伴随或不伴随ALT的再次升高(clinical resistance, 临床耐药)(图1). 4例患者从治疗开始到结束, 持续HBeAg(+)及HBeAb(-), 均未发生血清学转换.
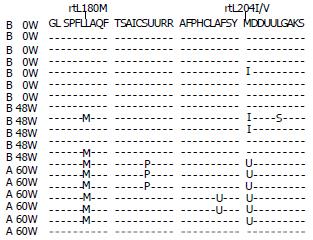
构建质粒的示意图如图2, 挑选18个克隆后, 质粒测序鉴定结果如图3. 由图3看出, 患者(B)治疗前血清中可检测到变异病毒株(1/7).
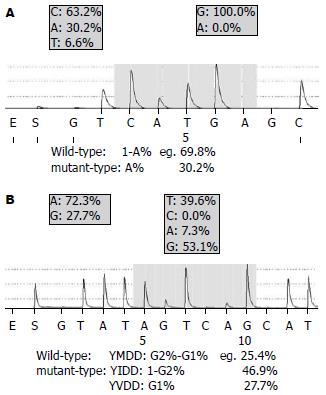
通过检测代表不同变异类型的标准质粒, 结果显示背景峰核苷酸频率在0.1%-3.9%之间. 为了增加特异性, 确定5%为测序背景信号峰核苷酸频率, 也就是说碱基频率分析的敏感性可以达到5%. 因为用α-硫化的三磷酸腺苷(dATPαS)替代三磷酸腺苷(dATP)后, 尽管可以有效地被DNA聚合酶利用而不被虫荧光素识别, 但是核苷酸"A"的信号峰会偏高, 所以频率分析软件计算"A"的频率时默认把"A"的峰值乘86%后, 重新计算"A"的频率.
rtL180M位点(CTG)和rtM204I/V位点(TATATGGATGAT)调整后, 核苷酸频率如图4所示. 既然编码密码子已知为: Leu(CTG和TTG)、Met(ATG)、Ile(ATT、ATC及ATA)和Val(GTG), 那么把核苷酸频率转化为变异株比例为: rtL180M位点, 野生株所占比例为1-A%, 变异株所占比例为A%; rtM204I/V位点, YMDD所占比例为G2%-G1%, YIDD所占比例为1-G2%, YVDD所占比例为G1%(图4).
按上述计算4例慢性乙型肝炎患者在接受拉米夫定治疗时的血清中变异病毒株比例后, 4例患者治疗前血清中均可检测出变异的病毒株(4.5%-33%). 随着治疗时间的延长, 变异病毒株的比例呈增多的趋势(图5). 结合临床资料(病毒载量及ALT)分析, 基因型耐药发生后, 发生的病毒学反跳及临床耐药在时间上不尽一致, 提示可能与其他因素有关, 如变异病毒株本身的复制能力及机体的免疫力状态等.
1995年拉米夫定作为临床上较早而且广泛应用的口服抗HBV的药物, 能够迅速降低患者血清中HBV DNA的载量, 并且患者耐受性较好. 然而随着治疗时间的延长, 病毒耐药的问题越来越突出. 值得注意的是拉米夫定治疗后发生的耐药变异常常为变异株和野生株共生, 即变异病毒株的载量不同或变异病毒株在共生的总病毒中所占的比例不同产生对变异界定的差异(国外有学者以共生病毒中变异株>5%定义为发生了变异), 从而影响变异发生后对治疗应答的判断. 因此, 对耐药变异的诊断, 包括有无变异, 变异病毒株载量及所占比例等, 是当前迫切需要解决的问题[4-5].
目前, 定量检测变异病毒株的方法主要有探针杂交(line probe hybridization)[6]、实时扩增突变阻止系统PCR(real-time amplification refractory mutation system PCR)[7]以及聚合酶链式反应(PCR)扩增、克隆、鉴定及测序[8]等. 但是上述方法可能存在如敏感性低(线性探针敏感性为为变异株>10%以上才检测出)且操作烦琐等问题. 焦磷酸测序(pyrosequencing)是由4种酶催化的同一反应体系中的酶级联化学发光反应, 每一轮测序反应依次只加入一种dNTP, 若该dNTP与模板配对, 聚合酶就可以将其掺入到引物链中并释放出等摩尔数的焦磷酸基团(PPi). PPi可最终转化为可见光信号, 并由PyrogramTM转化为一个峰值, 然后加入下一种dNTP, 继续DNA链的合成. 因为每个峰值的高度与反应中掺入的核苷酸数目成正比, 所以在遗传多态性关联研究中, 该技术常常与DNA池(DNA pooling)技术相结合, 来研究不同组DNA池中的等位基因频率. 有研究证实该方法检测的核苷酸频率与实际的核苷酸频率相关性达97%-99%, 敏感性达2%[9]. 因为测序过程可能会有一定的背景信号峰, 本实验通过检测构建的纯代表野生株或变异株的标准质粒, 结果显示背景峰核苷酸频率在0.1%-3.9%之间. 为了增加特异性, 确定5%为测序背景信号峰核苷酸频率, 也就是说核苷酸频率分析的敏感性可以达到5%. 另外该技术具有不用制胶、不需要荧光染料和同位素标记、高通量、快速(96个/10 min)、结果直观等优点.
应用拉米夫定治疗后, 出现变异病毒株的机制有两种学说. 一是选择学说, 即自然状态下就存在处于劣势的对拉米夫定不敏感的变异病毒株. 拉米夫定治疗中野生株迅速受到抑制, 而变异病毒株逐渐转变为优势病毒株, 目前多数学者支持此学说. 本实验的4例慢乙肝患者治疗前均可检测到变异病毒株(4.5%-33%), 与国外学者[7-8]采用其他方法研究的结果一致. 另一是诱导学说, 如国内学者[10]采用治疗前克隆(20个克隆/份标本)测序的方法, 未检测到变异病毒株, 尽管不能排除诱导出现变异的可能, 我们认为可能与挑选的克隆数较少(国外学者挑选30个克隆/份标本)及标本中变异病毒株所占的比例较低(可能<5%)有关. 本实验结合临床资料(总病毒载量及ALT)分析显示, 随着治疗时间的延长, 变异病毒株的比例呈增多的趋势. 但是基因型耐药发生后, 发生的病毒学反跳及临床耐药在时间上不尽一致, 可能与变异病毒株本身的复制能力(治疗前变异病毒株比例及类型等)[11]及机体的免疫力状态等有关, 有待于进一步研究.
随着核苷(酸)类似物抗HBV的治疗以来, HBV耐药的问题越来越突出, 而目前无比较满意的监测HBV耐药突变的方法.
国外学者分别通过探针杂交、荧光定量PCR及挑选多个克隆测序的办法, 动态观察了变异病毒的存在变化, 但以上方法有其自身的缺点.
探讨新的敏感的定量检测变异病毒株的方法是当前耐药研究的热点之一, Pyrosequencing方法及其技术是目前低-中通量检测DNA突变位点的定量方法之一. 本文应用此技术和方法进行HBV耐药株的动态监测.
本文应用较先进的焦磷酸测序, 通过检测变异位点的核苷酸频率来定量观察了变异病毒株的变化, 方法快速、准确而且结果直观.
本文建立的焦磷酸测序方法, 可以对变异病毒株进行定量, 有潜在的临床应用价值.
本文语言表达比较流畅, 研究方法新颖, 贴近临床实际, 为进一步研究HBV耐药性问题提供了一条思路, 具有一定的科学性和实用性.
编辑: 李军亮 电编:郭海丽
| 1. | Lai CL, Dienstag J, Schiff E, Leung NW, Atkins M, Hunt C, Brown N, Woessner M, Boehme R, Condreay L. Prevalence and clinical correlates of YMDD variants during lamivudine therapy for patients with chronic hepatitis B. Clin Infect Dis. 2003;36:687-696. [PubMed] |
| 2. | Allen MI, Deslauriers M, Andrews CW, Tipples GA, Walters KA, Tyrrell DL, Brown N, Condreay LD. Identification and characterization of mutations in hepatitis B virus resistant to lamivudine. Hepatology. 1998;27:1670-1677. [PubMed] |
| 3. | Kobayashi S, Ide T, Sata M. Detection of YMDD motif mutations in some lamivudine-untreated asymptomatic hepatitis B virus carriers. J Hepatol. 2001;34:584-586. [PubMed] |
| 6. | Pas SD, de Man RA, Fries E, Osterhaus AD, Niesters HG. The dynamics of mutations in the YMDD motif of the hepatitis B virus polymerase gene during and after lamivudine treatment as determined by reverse hybridization. J Clin Virol. 2002;25:63-71. [PubMed] |
| 7. | Punia P, Cane P, Teo CG, Saunders N. Quantitation of hepatitis B lamivudine resistant mutants by real-time amplification refractory mutation system PCR. J Hepatol. 2004;40:986-992. [PubMed] |
| 8. | Pallier C, Castera L, Soulier A, Hezode C, Nordmann P, Dhumeaux D, Pawlotsky JM. Dynamics of hepatitis B virus resistance to lami-vudine. J Virol. 2006;80:643-653. [PubMed] |
| 9. | Gruber JD, Colligan PB, Wolford JK. Estimation of single nucleotide polymorphism allele frequency in DNA pools by using pyrosequencing. Hum Genet. 2002;110:395-401. [PubMed] |
| 11. | Lee CH, Kim SO, Byun KS, Moon MS, Kim EO, Yeon JE, Yoo W, Hong SP. Predominance of hepatitis B virus YMDD mutants is prognostic of viral DNA breakthrough. Gastroenterology. 2006;130:1144-1152. [PubMed] |