修回日期: 2007-10-06
接受日期: 2007-10-28
在线出版日期: 2007-10-28
目的: 观察实验性大鼠肝硬化形成过程中, 肝组织TGF-β1, Smad3, Smad7水平的动态变化, 研究三者在肝硬化发生过程中的作用及机制.
方法: 以SD大鼠为实验对象, 于实验开始时处死6只大鼠作为wk 0正常对照组, 剩余大鼠, 600 mL/L四氯化碳3 mL/kg, sc, 2次/wk, 复制肝硬化动物模型. 于wk 3, 6, 9, 12各处死一批大鼠, 用RT-PCR检测动物肝组织中TGF-β1, TGF-β RⅡ的mRNA表达水平, Western blot检测肝组织中Smad3, Smad7蛋白水平, 免疫组织化学方法检测动物肝组织中TGF-β1的表达和定位.
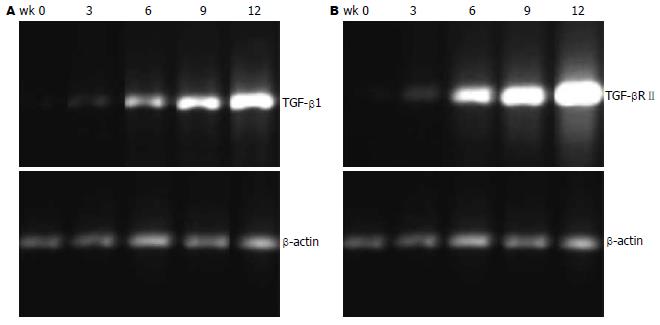
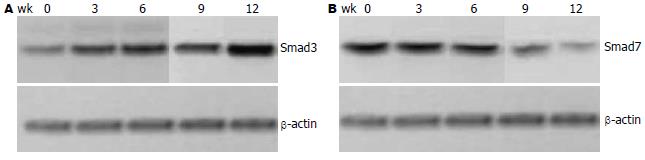
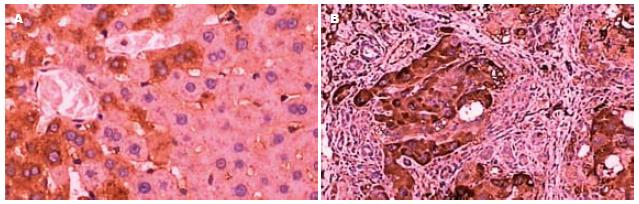
结果: 正常肝组织中有少量TGF-β1, TGF-β RⅡ的mRNA表达. 随着肝纤维化及肝硬化的形成, 模型组wk 0, 3, 6, 9, 12, TGF-β1, TGF-β RⅡ和Smad3表达量分别逐渐递增(TGF-β1: 0.19±0.12, 0.29±1.02, 0.89±0.23, 0.98±0.77, 1.7±1.00; TGF-β RⅡ: 0.30±0.22, 0.49±0.16, 1.02±0.33, 1.51±0.72, 2.14±1.02; Smad3: 0.44±0.24, 0.84±0.69, 1.10±0.16, 1.40±0.12, 1.75±1.05), Smad7表达量呈逐渐减少(1.35±0.12, 1.09±0.78, 1.14±0.31, 1.11±0.91, 0.74±1.21). 正常肝组织TGF-β1可见少量表达, 主要在中央静脉周围肝细胞中. 随着肝纤维化及肝硬化的形成, TGF-β1表达增强(P<0.01).
结论: 随着肝硬化的形成, 肝脏中TGF-β1, TGF-β RⅡ和Smad3表达增加, Smad7表达下降.
引文著录: 俞蕾敏, 吕宾, 李善高, 斯淑英. 大鼠肝硬化形成过程中肝组织TGF-β1, Smad3, Smad7水平动态的变化. 世界华人消化杂志 2007; 15(30): 3163-3167
Revised: October 6, 2007
Accepted: October 28, 2007
Published online: October 28, 2007
AIM: To observe changes in transforming growth factor (TGF)-(r)1, Smad3 and Smad7 during liver fibrosis, and to study their role hepatic tissue during the formation of experimental liver cirrhosis in rats.
METHODS: Male rats were divided into control group and model group. Control: Six male rats were killed at the beginning of the experiment as the week 0 group. Model: The surplus rats was injected subcutaneously 600 mL/L CCl4 in oil two times per week at the dosage of 3 mL/kg body weight. The rats were sacrificed after 3, 6, 9 and 12 wk. Expression of mRNA for TGF-β1 and TGF-β receptor Ⅱ (TGF-β RⅡ) in rat liver was detected by reverse transcription-polymerase chain reaction (RT-PCR), and Smad3 and Smad7 were determined by Western blotting. Meanwhile, the level of TGF-β1 was measured by immunocytochemistry.
RESULTS: TGF-β1 mRNA, TGF-β RⅡ mRNA and Smad3 at 3, 6, 9 and 12 wk were expressed in low amounts in the normal liver tissue, and were increased after CCl4 treatment, while Smad7 at the same point was decreased (TGF-β1, 0.19 ± 0.12, 0.29 ± 1.02, 0.89 ± 0.23, 0.98 ± 0.77, 1.7 ± 1.00; TGF-β RⅡ, 0.30 ± 0.22, 0.49 ± 0.16, 1.02 ± 0.33, 1.51 ± 0.72, 2.14 ± 1.02; Smad3, 0.44 ± 0.24, 0.84 ± 0.69, 1.10 ± 0.16, 1.40 ± 0.12, 1.75 ± 1.05; Smad7, 1.35 ± 0.12, 1.09 ± 0.78, 1.14 ± 0.31, 1.11 ± 0.91, 0.74 ± 1.21). TGF-β1 was expressed at a low level in the portal vein of the normal liver. It was up-regulated in rats after CCl4 treatment (P < 0.01).
CONCLUSION: During hepatic fibrosis induced by CCl4 in rats, expression of TGF-β1, TGF-β RⅡ and Smad3 was increased, while Smad7 was decreased. The mechanism may be that TGF-β1 causes liver fibrosis by increasing Smad3 and decreasing Smad7.
- Citation: Yu LM, Lv B, Li SG, Si SY. Expression of transforming growth factor-b1, Smad3 and Smad7 in experimental liver cirrhosis in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(30): 3163-3167
- URL: https://www.wjgnet.com/1009-3079/full/v15/i30/3163.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i30.3163
肝纤维化是诸多慢性肝病向肝硬化发展的必经病理阶段, 此期尚可逆转. 阻止和逆转肝纤维化, 是防止肝硬化发生, 改善肝脏疾病预后的关键. 但目前国内外对肝纤维化发生的机制仍然不十分清楚. 研究表明, 转化生长因子TGF-β1在肝纤维化发展过程中具有活化肝星状细胞(hepatic stellate cell, HSC), 促进胶原蛋白基因表达, 增加细胞外基质(extrocellular matrix, ECM)合成与沉积, 抑制ECM降解等作用, 是肝纤维化最重要的始动因子之一[1], 其通过TGF-Smad信号转导通路发挥作用. 我们以四氯化碳诱导肝纤维化大鼠为模型, 探讨TGF-β1, Smad3蛋白, Smad7蛋白在肝纤维化过程中可能作用及机制.
清洁级SD♂大鼠46只, 体质量180-220 g, 购自中国科学院上海实验动物中心, 饲养于浙江中医药大学动物实验中心. 四氯化碳分析纯, 由武汉化学试剂公司出品, 临用前用过滤后的中性菜籽油稀释, 配成600 mL/L的溶液. RT-PCR和Western blot所用试剂: 羊抗大鼠Smad3, Smad7, TGF-β1, TGF-βRⅡ抗体, 均由美国Santa Cruza公司提供. TRIzol试剂、逆转录试剂盒购置于Invitrogen公司, PVDF膜购置于美国Milipore公司, 其余试剂购置于上海生物有限公司. 免疫组化试剂: TGF-β1一抗购自北京中杉晶金桥公司, 二抗由上海仪涛生物仪器有限公司提供.
于实验开始时随机抽取6只作为wk 0正常对照组. 剩余大鼠分为正常组和模型组, 模型组大鼠600 mL/L四氯化碳3 mL/kg, sc, 每周2次,复制肝硬化动物模型; 正常组大鼠同等条件下饲养, 不做任何处理. 于实验wk 3, 6, 9, 12分别随机抽取正常组2只, 模型组8只大鼠处死. 实验结束时, 模型组除wk 12大鼠因肝功能衰竭死亡2只外(不计入数据统计), 余大鼠均存活. 至wk 12, 存活大鼠经病检证实均形成肝硬化. 处死前12 h禁食, 处死时均经戊巴比妥钠麻醉后(50 mg/kg)切开腹腔, 取肝组织部分置40 g/L甲醛中固定, 石蜡包埋, 连续3 μm切片, 行免疫组化检测. 部分于液氮中保存, 以备提取mRNA和蛋白质.
1.2.1 RT-PCR检测肝组织中TGF-β1和TGF-β RⅡ: 按照TRIzol试剂盒说明书提取肝脏组织总RNA, 再按RT-PCR试剂盒说明书逆转录得 cDNA. 合成的引物序列, 扩增条件及产物见表1. 以β-actin为内参照, PCR反应产物置15 g/L琼脂糖凝胶电泳检测.
| 名称 | 序列 | 扩增长度 |
| TGF-β1 | 正向引物:5'-CACCATCCATGACATGAACC-3' | 404 bp |
| 反向引物:5'-TCATGTTGGACAACTGCTCC-3' | ||
| 扩增条件:94℃, 30 s; 56℃, 30 s, 72℃, 30 s; 32 | 循环 | |
| TGF-β RII | 正向引物:5'-GCTTAGACACGACAACATCC-3' | 345 bp |
| 反向引物:5'-CCAATGTCCAGGTAATCGCT-3' | ||
| 扩增条件:94℃, 30 s; 60℃, 30 s, 72℃, 30 s; 30 | 循环 |
1.2.2 Western blot检测肝组织中Smad3和Smad7的蛋白水平: 取肝脏组织, 按照1:2(m/V)加入组织提取液(mmol/L: EDTA 20, EGTA 10, PMSF 1, Urea 2, DTT和aprotinin 0.2 kg/L的TBS缓冲液, pH7.6), 冰浴超声匀浆, 15 000 r/min 4℃离心5 min, 取上清液进行乙醇沉淀. Bradford法测定总蛋白量. 每孔加样量为20 μg蛋白, 然后进行SDS-PAGE(凝胶浓度为85 g/LT, 27 g/LC)分离, 电转移至PVDF膜, 取出膜放到T-TBS(含50 g/L脱脂奶粉)室温封闭2 h, 然后T-TBS漂洗, 加入Rabbit Anti-Hsp70/Hsc70 polyclonal Antibody (以1:20 000溶于T-TBS), 4℃孵育过夜. T-TBS漂洗, 再加入anti-Rabbit lgG(Fc) alkaline phosphatase conjugate(以1:5000溶于T-TBS), 室温2 h, 最后加入显色底物NBT/BCIP, 室温暗处显色, TE缓冲液终止反应.
1.2.3 免疫组化法检测肝组织中TGF-β1的表达: 采用二步法(EnVision系统), 基本工作程序为: 脱蜡, 水化组织片; 预处理组织切片, 酶修复或热修复; 蒸馏水漂洗, 置于PBS中; 滴加30 mL/L H2O2阻断内源性过氧化物酶, 孵育10 min; 蒸馏水漂洗, 置于PBS中, 一抗孵育30 min, TPS漂洗10 min, EnVision TM孵育30 min, TBS漂洗10 min, 色源底物溶液DAB孵育, 光镜控制, 蒸馏水漂洗, 复染或封片. (1)阳性细胞≤5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分; (2)阳性强度: 无色为0分, 淡黄色为1分, 黄色为2分, 棕黄色为3分. 将(1), (2)两者积分相乘, 0分为阴性(-), 1-4分为弱阳性(+), 5-8分为阳性(++), 9-12分为强阳性(+++).
统计学处理 计量资料采用mean±SD表示, 以SPSS11.0统计分析程序对计量资料进行单因素方差分析, P<0.05为差异有统计学意义.
随着肝纤维化及肝硬化的形成, wk 0, 3, 6, 9, 12表达量逐渐递增(表2, 图1A-B).
随着肝纤维化及肝硬化的形成, Smad3在wk 0, 3, 6, 9, 12表达量逐渐递增(P<0.01); Smad7在wk 0, 3, 6, 9, 12表达量呈逐渐减少(表2, 图2A-B).
肝纤维化的发生是复杂的过程, 其本质是细胞外基质ECM成分在肝内的异常沉积. 活化的肝星状细胞HSC是肝纤维化细胞外基质的主要来源细胞. HSC由正常静止状态被激活, 转变成肌纤维样细胞(myofibrblast-like cell, MFBS)和成纤维细胞(fibroblast)是肝纤维化发生的中心环节. 转化生长因子β是目前公认最重要的致肝纤维化的细胞因子之一[2], 其中TGF-β1是激活HSC的主要因子, 可促进活化后肌纤维母细胞过表达ECM, 并抑制其降解, 也有间接促ECM增殖作用. 在细胞外基质降解失常为主要致病机制的肝纤维化疾病的形成过程中, TGF-β1起关键作用[3]. 李蕾 et al[4]证实, TGF-β1可导致HSC骨架改变, 增加细胞迁移. 我们的实验研究表明, 随着CCl4诱导时间的延长及肝纤维化程度的加重, 肝组织中TGF-β1 mRNA, TGF-βRⅡ mRNA表达呈递增趋势. 免疫组化方法检测大鼠肝组织TGF-β1表达, 也取得了表达增强的结果. 目前认为TGF-β1在所有类型的细胞中均以无活性形式合成和分泌, 在体内通过二硫健结合后激活, 并与其效应细胞上的受体结合发挥作用[5], 即活化后与细胞膜表面Ⅱ型受体结合, 形成复合物, 然后再与Ⅰ型受体结合, 形成异四聚体结构, 并与TGF-β1结合. Ⅱ型受体自磷酸化, 进而磷酸化Ⅰ型受体, 使之激活具有激酶活性. 激活Smads蛋白并形成复合物, 由此转入核内, 与各种转录因子结合, 调控基因转入. Smads蛋白是目前所知唯一的Ⅰ型受体胞内底物, 介导TGF-β1的胞内信号转导, 是TGF-β家族信号从受体到核的细胞内转导分子[6-7]. Smad3是膜受体激活的Smad(R-Smad), 可被活化的TβRⅠ磷酸化[8]. Smad7是TGF-Smad信号转导通路的抑制因子, 是细胞中TbRⅠ型受体丝氨酸/苏氨酸激酶的拮抗蛋白[9], 能牢固的与TbRⅠ型受体结合, 完全阻断TGF-β的信号转导[10]. 本实验证实, 随着肝纤维化程度的加重, 肝组织中Smad3蛋白的表达呈递增趋势, Smad7蛋白则表达下降.
由此推测, 在慢性肝损伤发生时, 各种始发的致病因子触发机体TGF-β1表达上调, 激活TGF-Smad信号转导通路, 使Smad3蛋白的合成增加, 同时抑制Smad7蛋白的表达, 于是触发HSC活化, 转变成肌纤维样细胞和成纤维细胞, 使ECM成分在肝内异常沉积, 最终促进肝纤维化. Jiang et al[11]将反义重组TβRⅠ和TβRⅡ质粒转入载体, 然后分别注射到肝纤维化大鼠体内, 结果显示两者都可减少体内TGF-β, 使肝内羟脯氨酸, Ⅰ, Ⅲ型胶原的含量较对照组减少, 减轻肝脏纤维化. 近年来报道一些中西药物如培哚普利[12]、粉防己碱[13]、红景天甙[14]、金三莪术[15]均可通过影响TGF-Smad信号转导通路, 达到抗纤维化目的. 因此, 阻止此信号转导通路, 将成为防治肝纤维化的一个新的手段.
肝纤维化是诸多慢性肝病向肝硬化发展的必经病理阶段, 阻止和逆转肝纤维化, 是防止肝硬化发生, 改善肝脏疾病预后的关键. 近年来发现, TGF-β1是肝纤维化最重要的始动因子之一, 具有活化肝星状细胞, 促进胶原蛋白基因表达, 增加细胞外基质合成与沉积, 抑制ECM降解等作用, 其通过TGF-Smad信号转导通路发挥作用.
Heldin et al报道, TGF-β1在细胞外基质降解失常为肝纤维化疾病的形成过程中主要致病机制. 李蕾et al证实, TGF-β1可导致HSC骨架改变, 增加细胞迁移. Derynck et al及Calabrese et al认为, Smads蛋白是目前所知唯一的Ⅰ型受体胞内底物, 介导TGF-β1的胞内信号转导, 是TGF-β家族信号从受体到核的细胞内转导分子.
目前国内外对肝纤维化发生的机制仍然不十分清楚. 本文结果表明, 在慢性肝损伤发生时, 各种始发的致病因子触发机体TGF-β1表达上调, 激活 TGF-Smad信号转导通路, 使Smad3蛋白的合成增加, 同时抑制Smad7蛋白的表达, 于是触发HSC活化, 转变成肌纤维样细胞和成纤维细胞, 使ECM成分在肝内异常沉积, 最终促进肝纤维化.
本文目前还处于体外研究阶段, 但为TGF-β1, Smad3, Smad7在肝纤维化发生机制中的作用提供了实验依据, 如能阻止此信号转导通路, 可成为防治肝纤维化的一种新手段.
本文设计严谨, 方法成熟, 分析有据, 层次清楚, 具有较好的可读性和参考性.
编辑: 程剑侠 电编:马文华
| 2. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] |
| 3. | Heldin CH, Miyazono K, ten Dijke P. TGF-beta signalling from cell membrane to nucleus through SMAD proteins. Nature. 1997;390:465-471. [PubMed] |
| 5. | Lu JP, Mao JQ, Li MS, Lu SL, Hu XQ, Zhu SN, Nomura S. In situ detection of TGF betas, TGF beta receptor II mRNA and telomerase activity in rat cholangiocarcinogenesis. World J Gastroenterol. 2003;9:590-594. [PubMed] |
| 6. | Derynck R, Zhang YE. Smad-dependent and Smad-independent pathways in TGF-beta family signalling. Nature. 2003;425:577-584. [PubMed] |
| 7. | Calabrese F, Valente M, Giacometti C, Pettenazzo E, Benvegnu L, Alberti A, Gatta A, Pontisso P. Parenchymal transforming growth factor beta-1: its type II receptor and Smad signaling pathway correlate with inflammation and fibrosis in chronic liver disease of viral etiology. J Gastroenterol Hepatol. 2003;18:1302-1308. [PubMed] |
| 8. | Dennler S, Goumans MJ, ten Dijke P. Transforming growth factor beta signal transduction. J Leukoc Biol. 2002;71:731-740. [PubMed] |
| 9. | Tahashi Y, Matsuzaki K, Date M, Yoshida K, Furukawa F, Sugano Y, Matsushita M, Himeno Y, Inagaki Y, Inoue K. Differential regulation of TGF-beta signal in hepatic stellate cells between acute and chronic rat liver injury. Hepatology. 2002;35:49-61. [PubMed] |
| 10. | Mori Y, Chen SJ, Varga J. Expression and regulation of intracellular SMAD signaling in scleroderma skin fibroblasts. Arthritis Rheum. 2003;48:1964-1978. [PubMed] |
| 11. | Jiang W, Yang CQ, Liu WB, Wang YQ, He BM, Wang JY. Blockage of transforming growth factor beta receptors prevents progression of pig serum-induced rat liver fibrosis. World J Gastroenterol. 2004;10:1634-1634. [PubMed] |