修回日期: 2006-11-01
接受日期: 2006-11-16
在线出版日期: 2007-01-28
目的: 研究急性肝损伤时大鼠肝脏HO-1/CO系统的变化规律, 探讨HO-1和内源性CO的作用机制及其病理生理意义.
方法: 采用D-氨基半乳糖(GalN)和脂多糖(LPS)联合腹腔注射制备大鼠急性肝损伤模型, 动态测定各时间点(3, 6, 12, 24, 36 h)大鼠肝脏HO-1活性和蛋白表达情况, 测定肝脏CO浓度以及血清ALT, AST水平和肝组织SOD活性、MDA含量变化.
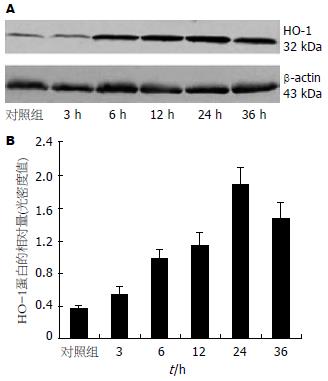
结果: GalN和LPS联合注射成功诱导了大鼠急性肝损伤, 表现为染毒24 h时大鼠血清ALT, AST水平以及肝组织MDA浓度显著升高(10872.5±708.5 nkat/L, 9246.8±814.7 nkat/L, 5.06±1.21 μmol/g vs 1043.5±247.4 nkat/L, 1278.6±273.8 nkat/L, 2.03±0.59 μmol/g, 均P<0.01), SOD活性明显下降(813.7±168.3 nkat/mg vs 1248.2±84.9 nkat/mg, P<0.01), HE染色显示肝细胞出现严重损伤. 染毒3-24 h大鼠肝脏HO-1活性明显增强, 6-24 h呈现一定的时间依赖方式(4.02±0.74, 5.97±1.51, 6.13±1.18 μmol/g vs 2.86±0.41 μmol/g); Western blot测定结果亦显示, HO-1蛋白表达显著增强, 24 h时明显高于正常对照组(1.87±0.39 vs 0.37±0.09, P<0.01). 正常大鼠肝脏的CO浓度极低, 染毒后以时间依赖方式开始升高, 并显著高于正常对照组(0.373±0.112, 0.474±0.152, 0.513±0.193 μmol/g vs 0.172±0.041 μmol/g, P<0.01), 这与HO-1表达情况相一致.
结论: 大鼠急性肝损伤时出现HO-1活性增加和蛋白表达持续上调以及CO浓度迅速增高, 提示HO-1/CO系统参与急性肝损伤的病理生理过程, 其表达增加可能对机体有重要调节作用.
引文著录: 吴煜, 李琳, 温韬, 李跃旗. 急性肝损伤大鼠肝脏血红素加氧酶-1/一氧化碳系统的变化及意义. 世界华人消化杂志 2007; 15(3): 228-233
Revised: November 1, 2006
Accepted: November 16, 2006
Published online: January 28, 2007
AIM: To investigate the changes of heme oxygenase-1 (HO-1) expression and carbon monoxide (CO) production in acute liver injury induced by D-galactosamine (GalN) and Lipopolysaccharide (LPS), and explore the role of HO-1/CO system in the pathogenesis of liver injury.
METHODS: GalN (700 mg/kg body weight) and LPS (50 μg/kg body weight) were used to establish the models of acute liver injury in male rats by intraperitoneal injection. Liver injury was assessed biochemically and histologically. HO-1 activity in liver homogenate was examined at different time points following GalN/LPS treatment and the expression of HO-1 protein was determined by Western blot. The activity of super oxide dismutase (SOD) and the content of malondialdehyde (MDA) in liver tissues were also examined at the same time.
RESULTS: Administration of GalN/LPS caused severe hepatic damage, characterized by significant elevation of serum alanine aminotransferase (ALT: 10872.5 ± 708.5 nkat/L vs 1043.5 ± 247.4 nkat/L, P < 0.01), aspartate aminotransferase (AST: 9246.8 ± 814.7 nkat/L vs 1278.6 ± 273.8 nkat/L, P < 0.01) levels and hepatic MDA content (5.06 ± 1.21 μmol/g vs 2.03 ± 0.59 μmol/g, P < 0.01) as well as a remarkable reduction of liver SOD activity (813.7 ± 168.3 nkat/mg vs 1248.2 ± 84.9 nkat/mg, P < 0.01) at 24 hours as compared with those in the control group. HO-1 activity was elevated significantly after modeling, showing a time-dependent manner from 6 to 24 hours (4.02 ± 0.74, 5.97 ± 1.51, 6.13 ± 1.18 μmol/g vs 2.86 ± 0.41 μmol/g), while expression of HO-1 protein was increased remarkably from 6 to 24 hours (24 h: 1.87 ± 0.39 vs 0.37 ± 0.09, P < 0.01), which was demonstrated by Western blot analysis. Endogenous CO concentration in the liver of control rats remained very low but was elevated significantly after GalN/LPS treatment (6, 12, 24 h: 0.373 ± 0.112, 0.474 ± 0.152, 0.513 ± 0.193 μmol/g vs 0.172 ± 0.041 μmol/g, P < 0.01), which was in accordance with the changes of HO-1.
CONCLUSION: HO-1 activity and protein as well as CO production are increased significantly in rats with acute liver injury induced by GalN/LPS, suggesting that HO-1/CO system plays an important role in the pathogenesis of acute hepatic damage.
- Citation: Wu Y, Li L, Wen T, Li YQ. Changes in expression of heme oxygenase-1 and production of carbon monoxide in rats with acute liver injury induced by D-galactosamine and lipopolysaccharide. Shijie Huaren Xiaohua Zazhi 2007; 15(3): 228-233
- URL: https://www.wjgnet.com/1009-3079/full/v15/i3/228.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i3.228
血红素加氧酶(heme oxygenase, HO)是催化血红素产生一氧化碳(CO)、胆红素和铁离子的一种限速酶. HO-1为诱导型, 又称为热休克蛋白32(HSP32), 可在氧化应激或其他病理因素的诱导下大量表达[1-5], 进而促进血红素分解代谢, 使内源性CO、胆红素等生成增加. 近年研究发现, HO-1/CO诱导表达参与机体多种组织器官的病理生理反应, 并可能有重要的细胞保护作用. 目前关于HO-1/CO系统在急性肝损伤过程中的确切变化尚不清楚, 本次研究采用D-氨基半乳糖(GalN)和脂多糖(LPS)联合腹腔注射制备大鼠急性肝损伤模型, 通过研究肝脏HO-1活性、蛋白表达和内源性CO浓度变化情况, 同时, 结合肝功能、氧化应激等指标, 拟系统探讨HO-1/CO系统在急性肝损伤发生机制中的可能作用及其病理生理意义, 以期为深入研究急性肝损伤的发生机制及干预等提供一定的理论依据.
健康♂Wistar大鼠, 体质量250-300 g(中国科学院动物研究所提供), 在恒温(25℃)、光照周期12-12 h环境中饲养1 wk后实验, 实验前12 h和实验期间禁食, 自由饮水. GalN、LPS、血晶素(hemin)、血红蛋白、NADPH、6-磷酸葡萄糖和6-磷酸葡萄糖脱氢酶等试剂均购自美国Sigma公司, 兔抗鼠HO-1多克隆抗体购自美国Santa Cruze公司. SOD和MDA试剂盒购自南京建成生物公司. 动物分组和模型制备: 随机将大鼠分为正常对照组和实验组, 实验组又按不同时间点分为3, 6, 12, 24, 36 h 5个亚组, 每组各5只. GalN临用前溶于生理盐水, 调pH值为7.2-7.4, 按700 mg/kg体质量给予大鼠腹腔注射; 同时配制LPS溶液, 按50 μg/kg剂量腹腔注射以诱发大鼠肝损伤反应. 在不同时间点取大鼠肝组织, 部分于40 g/L甲醛溶液固定, 石蜡包埋, 以制备组织切片; 另取部分新鲜肝组织拟测定HO-1活性和CO含量, 其余肝组织立即投入液氮冻存, 待制备组织匀浆; 同时采集大鼠股静脉血, 于3000 r/min离心10 min后留取上清-70℃冻存待测.
1.2.1 大鼠肝脏HO-1活性测定: 取新鲜肝组织, 采用超高速离心法提取肝组织微粒体并测定蛋白浓度(Bradford法); 冰浴下加入胆绿素还原酶、NADPH、6-磷酸葡萄糖、6-磷酸葡萄糖脱氢酶和血晶素, 充分混匀, 于37℃水浴, 避光反应20 min, 冰浴终止反应. 然后用双波长分光光度计测定A464和A530的吸光度差值, 最后根据公式计算HO-1活性.
1.2.2 采用Western blot测HO-1蛋白表达: 用细胞裂解液制备大鼠肝组织匀浆, 4℃高速离心后留取上清并进行蛋白定量; 取50 μg蛋白经SDS-PAGE电泳、转膜、封闭, 然后以兔抗鼠HO-1多克隆抗体(1:500稀释)进行孵育, PBST漂洗后以辣根过氧化物酶标记的羊抗兔IgG抗体(中山生物技术有限公司提供, 1:2000稀释)进行二抗反应. 最后在暗室中以ECL发光液(Pierce公司)进行显色、曝光, 并用Bio-Rad图像分析系统对所得区带进行扫描, 经b-actin校正后, 比较各组的积分光密度值.
1.2.3 大鼠肝组织的CO含量测定: 取新鲜肝组织, 用预冷PBS缓冲液冲洗后在冰浴条件下迅速匀浆; 取匀浆液加入血红蛋白溶液充分混匀, 再加入连二亚硫酸钠溶液混匀后静置10 min, 然后在分光光度计上测A564和A582的吸光度差值, 最后根据公式计算CO含量.
1.2.4 肝组织超氧化物岐化酶(SOD)和丙二醛(MDA)含量测定: SOD活性测定采用黄嘌呤氧化酶法, MDA含量测定采用硫代巴比妥酸法, 具体操作参见说明书进行.
1.2.5 血清ALT, AST测定: 采用全自动生化分析仪测定不同时间点大鼠血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)变化.
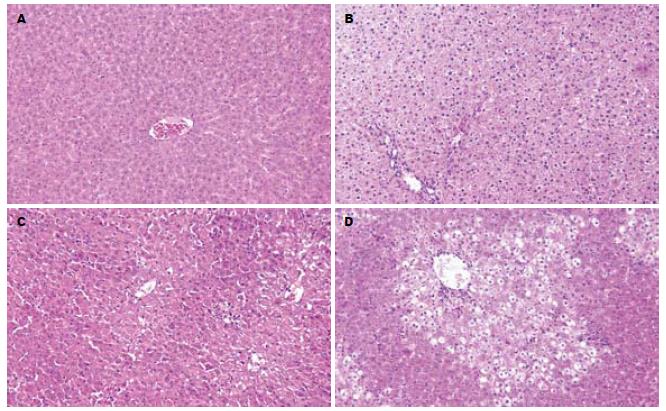
1.2.6 病理学变化: 以石蜡包埋的肝组织标本制备4 μm切片, HE染色, 光学显微镜下观察组织损伤情况.
统计学处理 所有数据以均数±标准差(mean±SD)表示, 以SPSS统计软件进行分析处理.
正常大鼠肝脏体积正常, 呈鲜红色, 表面光滑、边缘整齐, 组织切片显示肝细胞、汇管区、胆管上皮细胞等形态结构完整, 未见变性、坏死以及炎性细胞浸润等. 大鼠腹腔联合注射Ga1N/LPS后3 h, 即观察到有部分肝细胞出现胞质疏松化, 嗜酸变性等; 12-24 h肝损伤最为加重, 表现为肝组织结构紊乱, 大量肝细胞肿胀变性, 肝小叶内有不同程度的细胞凋亡及坏死, 汇管区可见大量炎性细胞浸润等(图1).
生化指标检测结果表明, 大鼠血清ALT, AST水平在给予Ga1N/LPS后3 h即开始升高, 24 h达高峰, 36 h时仍处于高水平, 和正常对照组相比差异十分显著. 同时大鼠肝组织SOD活性降低, MDA含量相应升高, 并随着时间延长肝损伤加重, 这种变化趋势更为明显, 和正常对照组相比差异亦十分显著(表1).
| 分组 | ALT (nkat/L) | AST (nkat/L) | SOD (nkat/mg) | MDA (μmol/g) |
| 对照组 | 1043.5±247.4 | 1278.6±273.8 | 1248.2±84.9 | 2.03±0.59 |
| 3 h | 1736.8±371.2b | 2314.3±421.8b | 1157.7±157.6 | 2.57±1.41 |
| 6 h | 7148.5±576.7b | 6902.6±581.7b | 975.4±173.1b | 4.43±1.37b |
| 12 h | 9754.8±672.9b | 8746.2±712.3b | 845.6±214.7b | 4.87±1.47b |
| 24 h | 10872.5±708.5b | 9246.8±814.7b | 813.7±168.3b | 5.06±1.21b |
| 36 h | 9024.7±698.3b | 8142.8±597.4b | 974.6±172.8b | 3.89±1.13b |
研究结果表明, 大鼠染毒3 h后肝脏HO-1活性即开始增强, 其变化呈一定的时间依赖方式, 并在6-36 h内均显著高于对照组, 差异有统计学意义(表2). 同时, Western blot测定结果显示, 正常大鼠肝脏有HO-1蛋白表达, 染毒3 h后HO-1蛋白表达开始增强, 24-36 h表达至高峰, 均显著高于正常对照组(图2).
在生理条件下大鼠肝脏中有CO生成, 但含量极低; 大鼠染毒后6-36 h内, 肝脏CO生成量均明显增加, 呈一定的时间依赖方式, 并显著高于正常对照组, 差异有统计学意义(表2).
HO是一种催化血红素的起始酶和限速酶, 有着重要的生物学作用. HO在体内主要有3种同工酶形式, 即HO-1, HO-2和HO-3; 这3种酶是不同基因的表达产物, 但均能作用于血红素, 将其分解产生相同摩尔数的生物活性分子: CO、胆红素和铁离子[1-5]. HO-1又称为热休克蛋白32, 是迄今为止发现的生物体内最容易被诱导产生的抗氧化酶; 大量研究表明, 凡能引起细胞活性氧水平增加的外来刺激, 或是导致细胞谷胱甘肽水平下降的因素, 如缺氧、高氧、重金属、内毒素等, 都可以使HO-1基因表达增加. HO-2在脑和前列腺中含量最高, 是生理条件下的主要存在形式; HO-3是近些年发现的另一种异构酶, 亦为组成型, 多种诱导因素均不能诱导其表达增高, 其具体生理特性还有待于进一步研究[6-10]. 近年来, HO-1/CO系统的生理特性受到广泛关注; 研究证实, HO-1在多种疾病发生、发展过程中大量表达, 对机体可产生保护作用, 有利于减少细胞死亡、蛋白质氧化及脂质过氧化等[11-15]. 本次实验采用GalN/LPS联合注射建立大鼠急性肝损伤模型, 探讨急性肝损伤时大鼠肝脏HO-1/CO系统的变化规律, 同时结合肝功能、氧化应激等指标, 以深入研究HO-1/CO系统在中毒性肝损伤发病中的地位及其调控机制.
目前认为, GalN/LPS联合应用所诱导的肝损伤模型与临床上病毒性肝炎的肝脏病理变化十分相似, 因此常用于研究肝损伤的发病机制和评估临床新药的疗效, 其损伤机制可能与GalN在细胞内与磷酸尿苷结合形成复合物, 致使磷酸尿苷耗竭, RNA和蛋白合成障碍, 进而导致肝细胞坏死有关[16-17]. 研究结果显示, 大鼠给予GalN/LPS后诱导了严重的肝脏损伤, 表现为血清ALT, AST水平显著升高, 组织病理学出现典型的肝细胞坏死表现等. 大鼠肝脏HO-1活性在染毒后6-36 h内均明显增强, 显著高于正常对照组, 差异有统计学意义; Western blot亦证实, 肝脏HO-1蛋白表达以一定的时间依赖方式明显增加, 和正常对照组相比差异十分显著, 这和HO-1活性的变化趋势相一致. 同时研究结果还表明, 大鼠肝脏CO在GalN/LPS染毒之后生成量明显增加, 与对照组相比差异显著, 其变化趋势和HO-1变化一致, 因而提示HO-1诱导表达可能是导致内源性CO水平升高的主要原因.
在应激状态下肝脏HO-1活性增加和蛋白表达上调, 对机体可能有重要保护作用, 这是因为HO-1催化血红素分解的三种产物均具有重要生理功能, 如胆红素具备抗氧化功能, 是有效的自由基清除剂; 铁能诱导产生铁蛋白与游离的铁结合, 减少氧化应激产生的自由铁, 从而中和其氧化毒性; 内源性CO则是一种更为重要的气体信使分子, 在体内具有广泛的生物学活性[18-22], 如CO不仅可通过直接舒张血管平滑肌细胞, 调节血管张力、维持血管紧张度, 还能参与神经递质的传递、氧应激、血小板的激活及松弛平滑肌等[22-25]. 大量生成的CO可通过自分泌或旁分泌方式扩散, 在肝脏的损伤过程中发挥重要的生理效应, 这将有利于提高机体防御反应, 减轻肝损伤, 因此是一正性因子.
目前有关HO-1/CO系统在急性肝损伤中被激活的具体机制尚不清楚, 有研究认为, 肝损伤时循环中细胞因子及内毒素增多可激活HO-1 mRNA翻译和蛋白表达[26-28]; 此外, 自由基生成增加可能也是诱导HO-1表达的另一重要因素[29-30], 这与本次研究中SOD(自由基清除剂)活性显著降低和MDA(脂质过氧化产物)含量增加的结果相吻合.
总之, HO-1/CO系统参与了大鼠急性肝损伤的病理生理过程; HO-1表达增加和CO水平升高可能有利于机体抗氧化应激作用, 其确切机制和作用途径值得深入探讨. 我们在以后的实验中将进一步研究HO-1抑制剂或激动剂对急性肝损伤的干预作用, 以及内源性CO或胆红素的临床应用价值等, 从而可为进一步探讨急性肝损伤的发病机制和临床干预等提供科学线索.
血红素加氧酶( H O ) 是催化血红素产生一氧化碳、胆红素和铁离子的一种限速酶, 其中HO-1为诱导型, 又称为热休克蛋白32, 可在氧化应激或其他病理因素的诱导下大量表达. 研究发现, HO-1/CO体系参与机体多种组织器官的病理生理反应, 并可能有重要的细胞保护作用, 是近年来的研究热点. 目前HO-1/CO体系在大鼠急性肝损伤过程中的动态变化尚未见报道.
大量研究显示, HO-1/CO体系具广泛的生物学效应, 参与机体各系统的病理生理反应; HO-1及其代谢产物CO、胆红素和铁离子等均可对机体产生保护作用, 有利于减少细胞死亡、蛋白质氧化及脂质过氧化等.
通过研究HO-1/CO体系的动态变化, 可初步阐明急性肝损伤发病过程中的一些分子机制, 并有利于在此基础上进一步深入探讨CO、胆红素等分解产物是否具备肝保护作用, 从而进一步 验证前面的研究, 并为临床干预等提供科学依据.
GalN/LPS联合诱导大鼠急性肝损伤与临床上病毒性肝炎的病理变化十分相似, 因此研究HO-1/CO体系在此模型中的动态变化, 将为深入探讨病毒性肝炎的损伤机制提供新的干预途径和研究思路, 并为今后临床上药物的开发应用提供重要线索. 本文设计合理, 方法较先进, 结论有意义.
电编: 张敏 编辑:张焕兰
| 1. | Kikuchi G, Yoshida T, Noguchi M. Heme oxygenase and heme degradation. Biochem Biophys Res Commun. 2005;338:558-567. [PubMed] |
| 2. | Zuckerbraun BS, Billiar TR. Heme oxygenase-1: a cellular Hercules. Hepatology. 2003;37:742-744. [PubMed] |
| 4. | Tosaki A, Das DK. The role of heme oxygenase signaling in various disorders. Mol Cell Biochem. 2002;232:149-157. [PubMed] |
| 5. | Fujii H, Takahashi T, Nakahira K, Uehara K, Shimizu H, Matsumi M, Morita K, Hirakawa M, Akagi R, Sassa S. Protective role of heme oxygenase-1 in the intestinal tissue injury in an experimental model of sepsis. Crit Care Med. 2003;31:893-902. [PubMed] |
| 6. | Nakahira K, Takahashi T, Shimizu H, Maeshima K, Uehara K, Fujii H, Nakatsuka H, Yokoyama M, Akagi R, Morita K. Protective role of heme oxygenase-1 induction in carbon tetrachloride-induced hepatotoxicity. Biochem Pharmacol. 2003;66:1091-1105. [PubMed] |
| 7. | Sass G, Seyfried S, Parreira Soares M, Yamashita K, Kaczmarek E, Neuhuber WL, Tiegs G. Cooperative effect of biliverdin and carbon monoxide on survival of mice in immune-mediated liver injury. Hepatology. 2004;40:1128-1135. [PubMed] |
| 8. | Brouard S, Otterbein LE, Anrather J, Tobiasch E, Bach FH, Choi AM, Soares MP. Carbon monoxide generated by heme oxygenase 1 suppresses endothelial cell apoptosis. J Exp Med. 2000;192:1015-1026. [PubMed] |
| 9. | Otterbein LE, Bach FH, Alam J, Soares M, Tao Lu H, Wysk M, Davis RJ, Flavell RA, Choi AM. Carbon monoxide has anti-inflammatory effects involving the mitogen-activated protein kinase pathway. Nat Med. 2000;6:422-428. [PubMed] |
| 10. | Ryter SW, Otterbein LE. Carbon monoxide in biology and medicine. Bioessays. 2004;26:270-280. [PubMed] |
| 11. | Wen T, Guan L, Zhang YL, Zhao JY. Dynamic changes of heme oxygenase-1 and carbon monoxide production in acute liver injury induced by carbon tetrachloride in rats. Toxicology. 2006;228:51-57. [PubMed] |
| 14. | Kim HS, Loughran PA, Kim PK, Billiar TR, Zuckerbraun BS. Carbon monoxide protects hepatocytes from TNF-alpha/Actinomycin D by inhibition of the caspase-8-mediated apoptotic pathway. Biochem Biophys Res Commun. 2006;344:1172-1178. [PubMed] |
| 15. | Sass G, Soares MC, Yamashita K, Seyfried S, Zimmermann WH, Eschenhagen T, Kaczmarek E, Ritter T, Volk HD, Tiegs G. Heme oxygenase-1 and its reaction product, carbon monoxide, prevent inflammation-related apoptotic liver damage in mice. Hepatology. 2003;38:909-918. [PubMed] |
| 16. | Tsuchihashi S, Fondevila C, Kupiec-Weglinski JW. Heme oxygenase system in ischemia and reperfusion injury. Ann Transplant. 2004;9:84-87. [PubMed] |
| 17. | Zuckerbraun BS, McCloskey CA, Gallo D, Liu F, Ifedigbo E, Otterbein LE, Billiar TR. Carbon monoxide prevents multiple organ injury in a model of hemorrhagic shock and resuscitation. Shock. 2005;23:527-532. [PubMed] |
| 18. | Fondevila C, Shen XD, Tsuchiyashi S, Yamashita K, Csizmadia E, Lassman C, Busuttil RW, Kupiec-Weglinski JW, Bach FH. Biliverdin therapy protects rat livers from ischemia and reperfusion injury. Hepatology. 2004;40:1333-1341. [PubMed] |
| 19. | Zuckerbraun BS, Billiar TR, Otterbein SL, Kim PK, Liu F, Choi AM, Bach FH, Otterbein LE. Carbon monoxide protects against liver failure through nitric oxide-induced heme oxygenase 1. J Exp Med. 2003;198:1707-1716. [PubMed] |
| 20. | Bak I, Varadi J, Nagy N, Vecsernyes M, Tosaki A. The role of exogenous carbon monoxide in the recovery of post-ischemic cardiac function in buffer perfused isolated rat hearts. Cell Mol Biol (Noisy-le-grand). 2005;51:453-459. [PubMed] |
| 21. | Otterbein LE, Soares MP, Yamashita K, Bach FH. Heme oxygenase-1: unleashing the protective properties of heme. Trends Immunol. 2003;24:449-455. [PubMed] |
| 22. | Ryter SW, Otterbein LE, Morse D, Choi AM. Heme oxygenase/carbon monoxide signaling pathways: regulation and functional significance. Mol Cell Biochem. 2002;234-235:249-263. [PubMed] |
| 23. | Hegazi RA, Rao KN, Mayle A, Sepulveda AR, Otterbein LE, Plevy SE. Carbon monoxide ameliorates chronic murine colitis through a heme oxygenase 1-dependent pathway. J Exp Med. 2005;202:1703-1713. [PubMed] |
| 24. | Mazzola S, Forni M, Albertini M, Bacci ML, Zannoni A, Gentilini F, Lavitrano M, Bach FH, Otterbein LE, Clement MG. Carbon monoxide pretreatment prevents respiratory derangement and ameliorates hyperacute endotoxic shock in pigs. FASEB J. 2005;19:2045-2047. [PubMed] |
| 25. | Nakao A, Choi AM, Murase N. Protective effect of carbon monoxide in transplantation. J Cell Mol Med. 2006;10:650-671. [PubMed] |
| 26. | Amersi F, Shen XD, Anselmo D, Melinek J, Iyer S, Southard DJ, Katori M, Volk HD, Busuttil RW, Buelow R. Ex vivo exposure to carbon monoxide prevents hepatic ischemia/reperfusion injury through p38 MAP kinase pathway. Hepatology. 2002;35:815-823. [PubMed] |
| 27. | Park JH, Oh SM, Lim SS, Lee YS, Shin HK, Oh YS, Choe NH, Park JH, Kim JK. Induction of heme oxygenase-1 mediates the anti-inflammatory effects of the ethanol extract of Rubus coreanus in murine macrophages. Biochem Biophys Res Commun. 2006;351:146-152. [PubMed] |
| 28. | Farombi EO, Surh YJ. Heme oxygenase-1 as a potential therapeutic target for hepatoprotection. J Biochem Mol Biol. 2006;39:479-491. [PubMed] |
| 29. | Naito Y, Takagi T, Yoshikawa T. Heme oxygenase-1: a new therapeutic target for inflammatory bowel disease. Aliment Pharmacol Ther. 2004;20 Suppl 1:177-184. [PubMed] |