修回日期: 2007-10-13
接受日期: 2007-10-28
在线出版日期: 2007-10-18
目的: 评估终末期肝病模型(MELD)近期变化率(ΔMELD)对我国失代偿期肝硬化患者短期(6 mo)预后分析中的价值.
方法: 对具有完整病例资料和随访结果的181例失代偿期肝硬化患者进行分析, 计算每例患者入院时的MELD、Child-Pugh评分和分级以及随访期间的MELD, 两次MELD之差与随访间隔时间(mo)之比ΔMELD. Kaplan-Meier生存分析Child-Pugh分级、首次MELD、ΔMELD各组患者的6 mo生存率, 受试者工作曲线(ROC)比较上述三者预测患者6 mo生存率的准确性, 多因素分析影响患者ΔMELD急剧上升的危险因素.
结果: Child-Pugh各级、首次MELD和ΔMELD及各组患者6 mo生存率差异有统计学意义. ROC曲线下面积分别为0.865、0.729、0.626, 任何两个曲线下面积比较差异均有统计学意义. 多因素分析显示腹水、血清肌酐值、血清总胆红素、肝性脑病、国际标准化比率(INR)为影响失代偿期肝硬化患者6 mo ΔMELD急剧上升的危险因素.
结论: ΔMELD是判断失代偿期肝硬化患者短期预后的一个较好的指标, 其准确性优于MELD和Child-Pugh评分和分级.
引文著录: 别彩群, 杨冬华, 汤绍辉, 黄卫. 终末期肝病模型变化率在失代偿期肝硬化患者预后分析中的价值. 世界华人消化杂志 2007; 15(29): 3135-3139
Revised: October 13, 2007
Accepted: October 28, 2007
Published online: October 18, 2007
AIM: To assess the prognostic significance of ΔMELD (longitudinal modifications of the model for end-stage liver disease over time) in patients with decompensated liver cirrhosis.
METHODS: A cohort of 181 patients with decompensated liver cirrhosis was studied. Initial MELD and Child-Pugh score and classification were calculated at entry. MELD score was obtained for each patient according to the modified formula by Kamath. After initial assessment, all the patients had a second evaluation that was performed in the follow-up period. ΔMELD was calculated as second MELD subracted initial MELD, and divided by the time interval (months). Kaplan-Meier survival analysis was used to compare the survival in sub-groups ranked by the initial MELD, ΔMELD and Child-Pugh classification. The area under the receiver operating characteristic (ROC) curve (AUC) was used to compare initial MELD, ΔMELD and Child-Pugh classification in predicting accuracy. The variables, including gender, age, etiology and ascites were entered into a Cox proportional hazard model in survival analysis to determine the risk ratio.
RESULTS: All subgroups ranked by initial MELD, ΔMELD and Child-Pugh classification were significantly different from each other in pairwise comparisons. The AUC values generated by the ROC curves for the ΔMELD, initial MELD and Child-Pugh classification were 0.865, 0.729 and 0.626, respectively, in predicting 6-month survival. The differences in AUCs between ΔMELD, initial MELD and Child-Pugh classification were significant in pairwise comparisons. On multivariate Cox regression, there were five variables including ascites, bilirubin, albumin, encephalopathy and international normalized ratio (INR) being the independent risk factors for increasing delta MELD.
CONCLUSION: ΔMELD is a useful prognostic indictor for decompensated liver cirrhosis. Prognosis using ΔMELD is superior to initial MELD and Child-Pugh score and classification.
- Citation: Bie CQ, Yang DH, Tang SH, Huang W. Value of ΔMELD in evaluating the prognosis of patients with decompensated cirrhosis. Shijie Huaren Xiaohua Zazhi 2007; 15(29): 3135-3139
- URL: https://www.wjgnet.com/1009-3079/full/v15/i29/3135.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i29.3135
终末期肝病模型(the model for end stage liver disease, MELD)是2000年美国Malinchoc et al[1]建立的一个预后模型. 2001年, Kamath et al[2]又验证了该模型对终末期肝病患者的普遍适用性. 2002-02, 美国器官移植共享网络把MELD作为筛选肝移植患者的新标准[3]. 而终末期肝病模型变化率, 即ΔMELD, 能反映MELD近期变化的趋势和幅度, 在肝硬化失代偿期患者3 mo预后的评估方面有重要的价值[4]. 我们将在该文中继续探讨ΔMELD在我国失代偿期肝硬化患者6 mo预后分析中的价值.
暨南大学附属第一医院2003-01/2006-12期间住院治疗的失代偿期肝硬化患者216例, 所有患者均经病史、症状和体征、生化学、影像学及肝穿刺病理结果等确诊. 有下列情况者予以排除: (1)合并肝癌者, (2)伴有明显的心肺功能不全的患者, (3)既往有器质性肾病或入院后肾穿刺活检病理证实合并肾脏器质性病变者, (4)有血容量快速大量减少所致肾前性氮质血症者, (5)伴有其他恶性肿瘤者, (6)HIV感染者. 所有患者在入院后接受的治疗方案无明显差异, 包括卧床休息, 维持水、电解质、维生素、能量平衡, 纠正低蛋白血症, 补充凝血因子, 防治并发症等. 主要通过患者定期门诊复诊随访, 平均随访时间为14 mo. 因为肝癌及严重心肺功能不全等排除32例, 失访3例, 最后纳入研究的总人数为181例, 其中男141例, 女40例, 年龄23-76岁, 平均年龄61岁. 肝硬化病因为乙型肝炎后肝硬化者145例, 占患者总数81%; 酒精性肝硬化者18例, 占10%; 丙型肝炎后肝硬化者8例, 占4%; 余下10例为胆汁性及其他原因的肝硬化; 合并有腹水者78例, 占患者总数43%; 合并有肝性脑病的人数为45例, 占25%. 总胆红素平均值为1.5(0.5-5)(mg/dL), INR平均值为1.3(0.95-2.2), 血清肌酐平均值为1.1(0.3-3.0)(mg/dL), 白蛋白平均值为32.5(20-46)(g/L). Child-Pugh评分中位数为8.0(5-14), 评分为A级、B级、C级的患者数分别是78、58、45. MELD评分中位数为14(6-41), 评分为MELD<15、15≤MELD<30、MELD≥30的患者分别是50、87、44. ΔMELD评分中位数为1.1(-2.0~4.5), 评分为ΔMELD<0、0≤ΔMELD<2.5、ΔMELD≥2.5的患者数分别是 33、94、54.
根据患者入院后第1天的各项检验指标及入院情况进行首次MELD评分和Child-Pugh评分和分级, MELD值[1] = 3.8×loge(血清总胆红素)+9.6×loge(血清肌酐)+11.2×loge(INR)+6.4×病因(胆汁淤积或酒精性为0, 其他为1), 血清总胆红素与血清肌酐值以mg/dL为单位计算. 在随访期给予第2次MELD评分, 两次MELD值之差与随访间隔时间(mo)之比即为ΔMELD. 运用生存分析方法, 分析患者在首次MELD(MELD<15、10≤MELD<30、MELD≥30)各组、Child-Pugh(A级、B级、C级)各组和ΔMELD(ΔMELD<0 、0≤ΔMELD<2.5、ΔMELD≥2.5)各组的生存率变化. 应用受试者工作曲线(receiver operating characteristic curve, ROC)及其下面积(AUC)比较ΔMELD、MELD、Child-Pugh 3者预测肝硬化失代偿期患者6 mo预后的准确性. 以第1次入院诊断为观察起点, 6 mo内ΔMELD上升幅度达2.5作为终止事件. 将包括年龄、性别、病因、各种血清生化值、腹水、肝性脑病等30个可能与ΔMELD上升幅度大(ΔMELD≥2.5)有关的因素纳入Cox比例风险回归模型, 分析影响其上升的独立危险因素, 计算其风险比例.
统计学处理 所有数据用SPSS12.0 for Win-dows软件包进行处理, 以P<0.05为差异有统计学意义.
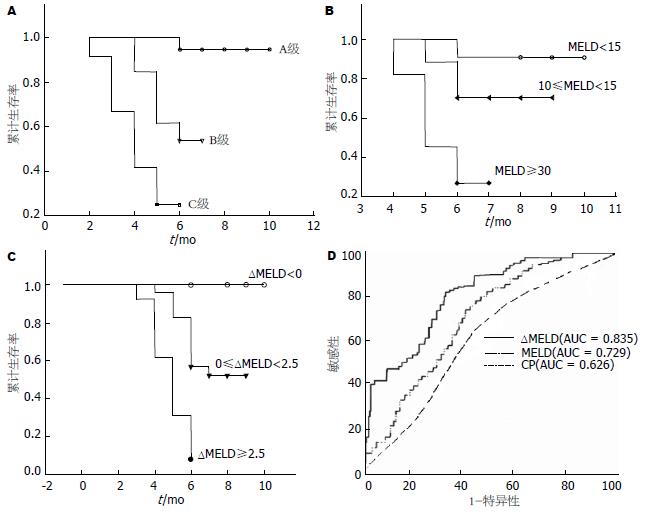
A级组、B级组、C级组患者的6 mo累计生存率分别为91%、53.85%、10.42%. log-rank检验各组的生存曲线(图1A), 任何两组间生存曲线差异均有统计学意义. A级 vs B级, P<0.001; B级 vs C级, P<0.001; A级 vs C级, P<0.001.
运用Kaplan-Meier分析MELD各组的6 mo生存率: MELD<15组, 10≤MELD<30组, MELD≥30组, 6 mo生存率分别为90.75%, 70.29%, 27.27%. log-rank检验各组的生存曲线(图1B), 任何两组间生存曲线差异均有统计学意义, MELD<15组 vs 10≤MELD<30组, P<0.001; MELD<15组 vs MELD≥30 组, P<0.001; 10≤MELD<30组 vs MELD≥30组, P<0.001.
将ΔMELD分为ΔMELD<0、0≤ΔMELD< 2.5、ΔMELD≥2.5共3组, 运用Kaplan-Meier分析ΔMELD各组的6 mo生存率: ΔMELD<0组, 0≤ΔMELD<2.5组, ΔMELD≥2.5组6 mo生存率为100%, 56.52%, 7%. log-rank检验各组的生存曲线(图1C), 任何两组间生存曲线差异均有统计学意义, ΔMELD<0组 vs 0≤ΔMELD<2.5组, P<0.001; ΔMELD<0组 vs ΔMELD≥2.5组, P<0.001; 0≤ΔMELD<2.5组 vs ΔMELD≥2.5组, P<0.001.
应用c-统计值(concordance statistic)评估MELD、ΔMELD、Child- Pugh评分和分级三者对生存率预测的准确性, ΔMELD, MELD评分和Child-Pugh分级判断失代偿期肝硬化患者6 mo预后的ROC曲线下面积分别为0.835, 0.729, 0.626, 95%可信区间分别为0.815-0.918, 0.673-0.796, 0.580-0.688; 首次MELD的准确性优于Child-Pugh分级(P<0.001), ΔMELD的准确性优于首次MELD(P<0.001), ΔMELD的准确性优于Child-Pugh分级(P<0.001). 各评分系统预测的ROC曲线比较见图1D.
以第1次入院诊断为观察起点, 6 mo ΔMELD上升幅度达2.5作为终止事件. 将包括年龄、性别、病因、及血清生化值、腹水、肝性脑病等30个可能与ΔMELD上升幅度大(ΔMELD≥2.5)有关的因素纳入Cox比例风险回归模型, 采用向前逐步法(Forward Stepwise: LR)筛选协变量, 在α = 0.05检验水平共有肝性脑病、腹水、血清总胆红素、血清肌酐值和INR一共5项进入Cox模型(表1), 其他指标未能进入Cox模型系统. 因此, 肝性脑病、腹水、血清总胆红素、血清肌酐值和INR均为影响ΔMELD上升幅度大(ΔMELD≥2.5)的独立危险因素.
| 回归系数 | 回归系数的标准误 | OR值 | OR值的95%可信区间 | P值 | |
| 血清总胆红素 | 0.738 | 0.082 | 1.76 | 1.50-2.06 | <0.001 |
| 血清肌酐值 | 0.263 | 0.048 | 1.51 | 1.28-1.76 | <0.001 |
| INR | 0.124 | 0.070 | 1.27 | 1.01-1.44 | <0.01 |
| 腹水 | 0.154 | 0.040 | 1.34 | 1.13-1.65 | <0.001 |
| 肝性脑病 | 0.453 | 0.064 | 1.12 | 1.01-1.38 | <0.01 |
近年来, 国内外关于MELD的研究很多, 多数学者认为, 与Child-Pugh评分系统比较, MELD在预测肝硬化和接受TIPS手术后的患者预后方面能提供更多信息[5-6]. MELD也被证实对酒精性肝炎、食道静脉曲张破裂出血及再次接受肝移植等患者的预后有非常显著的预测能力[7-9]. 但这些研究中MELD评分只在患者整个病程的某个时点取值, 没有报道死亡危险度随时间的变化. 肝硬化病程可随时间而进展, 肝功能也会因肝硬化的进展和其他原因而出现变化. 因此, 仅用某一次的MELD评分来预测患者的预后有其局限性. ΔMELD是反映MELD近期变化的趋势和幅度的指标, 随时间变化的ΔMELD能反映肝脏病变的进程, 是另一个预测肝硬化患者预后的因素[4,10].
ΔMELD为终末期肝病模型随时间的变化率, 其计算必须有不同时间的两次MELD评分, 两次MELD评分的差值与两次评分之间的时间间隔(mo)之比即为ΔMELD值. ΔMELD如为负值, 说明肝功能因某种原因有好转趋势; 如为正值, 即表示肝功能进一步恶化. ΔMELD值正方向变化较大(ΔMELD≥2.5), 表明患者的残存肝功能积聚下降. 本研究中, ΔMELD为负值变化的患者的6 mo生存率为100%, ΔMELD正向变化幅度较小(0≤ΔMELD<2.5)的患者的6 mo生存率为56.52%, 而ΔMELD值正方向变化较大(ΔMELD≥2.5)的患者的6 mo生存率仅为7%, 显示失代偿期肝硬化患者的生存时间与残存的肝功能高度相关. 且肝功能下降快的患者的生存时间显著短于肝功能好转或者比较稳定的患者, 该结果与Huo et al[10]和Merion et al[11]的研究结果一致.
统计学上, ROC曲线下面积在0-1之间, 曲线下面积越大, 诊断或预测准确性越高. 本研究显示, ΔMELD判断失代偿期肝硬化患者6 mo预后的ROC曲线下面积为0.865, MELD判断失代偿期肝硬化患者6 mo预后的ROC曲线下面积为0.729, Child-Pugh分级判断失代偿期肝硬化患者6 mo预后的ROC曲线下面积为0.626, 任何两者之间的比较差异均有统计学意义, 表明ΔMELD预测失代偿期肝硬化患者6 mo生存率的准确性优于MELD和Child-Pugh评分和分级. ΔMELD由于反应了残存肝功能随时间的动态变化, 而突破仅仅靠患者单次的肝功能来判断患者预后, 故其预测更准确.
ΔMELD值正方向变化较大(ΔMELD≥2.5)的患者的6 mo生存率仅为7%, 影响ΔMELD急剧上升的因素也被认为是影响患者预后的因素. 我们用Cox比例风险回归分析了30个可能影响ΔMELD上升的因素, 肝性脑病、腹水、血清总胆红素、血清肌酐值和INR共5个因素被纳入模型. 血清胆红素、肌酐和INR这3个生化变量具有重复性好、客观性强等特点, 为MELD评分系统中的几个要素. 在Cox回归模型中, 3个生化值都被引入, 证明了ΔMELD继承了MELD评分系统的优点. 腹水和肝性脑病是Child-Pugh评分和分级系统中的要素, 均为失代偿期肝硬化患者常见的症状之一, MELD评分系统未能对其进行合理分析. 在我们的研究中, 上述二者被引入Cox回归模型, 为影响ΔMELD上升的危险因素, 说明ΔMELD也具有Child-Pugh评分和分级系统的优点. 这也进一步说明了ΔMELD在分析患者预后方面优于MELD和Child-Pugh评分系统, 因为他综合两个评分系统的优点, 补充各自不足, 故更准确.
总之, ΔMELD应被视为一个对失代偿期肝硬化患者短期预后(6 mo)评估较准确的预测因子, 其对肝硬化患者的临床治疗很重要, 能阻止ΔMELD正方向大幅度波动的措施均可能延长失代偿期肝硬化患者的生存期. 对尽管首次MELD评分不高, 但ΔMELD增高很快的患者, 提示肝病进展迅速, 应予积极治疗. 对等待接受移植的肝硬化患者, ΔMELD具有更重要的意义. 首次MELD评分相同的患者, 相同时间内ΔMELD评分正方向迅速增加的患者比ΔMELD较稳定或者逆方向变化的患者应优先获得肝移植.
2000年, 美国的Malinchoc et al对231例TIPS患者进行Cox比例风险回归分析, 提出将胆红素、肌酐、INR、肝硬化病因作为TIPS术后患者生存率的预测指标, 并计算各指标的回归系数, 从而建立了MELD. 2001年Kamath et al将MELD用于预测终末期肝病的预后, 证明其优于Child-Pugh. 2002年, 美国器官共享网络正式将MELD作为器官分配的新标准.
肝硬化病程可随时间而进展, 肝功能也会因肝硬化的进展和其他原因而出现变化. 因此, 仅用某一次的MELD来预测患者的预后有其局限性. 有学者提出, 除MELD外, MELD近期变化的趋势和幅度(ΔMELD)是预测肝硬化患者预后的另一个因素.
以往的相关文章主要报道了MELD在各类肝病预后预测中的价值, 类似文章有从不同角度分析ΔMELD在肝病预后预测中的价值. 本文用生存分析及Cox回归方法分析了ΔMELD在失代偿期肝硬化患者预后预测中的价值.
ΔMELD可以弥补Child-Pugh和MELD系统的不足, 在临床上可以与上述二者联合使用, 以期对失代偿期肝硬化患者的预后作出更准确的评估, 进一步指导临床治疗.
ROC曲线: 是受试者工作曲线, 是用构图法揭示敏感性和特异性的相互关系, 他通过将连续变量设定出多个不同的临界值, 从而计算出一系列敏感性和特异性, 再以敏感性为纵坐标、特异性为横坐标绘制成曲线, 曲线面积在0-1之间, 曲线下面积越大, 诊断或预测准确性越高. 统计学上, 面积在0.8-0.9之间的模型被认为有非常好的预测/判断准确性, 大于0.7的模型即有临床应用价值, 超过0.9的模型是罕见的.
本文内容较新, 有一定的临床应用价值.
编辑: 程剑侠 电编:何基才
| 1. | Malinchoc M, Kamath PS, Gordon FD, Peine CJ, Rank J, ter Borg PC. A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts. Hepatology. 2000;31:864-871. [PubMed] |
| 2. | Kamath PS, Wiesner RH, Malinchoc M, Kremers W, Therneau TM, Kosberg CL, D'Amico G, Dickson ER, Kim WR. A model to predict survival in patients with end-stage liver disease. Hepatology. 2001;33:464-470. [PubMed] |
| 3. | Freeman RB Jr, Wiesner RH, Harper A, McDiarmid SV, Lake J, Edwards E, Merion R, Wolfe R, Turcotte J, Teperman L. The new liver allocation system: moving toward evidence-based transplantation policy. Liver Transpl. 2002;8:851-858. [PubMed] |
| 5. | Schepke M, Roth F, Fimmers R, Brensing KA, Sudhop T, Schild HH, Sauerbruch T. Comparison of MELD, Child-Pugh, and Emory model for the prediction of survival in patients undergoing transjugular intrahepatic portosystemic shunting. Am J Gastroenterol. 2003;98:1167-1174. [PubMed] |
| 6. | Angermayr B, Cejna M, Karnel F, Gschwantler M, Koenig F, Pidlich J, Mendel H, Pichler L, Wichlas M, Kreil A. Child-Pugh versus MELD score in predicting survival in patients undergoing transjugular intrahepatic portosystemic shunt. Gut. 2003;52:879-885. [PubMed] |
| 7. | Dunn W, Jamil LH, Brown LS, Wiesner RH, Kim WR, Menon KV, Malinchoc M, Kamath PS, Shah V. MELD accurately predicts mortality in patients with alcoholic hepatitis. Hepatology. 2005;41:353-358. [PubMed] |
| 8. | Chalasani N, Kahi C, Francois F, Pinto A, Marathe A, Bini EJ, Pandya P, Sitaraman S, Shen J. Model for end-stage liver disease (MELD) for predicting mortality in patients with acute variceal bleeding. Hepatology. 2002;35:1282-1284. [PubMed] |
| 9. | Rosen HR, Prieto M, Casanovas-Taltavull T, Cuervas-Mons V, Guckelberger O, Muiesan P, Strong RW, Bechstein WO, O'grady J, Zaman A. Validation and refinement of survival models for liver retransplantation. Hepatology. 2003;38:460-469. [PubMed] |
| 10. | Huo TI, Wu JC, Lin HC, Lee FY, Hou MC, Lee PC, Chang FY, Lee SD. Evaluation of the increase in model for end-stage liver disease (DeltaMELD) score over time as a prognostic predictor in patients with advanced cirrhosis: risk factor analysis and comparison with initial MELD and Child-Turcotte-Pugh score. J Hepatol. 2005;42:826-832. [PubMed] |
| 11. | Merion RM, Wolfe RA, Dykstra DM, Leichtman AB, Gillespie B, Held PJ. Longitudinal assessment of mortality risk among candidates for liver transplantation. Liver Transpl. 2003;9:12-18. [PubMed] |