修回日期: 2007-08-03
接受日期: 2007-08-28
在线出版日期: 2007-08-18
目的: 设计以X染色体连锁凋亡抑制蛋白(XIAP)为靶向的shRNA, 构建携带此shRNA的重组质粒, 检测其抑制XIAP表达的效应, 筛选RNA干扰作用最强的shRNA片段.
方法: 设计4对针对XIAP基因不同位点的shRNA片段, 构建携带此shRNA片段的真核表达载体psiRNA-Hhneo-XIAP, 通过脂质体介导的方法将重组质粒转染到肝癌细胞株HepG2细胞中. 采用逆转录酶链式反应(RT-PCR)及蛋白印迹(Western blotting)方法检测XIAP的mRNA及蛋白表达情况, 比较转染前后其表达差异, 以判断各shRNA的干扰效应.
结果: 成功构建含shRNA片段的重组质粒. 经质粒测序证实, 插入的DNA片段的序列与设计序列完全一致. 重组质粒转染HepG2细胞后, XIAP基因的mRNA水平及蛋白表达水平明显下调, 其中以1号重组质粒效应最强. shRNA作用48 h后, 对HepG2细胞中XIAP mRNA和蛋白的抑制率与3, 4号重组质粒相比, 均具有显著性差异(mRNA: 94.5% vs 81.5%, 82.6%, 均P<0.01; 蛋白: 92.6% vs 80.7%, 82.9%, 均P<0.01).
结论: 成功构建了携带以XIAP为靶向的shRNA的重组质粒, 其对肝癌细胞内XIAP的表达具有显著抑制效应.
引文著录: 吴小力, 张鹏, 张琼, 姚津剑, 林菊生. 靶向XIAP的shRNA重组质粒的构建. 世界华人消化杂志 2007; 15(23): 2482-2486
Revised: August 3, 2007
Accepted: August 28, 2007
Published online: August 18, 2007
AIM: To construct recombinant plasmids containing short hairpin RNA (shRNA) that targets the X-linked inhibitor of apoptosis protein (XIAP) gene, to assay the expression of XIAP in HepG2 cells after transfecting with recombinant plasmids, and to detect the RNAi effect of shRNA.
METHODS: Four pairs of shRNAs that target the XIAP gene were designed. The eukaryotic expression vector of psiRNA-Hhneo-XIAP was constructed and transfected via liposomes into HepG2 cells. XIAP mRNA expression was analyzed by reverse transcriptase-polymerase chain reaction. XIAP protein expression was examined by Western blotting. The difference in XIAP gene and protein expression levels between cells transfected or not transfected by psiRNA-Hhneo-XIAP was compared.
RESULTS: The successful construction of recombinant plasmids was confirmed by DNA sequencing of the inserted segments. Transfection of psiRNA-Hhneo-XIAP significantly down-regulated XIAP expression in HepG2 cells. Recombinant plasmid 1 had the strongest effect, with an inhibition ratio of 94.5% at the mRNA level and 92.6% at the protein level, which showed a significant difference from plasmids 3 and 4 (mRNA: 94.5% vs 81.5%, 82.6%, both P < 0.01; protein: 92.6% vs 80.7%, 82.9%, both P < 0.01).
CONCLUSION: XIAP gene targeted shRNA suppresses gene and protein expression.
- Citation: Wu XL, Zhang P, Zhang Q, Yao JJ, Lin JS. Construction of recombinant plasmids containing short hairpin RNA targeting the X-linked inhibitor of the apoptosis protein gene. Shijie Huaren Xiaohua Zazhi 2007; 15(23): 2482-2486
- URL: https://www.wjgnet.com/1009-3079/full/v15/i23/2482.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i23.2482
凋亡抵抗性是肿瘤细胞的一大特征, 使其在凋亡刺激因素的作用下仍能存活, 并对标准化疗方案中的多种化疗药物具有耐药性[1]. 凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)家族是目前所发现的唯一内源性caspase抑制物, 在凋亡调控中发挥着关键作用. 而X染色体连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)则是IAP家族中最具有caspase抑制能力的成员, 因而也具有最强的抗凋亡能力[2-4]. XIAP蛋白水平的变化很大程度改变细胞对凋亡刺激的反应, 其过度表达可抑制多种凋亡刺激因素(包括肿瘤坏死因子、Fas、缺血、放疗、化疗)所诱导的细胞凋亡[5-7]. 有研究表明XIAP在肿瘤中的高表达可能是肿瘤进展及导致肿瘤对化疗药物耐药的一个重要机制[8-13]. 本研究设计并构建以XIAP为靶向的短发夹状RNA(short hairpin RNA, shRNA)重组质粒, 观察其下调XIAP表达的作用.
人肝癌细胞株HepG2(购自ATCC)用含100 mL/L新生牛血清的DMEM培养基(美国Gibco公司), 在37℃, 50 mL/L CO2的细胞培养箱中培养. AseⅠ内切酶(MBI Fermentas公司)
针对Pubmed上的基因库中查出XIAP的完整基因序列(序列编号U45880), 利用http://www.sirnawizard.com上的在线设计软件设计针对XIAP的shRNA, 选择四对碱基序列送上海生工生物工程技术服务有限公司合成(表1). 将合成的含BbsⅠ酶切位点的寡核苷酸链用T4 DNA连接酶(美国NEB公司)插入到psiRNA-hH1neo质粒(购自美国Invitrogen公司)的两个BbsⅠ位点之间. 重组质粒转化感受态DH5α大肠杆菌. 通过蓝白斑筛选挑取阳性克隆, 接种到培养基中培养过夜. 用质粒小量提取试剂盒(中国博大泰克公司)抽提质粒, 得到质粒酶切后进行酶切鉴定与测序法鉴定(上海生工生物工程技术服务有限公司测序), 证实重组质粒中插入的shRNA片段的碱基序列与设计序列完全一致. HepG2细胞接种于6孔板及96孔板内, 培养18-24 h后将培养基换为无血清的DMEM培养基, 按照质粒:脂质体比例为1 g:6 L滴加入脂质体DNA-Metafectene(德国Biontex公司)及质粒复合物转染细胞, 轻晃孔板混匀. 6 h后换为含150 mL/L新生牛血清的DMEM培养基. 重组质粒为试验组, 空载体为对照组.
| 编号 | 针对XIAP基因的shRNA序列 |
| 序列1 | 正义链: 5'-TCCCAGGCCAGACTATGCTCACCTAACCACCTTAGGTGAGCATAGTCTGGCCTT-3' |
| 反义链: 5'-CAAAAAGGCCAGACTATGCTCACCTAAGGTGGTTAGGTGAGCATAGTCTGGCCT-3' | |
| 序列2 | 正义链: 5'-TCCCAGAGTGTCTGGTAAGAACTACTCCACCAGTAGTTCTTACCAGACACTCTT-3' |
| 反义链: 5'-CAAAAAGAGTGTCTGGTAAGAACTACTGGTGGAGTAGTTCTTACCAGACACTCT-3' | |
| 序列3 | 正义链: 5'-TCCCAGACAGTATGCAAGATGAGTCACCACCTGACTCATCTTGCATACTGTCTT-3' |
| 反义链: 5'-CAAAAAGACAGTATGCAAGATGAGTCAGGTGGTGACTCATCTTGCATACTGTCT-3' | |
| 序列4 | 正义链: 5'-TCCCAGTGGACATCTAGTCACTTGTACCACCTACAAGTGACTAGATGTCCACTT-3' |
| 反义链: 5'-CAAAAAGTGGACATCTAGTCACTTGTAGGTGGTACAAGTGACTAGATGTCCACT-3' |
1.2.1 RT-PCR检测XIAP基因表达: 利用Primer 5.0软件分别设计XIAP基因和β-actin的PCR引物, 由上海生工生物工程技术服务有限公司合成. XIAP引物: 5'-TGGTCAGAACACAGGCGACA-3'(上游); 5'-CCCTCCTCCACAGTGAAAGC-3'(下游), 目的片段长度为270 bp; β-actin引物: 5'-CTGGGGCGCCCCAGGCACCA-3'(上游), 引物: 5'-CTTTAGCACGCACTGTAATTCCTC-3' (下游), 目的片段长度531 bp. 细胞转染48 h后收集细胞提取总RNA, 进行逆转录制备cDNA, 每份样品分别加入XIAP引物和β-actin引物进行PCR反应. 在25 mL体系中加入上游及下游引物各1 mL, 退火温度52℃, 共30次循环. 制备20 g/L琼脂糖凝胶, PCR产物各取4 mL进行电泳, 用UVP凝胶成像系统拍照并使用图像分析软件分析同一样本XIAP基因与β-actin PCR产物条带的吸光度, 计算XIAP条带与β-actin条带吸光度比值, 对XIAP mRNA表达水平进行半定量分析.
1.2.2 Western: blot法检测XIAP蛋白的表达 收集转染后48 h的HepG2细胞, 用细胞裂解液抽提细胞总蛋白, 在紫外分光光度仪上比色分析, 利用考马斯亮蓝标准曲线计算各样本蛋白浓度. 试验组和对照组分别取总蛋白7 mg于120 g/L聚丙烯酰胺凝胶中电泳后转至PVDF膜. 用含50 g/L脱脂奶粉的TBST封闭后加入1:500鼠抗人XIAP mAb(加拿大Stressgen公司)和1:500兔抗人β-actin mAb(加拿大Stressgen公司)4℃孵育过夜. 洗涤后分别用辣根过氧化物酶标记的相应二抗(北京中山生物技术公司)孵育1 h, 化学发光(ECL)法显色. 用凝胶图像处理系统分析目的条带吸光度值, 计算XIAP与β-actin蛋白条吸光度比值, 进行XIAP蛋白表达水平的半定量分析.
统计学处理 实验所得数据资料采用SPSS 13.0统计分析软件进行方差分析, 比较各组间差异, P<0.05为有统计学意义.
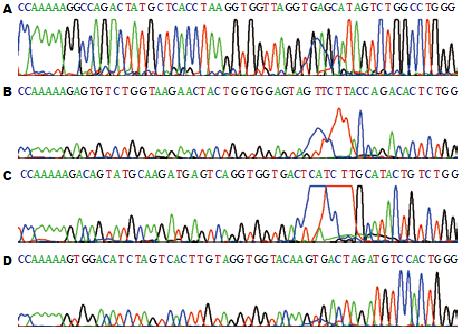
根据蓝白斑筛选取白色克隆株摇菌扩增后抽提重组质粒, 用AseⅠ内切酶进行单酶切. AseⅠ酶切后, 空载体由于含有2个酶切位点被切成大小2个片段; 而重组质粒仅含有1个酶切位点, 酶切后被线性化. 制备10 g/L琼脂糖凝胶电泳分析酶切结果. 选择酶切鉴定重组成功的质粒进行DNA测序, 证实插入的4个shRNA片段碱基序列与设计序列完全一致(图1).
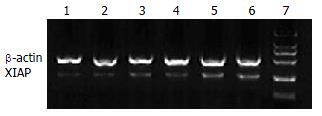
转染重组质粒48 h后RT-PCR产物电泳结果显示(图2), 各组内参β-actin条带亮度相似, shRNA重组质粒转染组XIAP mRNA水平低于空质粒转染组和空白对照组, 其中1号重组质粒转染后XIAP mRNA降低最为明显, 电泳条带光密度值XIAP/β-actin为0.0083±0.0005, 对照组为0.1512±0.0211. 4种重组质粒与空质粒转染组相比均存在显著性差异(P<0.05, 表2), 表明4个重组质粒均成功转染HepG2细胞并不同程度下调XIAP基因mRNA的表达. 其中以1号重组质粒抑制效应最强, shRNA作用48 h后, 对HepG2细胞中XIAP mRNA的最大抑制率为94.5%, 与3, 4号重组质粒相比, 具有显著性差异(P<0.01, 表2).
| 分组 | 24 h mRNA | 48 h mRNA | 72 h mRNA | 48 h 蛋白 | ||||
| XIAP/β-actin 吸光度比值 | 抑制率 (%) | XIAP/β-actin 吸光度比值 | 抑制率 (%) | XIAP/β-actin 吸光度比值 | 抑制率 (%) | XIAP/β-actin 吸光度比值 | 抑制率 (%) | |
| 空载体 | 0.1487±0.0363 | 0 | 0.1512±0.0211 | 0 | 0.1534±0.0278 | 0 | 1.36±0.23 | 0 |
| psiRNA1 | 0.0453±0.0039 | 69.5a | 0.0083±0.0005 | 94.5a | 0.0078±0.0013 | 94.9a | 0.10±0.02 | 92.6a |
| psiRNA2 | 0.0654±0.0213 | 56.0a | 0.0147±0.0054 | 90.3a | 0.0139±0.0073 | 90.9a | 0.16±0.05 | 88.3a |
| psiRNA3 | 0.0798±0.0109 | 46.3ad | 0.0279±0.0058 | 81.5ad | 0.0266±0.0053 | 82.7ad | 0.26±0.04 | 80.7ad |
| psiRNA4 | 0.0779±0.0084 | 47.6ad | 0.0263±0.0056 | 82.6ad | 0.0234±0.0089 | 84.7ad | 0.23±0.04 | 82.9ad |
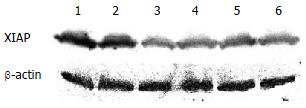
blot检测结果 转染48 h后, 各组细胞β-actin蛋白杂交条带亮度相似, 在54 kDa蛋白条带位置均呈现XIAP特异性蛋白杂交条带表达, 但亮度有明显差异(图3). shRNA干扰组细胞的XIAP蛋白条带亮度明显低于空质粒转染组和脂质体对照组, 其中1号质粒转染组蛋白条带亮度最弱. 凝胶图像处理系统分析显示, XIAP/β-actin吸光度值: 1号质粒为0.10±0.02, 对照组为1.36±0.23. 各重组质粒与空质粒转染组相比均存在显著性差异(P<0.05, 表2). 表明4个重组质粒均成功转染HepG2细胞并不同程度下调XIAP基因蛋白的表达, 尤以1号质粒产生效应最强, 与3, 4号重组质粒相比, 存在显著性差异(P<0.01). shRNA干扰后, HepG2细胞中XIAP蛋白表达抑制率最高达92.6%.
在肿瘤的发生与发展中, 有多种内源性及外源性凋亡刺激因素作用于肿瘤细胞, 促其凋亡. 但由于其具有凋亡抵抗性, 肿瘤细胞可逃避死亡进程, 继续生长. 尤其是应用对增殖细胞具有强凋亡诱导性的化疗药物进行化疗治疗时, 这种凋亡抵抗性显得尤为突出. 这种凋亡通路异常对肿瘤细胞的持续性生长和增殖具有关键作用, 并导致了肿瘤细胞的化疗抵抗性[12-15].
IAP家族成员表达增高是肿瘤细胞逃避各种内源性(线粒体途径)和外源性(死亡受体途径)强凋亡诱导因素导致的死亡事件的主要机制[16]. XIAP是凋亡抑制蛋白家族中抗凋亡作用最强的成员, 在细胞畸变、肿瘤形成时表达明显增加[17-22]. XIAP高表达与急性粒细胞白血病的预后不良相关[23-24], 并且其表达水平与放疗、化疗抵抗性[8-13]呈正相关.
我们前期研究发现, 在人肝癌组织和肝癌细胞系中XIAP基因的mRNA和蛋白表达水平明显高于癌旁组织与正常肝细胞系, 提示XIAP基因的高表达与肝癌的发生、发展密切相关[25]. 在此基础上, 我们构建针对XIAP基因的小RNA干扰(siRNA)真核表达载体, 然后转染高表达XIAP基因的肝癌细胞HepG2. 转染psiRNA-Hhneo-XIAP后, HepG2细胞XIAP表达明显低于空载体转染组, 说明所构建真核表达载体psiRNA-Hhneo-XIAP能特异性下调XIAP的表达. 在所合成的4个shRNA中, 1号shRNA抑制XIAP mRNA和蛋白表达的作用最为明显, 作用48 h抑制率达94.5%及92.6%, 与3, 4号shRNA相比具有显著性差异. 由于XIAP基因的过表达与肿瘤对多药化疗的抵抗性有关[26-28], 且XIAP基因敲除鼠未发现明显病理变化, 提示敲除XIAP对正常细胞无毒性[29], 故XIAP基因被认为是具有潜力的肿瘤治疗靶点. 在本研究结果中, 使用针对XIAP的shRNA, 可显著抑制肝癌细胞株内XIAP mRNA与蛋白表达, 这将为以XIAP为位点的肝癌靶向治疗提供科学的实验依据.
IAP家族成员表达增高是肿瘤细胞逃避各种内源性 (线粒体途径) 和外源性(死亡受体途径)强凋亡诱导因素导致的死亡事件的主要机制. XIAP是凋亡抑制蛋白家族中抗凋亡作用最强的成员, 在包括肝癌的多种恶性肿瘤中表达明显增高. 其在肿瘤中的高表达可能是肿瘤进展及导致肿瘤对化疗药物耐药的一个重要机制.
已有学者对XIAP在肺癌、前列腺癌、白血病等恶性肿瘤中的作用进行了研究, 但关于其在肝癌发展过程中所发挥的作用的研究尚少.
本研究设计以XIA P为靶向的 shRNA, 构建携带此shRNA的重组质粒, 经检测证实其对XIAP表达具有明显抑制效应, 从而筛选出了对XIAP干扰作用最强的shRNA片段, 为进一步观察XIAP在肝癌中作用的研究打下基础. 但构建的 shRNA的重组质粒能抑制XIAP基因并不意味着该质粒对XIAP的抑制作用具有显著的生物学意义, 尚需对XIAP基因受抑制后的生物学效应作进一步深入研究.
本文以XIAP为靶向的shRNA, 成功构建了含shRNA片段的重组质粒, 设计合理, 具有一定的创新性, 采用的技术先进, 结果可信, 为进一步利用shRNA的重组质粒来研究抑制 XIAP基因功能对肝癌细胞生物学特征的影响奠定了基础.
编辑: 何燕 电编:张敏
| 1. | Reed JC. Apoptosis-targeted therapies for cancer. Cancer Cell. 2003;3:17-22. [PubMed] |
| 2. | Deveraux QL, Leo E, Stennicke HR, Welsh K, Salvesen GS, Reed JC. Cleavage of human inhibitor of apoptosis protein XIAP results in fragments with distinct specificities for caspases. EMBO J. 1999;18:5242-5251. [PubMed] |
| 3. | Roy N, Deveraux QL, Takahashi R, Salvesen GS, Reed JC. The c-IAP-1 and c-IAP-2 proteins are direct inhibitors of specific caspases. EMBO J. 1997;16:6914-6925. [PubMed] |
| 4. | Tamm I, Wang Y, Sausville E, Scudiero DA, Vigna N, Oltersdorf T, Reed JC. IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas (CD95), Bax, caspases, and anticancer drugs. Cancer Res. 1998;58:5315-5320. [PubMed] |
| 5. | LaCasse EC, Baird S, Korneluk RG, MacKenzie AE. The inhibitors of apoptosis (IAPs) and their emerging role in cancer. Oncogene. 1998;17:3247-3259. [PubMed] |
| 6. | Holcik M, Yeh C, Korneluk RG, Chow T. Translational upregulation of X-linked inhibitor of apoptosis (XIAP) increases resistance to radiation induced cell death. Oncogene. 2000;19:4174-4177. [PubMed] |
| 7. | Marienfeld C, Yamagiwa Y, Ueno Y, Chiasson V, Brooks L, Meng F, Patel T. Translational regulation of XIAP expression and cell survival during hypoxia in human cholangiocarcinoma. Gastroenterology. 2004;127:1787-1797. [PubMed] |
| 8. | Li J, Feng Q, Kim JM, Schneiderman D, Liston P, Li M, Vanderhyden B, Faught W, Fung MF, Senterman M. Human ovarian cancer and cisplatin resistance: possible role of inhibitor of apoptosis proteins. Endocrinology. 2001;142:370-380. [PubMed] |
| 9. | Yang L, Cao Z, Yan H, Wood WC. Coexistence of high levels of apoptotic signaling and inhibitor of apoptosis proteins in human tumor cells: implication for cancer specific therapy. Cancer Res. 2003;63:6815-6824. [PubMed] |
| 10. | Schimmer AD, Dalili S, Batey RA, Riedl SJ. Targeting XIAP for the treatment of malignancy. Cell Death Differ. 2006;13:179-188. [PubMed] |
| 11. | Wright CW, Duckett CS. Reawakening the cellular death program in neoplasia through the therapeutic blockade of IAP function. J Clin Invest. 2005;115:2673-2678. [PubMed] |
| 12. | Kaufmann SH, Vaux DL. Alterations in the apoptotic machinery and their potential role in anticancer drug resistance. Oncogene. 2003;22:7414-7430. [PubMed] |
| 13. | Wrzesien-Kus A, Smolewski P, Sobczak-Pluta A, Wierzbowska A, Robak T. The inhibitor of apoptosis protein family and its antagonists in acute leukemias. Apoptosis. 2004;9:705-715. [PubMed] |
| 15. | Igney FH, Krammer PH. Death and anti-death: tumour resistance to apoptosis. Nat Rev Cancer. 2002;2:277-288. [PubMed] |
| 16. | LaCasse EC, Holcik M, Korneluk RG, MacKenzie AE. Apoptosis in health, disease, and therapy: overview and methodology. Apoptosis in health and disease: clinical and therapeutic aspects. Cambridge: Cambridge University Press 2005; 1-48. |
| 17. | Tamm I, Kornblau SM, Segall H, Krajewski S, Welsh K, Kitada S, Scudiero DA, Tudor G, Qui YH, Monks A. Expression and prognostic significance of IAP-family genes in human cancers and myeloid leukemias. Clin Cancer Res. 2000;6:1796-1803. [PubMed] |
| 18. | Fong WG, Liston P, Rajcan-Separovic E, St Jean M, Craig C, Korneluk RG. Expression and genetic analysis of XIAP-associated factor 1 (XAF1) in cancer cell lines. Genomics. 2000;70:113-122. [PubMed] |
| 19. | Shiraki K, Sugimoto K, Yamanaka Y, Yamaguchi Y, Saitou Y, Ito K, Yamamoto N, Yamanaka T, Fujikawa K, Murata K. Overexpression of X-linked inhibitor of apoptosis in human hepatocellular carcinoma. Int J Mol Med. 2003;12:705-708. [PubMed] |
| 20. | Ferreira CG, van der Valk P, Span SW, Ludwig I, Smit EF, Kruyt FA, Pinedo HM, van Tinteren H, Giaccone G. Expression of X-linked inhibitor of apoptosis as a novel prognostic marker in radically resected non-small cell lung cancer patients. Clin Cancer Res. 2001;7:2468-2474. [PubMed] |
| 21. | Liu SS, Tsang BK, Cheung AN, Xue WC, Cheng DK, Ng TY, Wong LC, Ngan HY. Anti-apoptotic proteins, apoptotic and proliferative parameters and their prognostic significance in cervical carcinoma. Eur J Cancer. 2001;37:1104-1110. [PubMed] |
| 22. | Takeuchi H, Kim J, Fujimoto A, Umetani N, Mori T, Bilchik A, Turner R, Tran A, Kuo C, Hoon DS. X-Linked inhibitor of apoptosis protein expression level in colorectal cancer is regulated by hepatocyte growth factor/C-met pathway via Akt signaling. Clin Cancer Res. 2005;11:7621-7628. [PubMed] |
| 23. | Tamm I, Richter S, Oltersdorf D, Creutzig U, Harbott J, Scholz F, Karawajew L, Ludwig WD, Wuchter C. High expression levels of x-linked inhibitor of apoptosis protein and survivin correlate with poor overall survival in childhood de novo acute myeloid leukemia. Clin Cancer Res. 2004;10:3737-3744. [PubMed] |
| 24. | Tamm I, Richter S, Scholz F, Schmelz K, Oltersdorf D, Karawajew L, Schoch C, Haferlach T, Ludwig WD, Wuchter C. XIAP expression correlates with monocytic differentiation in adult de novo AML: impact on prognosis. Hematol J. 2004;5:489-495. [PubMed] |
| 26. | Tong QS, Zheng LD, Wang L, Zeng FQ, Chen FM, Dong JH, Lu GC. Downregulation of XIAP expression induces apoptosis and enhances chemotherapeutic sensitivity in human gastric cancer cells. Cancer Gene Ther. 2005;12:509-514. [PubMed] |
| 27. | Berezovskaya O, Schimmer AD, Glinskii AB, Pinilla C, Hoffman RM, Reed JC, Glinsky GV. Increased expression of apoptosis inhibitor protein XIAP contributes to anoikis resistance of circulating human prostate cancer metastasis precursor cells. Cancer Res. 2005;65:2378-2386. [PubMed] |
| 28. | Wilkinson JC, Cepero E, Boise LH, Duckett CS. Upstream regulatory role for XIAP in receptor-mediated apoptosis. Mol Cell Biol. 2004;24:7003-7014. [PubMed] |
| 29. | Harlin H, Reffey SB, Duckett CS, Lindsten T, Thompson CB. Characterization of XIAP-deficient mice. Mol Cell Biol. 2001;21:3604-3608. [PubMed] |